多花黄精提取物体外干预3T3-L1 前脂肪细胞并缓解其脂质积累
2024-01-09李婷婷严晓雪周溯鲍星宇蒋益虹
李婷婷,严晓雪,周溯,鲍星宇,蒋益虹
(浙江大学生物系统工程与食品科学学院,浙江杭州 310058)
肥胖属于慢性疾病的范畴,由体内脂肪过度堆积致使体质量异常增长引起,与相关种类癌症、心血管疾病、中风等的发病率和死亡率上升具有密切关系[1]。迄今为止,已有许多研究对天然食品成分的抗肥胖活性进行了评估。先前临床试验表明,天然植物提取物中的黄酮类[2]、萜类[3]、多酚类[4]等化合物具有降低肥胖小鼠体重和抑制脂肪细胞增大等作用。一些研究还表明,甘油三酯、胆固醇等代谢生物标志物水平与植物多糖水平呈负相关,且植物多糖因相对无毒、副作用少的优势,在天然植物通过调节肠道菌群减肥方面更受关注[5-7]。Yuan 等[8]发现,植物多糖还可以通过降低过氧化物酶体增殖物激活受体γ(Peroxisome Proliferators-Activated Receptors Gamma,PPARγ)、CCAAT/增强子结合蛋白α(CCAAT/Enhancer Binding Protein Alpha,C/EBPα)、甾醇调节元件结合蛋白-1c(Sterol Regulatory Element Binding Proteins-1c,SREBP-1c)、脂肪酸合酶(Fatty Acid Synthase,FAS)等脂代谢相关mRNA 的水平发挥作用,使3T3-L1 细胞在分化之后胞内脂肪积累受阻。这些表明含有丰富多糖的植物提取物可能有助于防止脂肪积累。
黄精(Rhizomapolygonati)是百合科(Liliaceae)黄精属(PolygonatumMill.)多年生草本植物,根茎可药食两用。黄精属植物包括71 种,约40 种有药用记录[9]。黄精主要生长在北温带,并在中国、日本和韩国广泛食用。药用黄精有3 种[10],其中多花黄精(俗称“姜形黄精”)含有丰富的多糖、皂苷、黄酮类、生物碱、木质素、凝集素等功能成分,尤其是多糖,具有潜在的治疗作用[11-18]。已有研究证明,黄精中的多糖成分能够控制能量和脂质代谢,减小脂肪细胞直径和脂滴,具有抗肥胖作用[19]。因此预计多花黄精提取物可能具有抑制3T3-L1 细胞脂肪积累的作用。然而,多花黄精提取物抑制脂肪积累这方面研究较少,仍有待探索。
因此本文中自制多花黄精生品乙醇提取物(RPE)、多花黄精九蒸九制品乙醇提取物(PPE)、多花黄精生品多糖(CPP),并购买市售九蒸九制多花黄精多糖(PP),通过体外培养3T3-L1 细胞,检测了四种提取物处理后3T3-L1 细胞的增殖、细胞周期、细胞凋亡、细胞分化程度、胞内脂质水平以及脂代谢关键基因表达水平的改变,研究探讨多花黄精提取物对3T3-L1细胞分化和脂质积累的作用及机制。此外,比较了自制多花黄精乙醇提取物、多花黄精生品多糖和市售九蒸九制多花黄精多糖的预防效果和相关活性成分的质量分数,为多花黄精系列食品在肥胖及相关疾病防治的效果提供了科学依据。
1 材料与方法
1.1 材料与试剂
多花黄精(PolygonatumcyrtonemaHua)生品采自浙江省宁波市宁海县;九蒸九制品购自湖南省娄底市新化县颐朴源黄精科技有限公司;市售多花黄精九蒸九制品多糖(PP)来自上海源叶生物科技有限公司。
3T3-L1 前脂肪细胞,中科院上海细胞库;胰岛素(Insulin,INS),Solarbio 公司;3-异丁基-1-甲基黄嘌呤(3-Isobutyl-1-Methylxanthine,IBMX)、地塞米松(Dexamethasone,DEX),Sigma-Aldrich 公司;TG试剂盒,南京建成生物工程研究所;芦丁标准品、纤维素酶(50 U/g)、木瓜蛋白酶(≥200 U/g)、MTT,上海源叶生物科技有限公司;葡萄糖标准品,上海麦克林生物科技有限公司;薯蓣皂苷元、没食子酸标准品,杭州金百奥生物科技有限公司;胎牛血清,四季青公司;1%青霉素/链霉素溶液(100 U/mL)、DMEM培养基、0.25%胰蛋白酶,Biosharp 公司;RNAiso Plus、PrimeScriptTMRT reagent Kit with gDNA Eraser、TB Green Premix Ex TaqTMⅡ,TaKaRa 公司;引物序列,根据GenBank 提供的小鼠PPARγ、C/EBPα、LPL、SREBP-1c、FABP4、CPT-1 和β-actin 基因mRNA 的CDS 序列,于NCBI 网站自行设计上下游引物(表1),交由北京擎科生物有限公司合成。
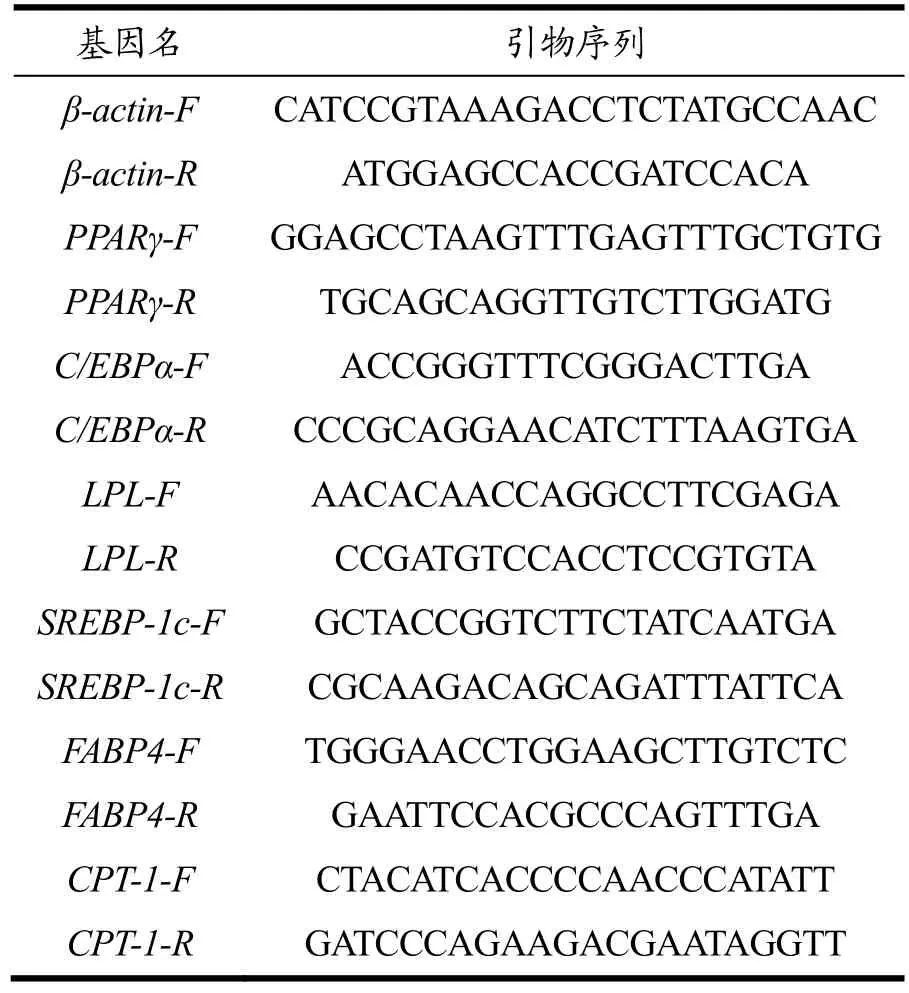
表1 引物序列Table 1 Primer sequence
1.2 仪器与设备
Eon 酶标仪,BioTek 公司;BD FACSVerse 流式细胞仪,碧迪公司;CP-ST200A CO2培养箱,长沙长锦科技有限公司;SW-CJ-2F 超净工作台,上海博讯实业有限公司;CKX41GF 倒置显微镜,Olympus 公司;RE-52AAA 旋转蒸发仪,上海亚荣生化仪器厂;SHZ-D(III)循环水式真空泵,杭州瑞佳精密科学仪器有限公司;DK-S24 恒温水浴锅,上海精宏实验设备有限公司;万能粉碎机,温岭市林大机械有限公司;FE20实验室pH 计,METTLER TOLEDO(上海)有限公司;Centrifuge 5423 R 冷冻离心机,Eppendorf 公司;FD-1C-50 冷冻干燥机,北京博医康实验仪器有限公司;Long Gene A200 梯度热循环仪,杭州朗基科学仪器有限公司;Nanodrop 2000 微量核酸蛋白分析仪,Thermo Fisher Scientific 公司;QuantStudio3 实时荧光定量PCR 仪,Life Technologies ABI 公司。
1.3 方法
1.3.1 提取物制备
预处理:新鲜根茎样品用水冲洗后烘干(干燥前后质量差小于0.000 3 g),用植物万能粉碎机制粉。
RPE 的制备:多花黄精生品粉末按料液比1:5(g/mL)加入φ=70%乙醇,25 ℃浸泡3 d 后纱布过滤,滤液浓缩冻干,-18 ℃冰箱保存。
PPE 的制备:多花黄精九蒸九制品粉末同RPE 步骤。
CPP 的制备参考苑璐等[20]的方法并改进:称取10 g 多花黄精生品粉末,按料液比1:10(g/mL)加入石油醚100 mL,用索氏法85 ℃提取2 h,抽提后将残留石油醚挥干。转移滤渣,按料液比1:10(g/mL)加入φ=80%乙醇,80 ℃水浴回流2 h,纱布过滤,105 ℃烘干滤渣备用。向脱脂多花黄精粉中加入活化好的复合酶(酶活力比值为纤维素酶:木瓜蛋白酶=3:7),用磷酸盐缓冲液调节pH 值至4.5,在45 ℃恒温振荡器中酶解120 min。提取结束后迅速升温,沸水浴回流2 h,趁热过滤。滤液蒸发浓缩至10 mL,再加入40 mL 无水乙醇。搅拌均匀后4 ℃静置24 h,离心10 min,沉淀按φ=95%乙醇-无水乙醇-丙酮-无水乙醚顺序洗涤,冷冻干燥。
样品药物制备:将各冻干粉按生药量50 000 μg/mL溶解于蒸馏水中,在超净台中过0.22 μm 滤膜,配置成母液置于4 ℃保存,工作时再完全培养基稀释。
1.3.2 提取物中功能成分的测定
多糖参照2020 版《中国药典》一部,采用硫酸蒽酮法。总皂苷参考苑璐等[20,21]的方法测定OD560nm,根据标准曲线计算。总黄酮根据何兰香等[22]的方法并稍加修改,采用铝盐显色法。总酚采用福林-酚法,参照焦劼等[23,24]的步骤,并稍作修改。
1.3.3 细胞培养
将50 mL 胎牛血清和5 mL 青霉素/链霉素溶液(100 U/mL)加入500 mL Dulbecco’s Modified Eagle’s Medium(DMEM)高糖培养基制备完整培养基。将细胞复苏后移入25 cm2细胞培养瓶,保持8~10 mL 体积,在37 ℃和φ=5% CO2环境培养。
1.3.4 MTT 法检测细胞存活率
吸走旧培养基,换成配制好的给药培养基。每种药物设置9 个药物质量浓度组,含有不同质量浓度RPE(10、50、100、500、1 000、5 000、8 000、10 000、12 000 μg/mL),PPE(10、50、100、500、1 000、4 000、5 000、8 000、10 000 μg/mL),CPP(10、50、100、500、800、1 000、1 500、2 000、3 000 μg/mL)和PP(10、30、50、100、500、800、1 000、1 500、2 000 μg/mL),一个溶剂对照组以及一个细胞对照组,每个处理组设置6 个平行。培养24、48、72 h 后,在各个时间点吸弃原培养液,换含MTT(终质量浓度0.5 mg/mL)的培养基。4 h 后将培养板上液体不碰底地吸走,添加150 μL 二甲基亚砜,摇床震荡,待紫色晶体完全溶解,测定OD570nm。计算经药物处理24、48、72 h 的细胞相对活力和半抑制浓度(Semi-Inhibitory Concentration,IC50)。
1.3.5 细胞周期检测
将3T3-L1前脂肪细胞以每孔2×105个密度接种到6 孔板中培养24 h 贴壁,换含RPE、PPE、CPP 和PP(终质量浓度分别为50、500、1 000 μg/mL)的新培养基,并设置对照组。24 h 后每孔加入m=0.25%胰蛋白酶消化收集细胞,轻柔吹打,转入1.5 mL 离心管,4 ℃ 1 200 r/min 离心5 min。每个离心管弃上清后加PBS 重悬,同样条件下离心,再加500 μL PBS,细胞轻轻吹散,调整细胞浓度每毫升1×106个,重复离心。去上清,离心管搭在涡旋器上震荡,同时滴加-20 ℃预冷的φ=70%冰乙醇,4 ℃固定24 h。4 ℃ 3 000 r/min 离心5 min,去上清,加入1 mL 4 ℃ PBS 重悬,4 ℃3 000 r/min 离心5 min,去上清,轻弹管底使细胞散开。锡箔纸包住离心管,避光加入500 μL PI 染料,37 ℃避光水浴30 min,上机。
1.3.6 细胞凋亡检测
按1.3.4 接种细胞,24 h 后换含RPE(终质量浓度分别为95、190、380 μg/mL)、PPE(终质量浓度分别为95、190、380 μg/mL)、CPP(终质量浓度分别为95、190、380 μg/mL)、PP(终质量浓度分别为25、50、100 μg/mL)的新培养基,并设置对照组。24 h后每孔加入无EDTA的m=0.25%的胰蛋白酶消化收集细胞。4 ℃ PBS 重悬,1 200 r/min 离心5 min,重复2次。去上清,加入结合型缓冲液,调整细胞浓度每毫升5×106个。取100 μL 于新1.5 mL 离心管,包锡箔纸,加5 μL Annexin-V-FITC 染液混匀,避光5 min 后加5 μL PI 染液,最后加400 μL PBS。空白管取对照组细胞悬液;单染管取380 μg/mL PPE 组细胞悬液分两份单染。混匀后上机,计算凋亡率。
1.3.7 细胞分化和油红O 染色
按1.3.4 接种细胞,当细胞铺满瓶底后换液,继续培养2 d 达到接触抑制。换含10 μg/mL INS、0.5 mmol/L IBMX、1 μmol/L DEX 的分化剂I,同时加入RPE、PPE、CPP、PP,质量浓度同1.3.6,并设置细胞对照组分别培养48 h。更换只含INS 的分化剂II培养48 h,再更换正常培养基培养,隔天换液一次,每次换液重新加入多花黄精提取物,至第12 天约90%以上的脂滴明显,即为培养分化成熟。细胞诱导分化完成后小心吸尽上层液体,用预热PBS小心漂洗3 次,每次1 mL。加入m=4%多聚甲醛,37 ℃固定0.5 h。弃去液体,PBS 漂洗3 次,控制时间加1 mLφ=60%异丙醇30 s 后除去,PBS 清洗,将孔板置于37 ℃至孔底干燥。避光加1 mL 预热油红O,避光静置30 min后弃染液,PBS 清洗两次。异丙醇漂洗、脱色15 s 弃去,重蒸水漂洗2 次,随后加入500 μL 苏木素染色4 min,水洗。保留最后一次液体,显微镜观察,拍照。弃去液体,每孔加1 mL 异丙醇,低速摇晃至胞内脂滴溶解,充分吹打,混匀后的异丙醇吸入到96 孔板,检测OD510nm,计算相对脂滴体积分数。
1.3.8 细胞甘油三酯含量测定
各药物干预细胞分化成熟后,取出放冰袋上操作。吸去培养液,用预冷PBS 温和洗三次,每孔加200 μL放射免疫沉淀法缓冲液(Radioimmunoprecipitation Assay Buffer,RIPA 裂解液),含1 mmol/L 苯甲基磺酰氟(Phenylmethanesulfonyl Fluoride,PMSF),室温裂解10 min,刮下细胞,转移到离心管,振荡,插入碎冰裂解30 min。4 ℃ 12 000 r/min 离心5 min 得到上清液,按TG 试剂盒操作。
1.3.9 荧光定量PCR
用RNAiso Plus 提取细胞总RNA。用Nanodrop 2000 仪器分析RNA 纯度及浓度,A260/280 在1.8~2.1可用。按照逆转录试剂盒的操作说明书,先去除基因组DNA,再进行逆转录反应。按TaKaRa TB Green Premix Ex TaqTMⅡ试剂盒操作qRT-PCR 反应。各引物序列详见表1,β-Actin 为内参基因。
1.3.10 数据分析
采用IBM SPSS 20.0 软件(IBM Corp.Armonk,NY,USA)统计分析,用Graphpad Prism 7.0 软件(Graphpad Software,San Diego,USA)作图。所有实验结果以平均值±标准差(¯x±s)表示。根据单因素方差(ANOVA)检验,分析实验组与空白对照组之间的显著性差异,以P<0.05 为差异具有统计学意义。
2 结果与讨论
2.1 多花黄精提取物的得率及功能性成分含量的比较
用70%乙醇提取RPE、PPE 和用复合酶提取CPP得到提取物占原料的质量分数分别为53.35%、53.30%和14.02%。表2 四种提取物主要功能成分在含量上各不相同。其中多糖在原料中的质量分数在CPP 中73.33%是最高的,皂苷在PPE 中13.63%最高,黄酮在PPE 中5.37 mg/g 最高,总酚在PP 中47.65 mg/g最高。两种多花黄精生品提取物RPE、CPP 中的多糖组分质量分数要明显高于两种九蒸九制品提取物PPE和PP,但总皂苷更低。另外,PPE、PP 中的总黄酮、总酚酸质量分数也高于RPE 和CPP。
表2 多花黄精各提取物中总多糖、总皂苷、总黄酮、总酚质量分数的比较(,n=3)Table 2 Comparison of Polygonatum cyrtonema Hua extract yield,total polysaccharides,total saponins,total flavonoids,and total phenols

表2 多花黄精各提取物中总多糖、总皂苷、总黄酮、总酚质量分数的比较(,n=3)Table 2 Comparison of Polygonatum cyrtonema Hua extract yield,total polysaccharides,total saponins,total flavonoids,and total phenols
注:数值以平均值±标准差表示(n=3)。根据Duncan 检验,同列右肩不同的小写字母表示具有显著差异(P<0.05);RPE 为多花黄精生品乙醇提取物,PPE 为九蒸九制品乙醇提取物,CPP 为多花黄精多糖,PP 为市售多花黄精九蒸九制品多糖。
多花黄精的药理作用与其主要的多糖、皂苷、黄酮、多酚等活性成分密切相关[25-28]。生黄精在炮制过程中,多糖减少可能是由于黏液质消失水解,出现糖异构化,单糖成分变化,半乳糖含量升高,葡萄糖、甘露糖降低,β-1,4-Galp 出现,β-1,4-Manp 增加[29,30]。黏液质水解可显著减少引起黄精刺激性的物质,从而降低毒性,而多糖分解成小分子糖类,易被机体吸收,薯蓣皂苷元、黄酮等有效功能性成分增加,可达增效目的[31]。Wang 等[32]发现黄精的九制品比生品具有更显著的“益气活血,补脾、肾、肝”的作用。因此,多花黄精九蒸九制品乙醇提取物和九蒸九制品多糖中的多糖低但可能得到了更多的有效成分,作用更佳。
2.2 多花黄精提取物对3T3-L1 前脂肪细胞增殖的影响
如图1、2 所示,RPE、PPE、CPP 和PP 能够以剂量关系和时间关系的方式抑制3T3-L1 前脂肪细胞的活力。如表3 所示,处理24、48 和72 h 后,各提取物对3T3-L1 前脂肪细胞增殖的半抑制质量浓度(IC50)均呈下降趋势,RPE、PPE、CPP、PP 分别从8 334.00、7 450.00、866.80、1 406.00 µg/mL 降到7 829.00、2 617.00、798.40、1 062.00 µg/mL。且IC50顺序为RPE>PPE>PP>CPP。几项研究表明,多花黄精提取物抑制各种代谢疾病细胞增殖,包括HepG2 细胞、3T3-L1 细胞、C2C12 肌管细胞和内皮细胞[33-37]。RPE、PPE 对3T3-L1前脂肪细胞的细胞毒性较小,且500 μg/mL 以内的醇提取物和100 μg/mL 以内的黄精多糖对3T3-L1 脂肪细胞的存活率基本没有影响,这对于后续的体外抗肥胖实验是安全质量浓度。

图1 多花黄精提取物对3T3-L1 前脂肪细胞的増殖抑制作用(剂量效应)Fig.1 Inhibitory effect of Polygonatum cyrtonema Hua extract on proliferation of 3T3-L1 preadipocytes (Dose effect)

图2 多花黄精提取物对3T3-L1 前脂肪细胞的増殖抑制作用(时间效应)Fig.2 Inhibitory effect of Polygonatum cyrtonema Hua extract on proliferation of 3T3-L1 preadipocytes (Time effect)

表3 多花黄精各提取物作用下3T3-L1 细胞的IC50Table 3 IC50 of 3T3-L1 cells under the action of Polygonatum cyrtonema Hua extract
2.3 多花黄精提取物对3T3-L1 前脂肪细胞周期的影响
3T3-L1 细胞经四种多花黄精提取物处理24 h 后,细胞周期变化结果如图3 所示,与对照组相比,随着RPE和PP 处理质量浓度的增加(50、500、1 000 µg/mL),3T3-L1前脂肪细胞进入S期的比例逐渐减少,进入G2/M期的比例无明显变化,G0/G1 期有所上升。当PPE 和CPP组质量浓度为50 µg/mL 时,部分细胞被阻滞在G0/G1期,阻碍向S 期进程。PPE 组和CPP 组未看出明显的剂量关系,这可能是由于当质量浓度大于PPE 应选用的最大剂量380 µg/mL 和CPP 应选用的100 µg/mL 后,细胞本身活力明显下降,状态变差,导致G0/G1 期比例大幅下降而G2/M 期比例大幅上升。由上推测多花黄精提取物抑制前脂肪细胞增殖可能与G0/G1 期阻滞有关。

图3 多花黄精提取物对3T3-L1 前脂肪细胞周期的影响Fig.3 Effect of Polygonatum cyrtonema Hua extract on 3T3-L1 preadipocyte cycle
2.4 多花黄精提取物诱导3T3-L1 前脂肪细胞的凋亡
如图4 所示,四种多花黄精提取物均能有效促进前脂肪细胞凋亡。当以RPE 处理3T3-L1 前脂肪细胞后,早期凋亡率、晚期凋亡率及总体凋亡率均随质量浓度上升而显著升高(P<0.05),促早期凋亡作用呈现出明显的剂量依赖性。当以PPE 处理后,早期凋亡率、晚期凋亡率以及总体凋亡率先上升后降低,在95 μg/mL 凋亡最明显(早期凋亡率9.12%,晚期凋亡率19.00%,总体凋亡率28.12%)。当以CPP 处理后,早期凋亡率以及总体凋亡率总体上升,晚期凋亡率呈先上升后平稳趋势。当以PP 处理后,早期凋亡率、晚期凋亡率及总体凋亡率先上升后降低,在50 μg/mL凋亡最明显(早期凋亡率15.50%,晚期凋亡率13.40%,总体凋亡率28.90%)。其他研究表明,400 µg/mL 剂量黄精多糖可诱导HepG2 细胞凋亡,阻滞G1 期细胞周期[35],可反映本文多花黄精提取物将部分细胞阻滞在G0/G1 期延缓3T3-L1 前脂肪细胞的细胞周期进程,促进早期凋亡。

图4 多花黄精提取物诱导3T3-L1 前脂肪细胞凋亡的作用Fig.4 Effect of Polygonatum cyrtonema Hua extract on 3T3-L1 preadipocyte apoptosis
2.5 多花黄精提取物对3T3-L1 前脂肪细胞分化的影响
IBMX、地塞米松和胰岛素联用的情况下可诱导3T3-L1 前脂肪细胞分化[38]。如图5 所示,诱导分化后,对照组细胞出现较大的红色斑点,说明细胞内存在较大的脂质沉积。加入多花黄精提取物后,3T3-L1 前脂肪细胞分化受到不同程度的抑制,细胞内脂肪堆积减少,脂滴变小,油红O 染色较空白组弱。抑制程度随质量浓度升高而加重。对细胞中总脂质的体积分数进行了分析,如表4 所示。在四种多花黄精提取物的干预下,成熟脂肪细胞内的脂滴体积分数均减少,脂滴沉积情况均得到显著改善,且高剂量组的PP(100 µg/mL)和PPE(380 µg/mL)脂滴体积分数降低的程度最大(28.39%、37.97%),效果最好。体内研究表明黄精乙醇提取物改善了肥胖小鼠的代谢特征[33,34]。在本研究中可以发现,多花黄精提取物能通过促进成熟脂肪细胞脂解降低脂滴的体积分数,抑制3T3-L1 细胞向成熟脂肪细胞的分化,其中多花黄精九蒸九制品提取物PPE 的干预效果比生品提取物RPE、CPP 的效果更好。

图5 多花黄精提取物对3T3-L1 前脂肪细胞分化的影响(×400)Fig.5 Effect of Polygonatum cyrtonema Hua extract on 3T3-L1 preadipocyte differentiation (×400)

表4 多花黄精提取物对3T3-L1 前脂肪细胞分化的影响Table 4 Effect of Polygonatum cyrtonema Hua extract on TG content in mature adipocytes
2.6 多花黄精提取物对成熟脂肪细胞内甘油三酯含量的影响
如表5 所示,与对照组相比,四种多花黄精提取物能促进成熟脂肪细胞的脂解,RPE、CPP 组体现出了明显的剂量关系,但PPE、PP 组没有明显的剂量关系。此外,多花黄精九蒸九制品提取物高剂量组的甘油三酯下降程度比生品提取物组更大,计算得380 µg/mL PPE 组细胞TG 含量下降了89.07%,是同样质量浓度RPE 组(79.19%)的1.12 倍,是100 µg/mL CPP 组(85.28%)的1.04 倍。本实验证明了多花黄精提取物能通过促进成熟脂肪细胞脂解降低甘油三酯的含量,从而达到减小脂肪细胞体积的效果,有效阻止3T3-L1细胞向成熟脂肪细胞的分化。相似地,其他研究在添加50 μg/mL 黄精提取物的分化培养基中培养前脂肪细胞14 d,发现显著减少了细胞内脂肪的积累,降低脂肪含量至对照组的80%以下[34]。

表5 多花黄精提取物对成熟脂肪细胞内TG 含量的影响Table 5 Effect of Polygonatum cyrtonema Hua extract on TG content in mature adipocytes
2.7 多花黄精提取物对3T3-L1 细胞分化相关基因mRNA 的影响
脂肪生成是指成纤维细胞由前脂肪细胞转化为脂肪细胞,脂肪细胞标志物的表达和脂质的聚集是在3T3-L1 成纤维细胞系中被化学诱导的。前脂肪细胞的分化受一系列因素调控,其中C/EBPα和PPARγ作为核心转录因子,诱导脂肪细胞分化和增殖,在分化过程中协同促进脂肪生成。C/EBPβ在分化早期表达,并刺激C/EBPα和PPARγ的转录。脂代谢酶如FABP4、LPL 和FAS 的表达在脂肪形成过程中受到PPARγ和C/EBPα的调控。分化抗原簇 36(Cluster of Differentiation,CD36)与PPARγ正相关,CD36 基因沉默导致PPARγ表达降低可能导致脂肪细胞分化受损,这与PPARγ下调损害前脂肪细胞分化的发现一致[39,40]。甾醇调节元件结合蛋白-1c(SREBP-1c)是一种辅助脂肪形成的调节因子,参与脂质代谢并调节FAS[41]。从总体趋势看,虽然各质量浓度RPE 组(95、190、380 µg/mL)PPARγmRNA 表达水平与对照组无显著差异,但RPE、PPE、CPP、PP 均不同程度下调了3T3-L1 脂肪细胞PPARγ和C/EBPαmRNA 表达。但是,在完全分化的脂肪细胞中,RPE、PPE、CPP和PP 对SREBP-1c mRNA 表达无影响。之前的研究发现,黄精中多糖成分的12 周干预显著抑制了PPARγ和C/EBPα的mRNA 水平[42],与实验结果吻合。LPL是脂肪分化过程中的关键因素之一,也在脂肪生成的早期阶段表达,并且在成熟脂肪细胞中达到稳定水平。LPL 在脂质代谢中也起着重要作用,LPL 催化脂蛋白衍生的三酰基甘油的水解,并允许脂肪酸在脂肪组织中积累,脂肪酸在脂肪细胞中重新酯化以形成储存的三酰基甘油[43,44]。如图6d 所示,经RPE、PPE、PP处理后,3T3-L1 小鼠前脂肪细胞LPL mRNA 表达水平下降,随剂量增加而降低,而经CPP 处理后LPL mRNA 表达水平未见下降趋势。这些控制脂肪细胞分化的转录物是关键的早期脂肪形成调节因子,表明RPE、PPE、CPP、PP 均能有效的抑制PPARγ,C/EBPα这两种转录因子,RPE、PPE、PP 抑制LPL mRNA 水平,从而阻滞早期脂肪细胞分化。

图6 多花黄精提取物对分化后细胞相关基因mRNA 表达水平的影响Fig.6 Effect of Polygonatum cyrtonema Hua extract on mRNA expression of related genes in differentiated adipocytes
脂肪形成遵循一个多阶段的过程,根据脂肪形成水平的不同来组织转录物和蛋白质的表达模式,在不同阶段相互协调。脂肪酸结合蛋白4(Fatty Acid Binding Protein 4,FABP4),也称aP2,是脂质结合蛋白超家族一员,多在脂肪细胞中表达,可调节脂肪酸的氧化,并在生命体内脂肪酸摄取、运输及氧化还原过程具有关键的调控作用。FABP4 决定了脂肪细胞后期的分化阶段,相关脂肪酸和甘油三酯的生物合成受到SREBP、PPARγ和C/EBPα的调控。研究显示,FABP4能够与长链脂肪酸紧密结合,促进脂肪酸的跨膜转运,影响脂质在脂肪细胞中的蓄积及脂质代谢[45]。FABP4表达降低可显著阻断甘油三酯的从头合成和脂肪细胞分化[46,47]。FABP4 mRNA 表达水平的结果如图6e 所示。随着成熟脂肪细胞处理剂量的增加,RPE、PPE、CPP 和PP 组FABP4 mRNA 的相对表达量均随剂量增大而逐渐降低,由此抑制分化后期脂肪细胞内脂质产生与累积。
脂肪形成不仅影响脂质代谢,而且影响葡萄糖和蛋白质代谢。研究表明,脂肪形成的机制与多种信号通路有关,包括一磷酸腺苷活化蛋白激酶(Adenosine Monophosphate-Activated Protein Kinase,AMPK)通路、胰岛素信号通路、PPAR 调控、葡萄糖通路等,这些信号通路可作治疗肥胖和代谢性疾病的药物靶点的主要来源[48]。例如AMPK 的激活还通过改变参与脂肪酸代谢的酶,如肉碱棕榈酰转移酶-1(CPT-1)的表达来调节脂肪酸的生物合成和氧化,CPT-1 是调节酰基辅酶A 向β氧化的主要限速酶,增加CPT-1 的活性或表达将促进3T3-L1 分化后细胞中积累的脂肪酸的氧化,这有利于减轻脂肪的积累[49]。肉碱棕榈酰转移酶-1(CPT-1)mRNA 表达结果见图6f。经多花黄精提取物处理后,3T3-L1 前脂肪细胞中CPT-1 mRNA表达增加,表明多花黄精提取物促进CPT-1 的活性,可能是通过激活AMPK介导减少脂质积累。Yang等[50]研究也表明,黄精灌胃NAFLD 大鼠14 周后,CPT-1的mRNA 表达显著上调。
糖苷、类黄酮、生物碱和萜类是增强抗脂肪活性的植物化学物质的主要组成部分,含有这些活性成分的药食两用植物可通过各种代谢和细胞靶点对肥胖起有益作用。已有研究证明一些天然产物可以在3T3-L1模型中通过调节脂代谢相关因子产生抗肥胖活性。例如,Lamichhane 等[51]研究证实枸杞子乙醇提取物、正己烷馏分、乙酸乙酯馏分和三种分离的化合物均显示出抗脂肪形成活性,下调了关键的脂肪形成标志物PPARγ、SREBP-1、FABP4、aP2、LPL 和瘦素。Nallamuthu 等[52]比较评价了甘蓝、罗勒和辣木叶醇提取物对3T3-L1 前脂肪细胞的抗脂肪形成作用及其脂肪酶抑制特性,发现罗勒在抑制胞内甘油三酯的积累作用最强,下调了脂肪生成的关键转录因子(PPARγ、C/EPBα和FAS 酶),并调节了瘦素和脂联素的释放曲线,具有显著抗脂肪生成活性以及脂肪酶抑制特性。目前多花黄精提取物体外干预3T3-L1 前脂肪细胞和分化后脂肪细胞的研究未见报道,本实验研究表明,多花黄精提取物可通过抑制促脂肪生成基因PPARγ、C/EBPα、FABP4 和LPL 的表达和促进脂肪酸氧化相关基因CPT-1 的mRNA 表达来抑制3T3-L1 细胞的分化,减少脂质积聚。
3 结论
综上,多花黄精提取物富含多糖、皂苷、黄酮、多酚等关键活性成分,九蒸九制品提取物中的多糖质量分数降低,但其他活性成分增多。多花黄精提取物能够以剂量和时间依赖性方式抑制3T3-L1 前体脂肪细胞的增殖,将部分3T3-L1 前脂肪细胞阻滞在G0/G1期,延缓3T3-L1 前脂肪细胞的细胞周期进程,并具有促进该细胞凋亡的作用。多花黄精提取物可通过减少胞内甘油三酯的含量、抑制促脂肪生成蛋白(PPARγ、C/EBPα、FABP4 和LPL)的表达来抑制3T3-L1 细胞的分化,并且它还能够通过促进脂肪酸氧化相关基因CPT-1的mRNA表达来减少分化的3T3-L1细胞中的脂质积聚。从实验结果上看,RPE 主要是抑制C/EBPα、LPL 和FABP4 的mRNA 基因的表达,PPE主要是抑制C/EBPα、LPL 和FABP4 的mRNA 的表达量并促进CPT-1 的mRNA 基因表达,CPP 主要抑制了PPARγ的mRNA 基因的表达。本研究为黄精向食品的进一步研发提供理论依据,推动黄精产业向高新技术、新领域、深加工方向发展,对中国黄精食品的可持续发展具有重要意义和作用。未来黄精提取物在体内的抗肥胖作用,如对肥胖相关肠道菌群的调节以及产热相关基因和蛋白质的调节,还需进一步验证。
