藜麦麸皮皂苷的抗氧化活性及基于代谢组学探究其改善非酒精性脂肪肝的作用机制
2024-01-09余远陶飞燕纪雪莹宋林梦张若愚冯静薛鹏
余远,陶飞燕,纪雪莹,宋林梦,张若愚,冯静,薛鹏*
(1.潍坊医学院公共卫生学院,山东潍坊 261053)(2.潍坊医学院康复学院,山东潍坊 261200)
长期高脂饮食会使机体能量摄入超过能量消耗,从而导致脂质代谢紊乱,引发高脂血症、肥胖及二型糖尿病等代谢综合征。非酒精性脂肪肝(NAFLD)是代谢综合征在肝脏的局部表现,以甘油三酯在肝脏蓄积和肝脂肪变性为特征性病理改变,包括单纯非酒精性脂肪肝、非酒精性脂肪肝炎[1]。目前还未有治疗NAFLD 的特效药物,寻找植物源性化合物进行预防和治疗该疾病具有重大意义[2]。NAFLD 的发病机制复杂且尚不清楚,被广泛接受的“二次打击”学说认为,脂肪堆积及其引起的氧化应激水平升高是导致NAFLD的重要机制[1,3]。
藜麦原产于南美安第斯地区,是印加人的主要食物,被联合国粮农组织认为是“全营养食品”[4]。它不仅富含氨基酸、维生素和不饱和脂肪酸,并且含有多糖、多酚和皂苷等生物活性物质,是一种很有前途的功能性和药用食品[5]。藜麦皂苷存在于藜麦的各个部位,如根、茎叶、种子等,在藜麦的加工副产物藜麦麸皮中含量最丰富,为3%~8%左右[6]。经化学结构鉴定,藜麦皂苷主要为五环三萜皂苷,齐墩果酸、美商陆酸是其主要皂苷元构型[7]。研究证明,皂苷能降低血脂,预防肝细胞脂肪变性,可作为天然降脂药物的候选物之一[8]。日常膳食添加藜麦能降低体重和改善脂质代谢紊乱,而含有藜麦皂苷的藜麦的作用更加明显[4]。藜麦总皂苷能减少3T3-L1 前脂肪细胞中与脂质合成有关的基因和蛋白表达水平[9]。但是在长期高脂饮食刺激下,藜麦麸皮总皂苷体内抗氧化活性和对代谢组学的影响尚未被研究。
代谢组学是利用高分辨率和高灵敏度的测量分析仪器对待测物中的内源性小分子代谢物进行定性定量分析,可用于发现与疾病发生发展有关的代谢物质和代谢途径变化,从而有助于揭示机体发病机制及改善机制[10]。内源性代谢产物可以改变机体表型[11,12]。待测物质具有多样性,尿液、粪便、血清和组织匀浆皆可用于代谢组学分析。研究长期高脂饮食下藜麦麸皮总皂苷对尿液内源性代谢物的影响,利于探究降脂作用机制[13,14]。
本文旨在探究藜麦麸皮总皂苷体外抗氧化活性,以及通过尿液多组学研究藜麦总皂苷对NAFLD 的影响,阐述藜麦麸皮总皂苷预防肝脏脂质堆积的机理,为藜麦麸皮总皂苷用于NAFLD 防治的研究提供实验和理论依据。
1 材料与方法
1.1 材料和试剂
藜麦麸皮,内蒙古益稷生物科技公司;甲醇、乙醇(质谱级),Thermo Fisher Scientific;乙腈(质谱级),Thermo Fisher Scientific;纯净水,娃哈哈公司;瑞伐他汀钙片(批号:501109),阿里斯康药业;高脂饲料(成分含量以质量分数表示):10%猪油、4%胆固醇、10%蛋黄粉、0.4%胆酸钠和75.5%普通标准动物饲料,购自济南朋悦实验动物公司;TC(96T,批号:A111-1-1)、TG(96T,批号:A110-1-1)、ALT(96T,批号:C009-2-1)、AST(96T,批号:C010-2-1)、MDA(96T,批号:A003-1-2)和GSH(96T,批号:A006-2-1)试剂盒,购自南京建成生物工程研究所;抗坏血酸(Vc),购自北京索莱宝科技有限公司。
1.2 主要仪器
U3000 型UPLC-Q-Exactive-MS(Thermo Fisher Scientific,美国),配Amide column(2.1 mm×100 mm,1.7 μm,Waters,德国)分析柱;低温高速离心机,德国Sigma;酶标仪,美国Thermo Fisher Scientific Oy;倒置显微镜,日本OLYMPUS。
1.3 方法
1.3.1 藜麦麸皮总皂苷的提取
参考赵雷等[15]的方法对藜麦麸皮皂苷进行提取。准确称量藜麦麸皮100 g,用φ=75%的乙醇进行超声提取(V:V=8:1),取上清液,旋蒸浓缩除去乙醇后,依次通过石油醚、乙酸乙酯、正丁醇进行萃取,正丁醇部位干燥后即得藜麦总皂苷。
1.3.2 藜麦麸皮总皂苷体外抗氧化活性测定
1.3.2.1 DPPH 自由基清除率的测定
参照傅钰等[16]的方法,分别配置0.1、1、5、8 和10 mg/mL 的藜麦麸皮总皂苷溶液和Vc 溶液,Vc 作为阳性对照物,测定藜麦麸皮总皂苷的DPPH·清除率。
1.3.2.2 还原力的测定
分别配置0.1、1、5、8 和10 mg/mL 的藜麦麸皮总皂苷溶液和Vc 溶液,Vc 作为阳性对照物。取样品溶液0.5 mL,分别加入0.2 mmol/L PBS 0.5 mL 和10 mg/mL 铁氰化钾溶液0.5 mL,涡旋混匀,水浴20 min,后加入100 mg/mL 三氯乙酸0.5 mL,离心(3 000 r/min,10 min)。取上清液0.5 mL,加入超纯水2.5 mL 和1 mg/mL 三氯化铁0.5 mL,涡旋混匀,室温静置10 min 后,用酶标仪在波长700 nm 处测定吸光度值。
1.3.3 实验动物分组与给药
雄性SD 大鼠,体质量(220±10)g,购自济南朋悦实验动物公司,生产许可证号:SCXK(鲁)20190003,动物实验及操作经潍坊医学院伦理委员会批准(2020SDL183)。通风笼中饲养,自由饮水摄食,明暗交替条件为12 h/12 h。适应性喂养一周后,分成体重无差异性的2 组:空白组CON(n=6)、高脂饮食组(n=36),2 周后,剔除高脂饲料不耐受、体重不升的大鼠。CON 组予持续实验动物标准饲料饲养,高脂饮食组予持续高脂饲料饲养。高脂饮食组大鼠随机分成5 组(n=6),模型组(HFD)、HFD+藜麦麸皮皂苷低剂量(25 mg/(kg·d),LQS)、HFD+藜麦麸皮皂苷中剂量(100 mg/(kg·d),MQS)、HFD+藜麦麸皮皂苷高剂量(400 mg/(kg·d),HQS)和阳性药物瑞伐他汀钙片对照组(10 mg/(kg·d),Statins)。分组后,CON、HFD 组予蒸馏水灌胃,其他组予不同剂量藜麦麸皮总皂苷进行等体积灌胃,10 mL/(kg·d),实验周期8 weeks。实验结束前一天,将大鼠置于代谢笼中,每两只一笼,收集24 h 尿液,-80 ℃冻存。
1.3.4 标本采集与处理
实验结束前,大鼠禁食不禁饮12 h。予乙醚麻醉后,眼眶后静脉丛采血至无抗凝分离胶管中,室温静置一小时后,3 500 r/min 离心(4 ℃,10 min),取上清,分装后冻存于-40 ℃备用。迅速取出新鲜肝脏,予4 ℃生理盐水清洗后,用吸水纸吸干水分,取各组大鼠肝脏相同部位固定于质量分数为4%的多聚甲醛组织固定液中。肝脏固定后24 h 后,送至武汉赛维尔生物科技有限公司,行石蜡包埋,油红染色。
1.3.5 尿液代谢组学分析
1.3.5.1 尿液前处理
因为尿液中多为水溶性物质,因此使用亲水柱Amid进行分离。尿液原液放置常温复溶后,取200 μL,加入600 μL 冰甲醇(V:V=1:3),斡旋30 s 后冰箱静置1 h,12 500 r/min 离心5 min,取上清200 μL 常温中待干,1 mL 质谱级甲醇复溶后稀释50 倍,用0.22 μm滤膜过滤,备用[17]。
1.3.5.2 UPLC-MS 条件
采用UPLC-AMIDE-Q-Exactive MS 进行检测的条件。参考张若愚等[18]的方法,流动相A 为100 mmol/L醋酸铵水溶液,流动相B 为乙腈,线性梯度洗脱(0~10 min,99% B;10~15 min,40% B;15~20 min,99%B;20~30 min,1% B),进样量4 μL,流速0.3 mL/min,柱温30 ℃,紫外波长220 nm。质谱方法:鞘气流速30 Arb;辅助气体流速8 Arb;喷雾电压3.2 kV;离子传输管温度320 ℃;载气为氮气,Full MS-ddMS 模式下采用电喷雾离子源(ESI)正、负离子模式进行扫描,质荷比采集范围50~1 200m/z。
1.3.5.3 代谢组学数据和分析
利用Xcalibur 软件获得含保留时间(Rt)、峰面积和碎片分子量的图谱,使用Compound Discover 3.2.0软件检索数据库鉴定代谢产物,最终获得含有Rt、精确分子量、分子式和相对含量的序列表。采用SIMCA-P14.1 对数据进行无监督主成分分析(Principal Component Analysis,PCA)和正交偏最小二乘法(Orthogonal Partial Least-squares Discrimination Analysis,OPLS-DA)等多维度统计分析,进行差异化合物的筛选。PCA 和OPLS-DA 常被用来分析和比较代谢组学中获得的高通量、多维度的数据。PCA 是忽略每个样本的分组,单纯对每个样本进行分析,该模型能反应整体代谢物谱的分离趋势;OPLS-DA 是建立在有明确分组的基础之上对样本进行分析,该模型能缩小组内差异,将组间差异最大化,利于获得使两组间差异化合物,提供更多的生物学信息。差异代谢物通过MetaboAnalyst 5.0 和SMPDB 数据库进行代谢通路拓扑分析,最终得出差异代谢产物富集出的代谢通路。通过阐述其生物学意义,评价藜麦麸皮皂苷对机体代谢的影响。
1.3.6 数据处理与分析
生化实验结果以均值±标准差表示(X±SD),采用SPSS 25.0 软件对多组数据进行One-way ANOVA统计学分析,方差齐性用LSD 检验,方差不齐用Dunnett' s 检验。P<0.05 表示差异具有统计学意义。
2 结果与讨论
2.1 藜麦麸皮总皂苷的抗氧化活性
2.1.1 DPPH 自由基的清除能力
由图1a 可知,藜麦麸皮总皂苷质量浓度在0.1~10 mg/mL 时,均具有清除DPPH·的能力,并呈现出量效关系,随着质量浓度的增加,清除能力变强。当皂苷质量浓度为10 mg/mL 时,对DPPH·的的清除率为86.25%,对照品Vc 的DPPH·清除率较高。
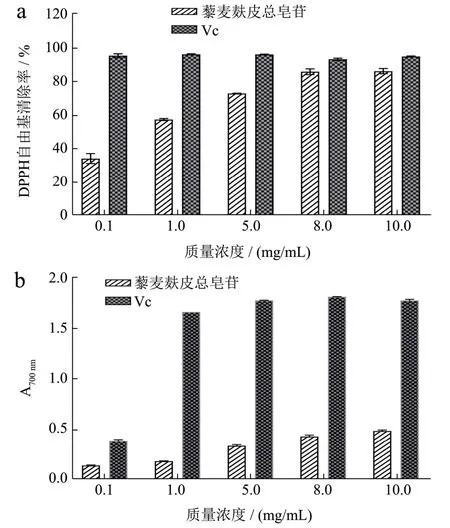
图1 藜麦麸皮总皂苷的体外抗氧化活性Fig.1 In vitro antioxidant activity of quinoa saponins in quinoa husks
2.1.2 总还原力
还原力可用于评价天然化学物质抗氧化能力。还原力的大小和700 nm 处溶液的吸光度成正比。如图1b 所示,藜麦麸皮总皂苷具有还原力。当皂苷质量浓度为10 mg/mL 时,还原力为0.49,对照品Vc 的还原力较高。
傅钰等[16]用三种不同颜色藜麦的混合皂苷进行DPPH·清除率和还原力测量实验,结果表明三种藜麦皂苷均具有抗氧化活性,DPPH·清除率和还原力分别最高可达80%和0.35。韦兴英等[19]测得藜麦总皂苷的DPPH·清除率和还原力分别最高可达76.5%和0.6。本研究发现,藜麦麸皮总皂苷具有良好的体外抗氧化效果,和之前研究结果一致。DPPH 是一种以氮为中心的自由基。除了活性氧自由基外,活性氮自由基也能促进NAFLD 的发生发展[20]。
2.2 藜麦麸皮总皂苷对肝脏组织病理形态的影响
肝脏组织脂质沉积是非酒精性脂肪肝特征性病理变化。图2 为肝脏组织切片油红染色结果,和空白组相比,模型组肝脏脂滴明显增多,肝细胞索排列紊乱,说明大鼠NAFLD 模型成功建立;藜麦麸皮总皂苷组能不同程度的减少肝脏脂滴沉积,肝细胞索排列较为整齐,效果呈浓度依赖关系,瑞伐他汀组几乎没有脂质沉积。切片结果和生化结果一致。因此,藜麦麸皮总皂苷能降低肝脏脂质沉积,且呈剂量依赖性。

图2 藜麦麸皮总皂苷对肝脏脂质的影响Fig.2 Effect of quinoa saponins on the pathological morphology of rats' liver
2.3 藜麦麸皮总皂苷对肝脏脂质、肝功能指标和氧化损伤的影响
和空白组对比,模型组肝脏TC、肝脏TG、AST和ALT 明显升高(P<0.05),说明高脂饮食已导致肝脏脂肪堆积和肝损伤(表1);和模型组相比,藜麦麸皮总皂苷组和瑞伐他汀组的肝脏脂质、ALT 和AST 明显下降(P<0.05),不同剂量的藜麦麸皮总皂苷呈现出不同的降脂保肝效果,剂量越高,对肝脏脂质和肝功能指标的改善作用越明显,高剂量组效果比他汀组更好,该结果说明藜麦麸皮总皂苷能改善由高脂饮食引起的NAFLD。和空白组比较,模型组MDA显著增加(P<0.05),GSH 显著降低(P<0.05);和模型组比较,皂苷干预组的MDA 降低(P<0.05),血清GSH 含量明显升高(P<0.05),表明藜麦麸皮总皂苷改善NAFLD 可能与降低高脂饮食引起的氧化应激有关。

表1 藜麦麸皮总皂苷对肝脏脂质和肝功能指标的影响(n=6)Table 1 Effects of quinoa saponin on liver lipids and liver function (n=6)
氧化应激水平升高是NAFLD 的重要发病机制之一。机体存在天然的抗氧化系统。高脂饮食使机体自由基增加,当超过机体清除率的时候,会造成抗氧化系统失调,使脂质过氧化物堆积,导致肝细胞膜和线粒体的损伤[3]。长链脂肪酸的氧化分解在肝细胞线粒体内进行,线粒体内膜上含有转运长链脂肪酸的肉毒碱棕榈酰转移酶,是脂肪酸分解氧化的限速酶,因此,损伤线粒体会加重脂质代谢紊乱[21]。MDA 是脂质过氧化的最终产物之一,常用来衡量机体氧化损伤程度。GSH 机体内最重要的非酶性抗氧化物,能够清除自由基。藜麦麸皮总皂苷能降低MDA,增加GSH,说明皂苷能够提高抗氧化能力,减轻脂质堆积导致的氧化应激。正常情况下,ALT 和AST 主要存在于肝细胞内,血清中浓度较低。肝细胞损伤时,血清中ALT 和AST 会异常升高。藜麦皂苷和瑞伐他汀干预后,ALT 和AST 明显降低;和他汀组相比,高剂量藜麦皂苷组肝损伤指标下降更明显,说明具有更好的降脂护肝效果。
2.4 尿液非靶向代谢组学分析
2.4.1 代谢轮廓分析
图3a 是尿液代谢物PCA 得分图,由图可知,中、高藜麦麸皮总皂苷干预组和模型组的无相交重叠部分,呈现出明显的聚类特征,说明藜麦麸皮总皂苷对整体代谢物谱产生了影响;6 个质量控制样本(Quality Control,QC)基本重合,说明检测仪器在整个检测分析过程中有高度的精确性和稳定性。图3b 是尿液代谢物OPLS-DA 得分图,每组样本分离更明显,模型的参数R2X>0.5、R2Y>0.5 和Q2>0.5,表明建立的模型具有较好的拟合优度和预测度。图3c 和3d 分别是正常组和模型组以及模型组和高剂量藜麦皂苷组的OPLS-DA 图,组间明显分开,说明NAFLD 和藜麦麸皮总皂苷使尿液代谢物产生了明显改变。
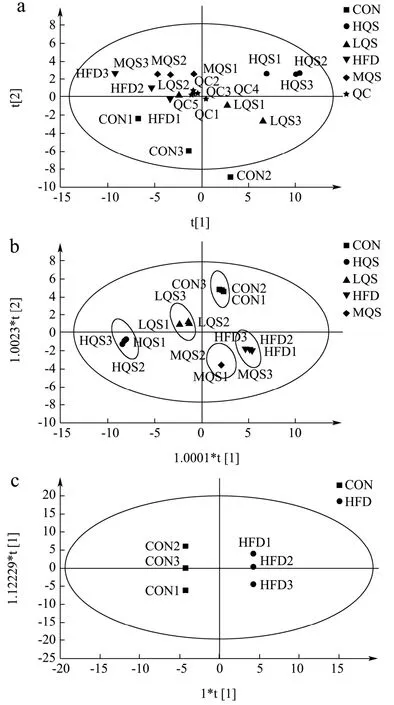
图3 尿液代谢物轮廓分析图Fig.3 Urine metabolites analysis
2.4.2 差异代谢物鉴定与分析
OPLS-DA 模型中每一个代谢物的权重值(Variable Importance in the Project,VIP)大小代表该化合物对模型区分的贡献值。以VIP≥1,P<0.05 和|log2(fold change)|≥0.32 作为标准,鉴定出差异代谢物[22]。筛选出正常组和模型组以及高剂量藜麦皂苷组和模型组之间的差异代谢物后,分析它们的变化趋势,藜麦皂苷干预后出现回调的代谢物可作为潜在的生物标志物。最终确定藜麦皂苷可能通过调节7 种潜在生物标志物改善NAFLD,如表2。与正常组相比,模型组 Betaine、Paracetamol、N,N-Dimethylglycine、2-Amino-4-[(3-Aminop-ro-pyl)amino]Butanoic Acid、Apigenin、L-Proline 和L-Glutamic Acid 含量明显下降;和模型组相比,高剂量藜麦皂苷组中该7 种潜在生物标志物明显升高,说明藜麦皂苷对NAFLD 引起的异常代谢物水平有逆转作用,能改善机体代谢紊乱。
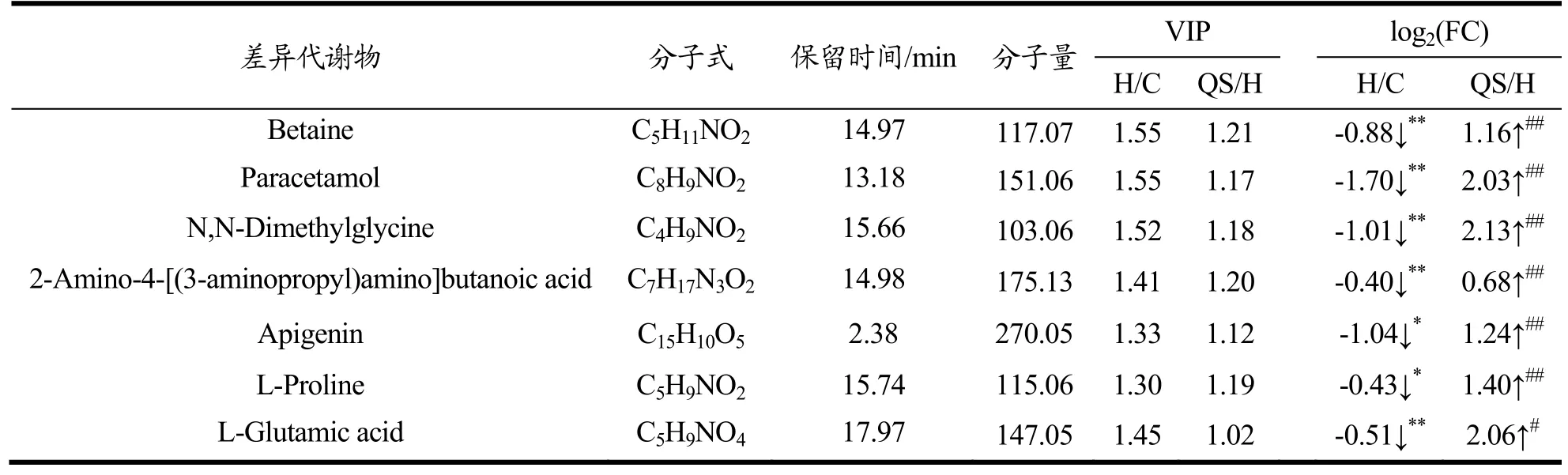
表2 尿液差异代谢物Table 2 The differential metabolites in urine
2.4.3 代谢通路分析
采用Metabo Analyst 5.0 工具,对表2 中差异代谢物进行富集通路分析。如图4 所示,柱子越长表示差异代谢物在该条代谢通路上出现的个数越多,颜色越深代表该条通路的影响值越高。差异代谢物主要影响的通路是甘氨酸和丝氨酸代谢(Glycine and Serine Metabolism)、甜菜碱代谢(Betaine Metabolism)、蛋氨酸代谢(Methionine Metabolism)与精氨酸和脯氨酸代谢(Arginine and Proline Metabolism)等。
差异代谢物谷氨酸(L-Glutamic Acid)、甜菜碱(Betaine)和二甲基甘氨酸(N,N-Dimethylglycine)富集在甘氨酸和丝氨酸代谢通路上,表明藜麦麸皮总皂苷对此代谢通路产生影响。张燕等[13]的研究表明,银耳多糖通过增加NAFLD 大鼠肝脏组织中内源性甘氨酸的产生改善甘氨酸和丝氨酸代谢通路,改善机体的氧化损伤,从而保护肝脏和降低肝脏脂肪堆积。单蕊[14]的研究表明,参苓白术散能通过甘氨酸、丝氨酸和苏氨酸代谢通路改善NAFLD 大鼠脂质代谢紊乱。甘氨酸、谷氨酸和半胱氨酸是体内抗氧化剂GSH 的重要组成部分。藜麦皂苷能增加血清GSH 水平。改善甘氨酸和丝氨酸代谢途径可能是藜麦皂苷提高机体抗氧化能力、降低肝脏脂质沉积的内在机制。值得一提的是,甜菜碱、二甲基甘氨酸、谷氨酸和甘氨酸是NAFLD 的生物标志物[23]。谷氨酸可作为治疗高脂血症的生物标志物和靶点[24]。在本次实验建立的NAFLD 大鼠模型尿液中,生物标志物甜菜碱、二甲基甘氨酸和谷氨酸均出现了下调,高剂量藜麦皂苷使之上调。因此,藜麦麸皮总皂苷可能通过增加谷氨酸的排泄和提高机体甜菜碱和二甲基甘氨酸代谢水平改善甘氨酸和丝氨酸代谢通路改善机体脂质代谢。
甜菜碱代谢和蛋氨酸代谢在脂质代谢中扮演着重要角色。差异代谢产物甜菜碱和二甲基甘氨酸均富集在这两条主要通路中(图4)。二甲基甘氨酸是甜菜碱去甲基化的下游产物。甜菜碱是一种有效的甲基供体,可促进同型半胱氨酸转化为蛋氨酸,以改善蛋氨酸代谢。蛋氨酸是人体重要的甲基来源之一,它为磷脂酰乙醇胺提供甲基,形成磷脂酰胆碱,可促进TG 以VLDL 的形式从肝脏排出,从而防止肝脏脂肪变性[8]。肝脏是脂质合成和代谢的主要场所,预防肝脏脂肪堆积和减少脂毒性对维持正常的脂质代谢具有重要作用。固醇调节元件结合蛋白(Sterol Regulatory Element Binding Protein,SREBP-1c)是机体调节胆固醇代谢和脂肪合成代谢的重要脂质转录因子,能够促进脂肪酸合成酶(Fatty Acid Synthetase,FAS)的表达,促进脂肪生成。蛋氨酸代谢异常会增加SREBP-1c 的表达,提高血脂水平[25,26]。蛋氨酸-胆碱缺乏饮食常用来诱导非酒精脂肪肝炎动物模型。
研究表明,甜菜碱可以通过铁代谢和脂质代谢相关基因的DNA 甲基化改善降低肝脏脂质沉积[27]。除了作为机体重要的甲基供体以外,甜菜碱可以通过改变肠道菌群,预防高脂饮食引起的肥胖和肝细胞脂肪变性[28]。甜菜碱本身也作为一种脂质化合物,参与TG的分解[8]。因此,藜麦麸皮总皂苷可能通过改变内源性代谢物二甲基甘氨酸和甜菜碱水平改善甜菜碱代谢和蛋氨酸代谢通路,从而预防NAFLD。
精氨酸和脯氨酸代谢途径的变化和肝损伤进展有关。精氨酸是脯氨酸(L-Proline)和肌酸的前体物质。脯氨酸代谢会产生活性氧,增加机体氧化应激水平,从而引起细胞凋亡和自噬[29]。杨璐等[22]证明栀子苷通过降低血清中脯氨酸含量,影响精氨酸和脯氨酸代谢途径,从而改善CCl4诱导的肝纤维化。肌酸能够降低S-腺苷甲硫氨酸的消耗和减少同型半胱氨酸的积累,降低肝损伤[25,30]。在本次实验研究中,藜麦皂苷降低NAFLD 大鼠尿液中脯氨酸含量,表明皂苷可能通过促进脯氨酸的排泄,改善机体精氨酸和脯氨酸代谢通路。
NAFLD 患者(大鼠模型)和正常个体(大鼠模型)相比,尿液会呈现不同的代谢谱特征,本次实验结果和之前研究一致[31-33]。多靶点和多途径是植物化学物质防治代谢性疾病的重要特点。NAFLD 的发病机制与胰岛素抵抗、炎症、肠道菌群和脂质代谢紊乱等有关。藜麦皂苷能抑制炎症、抑制体外胰脂肪酶活性和改善肠道菌群,可作为防治脂质代谢综合征的候选物[34,35]。除了将尿液非靶向代谢组学作为藜麦皂苷降脂机制的研究内容,未来还会对大鼠肝脏、血清以及粪便中内源性代谢物进行靶向代谢组学的探究,如脂质代谢组学、粪便短链脂肪酸检测和胆汁酸代谢等,从而获得更全面的生物学信息[11,36]。
3 结论
本研究利用藜麦麸皮为原料获取天然产物藜麦皂苷,其在体外具有良好的DPPH 自由基清除能力和还原力,并在体内表现出良好的抗氧化和降脂护肝作用,能减轻高脂饮食引起的肝脏脂肪病变。同时,采用基于UPLC-MS 的代谢组学研究方法,发现了正常组、NAFLD 模型组和藜麦皂苷干预组不同的代谢特征,确定了7 个潜在生物标志物在藜麦皂苷干预后,恢复或接近至正常代谢水平。这7 个差异代谢物主要与甘氨酸和丝氨酸代谢、甜菜碱代谢、蛋氨酸代谢和精氨酸和脯氨酸代谢途径有关,可能是藜麦皂苷的内在降脂机制。本实验为藜麦麸皮皂苷的后续利用和非酒精性脂肪肝的防治提供理论支持。
