牛源产肠毒素大肠杆菌的分离鉴定与致病性研究
2024-01-09张贺潘静赵敏王旭芬赵润涛侯琳张志丹周伟光
张贺,潘静,赵敏,王旭芬,赵润涛,侯琳,张志丹,周伟光*
(1.赤峰海关综合技术服务中心,内蒙古 赤峰 024000; 2.内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018)
大肠埃希菌(Escherichia coli,E.coli)主要存在于人和动物的肠道中,嗜热、嗜酸,是犊牛发生细菌性腹泻的主要病因之一[1]。其中产肠毒素大肠杆菌(enterotoxigenic E.coli,ETEC) 是引起1~7 日龄犊牛腹泻最为常见的致病性大肠杆菌,可引起犊牛脱水及酸中毒死亡。ETEC 分布广泛、侵袭力高,临床上表现为高热、食欲减退且粪便呈褐色,多为水样、糊状,部分犊牛消瘦死亡,给养殖场造成了重大经济损失,同时也是牛急性肠毒血症的病原之一[2-4]。近年来,由于我国畜牧业发展速度较快,以及牛养殖规模的不断扩大,由ETEC 引起的犊牛腹泻及败血症日益严重,发病率和死亡率不断升高[5-6]。
大肠杆菌O 抗原血清型的鉴定是大肠杆菌分型最为主要的方法。O 抗原凝集反应的血清学检测方法用时长,一些血清学交叉反应也会导致试验结果不准确[7-9]。而PCR 鉴定方法和使用wzx/wzy 和wzm/wzt 基因组序列的BLAST 检索方法可以精确对血清型进行鉴定。
本研究采集呼和浩特市周边地区犊牛养殖场腹泻犊牛肛拭子粪样进行ETEC 分离鉴定及毒力分析,在其中筛选出2 株毒力菌株,为进一步进行疫苗制备及免疫原性研究提供参考。
1 试验材料
1.1 主要试剂和仪器
细菌DNA 提取试剂盒购自全式金公司;500 bp DNA ladder、2 000 bp DNA ladder 和Premix Ex Taq购于TaKaRa 公司; 革兰染色液试剂盒和瑞氏染色液购自青岛海博生物。菌株编号CVCC209(血清型:O20:k101,产生ST 肠毒素)购于中国兽医微生物菌种管理保藏中心;通用台式离心机购自Thermo 公司;高速冷冻离心机和普通PCR 仪购自Eppendorf 公司; 定量PCR 仪购自Bio-Rad 公司;细菌恒温培养箱购自上海福玛实验设备有限公司。
1.2 病料来源
呼和浩特市周边地区腹泻粪样A 牧场14 份;B牧场8 份。
1.3 实验动物
SPF 级4 周龄ICR 小鼠,雌雄各半,购自斯贝福北京生物技术有限公司。
2 试验方法
2.1 病料处理及菌株纯化
将腹泻粪样置于LB 液体培养基内,于37 ℃恒温摇床200 r/min 增菌培养12 h,将培养后的增菌液划线接种于MAC 培养基上,划线后将培养基倒置于37 ℃恒温培养箱中培养24 h,用接种环挑取培养基上桃红色单个菌落于LB 液体培养基进行增菌培养,并标记号码,增菌后再次划线接种于EMB 鉴别培养基上,培养24 h 后挑取具有黑色金属光泽的单个菌落再次进行LB 液体培养基增菌培养,将增菌后菌液于-20 ℃甘油内保存[10]。
2.2 菌株分离鉴定
2.2.1 菌株PCR 鉴定。将2.1 分离鉴定后的菌株进行增菌培养,取增菌液进行DNA 提取,探针由实验室提供[11],合成引物序列见表1,引物由生工生物工程(上海)股份有限公司合成。
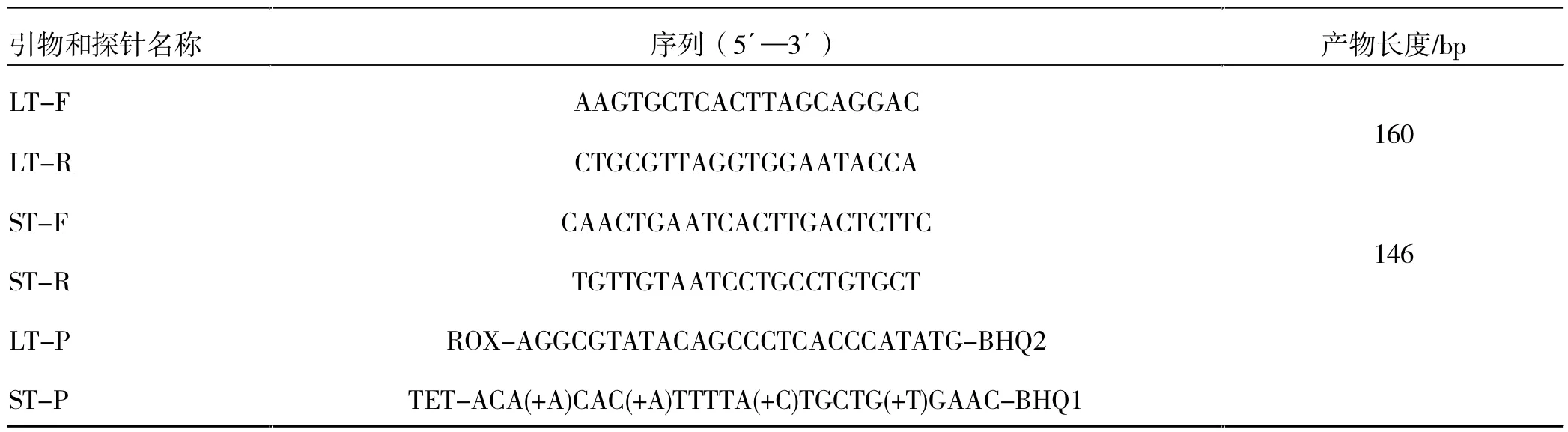
表1 ETEC 肠毒素和黏附素菌毛PCR 引物和探针
以上述DNA 为模板,对ETEC 肠毒素和黏附素菌毛进行双重定量PCR 扩增。采用25 μL 反应体系:Premix Ex Taq 12.5 μL,引物LT-F 和LT-R 各0.6 μL,引物ST-F 和ST-R 各1.2 μL,探针LT-P 0.6 μL,探针ST-P 1.1 μL,模板2 μL,ddH2O 补加至25 μL。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火延伸45 s,循环45 次观察结果。
2.2.2 菌株革兰染色镜检。用接种环蘸取1 滴生理盐水于载玻片中央,再用接种环蘸取固体培养基上的单个菌落与载玻片上的生理盐水混合,由内及外均匀涂开,进行火焰固定;使用革兰染液试剂盒进行染色,顺序为:A 液1 min、冲洗、B 液1 min、冲洗、C 液30 s、冲洗、D 液1 min,冲洗后用吸水纸吸取多余水分,晾干后进行镜检。
2.3 菌株致病力测定
2.3.1 菌株筛选。将ETEC 菌株于LB 液体培养基中增菌培养,置于37 ℃恒温摇床,200 r/min 培养12 h,取菌液3 mL 置于比色杯中测量其OD 值 (分光光度计读数为0.08~0.13,大肠杆菌浓度为1.5×108CFU/mL),调整待测菌浓度为1×109CFU/mL,选取4 周龄ICR小鼠(体重16~22 g)作为试验用鼠,根据菌株的数量设置组数,每组选取4 只小鼠作为研究对象,每只小鼠腹腔注射0.2 mL 菌液,同时分别设置灭菌PBS、生理盐水对照组。小鼠攻毒后72 h 内观察精神状态和死亡情况,分别记录每组小鼠的临床症状及死亡情况,挑选出毒力较强的菌株进行下一步试验。
2.3.2 LD50和LD100测定。结合致病力筛选试验结果,选取2 株较强毒株再次进行增菌培养,置于37 ℃恒温摇床培养12 h 至对数期,测定其吸光值。根据小鼠死亡情况,梯度调整其菌液浓度至预先测定的LD50和LD100浓度,选取4 周龄ICR 小鼠,每组选取4 只小鼠,每只小鼠腹腔注射0.2 mL 菌液,同时设置对照组,记录每组小鼠的死亡情况,再对浓度梯度进行重复验证。
2.3.3 小鼠临床症状及病理变化观察。攻毒后观察72 h 内小鼠的精神状况以及死亡情况,对死亡的小鼠进行剖检,观察病变部位并对病变部位进行触片染色镜检。
2.3.4 血清型鉴定。参考AtsushiIguchi 大肠杆菌O抗原PCR 血清实用分型,合成牛大肠杆菌常见的血清型引物[12],引物序列见表2,筛选出的菌株DNA 作为模板进行PCR 扩增,同时使用实验室购买的参考菌株作为阳性对照,鉴定其是否为阳性血清型。采用25 μL 反应体系:Premix Taq 12.5 μL,上、下游引物各1 μL,模板2 μL,ddH2O 补加至25 μL。反应条件为:94 ℃预变性3 min;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸20 s,循环30 次;72 ℃终延伸5 min,4 ℃保存。PCR 产物经2%琼脂糖凝胶电泳后通过紫外照射观察结果。
3 结果与分析
3.1 菌株PCR 检测
将22 份腹泻粪样分离菌株纯化后得到的大肠杆菌菌株进行定量PCR 检测。结果表明,22 份样品中14 份样品ETEC 呈阳性(图1)。
3.2 革兰染色菌体形态观察
革兰染色后,镜检可见两端钝圆的革兰阴性短杆菌(图2)。

图2 ETEC 菌株革兰染色镜检图
3.3 菌株致病力测定
3.3.1 分离株致病力筛选结果。通过PCR 特异性鉴定,筛选出3 株ETEC 菌株D2、D7 和D8,与实验室分离的1 株ETEC 菌株8-1 进行致病性试验。结果如表3 所示,根据4 株分离菌株小鼠致病力初筛结果,选取2 株具有致病力毒株8-1、D2 作为后续试验候选菌株进行下一步致病力试验。

表3 分离菌株致病力筛选结果
3.3.2 疫苗候选株LD50和LD100测定。对2 株菌的LD50和LD100进行测定,根据致病力初筛小鼠死亡情况,调整这2 株菌的浓度至预设的LD50和LD100梯度浓度。8-1 菌株LD50和LD100第1 次验证如结果表4所示;D2 菌株LD50和LD100第1 次验证结果如表5 所示。得出结果后进行重复验证,8-1 菌株重复试验结果如表6 所示,D2 重复试验结果如表7 所示。
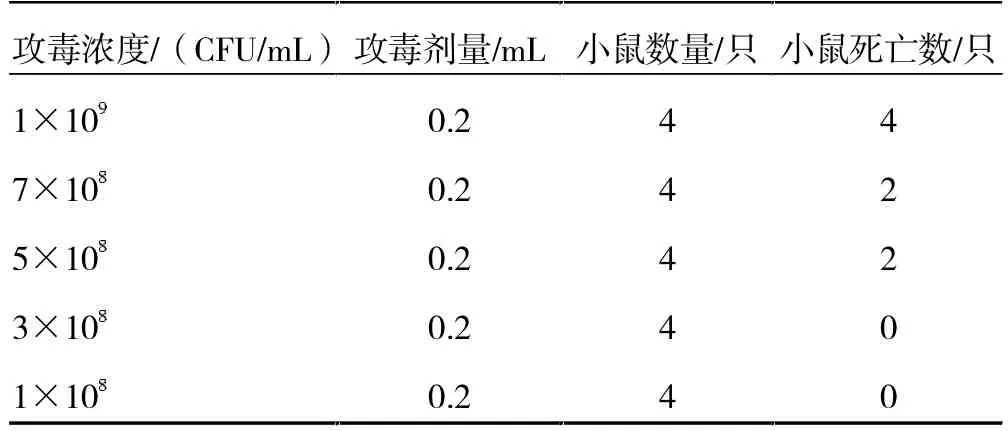
表4 8-1 菌株LD50、LD100 测定
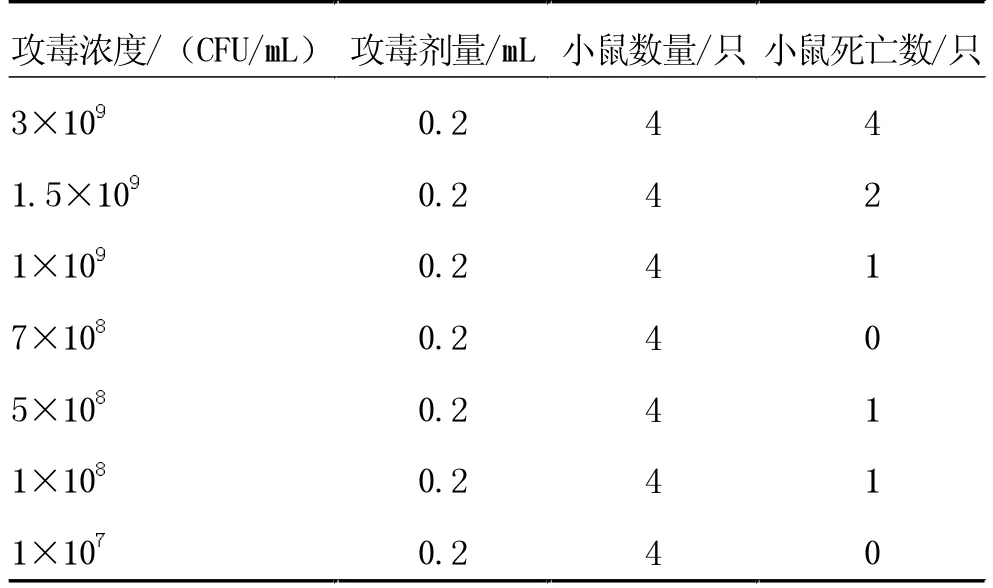
表5 D2 菌株LD50、LD100 测定

表6 重复验证8-1 菌株LD50、LD100
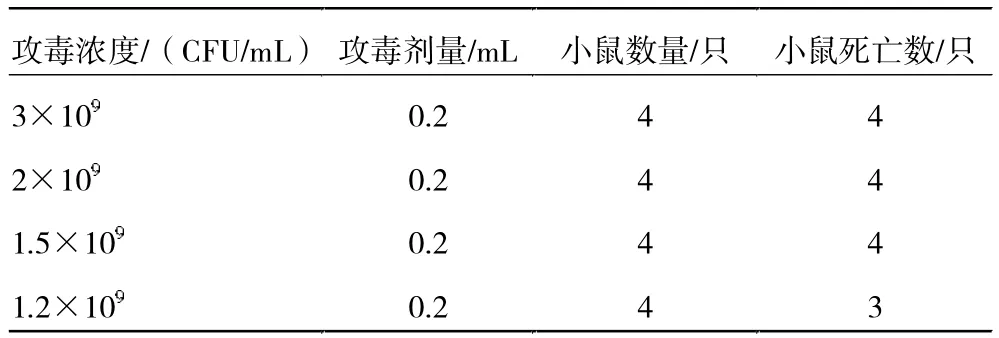
表7 重复验证D2 菌株LD50、LD100
根据分离株致病力初筛结果以及2 株菌LD50和LD100小鼠攻毒及重复验证试验结果,最终可知8-1 菌株LD50为5×108CFU/mL,LD100为9×108CFU/mL;D2菌株LD50为1.2×109CFU/mL,LD100为2×109CFU/mL。
3.3.3 血清型鉴定。对筛选出的8-1、D2 2 株菌使用参考文献[12]中牛源常见的68 对大肠杆菌O 抗特异性鉴定引物对进行PCR 扩增鉴定,最终得出8-1 菌株血清型为O118,D2 菌株血清型为O2,见图3。
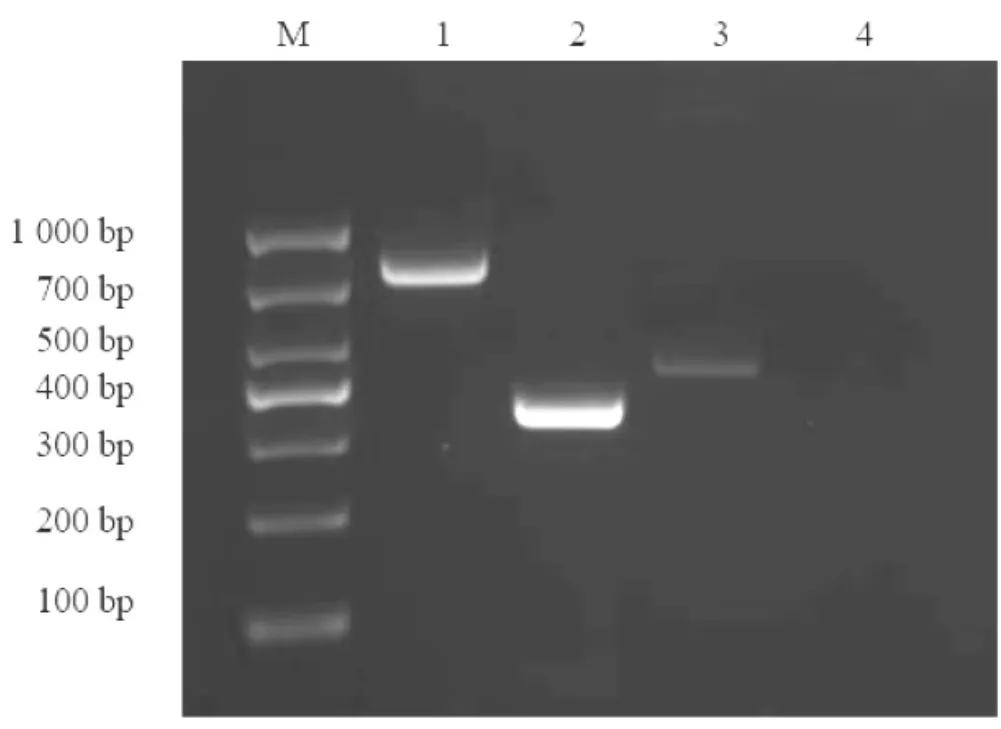
图3 2 株疫苗候选菌株血清型基因扩增条带
4 讨论
产肠毒素大肠杆菌作为引发犊牛腹泻的主要致病菌,其致病性较强,分布范围广泛,侵袭力强,是危害犊牛养殖业的主要病因,常伴随脱水、败血症及消化不良等症状。新生犊牛在1 月龄内易感,随着年龄的增长,发病率也逐渐下降。
宋美英[13]收集并分离获得致病性牛源大肠杆菌84 株,对其进行16 种毒力基因的PCR 检测。结果显示,携带毒力基因的致病性大肠杆菌有60 株,多种毒力基因组合以F41 和K99 为主,并结合耐药性进行分析,为研制以毒力基因为抗原的新型疫苗、选择敏感药物提供了一定依据。张洋龙[14]将分离出的53 株牛源ETEC 菌株进行耐药基因检测,通过致病性试验和毒力基因检测试验,成功构建牛源产肠毒素大肠杆菌强毒株的抑制消减基因组DNA 文库,并对差异基因进行了分布及分析研究。张力国[15]在黑龙江不同地区粪样中分离出88 株大肠杆菌,并进行毒素基因和黏附素基因检测。结果显示,黏附素类型以K88 和F18为主,大肠杆菌类型以ETEC 和EPEC 为主。
本试验从呼和浩特市周边的牧场犊牛腹泻粪样成功分离出ETEC 菌株,经分离纯化、小鼠毒力筛选后得到1 株疫苗备选菌株,并与实验室8-1 阳性菌株进行致病性试验,得到8-1 菌株LD50为5×108CFU/mL,LD100为9×108CFU/mL;D2 菌株LD50为1.2×109CFU/mL,LD100为2×109CFU/mL。2 株菌毒力较强,在小鼠攻菌后,以小鼠死亡情况作为判断标准的同时进行临床观察,在选择梯度攻菌浓度时也进行了重复验证,反映出2 株菌在小鼠上实际的致病作用。小鼠攻毒的最佳注射位置为腹腔。致病性试验感染模型的建立参考文献[16-19]的操作方法。在对大肠杆菌菌落数进行测定时,分光光度计读数为0.08~0.13,大肠杆菌浓度为1.5×108CFU/mL。为减小试验误差,本试验分光光度计读数均为0.1 左右,这也增加了试验的准确性。
血清型鉴定试验参考了大肠杆菌O 抗原基因wzx/wzy 或wzm/wzt 中的片段进行PCR 扩增,鉴定分离菌株的血清型。相对于玻片凝集鉴定,PCR 扩增鉴定更加准确,避免了与其他O-抗原发生交叉反应[20]。参考文献[12,20-21]筛选出68 对报道在犊牛和奶牛体内产生的大肠杆菌血清型特异性引物,分别对2 株菌进行PCR 鉴定,得出8-1 菌株血清型是O118,D2 菌株血清型是O2。
对本试验分离鉴定的ETEC 菌株进一步进行致病性试验,显示其对小鼠有致病性,适合作为菌株进行后续疫苗免疫相关试验。
