缺氧肿瘤细胞来源的外泌体miR-182通过调节PTEN的m6A修饰促进前列腺癌紫杉醇耐药*
2024-01-09戚晓红张朝阳
周 舰, 程 耿, 戚晓红, 张朝阳
武汉市第三医院泌尿外科,武汉 430060
前列腺癌(prostate cancer,PCa)是全球男性泌尿生殖系统中最常见的恶性肿瘤之一[1]。紫杉醇(paclitaxel,PTX)是一种紫杉烷类抗癌药物,已广泛应用于PCa的治疗,但对其耐药导致的预后不佳仍是临床上的一个重要挑战[2]。
目前的研究认为,缺氧是肿瘤微环境中的一个关键促癌因素,缺氧环境可以影响外泌体的释放,缺氧肿瘤细胞来源的外泌体中携带的RNA已被证明是调节肿瘤生物学和重塑肿瘤微环境的重要因素[3]。此外也有研究表明,缺氧肿瘤细胞外泌体能够促进PCa细胞的存活[4],但其具体机制尚不明确。以往研究表明miR-182的过度表达能够促进PCa细胞的增殖、集落形成并抑制凋亡[5-6]。
新近研究发现PCa组织和细胞系中脂肪和肥胖相关蛋白(fat mass and obesity-associated protein,FTO)表达下调,m6A水平增加,而该表达失调与PCa进程显著相关[7]。磷脂酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)在肿瘤细胞生长、凋亡、粘附、浸润及迁移等方面发挥重要作用,其水平升高能够抑制PCa进展[8]。另外PTEN被发现能够增强PCa细胞对PTX的敏感性,并促进PTX诱导的细胞凋亡[9]。
本研究旨在阐明缺氧肿瘤细胞外泌体在PCa中的作用及其机制,为了解PCa耐药的分子机制提供数据支持和理论基础。
1 材料与方法
1.1 细胞系及主要试剂
经STR鉴定正确的人前列腺癌DU145细胞及人正常前列腺上皮细胞RWPE-1均购自武汉普诺赛生物科技有限公司。RPMI l640培养液、EDTA溶液、胰蛋白酶购自上海雅心生物技术有限公司;免疫磁珠购自德国美天旎公司;转染用载体及lipofectaminTM3000购自Invitrogen公司;外泌体分离及纯化试剂盒均购自上海翌圣生物公司;双荧光素酶报告基因试剂盒购自Promega公司;Trizol试剂盒、MTT溶液、Annexin Ⅴ-FITC/PI双染试剂盒购自北京索莱宝公司;紫外-可见光分光光度计购自上海美析仪器有限公司;过表达质粒及其siRNA干扰质粒、各自对照产物均由上海吉玛基因公司设计并合成。
1.2 生物信息学分析方法
借助NCBI网站的GEO数据库查询PCa相关芯片,借助在线分析工具GEO2R对数据进行分析。差异筛选条件设置为adj.P.Value<0.05和|LogFoldChange|>1,limma package用于差异分析,ggplot2绘制表达火山图,heatmap package绘制热图。Targetscan网站(http://www.targetscan.org/vert_72/)预测与miRNA存在结合位点的基因。Starbase(http://starbase.sysu.edu.cn/)用于预测基因的RNA结合蛋白(RNA binding protein)。Disgenet网站(https://www.disgenet.org/home/)查找Malignant neoplasm of prostate(C0376358)疾病风险基因。借助在线Venn工具(http://www.bioinformatics.com.cn/static/others/jvenn/index.html)取预测结果交集,通过DAVID网站(https://david.ncifcrf.gov/)进行基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)代谢途径分析。GSCALite网站(http://bioinfo.life.hust.edu.cn/web/GSCALite/)用于基因对药物敏感性的预测。以UALCAN(http://ualcan.path.uab.edu/index.html)数据库对基因在PCa中的表达进行预测。SRAMP(http://www.cuilab.cn/sramp/)用于寻找基因的m6A甲基化修饰位点。
1.3 临床资料与组织样本获取
选取2019年1月至2020年6月收治于本院肿瘤科与泌尿外科的PCa患者52例(PCa组),患者均于PCa根治术前行造影检查,患者组织活检后均经2名以上病理学专家确诊为PCa。患者均为男性,年龄51~79岁,中位年龄68岁。纳入标准:①临床资料完整且均签署知情同意书;②患者均为初次进行诊疗;③既往无其他恶性肿瘤史也未接受过抗肿瘤治疗。排除标准:①有严重心肝肾功能障碍的患者;②合并系统性疾病;③患有自身免疫性疾病的患者。另选取50例因良性前列腺增生(benign prostatic hyperplasia,BPH)行电切手术的患者(Control组),患者均为男性,年龄49~79岁,中位年龄65岁。PCa组与Control组患者均于术后留取组织。患者组织经切除后立即置于冻存管中,并用液氮转移至-80℃条件下保存。本研究经我院伦理委员会审核批准。
1.4 细胞培养与PTX耐药细胞系建立
人前列腺上皮细胞系RWPE-1在添加有0.05 mg/mL BPE、5 ng/mL EGF生长因子和1% P/S(青链霉素合剂)的K-SFM培养液中培养。DU145细胞在补充有10% FBS和1% P/S的Ham’s F-12 K培养液中培养。所有的细胞均在含5% CO2的加湿培养箱中培养。将处于对数生长期的DU145细胞分为常氧细胞外泌体组和缺氧细胞外泌体组,常氧细胞置于20% O2、37℃、5% CO2中进行培养。缺氧条件设置为1% O2、37℃、5%CO2,细胞处理48 h后进行后续实验。通过逐步增加培养液中PTX的浓度获得PTX耐药(PTX resistance,PR)[10]的DU145细胞(DU145/PR)。
1.5 外泌体的分离、纯化和鉴定
收集常氧和缺氧条件处理的细胞并转移至EP管,以12000 r/min离心后收集上清,添加外泌体提取试剂,混匀后转移至4℃条件下静置2 h。随后再次离心1 h,收集沉淀,用1×PBS吹打沉淀产物,25000 r/min离心2 min后弃去沉淀,保留上清。采用3 kD超滤管再次将上清进行30000 r/min离心,30 min后即可获得纯化后的外泌体颗粒,随后借助0.22 μm的滤器进行过滤除菌。采用透射电镜(transmission electron microscope,TEM)观察外泌体形态,蛋白免疫印迹(Western blot)检测CD63、CD9、CD81的表达。
1.6 细胞转染与共培养
取耐药培养后的第3代对数生长期细胞,采用胰蛋白酶消化,转染前24 h用无血清培养液培养,采用LipofectamineTM3000转染试剂将oe-FTO-NC(过表达FTO阴性对照载体)、oe-FTO(过表达FTO载体)、si-FTO-NC(敲减FTO阴性对照载体)、si-FTO(敲减FTO载体)、oe-PTEN-NC(过表达PTEN阴性对照载体)、oe-PTEN(过表达PTEN载体)、mimic-NC(miR-182 mimic阴性对照载体)、miR-182 mimic(转染miR-182 mimic载体)、inhibitor-NC(转染miR-182-inhibitor阴性对照载体)、miR-182-inhibitor(转染miR-182-inhibitor)分别或联合转染至细胞。6 h后更换培养液,在37 ℃、5% CO2的培养箱中继续进行培养48 h。将1×105个各转染组的细胞与约150 μL的外泌体悬液共培养48 h,进行后续功能实验,另将等量PBS与各转染组细胞共培养作为对照组。
1.7 qRT-PCR实验
收集PCa组患者前列腺癌组织及对照组正常增生前列腺组织各约100 mg,生理盐水冲洗,借助Trizol试剂提取组织中的总RNA,紫外分光光度计测量吸光度以检测RNA纯度,以总RNA为模板借助反转录试剂盒合成cDNA,随后以cDNA为模板按照SYBR Premix Ex Taq试剂盒说明书在荧光定量PCR仪上进行PCR扩增。反应体系及反应条件均依据试剂盒说明书进行。采用2-ΔΔCt法计算目的基因的相对表达水平,miRNA以U6为内参,其余目的基因以GAPDH为内参,详细引物序列见表1。本方法同样适用于细胞检测。当检测对象为外泌体时,借助外泌体RNA分离试剂盒提取常氧PCa细胞外泌体及缺氧PCa细胞外泌体中的总RNA,其余操作相同。

表1 qRT-PCR引物序列
1.8 免疫印迹实验(Western blot)
组织和细胞用RIPA消化,BCA试剂盒测定蛋白质浓度。裂解物通过SDS-聚丙烯酰胺凝胶(10%)电泳分离,然后转移到聚偏氟乙烯膜上。5%的脱脂牛奶封闭膜以抑制非特异性结合,2 h后在4℃条件下添加以下检测抗体孵育过夜:抗FTO(1∶10000)、抗PTEN(1∶1000)、CD63(1∶1000)、CD9(1∶1000)、CD81(1∶1000;)。次日洗涤后,用山羊抗兔IgG(1∶2000)作为第二抗体进一步孵育膜2 h。根据制造商的说明,使用ECL Western blot检测试剂盒对蛋白质条带进行可视化,并通过Quantity One 4.6.2分析软件对蛋白条带的灰度进行量化,目的蛋白与内参蛋白(GAPDH)条带灰度值比值作为蛋白的相对表达量。
1.9 m6A RNA甲基化定量及MeRIP检测
根据制造商的说明,用EpiQuik m6A RNA甲基化定量试剂盒测量提取的RNA的总m6A水平。使用polyA SpinTM纯化mRNA后根据Magna MeRIPTMm6A试剂盒的说明进行MeRIP检测。将mRNA片段化为大约100 nt的寡核苷酸。将Magna ChIP蛋白A/G磁珠与m6A特异性抗体(anti-FTO,1∶10000)在免疫沉淀缓冲液中于室温下孵育1 h。然后将混合物与MeRIP反应混合物在4℃下孵育过夜。洗脱的RNA用于qRT-PCR分析,后续操作同1.7部分。
借助放线菌素D检测RNA稳定性,用5 μg/mL放线菌素D处理细胞以抑制转录。然后分别在0、2、4、8 h时收集细胞。使用qRT-PCR检测mRNA水平。
1.10 双荧光素酶报告基因实验
借助Targetscan预测miR-182与FTO之间的相互作用位点,构建荧光素酶报告质粒,pmirGLO-FTO-WT(FTO-WT)和pmirGLO-FTO-MUT(FTO-MUT)。将含有miR-182结合位点的FTO 3′UTR克隆到pmirGLO载体中。同样,将含有miR-182突变结合位点的FTO 3′UTR结构域插入pmirGLO载体以构建FTO-MUT。HEK-293T细胞接种至96孔板中,每孔1×105个细胞。根据制造商的说明,借助LipofectaminTM3000将miR-182 mimic(模拟物)与mimic-NC(miR-182 mimic模拟物阴性对照)转染至细胞。24 h后使用双荧光素酶报告基因系统进行检测。荧光密度由微板阅读器定量,以海肾荧光素酶作为对照荧光素酶报告基因,将其进行归一化处理。
1.11 MTT实验检测PTX药物敏感性
将1×104个DU145/PR细胞接种在96孔板中,用不同剂量的PTX(0~300 nmol)处理细胞24 h。随后添加MTT继续培养4 h。去除培养上清液后,加入200 μL DMSO溶解。使用微板阅读器在490 nm波长下检查吸光度值。借助相对生存曲线确定IC50值。
1.12 Annexin Ⅴ-FITC/PI双染检测细胞凋亡
使用Annexin Ⅴ-FITC/PI凋亡检测试剂盒检测细胞凋亡情况。DU145/PR用100 nmol PTX暴露24 h后用PBS清洗,结合缓冲液重悬,避光加入5 μL Annexin Ⅴ-FITC染色10 min,5 μL PI染色5 min。使用流式细胞仪对凋亡细胞进行分析。
1.13 统计学方法
采用SPSS 23.0软件分析本研究中数据。计量资料以平均值±标准差表示,两组间均数比较采用t检验,多组间比较采用单因素方差分析,组内两两比较使用SNK-q检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 缺氧肿瘤细胞外泌体促进PCa细胞PTX耐药
如图1A所示,TEM结果显示常氧和缺氧条件下培养的肿瘤细胞外泌体呈盘状囊泡结构,Western blot结果证实外泌体标记物CD9、CD81、CD63在常氧细胞外泌体和缺氧细胞外泌体中均有表达,但缺氧细胞外泌体中CD9、CD81、CD63的表达水平较常氧细胞外泌体组更高(均P<0.05)(图1B),提示缺氧增强了PCa细胞外泌体的分泌。PTX毒性检测结果显示,DU145/PR细胞对PTX的敏感性变低,PTX半数抑制浓度较DU145组细胞显著升高,提示PTX耐药细胞模型构建成功(图1C)。为了明确缺氧细胞外泌体对常氧PCa细胞的影响,本研究用PBS、常氧和缺氧细胞外泌体处理DU145/PR细胞。如图1D所示,在不同浓度的PTX处理后,常氧和缺氧细胞外泌体明显提高了DU145/PR细胞的存活率和PTX的半数抑制浓度,且缺氧外泌体组细胞存活率和PTX半数抑制浓度更高(均P<0.05)。此外,细胞凋亡实验结果显示(图1E),与PBS组相比,常氧和缺氧细胞外泌体组细胞凋亡减少且缺氧细胞外泌体组细胞凋亡率更低(均P<0.05),而以上变化均能被外泌体抑制剂GW4869部分挽救(均P<0.05)。以上结果表明,缺氧PCa细胞分泌的外泌体能够促进PCa细胞的PTX耐药。
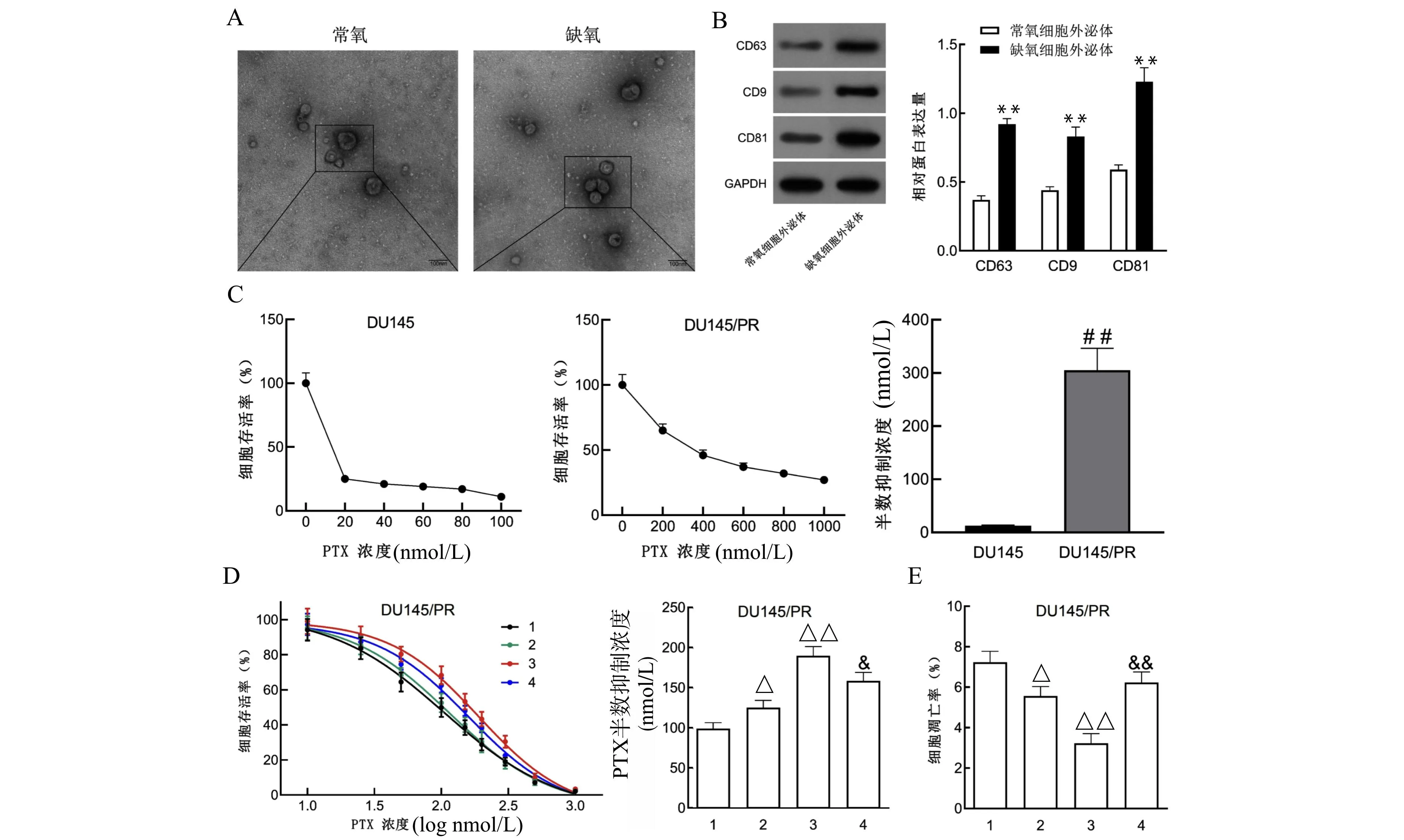
A:TEM观察外泌体形态;B:外泌体标志蛋白CD63、CD9、CD81的表达检测结果;C:PTX耐药细胞模型(DU145/PR)鉴定结果;D:PTX处理后各组细胞存活率和各组细胞的PTX半数抑制浓度检测结果;E:各组细胞凋亡率;1:DU145/PR+PBS组;2:DU145/PR+常氧细胞外泌体组;3:DU145/PR+缺氧细胞外泌体组;4:DU145/PR+缺氧细胞外泌体+GW4869组;与常氧细胞外泌体组比较,**P<0.01;与DU145组比较,##P<0.01;与DU145/PR+PBS组比较,△P<0.05 △△P<0.01;与DU145/PR+缺氧细胞外泌体组比较,&P<0.05 &&P<0.01
2.2 miR-182在缺氧肿瘤细胞外泌体中高表达
GSE36802数据集里面包含21对PCa组织及正常前列腺组织中的miRNAs表达情况,GEO2R在线分析共筛选出35个差异表达miRNAs,选择上调最显著的10个miRNAs并绘制热图(图2A),鉴于以往关于miR-182和PCa的报道不够深入,将miR-182纳入本研究。图2B、2C结果显示miR-182在PCa组织样本中表达显著升高(logFC=1.16549,adj.P.value=0.0000254)。图2D结果显示,与对照组比较,miR-182在PCa样本组织中表达上调(P<0.01)。与RWPE-1细胞相比,DU145细胞和DU145/PR细胞中miR-182水平上调且DU145/PR细胞中miR-182水平更高(P<0.05)(图2E)。对常氧和缺氧细胞外泌体中miR-182的表达进行检测发现缺氧条件处理的细胞分离的外泌体其miR-182水平更高(P<0.05)(图2F)。进一步将外泌体与DU145/PR细胞共培养并且检测miR-182表达发现,与DU145/PR+PBS组比较,常氧细胞外泌体和缺氧细胞外泌体处理的DU145/PR细胞中miR-182水平上调且DU145/PR+缺氧细胞外泌体处理组中miR-182水平更高(P<0.05)(图2G),提示缺氧细胞外泌体中miR-182能够转移到DU145/PR细胞中。

A~B:GSE36802数据集中显著上调的miRNAs;C:miR-182在GSE36802数据集样本中的表达;D:qRT-PCR检测miR-182在对照组(n=50)及PCa组(n=52)患者前列腺组织中的表达水平,与对照组比较,**P<0.01;E:miR-182在RWPE-1、DU145以及DU145/PR细胞中的表达水平,与RWPE-1细胞比较,##P<0.01;F:miR-182在常氧细胞外泌体和缺氧细胞外泌体中的表达水平;G:miR-182在PBS、常氧细胞外泌体及缺氧细胞外泌体处理的DU145/PR细胞中的表达水平,与PBS组比较,△P<0.05 △△P<0.01
2.3 miR-182 inhibitor部分逆转缺氧细胞外泌体对PCa细胞PTX耐药的促进作用
相对于DU145/PR+PBS组,DU145/PR+缺氧细胞外泌体组细胞的存活率和PTX半数抑制浓度增加,细胞凋亡减少(均P<0.05);而相对于DU145/PR+缺氧细胞外泌体+inhibitor-NC组,DU145/PR+缺氧细胞外泌体+miR-182 inhibitor组细胞的存活率和PTX半数抑制浓度降低,细胞凋亡率升高(均P<0.01,图3)。提示缺氧细胞外泌体对PCa细胞PTX耐药的影响是通过miR-182实现的。
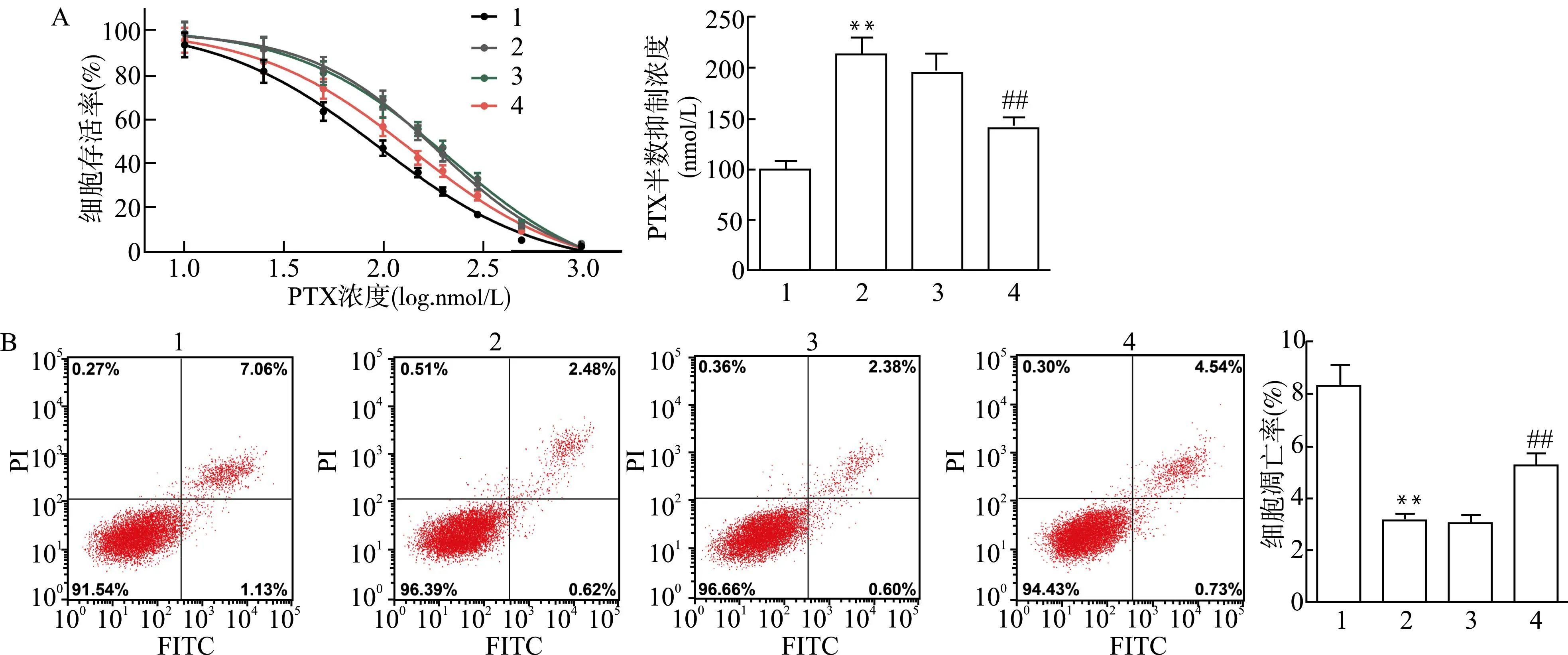
1:DU145/PR+PBS组;2:DU145/PR+缺氧细胞外泌体组;3:DU145/PR+缺氧细胞外泌体+inhibitor-NC组;4:DU145/PR+缺氧细胞外泌体+miR-182 inhibitor组;A:PTX处理后各组细胞存活率和各组细胞的PTX半数抑制浓度检测结果;B:各组细胞凋亡检测结果;与DU145/PR+PBS组比较,**P<0.01;与DU145/PR+缺氧细胞外泌体+inhibitor-NC组比较,##P<0.01
2.4 FTO为miR-182的作用靶点
为确定miR-182可能作用的靶点,Targetscan对其下游靶基因进行了预测。结果显示miR-182与FTO存在靶向结合位点(图4A)。双荧光素酶报告分析实验结果显示(图4B),相对于mimic-NC和FTO-WT共转染组,miR-182 mimic和FTO-WT共转染组的荧光素酶活性显著降低(均P<0.05)。图4C显示FTO在PCa组中表达水平较对照组显著下调(P<0.05),且与miR-182水平呈负相关(r=-0.83,P<0.01)(图4D)。另外,与RWPE-1组相比,FTO在DU145和DU145/PR细胞中水平显著下降(均P<0.05)(图4E)。图4F显示,与PBS组比较,常氧细胞外泌体和缺氧细胞外泌体处理的DU145/PR细胞中FTO的表达降低且缺氧细胞外泌体组FTO表达更低(均P<0.05)。综上结果表明,miR-182可靶向抑制FTO的水平。
2.5 FTO抑制PCa细胞的PTX耐药但该作用能够被缺氧细胞外泌体逆转
相对于DU145/PR+oe-FTO-NC组,DU145/PR+oe-FTO组细胞的存活率和PTX半数抑制浓度降低,细胞凋亡率增加(均P<0.05)。而相对于DU145/PR+oe-FTO+PBS组,DU145/PR+oe-FTO+缺氧细胞外泌体组中细胞存活率和PTX半数抑制浓度增加,细胞凋亡率降低(均P<0.05)。上述结果表明FTO能够抑制PCa细胞的PTX耐药但该作用能够被缺氧细胞外泌体挽救(图5)。

1:DU145/PR+oe-FTO-NC组;2:DU145/PR+oe-FTO组;3:DU145/PR+oe-FTO+PBS组;4:DU145/PR+oe-FTO+缺氧细胞外泌体组;A:PTX处理后各组细胞存活率和各组细胞的PTX半数抑制浓度检测结果;B:各组细胞凋亡检测结果;与oe-FTO-NC组比较,**P<0.01;与oe-FTO+PBS组比较,##P<0.01
2.6 FTO抑制PTEN的m6A修饰并上调其在PCa中的表达
为探究缺氧细胞外泌体/miR-128/FTO的下游机制,以Starbase对FTO的结合因子进行预测,并且通过Disgenet网站以Malignant neoplasm of prostate(C0376358)为关键词查找PCa疾病风险基因,做Venn图取交集后得到1673个基因(图6A)。KEGG富集分析结果中发现了PCa通路(图6B)。GSCALite网站预测显示E2F2,BCL2,E2F3,RAF1,PTEN,EP300,MTOR,PIK3CA的表达与耐药性呈负相关,即其在PCa组织中表达水平越高,PCa组织对紫杉醇敏感性越高。StarBase预测结果显示,PTEN在PCa中低表达(图6C),且PTEN与FTO在PCa中的表达水平呈正相关(r=0.22,P=6.77 e-06)(图6D)。SRAMP网站预测结果显示,PTEN存在多个具有非常高可信度的m6A甲基化修饰位点。另外,PCa组织中m6A水平上升(均P<0.01)(图6E);而PTEN表达水平在PCa组织及细胞中均下调(均P<0.01)(图6F、6G)。敲减FTO后PTEN稳定性下降(P<0.01),过表达FTO后PTEN稳定性增强(均P<0.01)(图6H)。MeRIP结果(图6I)显示FTO抑制了PTEN的m6A修饰,而敲减FTO则促进了PTEN的m6A修饰(均P<0.01)。综上结果表明,FTO通过抑制PTEN的m6A水平增强其转录稳定性,进而上调PTEN在PCa中的表达。
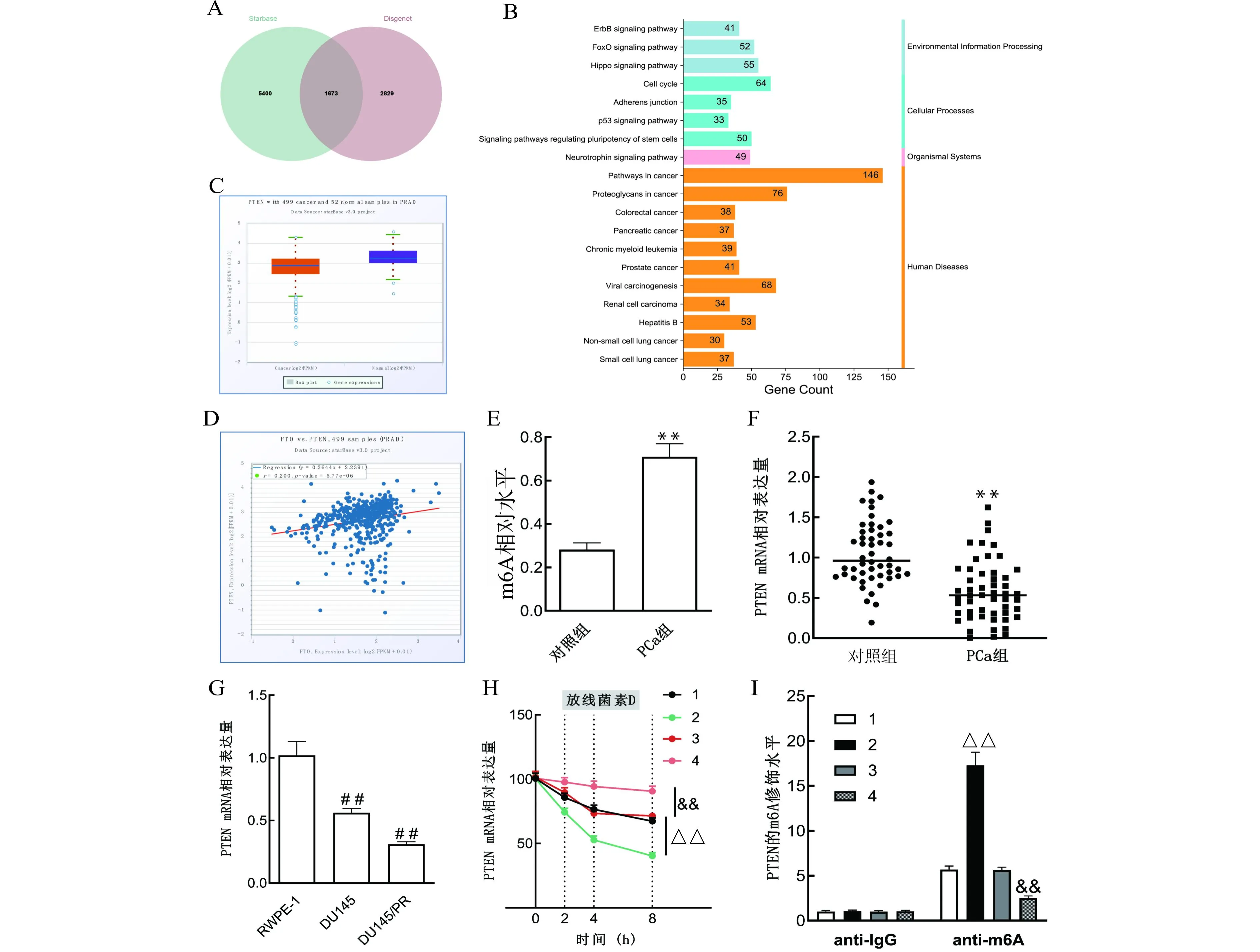
1:si-FTO-NC;2:si-FTO;3:oe-FTO-NC;4:oe-FTO;A:StarBase与Disgene预测结果交集;B:KEGG富集分析结果;C~D:GSCALite、StarBase预测结果;E:m6A水平检测结果;F~G:qRT-PCR检测PTEN在PCa组织和细胞中的表达水平;H:放线菌素D实验结果;I:MeRIP实验结果;与对照组比较,**P<0.01;与RWPE-1细胞比较,##P<0.01;与si-FTO-NC组比较,△△P<0.01;与oe-FTO-NC组比较,&&P<0.01
2.7 PTEN对PCa细胞PTX耐药的影响被si-FTO部分挽救
图7A结果显示,oe-PTEN促进PTEN的表达,但该效果能被si-FTO部分逆转(均P<0.05)。图7B、7C结果显示,与DU145/PR+oe-PTEN-NC组比较,oe-PTEN组细胞存活率降低,PTX半数抑制浓度降低,细胞凋亡率增加(均P<0.05)。另外,与DU145/PR+oe-PTEN+si-FTO-NC组比较,DU145/PR+oe-PTEN+si-FTO组DU145/PR细胞存活率和PTX半数抑制浓度增加,细胞凋亡减少(均P<0.05)。提示PTEN的作用被si-FTO挽救,结合结果2.6认为FTO通过上调PTEN进而影响PCa的PTX耐药。本研究机制见图7D。

1:DU145/PR+oe-PTEN-NC组;2:DU145/PR+oe-PTEN组;3:DU145/PR+oe-PTEN+si-FTO-NC组;4:DU145/PR+oe-PTEN+si-FTO组;A:各组细胞PTEN的mRNA表达水平;B:各组DU145/PR细胞的存活率和PTX半数抑制浓度;C:各组细胞凋亡率;D:本研究机制图;与DU145/PR+oe-PTEN-NC组比较,**P<0.01;与DU145/PR+oe-PTEN+si-FTO-NC组比较,##P<0.01
3 讨论
缺氧与肿瘤的不良预后相关,也是恶性肿瘤的重要标志,外泌体是肿瘤微环境的重要组成部分,缺氧条件下的外泌体能够通过调节免疫、传递货物分子等途径促进肿瘤的生长[11]。另外也有研究表明缺氧PCa细胞来源的外泌体能够促进原始PCa细胞的干性和侵袭性,促进PCa的上皮间充质转化[12-13]。首先本研究对常氧和缺氧细胞中分离的外泌体对PTX耐药细胞的影响进行探讨,发现常氧和缺氧细胞外泌体均增加了PCa细胞对PTX的耐药性并减少了凋亡,但缺氧细胞外泌体的作用更显著,这可能与缺氧条件下肿瘤细胞的恶性程度更高和增殖更多有关。
运输RNA和蛋白质等货物分子是外泌体参与肿瘤进展的重要途径,如缺氧结直肠癌细胞分泌的外泌体能通过传递Wnt4至常氧细胞,以激发常氧肿瘤细胞的迁移和侵袭[14]。缺氧的非小细胞肺癌细胞源性介导高水平的miR-21传递可促进常氧细胞对顺铂的耐药性[15]。本研究通过生物信息学分析发现miR-182在PCa中表达增强,关于PCa的研究也证实miR-182过表达能够促进PCa细胞增殖和侵袭[16]。本研究发现miR-182在缺氧条件处理的PCa细胞外泌体中表达显著增强。功能实验进一步表明缺氧细胞外泌体能够促进DU145/PR细胞的存活,抑制细胞凋亡,但是敲减miR-182后上述情况则改善,提示缺氧细胞外泌体对PCa细胞PTX耐药的影响可能是通过运输miR-182实现的。
FTO作为去甲基化酶被证实参与了PCa的进展,有研究表明FTO在PCa中表达降低且其表达与PCa患者预后有关[17]。本研究发现FTO和miR-182存在结合位点并且证实了二者直接的结合关系。此外FTO在DU145/PR细胞以及缺氧细胞外泌体中表达降低,可能是受到miR-182的靶向抑制。功能实验显示过表达FTO能够抑制PTX处理的PCa细胞的存活率并且促进细胞凋亡,提示FTO能够抑制PCa细胞的PTX耐药但该作用能够被缺氧细胞外泌体挽救,结合缺氧细胞外泌体中miR-182高表达以及FTO和miR-182的靶向关系我们推测缺氧细胞外泌体能够分泌miR-182进而调控FTO并影响PCa细胞对PTX的耐药。
进一步对FTO可能调节的下游因子进行分析,发现其能够与PTEN结合,PTEN作为PCa的抑癌因子证据较为充分[18],且本研究通过GSCALite网站发现其与PCa耐药呈负相关。FTO对其结合靶点的修饰有多种途径,比较常见的就是通过调节其靶基因的m6A水平进而调节靶基因表达,如FTO被发现能够抑制CLIC4 mRNA的m6A修饰水平进而增加CLIC4的表达和稳定性[19]。本研究对FTO和PTEN的关系进行验证发现FTO过表达增加了PTEN的稳定性,而敲减FTO则能够抑制PTEN的稳定性,进一步发现FTO对PTEN的调节是通过影响PTEN的m6A修饰水平实现的。功能实验进一步表明过表达PTEN后PTX处理的DU145/PR细胞存活率下降,细胞凋亡增加,但加入si-FTO后DU145/PR细胞的存活率增加,细胞凋亡减少,可能是敲减FTO后PTEN的稳定性受到了影响。
综上所述,本研究揭示了缺氧肿瘤细胞外泌体能够通过向常氧细胞传递高水平的miR-182,进一步靶向FTO,上调PTEN的m6A修饰水平进而抑制PTEN表达,促进PCa细胞对PTX的耐药。本研究认为缺氧细胞外泌体源性miR-182可以作为针对PCa耐药性治疗的一个新的潜在生物标志物和治疗靶点。
