腹侧被盖区多巴胺能神经元参与调控焦虑样行为研究进展☆
2024-01-08张逸杨璐彭劲涛蒋宇婷孙丰蛟崔明湖
张逸 杨璐 彭劲涛 蒋宇婷 孙丰蛟 崔明湖
焦虑障碍是最常见的精神疾病之一,对患者日常功能和幸福感产生显著影响[1]。近年来,其发病率一直上升[2]。多巴胺是重要的神经递质,对情绪(如焦虑)的调节起到关键作用[3]。腹侧被盖区(ventral tegmental area,VTA)作为多巴胺产生的主要区域[4],参与调控焦虑情绪[5]。本文深入探讨关于VTA多巴胺能神经元参与调控焦虑样行为的研究进展,分别综述生理及病理状态下,VTA多巴胺能神经元参与的神经环路对焦虑样行为的调控作用、VTA神经递质与焦虑样行为的关系以及相关影像学研究进展,从而为未来的治疗发展提供路线图。
1 神经环路
神经环路是脑内不同类型和功能神经元之间的复杂连接,各神经环路发挥着相同或不同的作用。VTA神经元参与的众多神经环路对焦虑样行为的调控产生重要影响[5-10],这些神经环路在生理与病理状态下对焦虑的编码也存在差异。
1.1 生理状态下VTA环路对焦虑样行为的编码在中枢神经系统中,神经元的连接特性决定了其功能。VTA在大脑中与其他脑区形成广泛的连接,这些环路连接在调控焦虑样行为中具有重要的作用。见图1A。
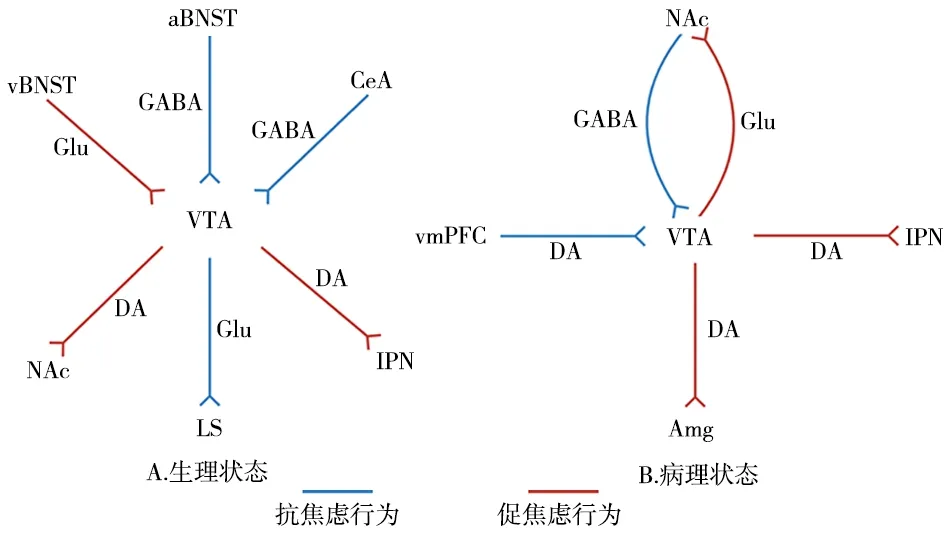
图1 VTA与焦虑样行为调节的相关神经环路 A.生理状态下VTA与焦虑样行为调节的相关神经环路;B.病理状态下VTA与焦虑样行为调节的相关神经环路。蓝色线条表示抗焦虑样行为,红色线条表示促焦虑样行为。VTA,腹侧被盖区;aBNST,终末纹前床核;vBNST,终末纹腹侧床核;NAc,伏隔核;LS,侧隔;IPN,脚间核;CeA,中央杏仁核;vmPFC,内侧前额叶皮质;Amg,杏仁核;GABA,γ-氨基丁酸; Glu,谷氨酸;DA,多巴胺
1.1.1 VTA-侧隔环路 侧隔(lateral septum,LS)是调控情感和运动的核心脑区,参与调节焦虑样行为[11-12]。研究发现,VTA到侧隔的多巴胺能神经投射调节包括焦虑在内的情绪和行为[13]。VTA多巴胺D1受体表达神经元双向调节小鼠焦虑样行为,激活该神经元可减轻小鼠焦虑样行为,而抑制该神经元则诱发焦虑,研究进一步发现VTA 多巴胺D1受体表达神经元的谷氨酸能神经投射特异性投射到侧隔,利用光遗传学方法激活该投射可缓解小鼠焦虑样行为,而抑制该投射则促进焦虑样行为[10]。
1.1.2 VTA-脚间核环路 脚间核(interpeduncular nucleus,IPN)是与熟悉、厌恶有关的脑区,其接受来自VTA的多巴胺能神经投射,构成中脚间回路[14]。腹侧脚间核(ventral IPN,vIPN)与尾侧脚间核(caudal IPN,cIPN)是脚间核中的两个重要部分,利用光遗传学方法激活VTA到腹侧脚间核的多巴胺能神经投射,可促进小鼠焦虑样行为,抑制该投射则发挥抗焦虑效应,这一效应主要是通过多巴胺D1受体而发挥作用,进一步研究发现激活VTA-尾侧脚间核多巴胺能神经投射可促进尾侧脚间核C型多巴胺D1受体表达神经元释放γ-氨基丁酸(gamma-aminobutyric acid,GABA),GABA通过调节腹侧脚间核A型和B型多巴胺能神经元的活动进而调控焦虑样行为[9]。
1.1.3 终末纹状体床核-VTA与中央杏仁核-VTA环路 终末纹状体床核在焦虑、恐惧等消极情绪状态中发挥独特的作用[15]。激活终末纹腹侧床核-VTA的谷氨酸能神经元可诱导小鼠焦虑样行为[16]。终末纹前床核和中央杏仁核与焦虑和恐惧情绪密切相关,促肾上腺皮质激素释放因子(corticotropin-releasing factor,CRF)在这两个脑区中大量表达[17]。此外,终末纹前床核和中央杏仁核中表达CRF的GABA能神经元特异性投射到VTA,该神经元释放的CRF与VTA多巴胺能神经元上的CRF受体1结合,从而激活VTA多巴胺能神经元放电并诱导多巴胺释放,发挥抗焦虑效应[18]。
1.1.4 VTA-伏隔核环路 伏隔核(nucleus accumbens,NAc)是大脑奖赏激励系统的关键脑区,也是焦虑相关脑区分布网络中的一部分[19]。VTA到NAc的多巴胺能神经投射在调节焦虑样行为中发挥作用[20]。VTA接收来自背外侧被盖的胆碱能神经递质,与VTA中胆碱能受体结合,激活VTA胆碱能受体可促进VTA投射到NAc的多巴胺能神经元活动,从而诱导焦虑样行为,而抑制VTA胆碱能受体则发挥抗焦虑效应[21]。
1.2 病理状态下VTA环路对焦虑样行为的编码过度应激和某些药物的长期使用可引起病理性焦虑。最近研究表明,过度使用烟草和应激可以通过影响VTA与其他脑区的功能连接,介导焦虑样行为[5-6,8]。见图1B。
1.2.1 VTA-杏仁核环路 杏仁核(amygdaloid nucleus,Amg)是处理焦虑相关信息的关键结构[22]。使用尼古丁对焦虑相关表型和症状的影响已成为重要研究领域[23]。在VTA中注射尼古丁能抑制杏仁核的多巴胺能神经元活性;而利用光遗传学方法抑制VTA到杏仁核的多巴胺能神经投射,可介导焦虑样行为,激活该投射则发挥抗焦虑效应[6]。基底外侧杏仁核(basolateral amygdala,BLA)是杏仁核的一个亚区,参与焦虑的调控[24]。慢性社会应激降低VTA投射到基底外侧杏仁核的多巴胺能神经元放电频率,从而诱导焦虑样行为,利用光遗传学方法可激活VTA到基底外侧杏仁核多巴胺能神经投射,发挥抗焦虑效应[25]。
1.2.2 伏隔核-VTA环路 动物实验中,慢性情绪应激可激活VTA多巴胺能神经元,从而诱导焦虑样行为,使用化学遗传学方法激活VTA多巴胺能神经元也可诱导焦虑样行为[8]。研究进一步阐明,在慢性情绪应激下,小鼠VTA 多巴胺能神经元接受的来自NAc的GABA能神经投射显著减少,从而发生焦虑,激活NAc到VTA的GABA能神经投射可逆转慢性情绪应激诱导的焦虑样行为[8]。另有研究表明VTA到NAc的谷氨酸能神经投射也可调节情绪[5]。慢性缩窄性损伤手术可激活VTA投射到NAc的谷氨酸能神经元,促进疼痛相关的焦虑和抑郁行为,进一步研究发现,利用光遗传学方法抑制VTA对NAc的谷氨酸能神经投射,可缓解疼痛诱发的焦虑样行为,发挥抗焦虑作用[5]。
1.2.3 内侧前额叶皮质-VTA环路 内侧前额叶皮质(ventromedial prefrontal cortex,vmPFC)对焦虑相关行为有调节作用[26]。研究表明,低频电针刺激可以缓解创伤后应激障碍小鼠的焦虑[27]。进一步研究发现,电针刺激可增加创伤后应激障碍大鼠vmPFC的原癌蛋白c-fos相关表达,提高vmPFC-VTA多巴胺能神经元通路活性,从而减少焦虑样行为[7]。
1.2.4 VTA-脚间核环路 脚间中间体(interpeduncular intermediate,IPI)是脚间核的一个子区,在尼古丁戒断期间,激活表达CRF受体1的脚间中间体神经元可诱导焦虑,向脚间核内注射CRF受体1拮抗剂,可抑制脚间中间体神经元的活性并缓解焦虑[14]。进一步研究发现,VTA多巴胺能神经元合成CRF作用于脚间中间体可增加焦虑样行为,此外,该CRF也可通过激活内侧缰核到脚间中间体的谷氨酸能神经投射,诱导焦虑样行为[14]。
2 神经递质
VTA是由多种神经元组成的异质性结构,这些神经元产生的神经递质,如多巴胺、GABA、谷氨酸等,对焦虑等情绪调控发挥重要的作用[28]。
2.1 多巴胺多巴胺是中枢神经系统和外周神经系统合成的神经递质[3],通过与多巴胺受体结合调节神经元活动[29]。多巴胺受体可分为D1样受体家族和D2样受体家族,其中D1样受体家族由D1和D5两种不同的多巴胺受体亚型组成,D2样受体家族由D2、D3和D4三种不同的多巴胺受体亚型组成[30]。研究表明,向VTA内输注多巴胺D2、D3受体激动剂或D1受体拮抗剂可缓解焦虑样行为并减少恐惧[31-32]。研究表明,激活VTA多巴胺能神经元到脚间核的投射诱导焦虑,向脚间核内输注多巴胺D1受体拮抗剂可缓解焦虑样行为[9];长期皮质酮治疗可通过多巴胺D2受体降低VTA多巴胺能神经元的兴奋性和兴奋性突触传递,减少VTA多巴胺递质释放,促进小鼠产生焦虑样行为[33]。虽然激活或抑制多巴胺能神经元参与部分神经环路已被证明可以调控焦虑样行为,但具体通过哪种多巴胺受体发挥作用尚未阐明。尼古丁抑制VTA 多巴胺能神经投射到杏仁核,减少VTA多巴胺到杏仁核的释放,从而使小鼠产生焦虑样行为[6];VTA中的瘦素可以通过直接抑制多巴胺能神经元放电,降低多巴胺能神经元的活动,缓解焦虑样行为[34]。综上,多巴胺在VTA中调节焦虑样行为发挥重要作用,然而具体通过哪种多巴胺受体发挥作用还有待进一步研究。
2.2 谷氨酸、GABA和乙酰胆碱除了多巴胺,VTA中其他神经递质也可直接或通过影响多巴胺间接调控焦虑。使用光遗传学方法激活VTA到侧隔的神经投射,可发挥抗焦虑效应,这一效应是由于VTA多巴胺D1受体表达神经元释放谷氨酸,从而激活侧隔谷氨酸能神经元所致[10]。慢性缩窄性损伤可增强VTA到NAc的谷氨酸能神经投射,促进与疼痛相关的焦虑样行为,利用光遗传学方法抑制该投射可缓解慢性缩窄性损伤诱发的焦虑样行为[5],而这一行为可能与VTA谷氨酸能神经元调节NAc中多巴胺D1和D2样受体的活动有关[35]。另有研究表明,激活小鼠VTA GABA能神经元可诱导焦虑样行为[10],而这是否与多巴胺相互作用仍待进一步研究。乙酰胆碱是与焦虑和抑郁等情绪障碍相关的神经递质[21]。乙酰胆碱与VTA中胆碱能受体结合,激活VTA到NAc的多巴胺能神经元活动,促进多巴胺释放,增加焦虑样行为[21]。综上,谷氨酸、GABA和乙酰胆碱在调节焦虑样行为中发挥直接或间接作用,这些研究成果为今后研究焦虑障碍的发病机制及治疗奠定了一定的基础。
3 影像研究
随着影像学技术的进步,对于焦虑障碍的研究也在不断深入。运用高分辨率磁共振成像研究焦虑障碍组和健康对照组受试者的VTA,发现焦虑障碍组的VTA体积大于健康对照组,但VTA内多巴胺信号强度却低于健康对照组,这说明焦虑障碍组的VTA多巴胺能系统结构完整性较健康对照组低[36]。此外,运用功能性磁共振成像的研究发现海马-VTA连接与焦虑、抑郁症状或奖赏敏感性没有相关性[37]。
4 小结
综合考虑以上分析,VTA、多巴胺与焦虑密切相关。因此,本文对生理及病理状态下VTA参与调节焦虑样行为的神经环路及相关神经递质进行总结,这为明确焦虑障碍的发病机制提供了更清晰的路线图(图1)。近年来,新兴的影像研究使得VTA定向分析可视化成为可能,这为焦虑障碍的诊断提供了新的辅助标准。未来可以进行更多临床研究,从神经影像学、生物学、表观遗传学等多个角度深入探讨焦虑障碍的发病机制,以期开发更有效且副作用更少的治疗方法。
