脓毒症肾损伤患者血清血管内皮钙粘蛋白水平变化及临床意义
2024-01-08陶伍元邓柳霞
陶伍元 邓柳霞
脓毒症肾损伤作是脓毒症最容易受累的脏器,其发病率及死亡率仍较高。脓毒症发病机制较为复杂,近年来血管血管内皮损伤,血管内皮通透性增加在脓毒症肾损伤的发生发展过程中起着重要的作用。血管内皮钙粘蛋白(vascular endothelial cadherin,VE-cadherin)为血管内皮细胞紧密连接蛋白,在维持正常的血管通透性方面具有重要的作用。本研究通过观察脓毒症患者血清VEcadherin 水平变化,探讨VE-cadherin 在临床中的指导作用。
1 临床资料
1.1 一般资料2020 年1 月-2022 年12 月深圳宝安区人民医院急诊科收治的脓毒症140 例,按照是否并发AKI,分为Sepsis 组和Sepsis-related acute kidney injury,SAKI)组(伦理号:BYL20190753)。纳入标准及排除标准(1)年龄18-75 岁,符合脓毒症诊断者即存在感染或可疑感染,且SOFA 评分≥2 分;(2)脓毒症诊断标准脓毒症和感染性休克管理国际指南(2021 版)标准[1]。(3)急性肾损伤按照肾脏疾病预后组织指南中的AKI 定义[2]:48 h 内血肌酐(Cr)上升≥0.3 mg/dL(≥26.5 mmol/L),或7 d 内SCr>1.5 倍基线值,或连续6 h 尿量<0.5 ml/(kg·h)。基线SCr 值定义为已知的3 个月SCr 最低值,如人院前SCr 未知则以此次入院后的最低值为基线值(4)病例资料完整。排除标准:(1)年龄>75周岁或年龄<18 周岁;(2)既往有冠心病、糖尿病、慢性肾功能不全、慢性心力衰竭、慢性阻塞性肺疾病、恶性肿瘤;(3)长期使用糖皮质激素;(4)放弃治疗或临床资料不缺失者;(5)人院72 h 内死亡患者。
1.2 实验分组纳入140 名脓毒症患者,血循感染12 例、肺部感染32 例、胆道感染31 例,泌尿系感染38 例,腹腔感染12 例,皮肤软组织感染15例;按照是否合并AKI 分为Sepsis 组和SA-AKI 组,按照Sepsis 3.0 指南进行脓毒症综合治疗,包括液体复苏,控制感染或清除感染灶,脏器功能支持,维持水电解质酸碱平衡维持等治疗措施。
1.3 病例资料收集记录患者生命体征,血常规CRP,PCT,肝肾功能凝血功能,血气分析,常规进行APACHE II 评分及SOFA 评分。
1.4 指标检测收集患者入院24 h 内的静脉血5 ml,放置于4 ℃离心机2000 rpm,10 min,分离上清液,放置于-80℃冰箱保存。采用ELISA 法检测血清VE-cadherin 水平,ELISA 试剂盒购于(武汉华美生物,CSB-E09372h)。
1.5 统计学方法计量资料采用(±s)表示,计数资料采用频数表示;采用SPSS 26.0 统计软件进行分析;均数比较采用t检验,计数资料采用χ2检验,Spearman 检验变量的相关性分析;P<0.05 表示差异具有统计学意义。
2 结 果
2.1 两组脓毒症患者一般资料见表1。

表1 两组患者一般资料统计
2.2 两组血清VE-cadherin、PCT 水平比较见表2。
表2 两组VE-cadherin 水平比较(μmol/L,±s)

表2 两组VE-cadherin 水平比较(μmol/L,±s)
注:与Sepsis 组比较,*P<0.05。
组别Sepsis 组SA-AKI 组PCT(ug/L)5.543±1.12 14.490±2.34*例数72 68 VE-cadherin(ug/ml)6.729±1.29 15.780±3.12*

图1 两组患者血清VE-cadherin 比较
2.3 SA-AKI 组患者血清VE-cadherin 水平与PCT、APACHE II 评分、SOFA 评分相关性分析见表3。
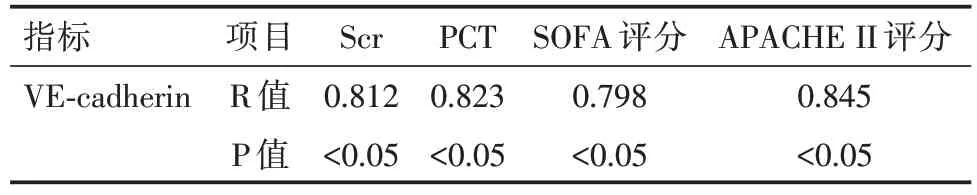
表3 VE-cadherin 与PCT、APACHE II 评分、SOFA 评分相关性分析
2.4 ROC 曲线分析血清VE-cadherin 对SA-AKI有一定预测价值(P<0.05),ROC 曲线下 面 积(AUC)为0.798;当PCT≥7.25 μg/mL 时,敏感度为0.839%,特异度为72.5%(图3)。
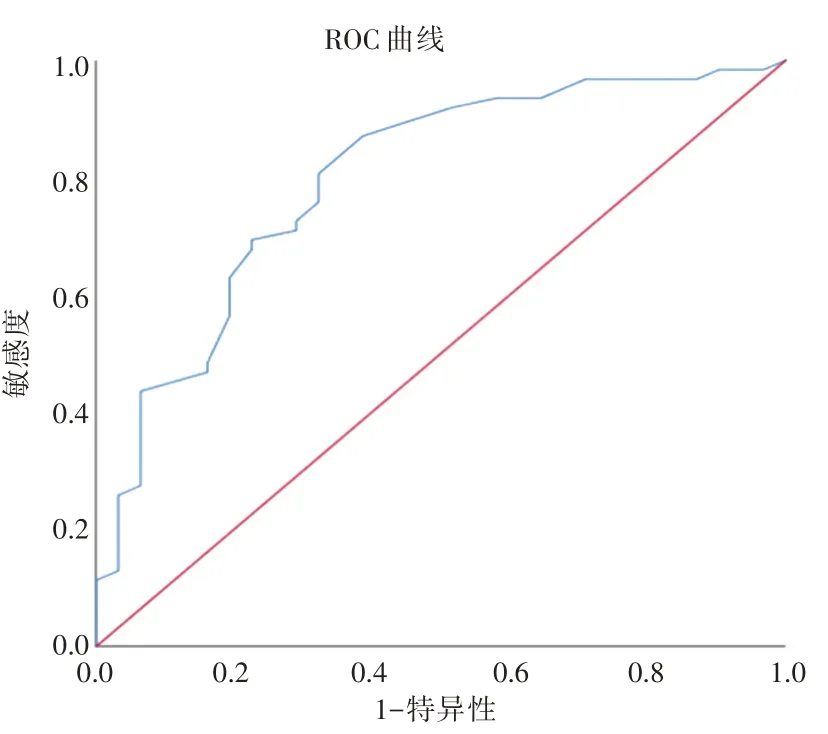
图3 血清VE-cadherin 预测脓毒症肾损伤的ROC 曲线
3 讨 论
脓毒症易导致多脏器功能衰竭,其中肾脏最易受累,脓毒症性相关的急性肾损伤发病率高达40-70%[3-4]。研究显示内皮细胞的激活和损伤在脓毒症发生发展过程中发挥重要作用,因此内皮细胞损伤的相关生物学指标在脓毒症的诊断及临床评估尤为重要[5-6]。
VE-cadherin 是由784 个氨基酸组成,是Cadherin 家族中的一员,作为血管内皮细胞间主要的连接蛋白,其膜内侧的连环蛋白分子β-catenin、αcatenin、γ-catenin 和p120 结合形成VE-cadherincatenin 复合体,此联合体通过α-连环蛋白与胞内肌动蛋白细胞骨架相连,维持VE-cadherin 介导的细胞黏附的稳定。完整的VE-cadherin 复合体是维持血管内皮功能的结构基础[7]。在炎症过程中,血管内皮细胞VE-cadherin 的胞外结构域可以被切割为可溶性VE-cadherin 进入循环[8]。研究发现可溶性VE-cadherin 水平在严重脓毒症中明显增加,且与脓毒症病死率呈正比,因此可证实VEcadherin 水平与脓毒症的发展进程相关。在228名严重脓毒症患者中,80 名(35%)出现AKIRRT。与未患AKI-RRT 的患者相比,患有AKIRRT 的患者入组时血浆sVE-钙粘蛋白水平显着较高[9]。
本研究显示脓毒症急性肾损伤患者血清水平VE-cadherin 显著高于脓毒症组,其可能因为脓毒症在炎症介质的作用下诱导血管内皮损伤,位于血管内皮的VE-cadherin 分子结果破坏,形成可溶性VE-cadherin 释放入血,而肾脏在脓毒症炎症基础损伤的基础之上,加重肾脏微循障碍,肾脏血管内皮通透性升高,导致可溶性VE-cadherin 进行性升高。同时在血清VE-cadherin 水平与Scr 相关性分析结果显示,其水平与血肌酐水平呈正相关,VE-cadherinr 可间接预测肾脏损伤的严重程度。此外研究结果发现VE-cadherin 与脓毒症病区评估指标APACHE II、SOFA 评分呈正相关,通过VEcadherin 值可间接判断脓毒症脏器损伤严重程度。
脓毒症诱导的血管内皮损伤在其脓毒症发生发展中具有重要的作用。VE-cadherin 作为血管内皮损伤的重要指标,脓毒症肾损伤患者血清VE-cadherin 呈升高,且与Scr、PCT、APACHE II 评分、SOFA 评分呈正相关,具有一定的临床预测价值。
