虚拟现实技术在晚期非小细胞肺癌化疗患者癌因性疲乏中的应用*
2024-01-08徐晓敏顾芬季李华王萍
徐晓敏,顾芬,季李华,王萍
(上海市宝山区吴淞中心医院,1a心内肾内科,1b门急诊办公室,上海宝山,200940;2 上海交通大学医学院附属第九人民医院护理部,上海黄浦,200011;3 上海中医药大学附属上海市中西医结合医院急诊科,上海虹口,200082)
肺癌是全球发病率和致死率较高的癌症,严重危害人类健康。非小细胞肺癌(non-small cell lung,NSCL)占肺癌类型的80%[1],其中以腺癌和鳞癌最为常见。由于起病隐匿,70%的患者发现时为晚期,无法手术根治[2],70%患者使用一线铂类药物化疗缓解症状或稳定疾病[3]。铂类药物在终止癌细胞分裂,遏制其DNA 合成的同时,会损伤正常的DNA,导致毒素累积,增加胃肠道及血液毒性风险发生率,患者可出现疲乏、恶心、呕吐等症状[4]。癌因性疲乏是癌症患者的主观负面感受,不随体力活动减少而缓解且持续时间长,影响患者恢复社会角色,严重降低生活质量[5]。研究表明[6],晚期癌症及化疗是导致癌因性疲乏的重要因素。随着科学技术不断发展,越来越多的数字技术及智能软件被应用于护理领域。虚拟现实技术(virtual reality,VR)[7]是一种数字技术,使用者借助各类穿戴设备及软件,进入人工三维场景,使其感官体验(如视觉、听觉、触觉等)身临其境,从而足不出户即可满足不同用户需求。近年来,VR 技术在国内外护理领域多用于教学以建立学生信心,并为其提供安全的学习空间,或患者康复及其症状改善,均取得良好效果[8-12]。相较于传统的非药物干预,VR 技术具有沉浸性、交互性、构想性等优势,其在癌症症状护理中的潜在交叉性优势是值得深入研究的[13-14]。1 项Meta 分析显示[15],VR技术能显著缓解患者癌症急性期的疲乏症状,但对于治疗期和晚期癌症症状干预效果还有待进一步研究。本研究假设在晚期非小细胞肺癌化疗患者中应用VR 技术,能缓解癌因性疲乏,提高生活质量。
1 对象与方法
1.1 研究对象
选取2020 年1 月—12 月上海某医院肿瘤一区和肿瘤二区晚期非小细胞肺癌初次化疗患者为研究对象。根据预实验30 例患者(对照组与试验组各15 例),疲乏得分研究期望差值为2 分左右,取患者化疗后期即第7 次化疗数据代入Excel 设定公式S=2.65,得每组24 例,考虑20%脱落率,最终试验组与对照组各为30 例。纳入标准:细胞学或病理诊断为晚期非小细胞肺癌[5];年龄>18 岁;已确诊即将初次化疗;采用铂类药物化疗方案,能完成7 个疗程的化疗;生存期预计>3 个月且卡诺夫斯基功能状态评估表(Karnofsky performance scores,KPS)分值>70分[16];无其他脏器严重合并症;无幽闭恐惧症、头面部损伤及眼部病变;无晕动症。排除标准:妇女妊娠期;精神病者;言语交流障碍者。剔除标准:干预过程中不遵守医疗护理方案。本研究所有患者均知情同意,研究已通过医院伦理委员会审批通过(编号:2020-01)。
1.2 研究方法
1.2.1 化疗方案 两组均采用NP(长春瑞滨+顺铂)、GP(吉西他滨+顺铂)、TP(紫杉醇+洛铂)化疗方案。化疗药物由肿瘤科医生根据个人体表面积计算,生成医嘱。长春瑞滨、吉西他滨及紫杉醇在疗程的第1天及与第8天应用,顺铂和洛铂在疗程的1~3d应用。8d为1个疗程,之后为间歇期,28d后进行下一疗程,需完成化疗7个疗程。
1.2.2 对照组 ①化疗药物输注前预处理:化疗药前1d、给药当天和化疗后1d给予口服地塞米松、雷尼替丁,预防胃肠道反应与皮疹;输注紫杉醇前给予肌内注射非那根。化疗药物的输注:顺铂500mL输注时间在2h内、紫杉醇500mL输注时间>3h、盐酸吉西他滨100mL输注时间在30min,输液过程中严密观察药物治疗后的反应。②做好导管护理、饮食护理(化疗期间食物以高热量、高蛋白、易消化为主;同时根据患者不同体质,指导患者服用茯苓白术银耳粥、黄芪党参鸡汤、山药栗子粥等)、情志护理(做好患者心理护理,指导患者每日听商调音乐并凝神静气20min,利于肺气肃降)。③运动指导:患者体力允许的情况下,指导患者每日进行坐式八段锦、呼吸操、散步等。④复诊指导:出院前指导患者每周2次来院复查。⑤随访:定期(2次/周)进行不同形式的随访,如电话、微信或家访,解决患者存在问题。
1.2.3 试验组 在对照组基础上进行VR干预。
1.2.3.1 成立干预小组 成立VR干预小组,共11人,其中指导员3人、研究人员4人、实施人员4人。①指导员:1名硕士研究生导师、1名电子信息工程专业高级工程师与1名国家二级心理咨询师,负责培训指导、整体把控;②研究人员:由4名硕士研究生,护师及以上职称人员组成,对患者解释本次干预的目的、方法及注意事项,签署知情同意书,进行问卷发放及资料收集工作。③实施人员:由4名本科及以上学历,中级职称医护人员组成,实施VR技术,同时确保干预过程中患者的安全及干预顺利完成。所有人员均通过VR培训,取得院内实施资质。
1.2.3.2 实施方法 (1)实施前准备。①制定意愿清单:收集患者希望进行VR体验的场景,筛选后将本次VR体验设为旅行、星空、四季、地球、公园、海底世界6个场景。②实施前指导:将患者集中于病区,统一指导设备穿戴及手动杆使用方法,并让患者进行一对一反馈。告知患者若使用VR设备过程中有任何不适,如眩晕、恶心、胸闷等及时按铃告知医护人员。③VR设备准备:本研究采用Oculus quest 2代VR眼镜一体机为患者制造沉浸式场景体验,除头戴设备外,还包含两个Touch控制器用于操作。(2)体验过程。本研究VR场景均为深度放松型沉浸式3D交互场景,给予患者轻松舒适的体验。所有场景均配有舒缓音乐,患者可根据自身喜好选择打开背景音乐或关闭。①旅行:可选择感兴趣的旅行路线,对于名胜古迹和景点,点击后出现语音讲解。②星空:可选择夜晚不同场景下的星空变化,穿梭于星云及银河系中。③四季:可选择特定的季节,感受当季的自然之美;也可以进行四季轮换体验,每个季节通过视觉、听觉的变化使患者感受多变的魅力。④地球:从国际空间站观测站视角,给予患者一段“卡尔萨根式”地球旅程,宁静与生机并存。⑤公园:公园主要以绿地景观切换为主,包括密林草结构空间、复层结构空间、疏林草结构空间、灰色临水硬质空间、灰绿参半临水硬质空间、绿色临水硬质空间6类对身心有复愈作用的景观结构。⑥海底世界:模拟海底各类生物及真实环境,如鱼群的游动、海藻摆动及海水律动等;此外,患者通过对海洋生物的选择,可以了解该物种的相关信息。
1.2.3.3 实施方式 (1)住院期间VR体验:每次化疗前由2名责任护士进行VR操作,2名责任医师配合。首先将患者床头摇高≥45°,根据其舒适体位进行微调(若患者自诉需要坐位,则摇高床头至80°,同时略摇低床尾,头部及腰部垫软枕,支起床上桌,嘱患者双臂放于桌上建立支撑点);其次调节VR眼镜瞳距与患者适配;最后为患者佩戴头戴设备,予Touch控制器,患者可自行选择内置场景观看。VR过程中拉起两边床栏,注意倾听患者主诉,及时观察有无不良反应。每次干预时间20min。(2)化疗间歇期VR体验。患者化疗间歇期每周2次来院复查时,由专科护士引导至医护联合门诊,患者在可调节座椅上取坐位,完成VR场景体验。
1.2.4 评价指标 Piper疲乏修订量表(revised Piper fatigue scale,RPFS)由亚利桑那大学护理学院的PIPER[17]于1997年编制,本研究采用中文版Piper修订量表[18](revised Piper fatigue scale of Chinese,RPFSCV)。RPFS-CV由28个条目组成,条目1若患者回答“没有疲乏”则不继续填写,条目3至条目24采用0~10数字标尺供患者选择,数字越大表明疲乏程度越严重。每项数字标尺条目分相加除以22即该量表总分。0~3分为没有疲乏或轻度疲乏、4~6分为中度疲乏、>6分为重度疲乏。除计分模块外,该量表还有选择项和表述项用以补充观测,不计入总分。RPFS-CV量表在中国人群中应用的重测信度为0.98,Cronbachα系数为0.91,4个维度在0.89~0.93之间,具有良好的信度、效度。本研究中,该量表的Cronbach α系数为0.724,内部一致性较好。
1.3 调查方法
由VR 干预小组4 名调研员收集资料。调查前,调研员统一进行标准化指导语培训。研究组根据调查过程中可能出现的情况,设定“剧本”,使用院内标准化患者对培训后的调研员进行考核,保证调查的同质化。一般资料在首次入院时(干预前)填写,疾病相关内容从患者电子病案获取,其余采取问答形式获得。RPFS-CV 量表在患者首次、第3 次、第5 次、第7 次化疗入院后2h 内收集,资料收集完毕后,现场进行查检,避免缺漏,并发放小礼物表示感谢。本研究资料回收率与合格率均为100.0%。
1.4 统计学方法
数据由双人录入WPS Excel 后导入SPSS19.0进行分析。计量资料如符合正态分布且方差齐,采用表示,组间比较采用t检验;计数资料采用频数、百分比表示,如总例数≥40,所有理论频数≥5 用Pearsonχ2检验;如果总例数≥40,至少2 个理论频数≥1 且<5 或总例数<40 或者出现理论频数<1 则用Freeman-Halton 检验。两组不同时间点RPFS-CV 评分符合正态分布且方差齐,采用重复测量方差分析,若显示组间与时间交互,需进行简单效应分析,采用Bonferroni 法进行两两对比。检验水准:α=0.05。
2 结果
2.1 两组患者一般资料比较
60 例患者均完成7 个疗程的化疗。两组患者一般资料比较见表1。由表1 可见,两组患者一般资料比较,均P>0.05,差异无统计学意义,具有可比性。
表1 两组患者一般资料比较 (n/%;±S)
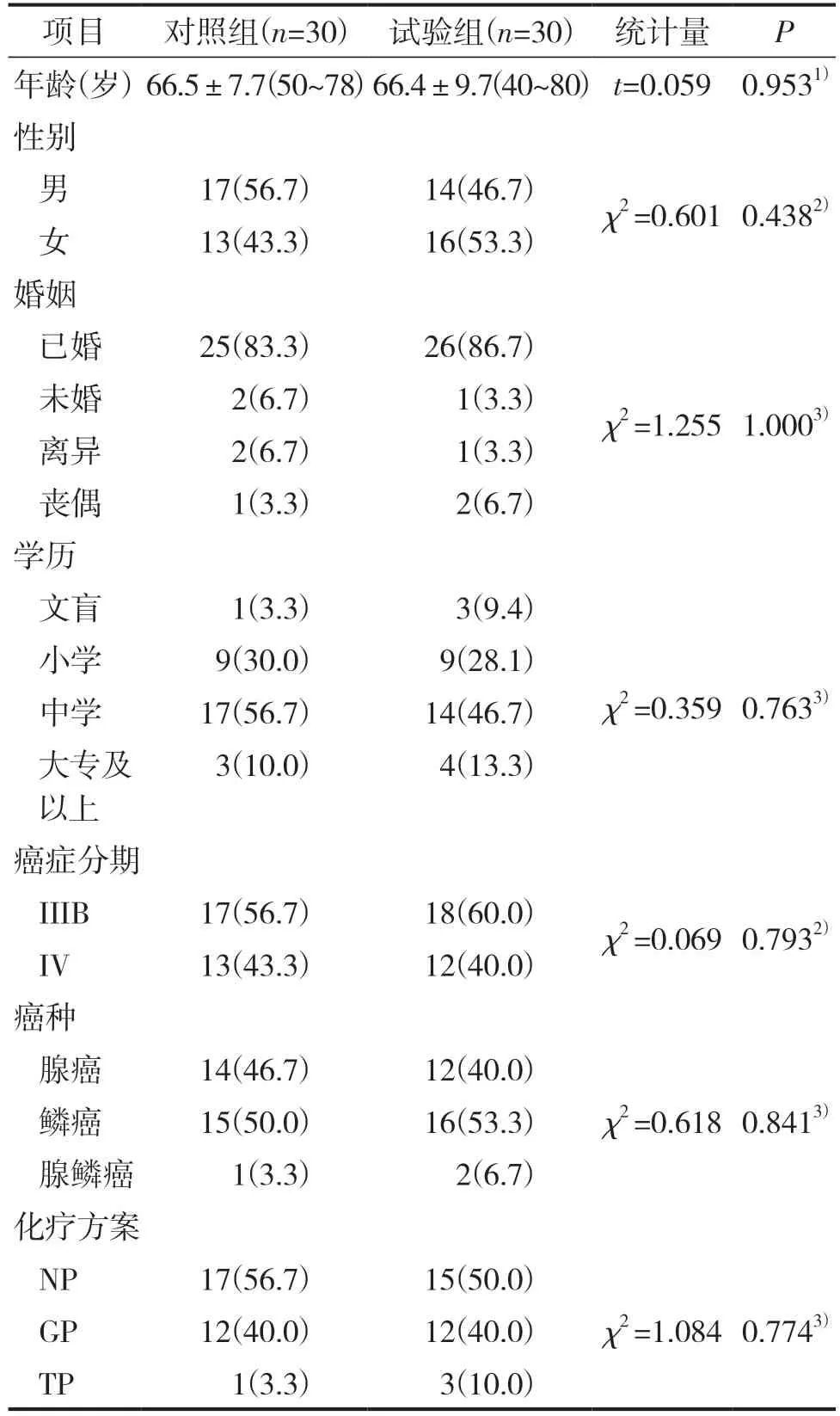
表1 两组患者一般资料比较 (n/%;±S)
注:1)t 检验,2)χ2 检验,3)Freeman-Halton 检验。GP 为吉西他滨+顺铂;NP 为长春瑞宾+顺铂;TP 为紫杉醇+洛铂。
项目对照组(n=30) 试验组(n=30) 统计量P年龄(岁)66.5±7.7(50~78)66.4±9.7(40~80) t=0.059 0.9531)性别男17(56.7)14(46.7)χ2 =0.601 0.4382)女13(43.3)16(53.3)婚姻已婚25(83.3)26(86.7)χ2 =1.255 1.0003)未婚 2(6.7) 1(3.3)离异 2(6.7) 1(3.3)丧偶 1(3.3) 2(6.7)学历文盲 1(3.3) 3(9.4)χ2 =0.359 0.7633)小学 9(30.0) 9(28.1)中学17(56.7)14(46.7)大专及以上3(10.0) 4(13.3)癌症分期IIIB17(56.7)18(60.0)χ2 =0.069 0.7932)IV13(43.3)12(40.0)癌种腺癌14(46.7)12(40.0)χ2 =0.618 0.8413)鳞癌15(50.0)16(53.3)腺鳞癌 1(3.3) 2(6.7)化疗方案NP17(56.7)15(50.0)GP12(40.0)12(40.0)χ2 =1.084 0.7743)TP 1(3.3) 3(10.0)
2.2 两组不同时间点RPFS-CV评分重复测量方差分析
两组不同时间点RPFS-CV 评分重复测量方差分析结果显示,组间(F=52.748)、时间(F=117.167)与时间×组间(F=12.053)的交互效应均有统计学意义,均P<0.001,因此对两组组内和时间进行单独效应的检验。
2.2.1 不同时间点两组组间RPFS-CV评分比较 第1次化疗前、第3次化疗两组RPFS-CV评分比较,差异无统计学意义,均P>0.05;第5次、第7次化疗两组RPFS-CV评分比较,均P<0.001,差异有统计学意义,对照组得分高于试验组,见表2。
表2 不同时间点两组患者组间RPFS-CV评分比较 (分;±S)
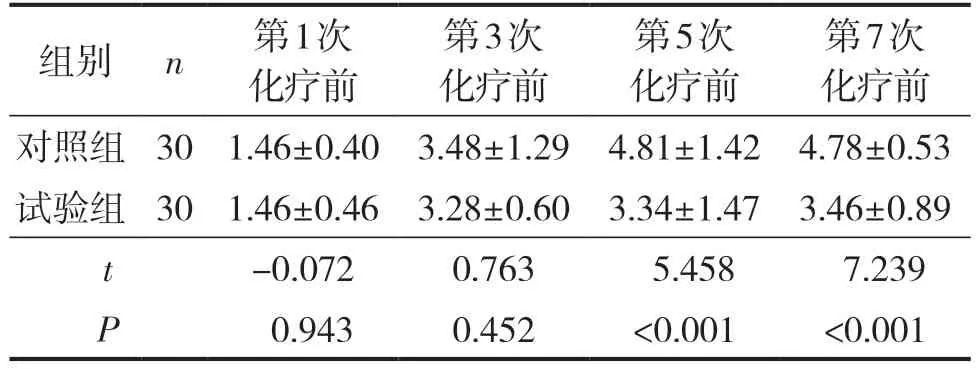
表2 不同时间点两组患者组间RPFS-CV评分比较 (分;±S)
注:Piper 疲乏修订量表(revised Piper fatigue scale,RPFS)。
组别 n第1次化疗前第3次化疗前第5次化疗前第7次化疗前对照组 30 1.46±0.40 3.48±1.29 4.81±1.42 4.78±0.53试验组 30 1.46±0.46 3.28±0.60 3.34±1.47 3.46±0.89 t-0.0720.763 5.458 7.239 P 0.9430.452<0.001<0.001
2.2.2 不同时间点两组组内RPFS-CV评分比较 ①在对照组中,RPFS-CV评分患者第1次化疗前与第3次、第5次、第7次化疗比较,均P<0.001,差异有统计学意义,均高于第1次化疗前评分;第3次化疗与第5次、第7次化疗比较,均P<0.01,差异有统计学意义,具有越往后得分越高的趋势;第5次化疗与第7次化疗比较,P>0.05,差异无统计学意义。②在试验组,RPFS-CV评分患者第1次化疗前与第3次、第5次、第7次化疗比较,均P<0.001,差异有统计学意义,均高于第1次化疗前评分;第3次化疗与第5次、第7次化疗比较,第5次化疗与第7次化疗比较,均P>0.05,差异无统计学意义,见表3。
表3 不同时间点两组患者组内RPFS-CV评分比较 (分;±S)

表3 不同时间点两组患者组内RPFS-CV评分比较 (分;±S)
注:Piper 疲乏修订量表(revised Piper fatigue scale,RPFS)。
组别时间tP差值及其95%置信区间对照组第1次化疗前与第3次化疗前-7.72<0.001-2.02±1.43(-2.761,-1.279)第1次化疗前与第5次化疗前-12.25<0.001-3.35±1.46(-4.110,2.599)第1次化疗前与第7次化疗前-28.40<0.001-3.32±0.64(-3.651,2.989)第3次化疗前与第5次化疗前-3.65 0.006-1.33±2.00(-2.370,-0.298)第3次化疗前与第7次化疗前-4.94<0.001-1.30±1.43(-2.040,-0.559)第5次化疗前与第7次化疗前 0.11 1.000 0.04±1.68(-0.833,0.902)试验组第1次化疗前与第3次化疗前-12.42<0.001-1.82±0.80(-2.229,-1.401)第1次化疗前与第5次化疗前-17.36<0.001-1.88±0.59(-2.183,-1.571)第1次化疗前与第7次化疗前-10.50<0.001-1.99±1.04(-2.531,-1.456)第3次化疗前与第5次化疗前-0.42 1.000-0.06±0.81(-0.479,0.356)第3次化疗前与第7次化疗前-1.06 1.000-0.18±0.92(-0.655,0.298)第5次化疗前与第7次化疗前-0.23 1.000-0.12±1.02(-0.644,0.410)
3 讨论
3.1 VR能改善晚期非小细胞肺癌患者化疗期间癌因性疲乏
近年来,VR 在护理领域文献发表增长曲线逐年攀升,说明其应用在国内受到了越来越多的重视及关注[19]。本研究两组不同时间点RPFS-CV 评分重复方差分析结果显示,组间、时间与交互作用均有统计学意义(均P<0.001),而且试验组第5 次化疗、第7 次化疗RPFS-CV 评分均低于对照组(均P<0.001),说明VR干预可以改善晚期非小细胞肺癌化疗患者的疲乏情况。研究表明[20],癌症及化疗会破坏下丘脑-垂体-肾上腺(hypothalamo-pituitary-adrenal axis,HPA)轴从而减少皮质醇的合成与释放,引起疲劳。VR 增强患者视觉感官刺激,形成应激应答,激活HPA 轴,增加皮质醇分泌,减缓疲乏[21]。1 项对乳腺癌患者开展的研究[22]显示,VR 能提高患者对化疗的耐受性,改善疲劳,提高生活质量,且干预效果优于对照组。本研究两组患者化疗前期(第3 次化疗)疲乏评分未呈显著差异(P>0.05),可能与纳入研究对象年龄整体老龄化有关。老年患者的身体机能随年龄增长而衰退,对外界事物的正性和负性的刺激应答均较缓慢[23]。此外,本研究纳入患者均为初次化疗,因此化疗前期均处于轻度或轻-中度疲乏,规范的常规护理对其有一定缓解作用,VR 优势尚未突显。
3.2 VR干预后不同化疗阶段两组患者组内癌因性疲乏改善情况不同
本研究结果显示,①在对照组中,患者RPFSCV 评分第1 次化疗前与第3 次、第5 次、第7 次化疗前比较,第3 次化疗与第5 次、第7 次化疗前比较,差异有统计学意义(P<0.01),而第5 次与第7 次化疗比较未呈显著差异(均P>0.05),具有越往后化疗疲乏得分越高,最终有稳定的趋势。研究显示[24-25],化疗药降解产物聚集,患者癌因性疲乏症状将在化疗中期达到峰值。化疗后期患者疲乏趋于稳定,可能与经过前期疗程后患者耐受增强,达到平衡,疲乏得分不再上升有关[26]。②在试验组,RPFS-CV 评分患者第1 次化疗前与第3 次、第5 次、第7 次化疗前比较,均P<0.001,差异有统计学意义,均高于第1 次化疗前评分;第3 次化疗与第5 次、第7 次化疗前,第5次化疗前与第7 次化疗前比较,均P>0.05,差异无统计学意义。这说明VR 在化疗初期时已对患者疲乏症状产生作用,遏制其上升趋势。SCHNEIDER 等[27]研究发现,化疗时接受VR 干预的患者,其疲劳评分即刻下降,与本研究一致。
3.3 VR干预注意事项
癌症化疗患者由于治疗与病理改变的共同作用,发生癌因性疲乏,相较于其他非药物疗法,患者在虚拟世界中能获得更舒适的精神体验[28]。为了保证VR 取得更好的效果,仍需注意以下几点:①干预前充分的指导和体验。对确定采用VR 干预的患者应用文字、图片、视频等多种教育方式,使其充分了解VR 的内涵及操作过程,必要时可进行同伴教育;在此基础上,给予患者1~2 次预体验,确认无不适后方可进行正式干预。②给予患者采用自觉舒适体位,最大程度达到患者躯体舒适体验。③日常偶发晕车、晕船患者需在医护人员一对一监护下进行VR 体验,本研究未纳入此类患者。④VR 干预应在患者进食2h 后进行,防止不适。⑤对于轻度视觉疲劳的患者,进行VR 体验可适当缩短其体验时间。
4 结论
非小细胞肺癌化疗患者癌因性疲乏随化疗疗程的进展而上升,但后期会趋于稳定。VR 技术能在化疗初期遏制患者疲乏发展趋势,一定程度上缓解症状。本研究存在一定局限:未进行随机对照试验,结果可能受其他混杂因素影响,影响其精度;研究的结局指标为主观疲劳量表评分,缺乏实验室客观指标。在今后的研究中,可增加实验室客观指标,以便更精确验证其结果。
