肝细胞癌组织HOXC9和KIF4A表达及其临床意义探讨*
2024-01-07何圣科蒲江汉冯海玲吴大平陈绵军
何圣科,蒲江汉,冯海玲,吴大平,陈绵军,陈 辉
肝细胞癌(hepatocellular carcinoma,HCC)是肝脏最常见的原发性恶性肿瘤,是全球第五大常见的恶性肿瘤之一,高居癌症相关死因的第二位[1]。目前,HCC的病因和发生机制尚未完全明确,其遗传异质性强,肿瘤发生发展涉及到多基因、多步骤、多环节的改变和相互作用。相关基因水平和功能也在HCC发生、发展和转移过程中发挥重要的作用[2,3]。同源盒基因C9(homeobox C9,HOXC9)是HOX基因家族成员,其包含参与脊椎动物胚胎发育的同源结构域,在胚胎的前-后轴形成过程中起到重要的作用[4]。目前已有报道显示,在胃癌和肺癌等多种肿瘤均存在HOXC9异常表达。HOXC9异常表达与肿瘤发生和发展关系密切[5-7]。驱动蛋白家族成员4A(kinesin family member 4A,KIF4A)是参与染色体的凝集和分离、纺锤体形成和细胞内大分子运输等生理过程的驱动蛋白超家族成员。多项研究发现KIF4A表达失调参与了乳腺癌和肺癌等肿瘤的发生和发展[8,9]。各种肿瘤组织HOXC9和KIF4A表达异常现象已引起了学者们的广泛关注。本研究采用免疫组化法检测了HCC组织HOXC9和KIF4A蛋白表达情况,并分析了它们与肿瘤病理学特征和临床预后的关系,现将研究结果报道如下。
1 资料与方法
1.1 一般资料 2018年1月~2021年1月我院诊治的HCC患者86例,男性58例,女性28例;年龄为48~69岁,平均年龄为(57.4±6.9)岁。HCC的诊断参照《原发性肝癌诊疗规范(2017年版)》[10]的标准,均经影像学检查和术后组织病理学检查诊断为HCC。其中,单发病灶36例,多发病灶50例;TNM Ⅰa/Ⅱa期46例,Ⅱb/Ⅲb期40例;在显微镜下见内皮细胞衬覆的血管腔内有癌细胞巢团,即微血管浸润者37例,无微血管侵犯49例。排除标准:(1)无法耐受手术治疗;(2)存在其他类型的肝癌或合并其他恶性肿瘤;(3)术前接受过放疗、化疗或免疫治疗;(4)有肝移植手术史;(5)存在人类免疫缺陷病毒感染;(6)存在心、脑、肺、肾等重要脏器功能障碍。本研究通过我院医学伦理委员审核,批准实施。患者签署知情同意书。
1.2 手术方法 根据肿瘤大小、数目、部位和分期,选择行肝叶、肝段、半肝和局部切除术治疗。无菌取癌组织和癌旁肝组织,置于-80℃冰箱冻存。
1.3 癌组织和癌旁肝组织HOXC9和KIF4A蛋白表达检测 采用免疫组化法检测。取组织,加二甲苯脱蜡、梯度酒精水化,再置于0.01 mol/L柠檬酸缓冲液中高温修复抗原12 min,冷却5 min;经磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤,滴加3%过氧化氢溶液,室温避光孵育25 min,以灭活内源性过氧化物酶;用PBS缓冲液洗涤,加入山羊血清白蛋白封闭非特异性位点,再分别加入稀释后的兔抗人HOXC9多克隆抗体(美国Abcam,1:200稀释)或兔抗人 KIF4A多克隆抗体(美国Abcam,1:150稀释),4 ℃下孵育过夜;次日,经PBS 缓冲液洗涤,加入酶标二抗(北京中杉金桥生物技术开发公司),37℃下孵育30 min;加入二氨基联苯胺(北京中杉金桥生物技术开发公司)显色,自来水冲洗,蒸馏水冲洗,用苏木素复染,再用PBS缓冲液洗涤、返蓝,常规脱水透明,用中性树胶封片。以PBS缓冲液或已知阳性切片,分别作为阴性或阳性对照。在200倍显微镜下观察整张切片,随机选择每张切片的5个视野,每个视野计数100个细胞。根据阳性细胞百分比和染色强度评分,阳性细胞百分比计分为无(0分)、<25%(1分)、25%~50%(2分)、>50%(3分);无着色(0分)、淡黄色(1分)、棕黄色(2分)、棕褐色(3分)。上述2项评分的乘积<3为低表达,≥3为高表达。
1.4 随访 通过门诊复诊或电话随访2年。第1年每3个月随访1次,第2年每6个月随访1次。随访终点为患者全因死亡或截至到2023年1月,记录生存情况。
1.5 统计学方法 应用R 4.1.2软件进行统计学分析。对计量资料先行Shapiro-Wilk检验,判断是否服从正态分布。对非正态分布者,以M (P25,P75)表示,采用秩和检验。计数资料以%表示,采用x2检验或Fishers确切概率计算。应用Kaplan-Meier绘制生存曲线,采用Log Rank检验比较累积生存率。可信区间为95%,所有检验均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 HCC患者癌组织与癌旁肝组织HOXC9和KIF4A蛋白阳性率比较 HCC癌组织HOXC和KIF4A高表达阳性率均显著高于癌旁肝组织(P<0.05,表1,图1、图2)。

表1 HCC患者癌组织与癌旁组织HOXC9和KIF4A阳性率(%)比较
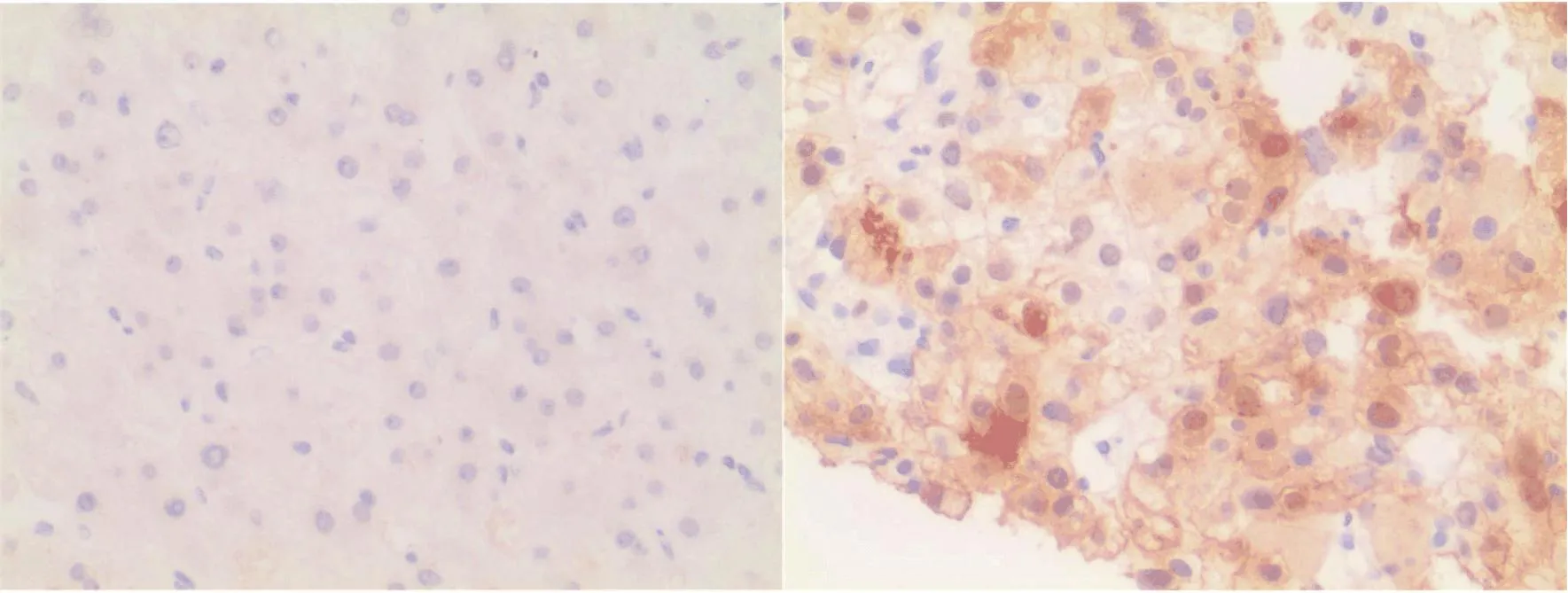
图1 HCC患者肝组织HOXC9蛋白表达(ABC, 200×)左:癌旁肝组织;右:癌组织
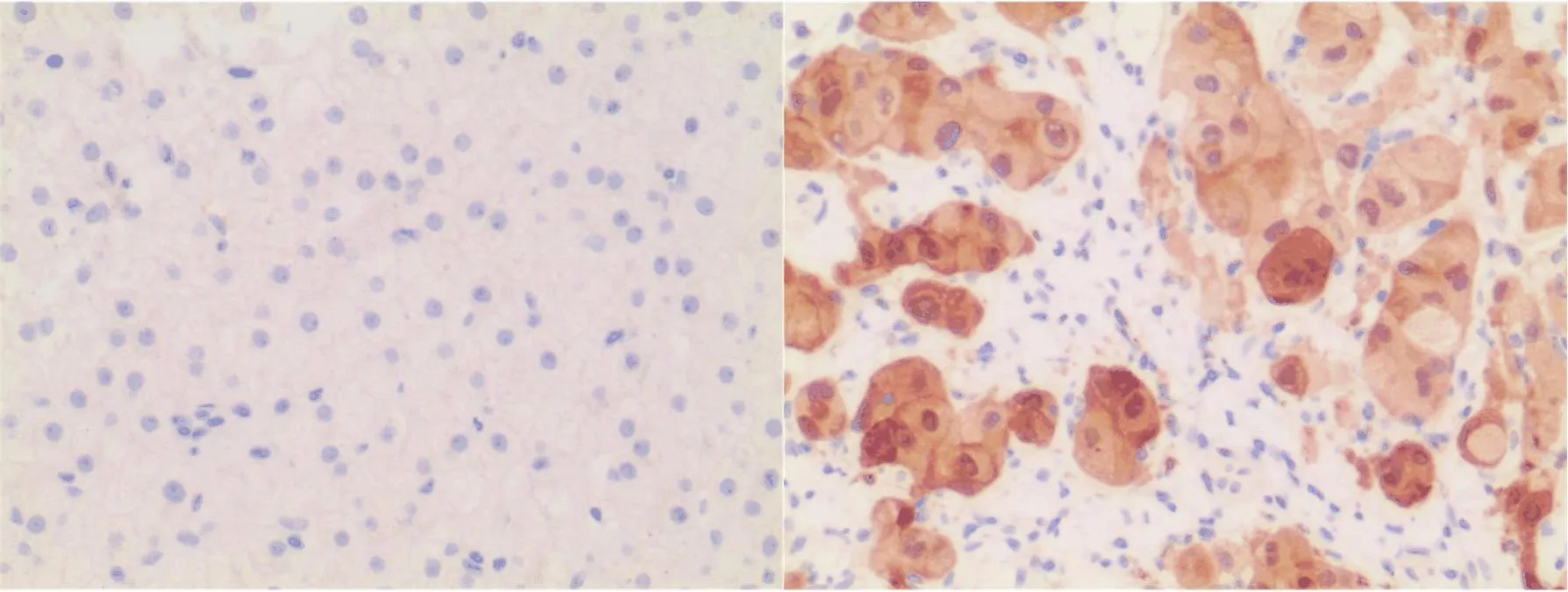
图2 HCC患者肝组织KIF4A蛋白表达(ABC, 200×)左:癌旁肝组织;右:癌组织
2.2 不同临床和病理学特征的HCC组织HOXC9和KIF4A蛋白高表达阳性率比较 肿瘤低分化和中分化、TNM Ⅱb/Ⅲb期、肿瘤包膜侵犯和发生微血管浸润的癌组织HOXC9和KIF4A高表达阳性率均显著高于高分化、TNM Ⅰa/Ⅱa期、无肿瘤包膜侵犯或无血管浸润的癌组织表达(P<0.05,表2)。
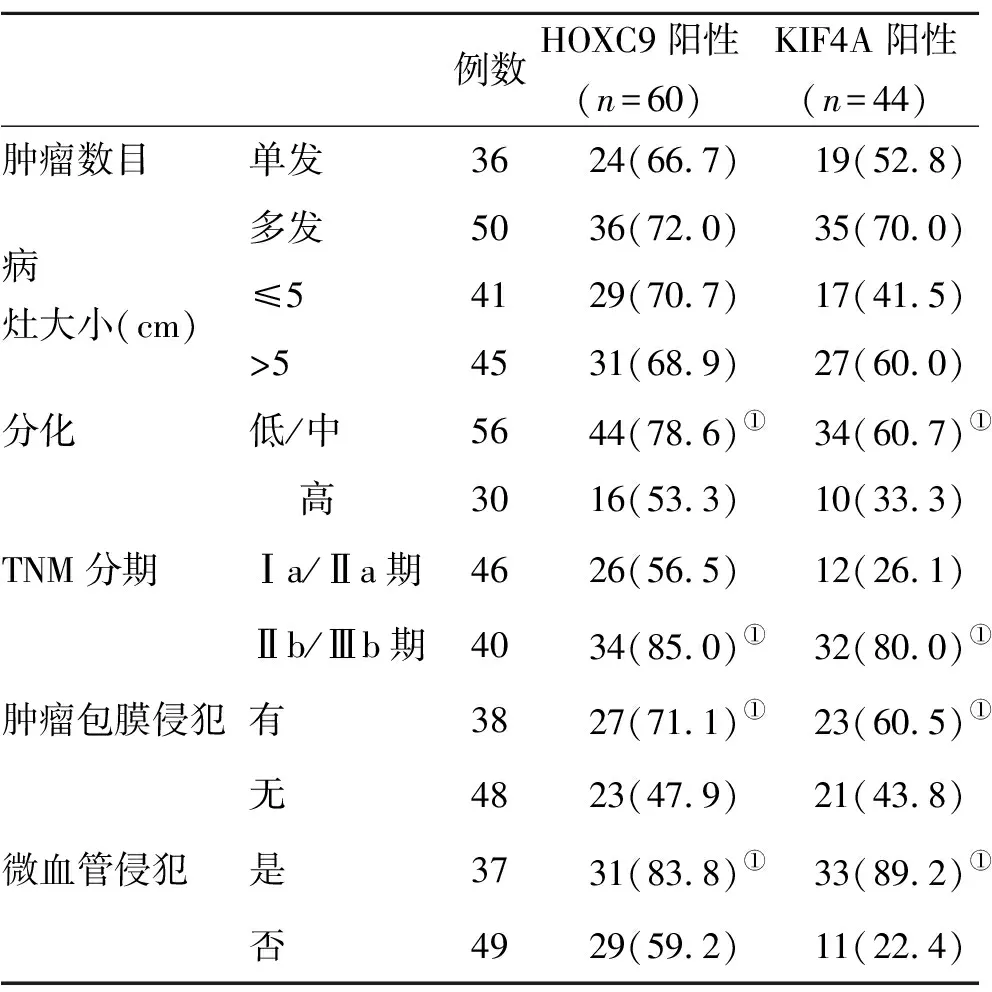
表2 不同临床和病理学特征的癌组织HOXC9和KIF4A蛋白高表达(%)比较
2.3 HCC癌组织HOXC9和KIF4A蛋白高表达与低表达患者生存情况比较 术后随访2年,86例患者生存38例(44.2%),死亡48例(55.8%);Log-rank分析显示,癌组织HOXC9蛋白高表达患者生存期显著短于低表达患者,癌组织KIF4A蛋白高表达患者生存期也显著短于KIF4A蛋白低表达患者(P<0.05,表3,图3)。
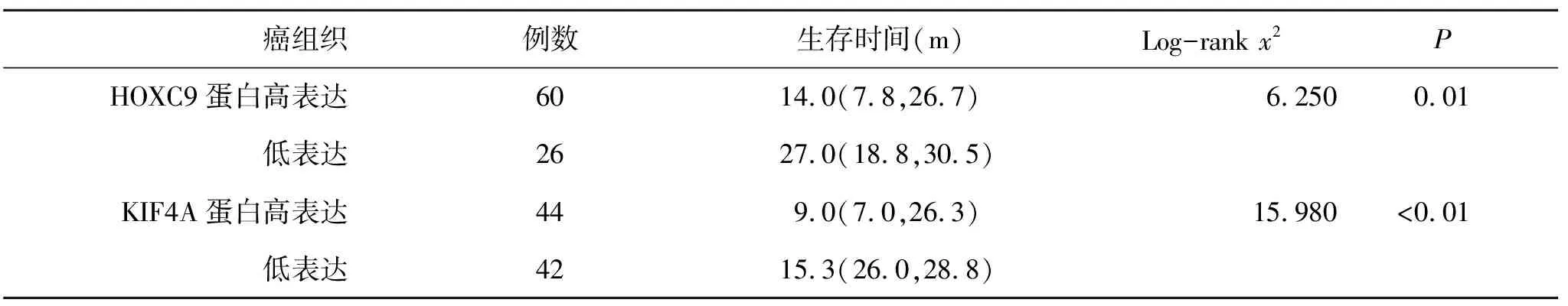
表3 癌组织蛋白高表达与低表达患者生存时间[M(P25,P75)]比较
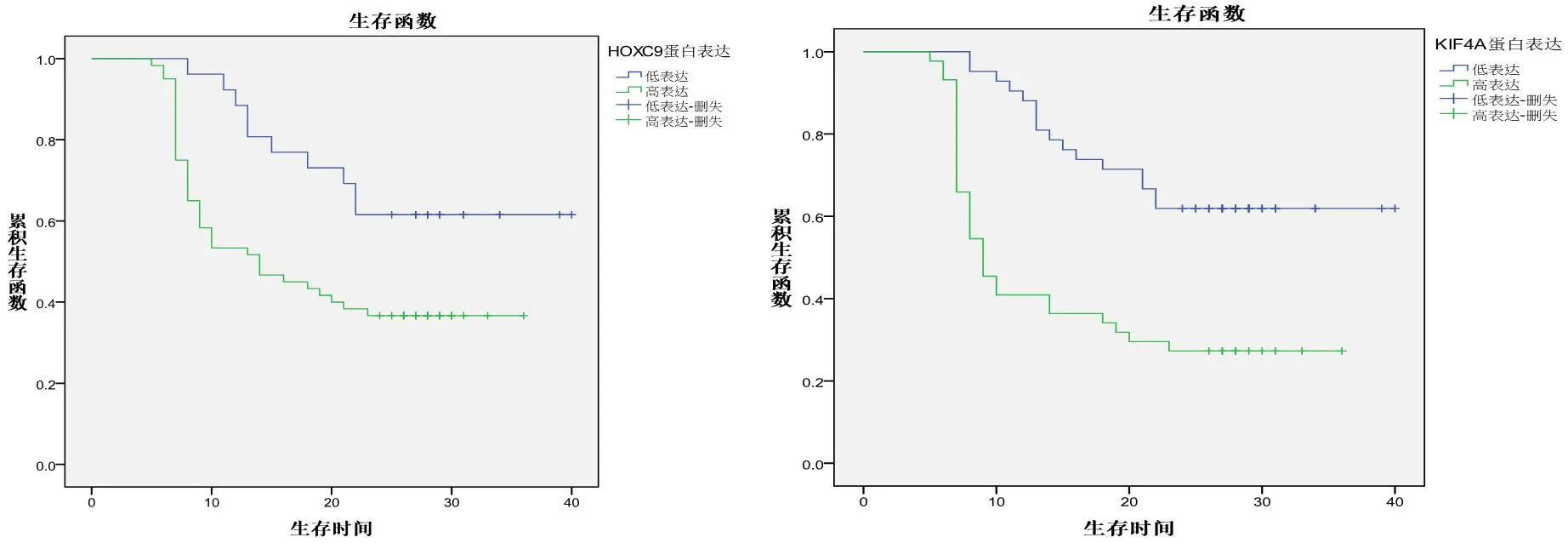
图3 HCC癌组织蛋白高表达与低表达患者生存时间比较左:HOXC9蛋白;右:KIF4A蛋白
3 讨论
HOXC9是具有高度保守性的调节基因,可控制胚胎发育、细胞分化和生长发育,其表达异常能够促进侵袭性肿瘤的DNA修复、侵袭、迁移、诱导血管生成等特征,在肿瘤细胞异常增殖、形成新生肿瘤组织微血管、转移等病理过程中发挥促进作用[11-14]。已有报道[15-17]显示,HOXC9表达上调可通过调节肿瘤生长和转移促进头颈部鳞状细胞癌的进展。沉默HOXC9能够赋予药物诱导的神经母细胞瘤细胞分化抗性,即产生抗肿瘤效果。本研究结果显示,86例患者HCC癌组织HOXC9高表达阳性率为69.8%,较癌旁肝组织15.1%更高,提示HOXC9在HCC显示为癌基因,可能参与了HCC的发生发展。KOXC9在甲状腺癌显示为抑癌基因,其低表达与甲状腺癌的发生和淋巴结转移有关。由此可见HOXC9在不同肿瘤细胞中的调控作用并不一致,具体机制仍有待探究。在不同分化程度、不同TNM分期、有无肿瘤包膜侵犯和有无微血管侵犯的HCC患者HOXC9高表达阳性率不同。本研究经生存分析显示,HCC癌组织HOXC9蛋白高表达患者生存期显著短于HOXC9蛋白低表达患者,提示HOXC9蛋白高表达与患者预后不良有关,与既往报道[18]结直肠癌HOXC9过表达提示预后不良的结果类似。
KIF4A是参与有丝分裂和胞质分裂过程的马达驱动蛋白家族成员,在有丝分裂过程中染色体凝聚和分离的调控方面发挥着重要的作用,其异常表达与有丝分裂异常和非整倍体细胞的形成有关[19]。基于UALCAN 在线数据库分析发现,CDCA5、KIF4A、TPX2和FOXM1过表达共同调控细胞周期,促进HCC的发生和发展。叉头框蛋白M1(fork head box protein M1,FOXM1)作为增殖相关的转录因子在肿瘤组织表达上调,HCC的发生发展存在FOXM1-KIF4A轴作用,FOXM1过表达能够调控下游靶标KIF4A表达增强,从而对癌细胞增殖、迁移和入侵产生促进作用[20]。本研究经生存分析显示,HCC癌组织KIF4A蛋白高表达患者生存期显著短于KIF4A蛋白低表达患者,提示KIF4A蛋白高表达与患者不良预后有关。有研究发现,KIF2C/4A/10/11/14/18B/20A/23表达上调不仅与HCC的病理学分级和肿瘤分期有关,还与患者预后不良有关,提示KIF4A蛋白是否可以作为HCC患者预后的生物标志物,值得进一步研究。
