失代偿期肝硬化并发自发性细菌性腹膜炎患者危险因素和PBMC CD36/mTORC1信号通路变化研究*
2024-01-07张迎迎魏珂乐郭慧杰
张迎迎,魏珂乐,丁 鹤,郭慧杰,崔 轶,王 昳
肝硬化为内科常见疾病,病程较长,为多种病因长期反复破坏肝组织功能而诱发的弥漫性肝损伤[1]。肝硬化存在结节性再生和渐进性肝细胞坏死,而炎症刺激纤维结缔组织增生,导致肝小叶结构变化,肝脏变硬,肝功能损伤。在肝硬化早期,肝功能代偿能力较强,临床症状隐匿,而在肝硬化后期则会出现肝功能受损和门静脉高压,累及全身系统,出现腹水、感染或癌变等表现[2]。自发性细菌性腹膜炎(SBP)为失代偿期肝硬化严重的并发症之一,主要是由致病菌经淋巴系统、肠道、血液进入引起的腹腔感染。SBP与肝病患者终末期高病死率相关[3]。当前,致病菌对抗菌药物的耐药性增加,给临床治疗带来了严峻的挑战。因此,了解失代偿期肝硬化患者病原菌分布及其耐药特点,探寻引起感染的危险因素,是临床防治研究的重点。应用抗生素治疗可控制或治愈感染,但仍需研究感染的发生机制,以便做好预防[4,5]。炎症为机体对外界刺激产生的自身防御反应,一般分为非感染性炎症和感染性炎症。在感染发生时,往往会激起机体自身免疫反应功能,并调节体液分子和免疫细胞抵御病原菌的侵袭。从机体炎症反应着手,有望成为临床抗感染治疗的新方向[6-8]。分化抗原36(cluster of differentiation 36,CD36)/哺乳动物雷帕霉素靶蛋白1(mammalian target of rapamycin 1,mTORC1)通路是机体调节炎症反应的重要通路,其中CD36为B型清道夫受体,可在跨膜结构的细胞质外环状部分介导下结合特异性受体,诱发炎症反应;mTORC1为细胞活动中心协调器,可感知激素、氨基酸、生长因子、营养等变化,对细胞存活、分化、生长和增殖进行调节,其表达水平异常与炎性疾病的发生相关[9-11]。本研究检测了失代偿期肝硬化并发SBP患者CD36/mTORC1信号通路表达,并探讨了它们的临床意义,现报道如下。
1 资料与方法
1.1 一般资料 2020年7月~2023年12月我院诊治的失代偿期肝硬化患者82例,男55例,女27例;年龄为39~76岁,平均年龄为(54.2±6.3)岁。符合失代偿期肝硬化的诊断标准[12]和SBP的诊断标准[11],后者即腹水白细胞计数在250×106/L以上,发热、腹部压痛、反跳痛、对利尿剂治疗应答差,腹水细菌培养阳性。其中乙型肝炎肝硬化49例,丙型肝炎肝硬化5例,酒精性肝硬化20例,原发性胆汁性肝硬化8例。排除标准:(1)癌性、结核性腹水;(2)近期有腹部手术史或继发性感染;(3)合并全身性感染。
1.2 病原菌检测 在无菌条件下,抽取腹水10 ml,进行厌氧和需氧菌培养,并采用美国临床实验室提供的MicroSean Auto-4全自动细菌鉴定仪进行细菌鉴定。
1.3 临床资料收集 收集患者性别、年龄、并发症、饮酒史、既往SBP发生史、实验室指标[总胆红素(TBIL)、白蛋白(albumin,ALB)、谷草转氨酶(aspartate、aminotransferase,AST)、谷丙转氨酶((alanine aminotransferase,ALT)、国际标准化比值(international normalized ratio,INR)],计算终末期肝病模型(model of end-stage liver disease,MELD)评分。
1.4 外周血单个核细胞(peripheral blood mononuclear cells,PBMC)CD36/mTORC1信号通路水平检测 采用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,PCR)法检测PBMC CD36/mTORC1信号通路水平。清晨采集空腹肘静脉血4 mL,加入EDTA抗凝管。采用淋巴细胞分离液分离PBMCs,采用Trizol法提取PBMCs总RNA,使用反转录试剂盒(赛默飞世尔科技有限公司)将总RNA反转录为cDNA,于-20℃保存备用;采用荧光定量PCR试剂盒(北京华夏远洋科技有限公司)和瑞士罗氏公司生产的Light Cycler 480实时荧光定量PCR仪检测CD36 mRNA和mTORC1 mRNA水平,引物序列均由上海生工生物工程有限公司合成,PCR反应体系为20 μL,包括cDNA 1 μL,上下游引物各0.4 μL,2×KAPA SYBR FAST qPCR Master Mix 10 μL,加ddH2O补齐。反应条件为:95℃预变性3 min,95℃变性10 s,60℃退火20 s,72℃延伸30 s(40 cycles),72℃延伸10 min。扩增产物经凝胶电泳,采用2-△△Ct计算结果,每个样本检测3次,取平均值。

2 结果
2.1 病原菌分离情况 本组发生SBP者43例(52.4%),分离出病原菌8株(9.8%),其中科氏葡萄球菌和溶血葡萄球菌各1株,大肠埃希菌2株,肺炎克雷伯菌2株和阴沟杆菌2株。
2.2 失代偿期肝硬化并发SBP的单因素分析 SBP组与肝硬化组在既往SBP发生史、血清总胆红素、ALB、INR、MELD评分、PBMCs CD36和mTORC1水平方面比较,差异有统计学意义(P<0.05,表1)。
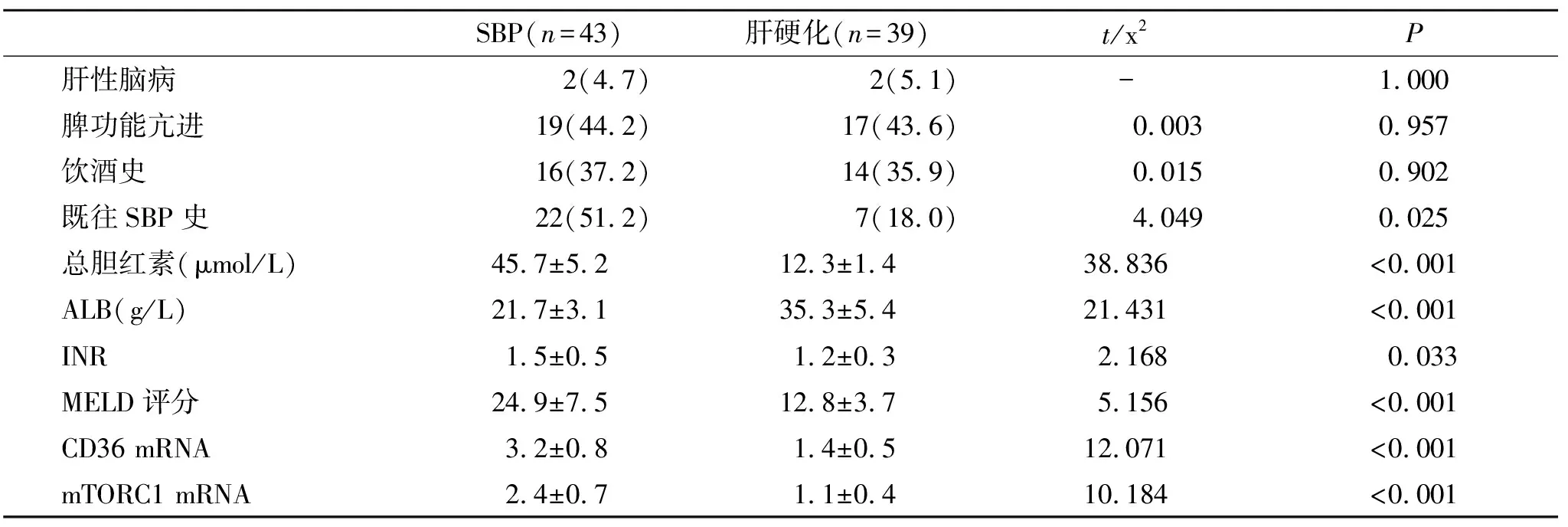
表1 失代偿期肝硬化并发SBP的单因素分析
2.3 多因素分析 将上述单因素分析具有统计学意义的指标赋值(未列出),并代入Logistic回归方程,进行多因素Logistic回归分析,结果显示,SBP发生史、血清总胆红素、ALB、MELD评分及PBMC CD36和mTORC1水平为影响失代偿期肝硬化并发SBP的独立危险因素(P<0.05,表2)。
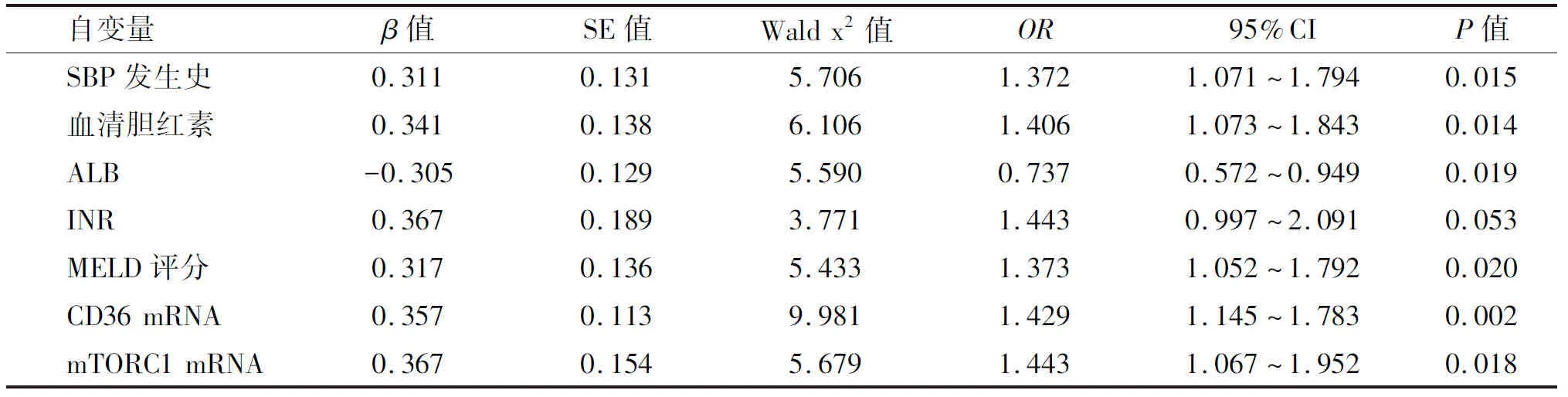
表2 影响失代偿期肝硬化并发SBP的多因素分析
3 讨论
SBP为失代偿期肝硬化最严重的并发症之一,且发病机制复杂。当前,研究多认为与患者吞噬细胞功能降低、肝内单核-巨噬细胞系统受损和白细胞黏附趋化作用降低有关[13]。随着医疗技术的发展,SBP治疗得到一定的改善,但仍具有一定的复发率,且治疗难度较大,治愈率较低,严重者还可能并发感染性休克,威胁患者生命健康。SBP起病隐匿,极易诱导其他器官功能衰竭[14,15]。如何降低失代偿期肝硬化并发SBP的发生风险,已成为临床亟待解决的问题之一。
SBP相关的感染病原菌特征发生了明显的变化。针对失代偿期肝硬化并发SBP患者病原学特点进行有效监控是保证临床合理应用抗菌药物的重要手段。本研究在43例患者分离出8株感染病原菌,提示失代偿期肝硬化并发SBP患者以革兰氏阴性菌感染为主[16]。抗菌药物的广泛使用不仅会增加细菌的耐药性,还会在一定程度上改变感染的病原菌谱,需要认真监测。
本研究经Logistic回归分析发现,过去感染SBP、血清总胆红素、ALB和MELD评分为影响失代偿期肝硬化并发SBP的独立危险因素。高胆红素血症是肝功能损伤的最直接的指标,后者功能降低会改变肝脏血管通透性,增加SBP发生。SBP的发生也可在一定程度上损伤肝细胞,导致胆红素居高不下,发展为恶性循环[17]。因此,在临床治疗方面可针对性降低胆红素水平,阻止病情恶化。ALB和MELD评分为反映肝功能的有效指标。MELD评分越高,肝脏储备功能越差,造成消化道淤血和门体分流,更易出现腹腔感染,增加SBP发生的机会[18]。临床医生应重点监护MELD评分差的患者,早期给予针对性的治疗,以减少SBP的发生。
炎症反应的本质为机体在出现组织损伤及病原微生物入侵后作出的应答反应,其中细胞因子可通过多种信号转导途径调节机体炎症反应。常见的病理过程是在机体感染病毒或细菌后会出现炎症反应,而控制机体炎症反应具有一定的积极作用[19]。本研究发现SBP组CD36 mRNA和mTORC1 mRNA水平显著高于肝硬化组,提示失代偿期肝硬化患者在感染SBP后,机体CD36/TORC1通路蛋白表达上调。CD36为B型清道夫受体,可识别在跨膜结构胞质外环状结构并结合特异性配体,诱导机体炎症反应,抑制机体感染,故在机体感染后其水平显著升高。mTORC1为细胞活动中心协调器,可感知氨基酸、生长因子、激素和营养的变化,调节细胞存活、分化、增殖和生长。mTORC1功能异常多与炎性疾病的发生发展相关[20]。CD36/mTORC1参与炎症反应的调控,而炎症多发生在感染之后,因此推测CD36/mTORC1参与机体感染发生和发展。此外,CD36/mTORC1信号通路与机体肝功能水平密切相关,而肝功能异常者出现SBP风险更高。我们推测CD36/mTORC1信号通路可能参与了失代偿期肝硬化并发SBP的发生和发展,但仍需进行研究验证。
综上所述,血清总胆红素、ALB、MELD评分、PBMC CD36 mRNA和mTORC1 mRNA水平是失代偿期肝硬化患者发生SBP的独立危险因素,PBMC CD36/mTORC1信号通路水平上调,其意义需要进一步研究。
