Notch抑制剂DAPT体外改善L02细胞脂肪变研究*
2024-01-07吴伟杰丁雯瑾杨蕊旭范建高
吴伟杰,丁雯瑾,杨蕊旭,范建高
Notch信号通路是高度保守的单次跨膜信号受体蛋白家族,包括四个受体(Notch1/2/3/4)和五个配体(Jagged1、Jagged2、DLL1、DLL3和DLL4)及靶基因编码转录因子(Hes1和Hey1),涉及多种组织和器官早期发育所必需的细胞间调节,在细胞增殖、分化、凋亡等方面具有重要作用[1、2]。近几年,有研究报道Notch 信号的活化参与肝脏再生与修复、炎症和纤维化过程[3]。此外,Notch 基因异常表达会导致胰岛素抵抗(insulin resistance,IR)、脂质异常和肥胖等多种代谢性疾病,它也能诱发非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)的发生[4,5]。我们之前的研究证实,无论是在蛋氨酸胆碱缺乏(methionine-choline deficient,MCD)小鼠模型还是棕榈酸(palmitic acid,PA)诱导体内肝细胞脂肪变模型,均存在Notch基因家族的异常表达,并随代谢障碍相关脂肪性肝病(metabolic dysfunction-associated fatty liver disease,MAFLD)不同发展阶段而改变[6]。随后,我们应用Notch信号通路抑制剂(DAPT)体外处理脂肪变肝细胞,发现DAPT能抑制Notch下游 Hes-1和 Hey-1基因水平,同时能有效降低甘油三酯(triglyceride,TG)和转氨酶水平[7]。本研究在体外应用DAPT处理脂肪变的L02细胞,观察了抑制Notch家族后细胞炎症因子和脂质代谢相关基因水平变化。
1 材料与方法
1.1 细胞、试剂与仪器 人正常肝细胞L02由中国科学院上海细胞库提供;RPMI-1640 培养基和杜氏磷酸盐缓冲液(Dulbecco's phosphate buffered saline,DPBS)均购于美国Hyclone 公司;胎牛血清(fatal bovine serum,FBS)购于以色列Biological Industries 公司;γ分泌酶抑制剂N-[N-( 3,5-difluorophenacetyl) - L - alnyl]-S-phenylycine t- butyl ester(DAPT)和PA均购于美国默克公司;RPS-18内参引物购于中国上海生物工程公司;Trizol 试剂和预混型定量用逆转录试剂盒均购于日本宝日医公司;qPCR SYBR Green Master Mix 购于中国上海翊圣生物科技有限公司;CCK-8试剂盒、BCA蛋白浓度测定试剂盒、RIPA裂解液(强)和含DAPI的抗荧光淬灭封片剂均购于上海碧云天生物技术有限公司;尼罗红染料购于上海晶纯生化科技股份有限公司;抗GAPDH小鼠单克隆抗体购于美国Proteintech Group 公司;抗固醇调节元件结合蛋白1c(sterol regulatory element-binding protein 1c,SREBP1c)小鼠单克隆抗体购于美国NOVUS 公司;抗p65(NF-kappaB,NF-κB)兔单克隆抗体购于美国Abcam公司;ECL发光液购于美国Millipore 公司;凝胶成像仪(美国Bio-Rad 公司);Q3 PCR 扩增仪和Nano Drop 2000 超微量分光光度仪(美国赛默飞公司);PCR 逆转录仪(德国艾本德公司);Bio Tek Epoch 全波长酶标仪(美国博腾仪器有限公司)。
1.2 体外细胞脂肪变模型的建立与DAPT干预 将5 mM PA原液用RPMI-1640完全培养基(含10% FBS)稀释成含0.1 mM、0.25 mM和0.5 mM PA的高脂培养基工作液、备用。取L02细胞,分为对照组(Con)、0.1 mM PA组、0.25 mM PA组和0.5 mM PA组。待L02细胞融合度达到60%~70%时,弃培养基,用DPBS洗1遍,加入培养基或相应浓度的高脂培养基工作液处理L02细胞24 h,收集细胞。根据前期实验结果确定0.25 mM PA浓度作为体外细胞脂肪变的造模条件,分含或不含0.25 mM PA处理细胞。采用0μM、1μM、2μM、5μM和10 μM DAPT处理细胞,其中0.25 mM PA处理细胞在不加DAPT处理组为模型组,处理L02细胞24 h,收集细胞。
1.3 细胞存活率试验 使用CCK-8试剂盒进行细胞存活率测定。
1.4 细胞mRNA提取及水平检测 采用Trizol法提取细胞总RNA,逆转录后行实时荧光聚合酶链式反应(RT-qPCR),基因特异性引物序列为:SREBP1c-F: 5’-CGGAACCATCTTGGCAACAGT-3’; SREBP1c-R: 5’-CGCTTCTCAATGGCGTTGT-3’; FASN-F: 5’-CCGAGACACTCGTGGGCTA-3’; FASN-R: 5’-CTTCAGCAGGACATTGATGCC-3’; ACACA-F: 5’-ATGTCTGGCTTGCACCTAGTA-3’; ACACA-R: 5’-CCCCAAAGCGAGTAACAAATTCT-3’; TNF-α-F: 5’-CCTCTCTCTAATCAGCCCTCTG-3’; TNF-α-R: 5’-GAGGACCTGGGAGTAGATGAG-3’; IL-1β-F: 5’-AGCTACGAATCTCCGACCAC-3’; IL-1β-R: 5’-CGTTATCCCATGTGTCGAAGAA-3’; IL-6-F: 5’-ACTCACCTCTTCAGAACGAATTG-3’; IL-6-R: 5’-CCATCTTTGGAAGGTTCAGGTTG-3’。
1.5 细胞p65及SREBP1蛋白检测 采用Western blot法,用RIPA裂解法提取细胞总蛋白,经BCA试剂盒测定蛋白浓度,调节上样蛋白总量至相同。根据目的蛋白分子大小配制合适的SDS PAGE凝胶后开始上样、电泳、转膜,用5%脱脂牛奶封闭,按照抗体说明书相继加入一抗和二抗孵育后,经凝胶成像仪曝光成像,应用Image J软件对条带的灰度值进行定量分析。
1.6 细胞脂滴观察 在12孔细胞培养板,加入不同浓度的DAPT干预PA处理的L02细胞24 h,弃培养基,用DPBS洗2遍,加入4%多聚甲醛固定15~30 min,用DPBS洗2遍。按照尼罗红原液:DPBS=1:500的比例配制工作液,避光染色15 min,弃去尼罗红染色工作液,用DPBS洗2遍。在每孔中加入含DAPI的抗荧光淬灭封片液100 μL,置于荧光显微镜下观察。

2 结果
2.1 各组L02细胞存活率比较 在PA干预L02细胞8 h、16 h和24 h,经CCK-8测定显示, L02细胞存活率随干预时间呈剂量依赖性下降趋势;与对照组细胞存活率为100%比,在干预8 h、16 h和24 h时,0.1 mM、0.25 mM和0.5 mM PA干预L02细胞存活率均显著下降(P均<0.05,图1A);在无PA干预的L02细胞,经1μM、2μM、5μM和10 μM DAPT处理细胞24 h,细胞存活率均较对照组显著下降(分别为85.2±5.3%、84.6±2.9%、84.4±6.0%和84.5±3.2%对100.0%,P均<0.05,图1B)。
2.2 不同浓度DAPT干预PA处理细胞相关细胞因子mRNA水平和p65蛋白表达变化 与模型(0 μM DAPT处理)组比,各DAPT处理组TNF-α、IL-1β和IL-6 mRNA水平均显著下调(P均<0.05,表1);与0 μM DAPT处理组比,各DAPT处理组细胞p65蛋白均显著下调(P均<0.05,图2A、2B)。

表1 不同浓度DAPT干预PA处理细胞相关细胞因子mRNA水平比较
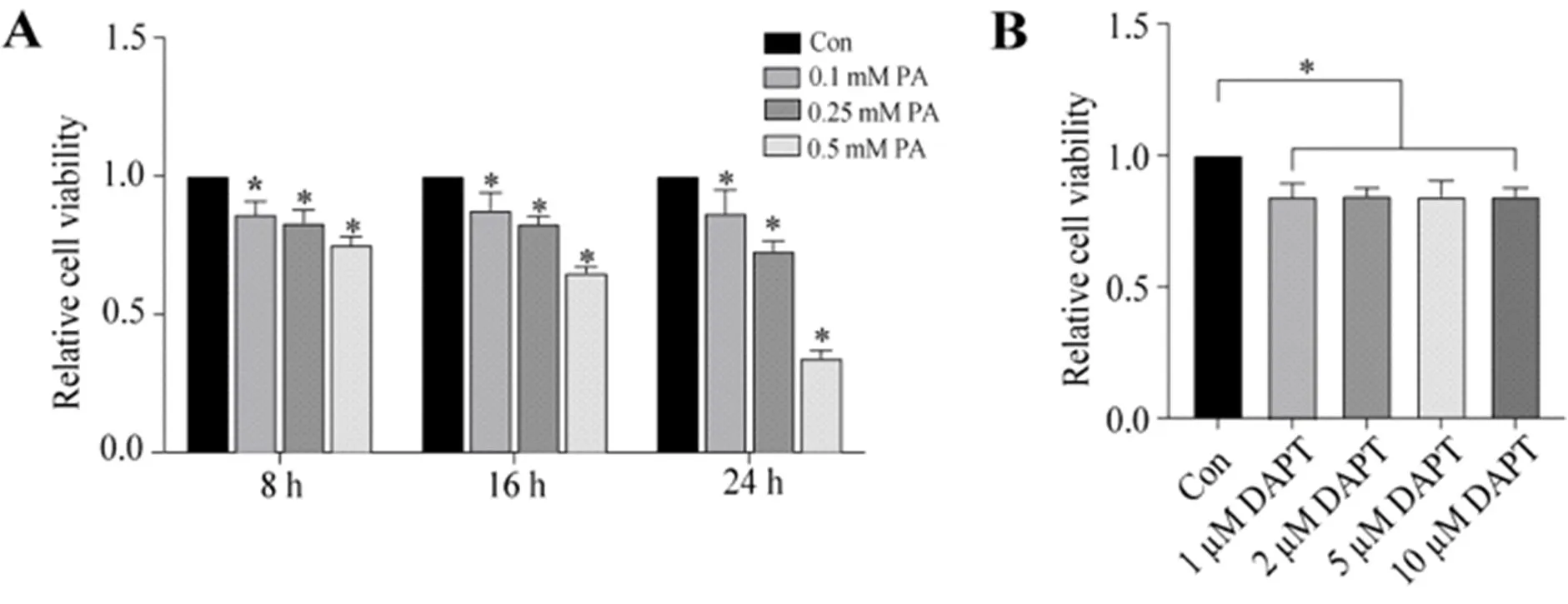
图1 不同浓度PA和DAPT干预L02细胞存活率比较A:不同浓度的PA处理L02细胞;B:不同浓度的DAPT处理L02细胞24 h; *P<0.05
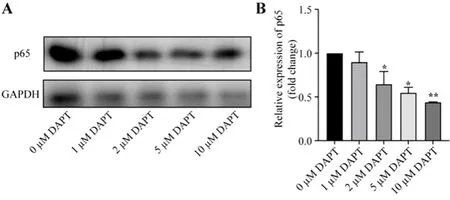
图2 不同浓度DAPT干预PA处理细胞p65蛋白表达变化A:细胞p65蛋白表达(Western blot法);B:p65蛋白表达相对水平;*P<0.05;**P<0.01
2.3 不同浓度DAPT干预PA处理细胞脂质代谢水平变化 与0 μM DAPT组相比,各DAPT处理组细胞SREBP1c mRNA水平均无显著变化,在2μM、5μM和10 μM DAPT处理组细胞FASN和ACACAmRNA水平均显著下降(P均<0.001,表2);在2μM、5μM和10 μM DAPT处理组,细胞脂滴红色荧光强度较0 μM DAPT组显著减弱[分别为(0.2±0.1)、(0.3±0.0)和(0.1±0.0)对(0.7±0.0),P均<0.001,图3A);与0 μM DAPT组相比,5 10 μM和10 μM DAPT处理组细胞SREBP1c蛋白水平均显著下调(P均<0.05, 图3B和3C)。

图3 不同浓度DAPT干预PA处理细胞脂质代谢变化A:细胞脂滴形成情况(尼罗红染色, 400×);B:细胞SREBP1c蛋白表达(Western blot法);C:细胞SREBP1c蛋白表达相对水平;*P<0.05;**P<0.01

表2 不同浓度DAPT干预PA处理细胞脂质代谢相关基因mRNA水平比较
3 讨论
Notch 基因的激活不仅与异常增殖、癌症疾病发生密切相关,也在细胞代谢过程中起着重要作用,其表达紊乱会导致多种代谢相关性疾病[8,9]。通常,MAFLD伴随代谢综合征的出现,目前普遍被认可的是“多次打击”学说,胰岛素抵抗、脂质过氧化、氧化应激等均参与其发病。在小鼠肝脏病理学研究发现,肝细胞特异性Notch功能丧失可缓解脂肪性肝炎相关肝纤维化,而增强Notch在肝细胞中的表达会通过上调Sox9依赖性骨桥蛋白,激活肝星状细胞并诱导肝脏纤维化[10]。也有研究使用Notch抑制剂可改善动物因高脂高糖饮食而导致的肝纤维化[11]。结合文献报道及我们团队先前的研究结果,有足够的证据表明Notch家族参与了MAFLD的发生和进展[6]。
长期高脂饮食可以导致高脂血症、异位脂质沉积,过量的脂质沉积在肝细胞内而引起肝脏损伤,最后形成MAFLD[12]。有研究发现Notch在肝脏脂代谢过程中扮演重要角色。Notch1信号活化可以导致胰岛素抵抗加重,并与FOXO1协同增强葡萄糖-6-磷酸酶表达[13,14]。Notch信号可以激活mTOR信号通路,促使其下游SREBP1c表达,促进肝细胞脂肪生成。抑制Notch基因能通过降低mTOR的稳定性,弱化下游激酶核糖体蛋白S6激酶1活化,减缓SREBP1c依赖的脂肪从头合成,达到改善肝脂肪沉积的目的[15,16]。我们采用0.25 mM PA浓度干预L02细胞24 h成功构建体外细胞脂肪变模型,并可显著引起细胞内的脂质沉积和稳定激活Notch信号通路[7]。在体外肝细胞脂肪变细胞,以“不影响细胞活性”为基础,发现DAPT能缓解细胞炎症因子(TNF-α、IL-1β和IL-6)水平上升并下调p65蛋白表达,改善程度与DAPT浓度有一定的剂量依赖性。尼罗红染色可观察到细胞脂滴数量明显减少。TNF-α、IL-1β和IL-6与NF-κB 核内易位活化密切相关。NF-κB信号通路激活可能是引起细胞内炎症反应的主要原因[17]。NF-κB的IKKα启动子序列与Notch信号下游转录因子Hes1存在部分重合,表明Notch信号可能从基因转录层面对炎症信号通路产生影响。因此,使用DAPT等Notch抑制剂或可抑制肝细胞内炎症反应和脂质沉积,具有防治MAFLD进展的潜力。
作为γ-分泌酶底物的DAPT可以竞争性与γ分泌酶结合,从而实现间接抑制Notch信号转导[18]。在非酒精性脂肪性肝炎患者肝组织往往存在Notch基因异常激活[19]。抑制Notch信号可改善糖尿病模型小鼠肝脏脂滴数量、降低血清肝酶水平并提高胰岛素敏感性,抑制Notch基因后可诱导AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)和ACACA磷酸化,从而激活AMPK信号通路,促进脂肪酸氧化并抑制脂肪合成[20]。本研究我们进一步检测脂质代谢相关性基因 SREBP1、FASN和ACACA表达情况,经WB检测结果显示SREBP1c蛋白表达水平经过DAPT处理后明显下调,下游的FASN和ACACA脂肪合成相关基因mRNA水平也相应出现了下降。故DAPT可能通过降低SREBP1c蛋白的表达而抑制脂肪合成,从而具有调控脂质紊乱的作用。
综上所述,应用DAPT抑制Notch基因家族可改善MALFD的炎症反应和脂质代谢异常。
