总余氯标准物质研制
2024-01-06姚旭霞
龚 维, 姚旭霞, 田 平, 吕 辉, 刘 新
(山东非金属材料研究所,山东 济南 250031)
1 引 言
余氯是指消毒剂作用一定时间后,水中剩余的总氯含量[1]。余氯分为游离余氯和结合性余氯,两者之和为总余氯[2]。游离余氯主要是指次氯酸或次氯酸根,结合性余氯主要是指一氯胺、二氯胺及其它有机氯胺。
我国2001年颁布的《生活饮用水水质卫生规范》中采用游离性余氯含量作为衡量消毒效果的指标[3]。在给排水工业和水质监测中,余氯也是评价水质的主要参数。各类电厂的冷凝装置系统需要大量的水用以冷却,为了防止电厂的冷凝器被附着生物堵塞,需要对冷却水进行氯化处理[4]。经过氯化处理后,会对水环境造成影响,排放前需要进行余氯的测量。
为了满足余氯检测的需求,更好地控制水质,实现余氯、总余氯的快速测量,余氯测定仪和手持式余氯测定仪不断地推入市场[5]。目前市售的余氯测定仪主要依据水中余氯与显色剂反应后生成的有色物质在特定波长处的吸收程度进行定量分析。根据JJF 1609—2017《余氯测定仪校准规范》的要求[6],在进行仪器校准的时候,需要使用总余氯标准物质对仪器的示值误差及重复性进行校准。因此,研制相应的标准物质以满足检测及仪器校准的需求意义较大。
2 标准物质制备与分装
2.1 制备方案
总余氯包括游离余氯和结合余氯。其中游离余氯包含单质氯、次氯酸及次氯酸盐,结合余氯包含一氯胺、二氯胺及其他氯胺类化合物。当游离余氯不存在时,总余氯即为结合性余氯。
由于游离余氯在水溶液中不能稳定存在,总余氯制备时将不引入游离余氯。在结合性余氯中:一氯胺在中性水溶液中易发生水解,性质不稳定;二氯胺为油状液体,在水溶液中不易分散均匀。因此需要选择性质稳定,在水溶液中溶解性好的氯胺。
余氯测定时,显色剂有多种,包括N,N-二乙基对苯二胺[7~14]、邻联甲苯胺[15,16]、四甲基联苯胺[17~22]、丁香醛连氮[23]等。不同余氯测定仪又具有不同的波长检测系统包括248 nm,420~440 nm、510~530 nm等。因此,要求所制备的标准物质可与不同显色剂发生反应并能在不同波长下进行测量。
由于氯胺T符合以上要求,所以选择该原料溶于水中以制备总余氯标准物质。
2.2 标准物质制备用设备和试剂
电子天平:220 g/0.1 mg,梅特勒公司,经检定合格后使用;容量瓶:2 000 mL,天玻,A级检定合格;透明玻璃安瓿瓶:20 mL,山东力诺特种玻璃股份有限公司;氯胺T:AR,麦克林;超纯水:Milli-Q型(美国Millipore公司)超纯水仪制备一级分析实验室用水。
2.3 总余氯标准物质制备过程
制备的总余氯标准物质量值分别为50 mg/L和500 mg/L。原材料中纯水及氯胺T中有效氯含量直接影响标准物质制备,因此需要对其进行检测。
2.3.1 氯胺T有效氯含量测量
氯胺T有效氯含量是根据氯胺T在酸性环境中氧化碘化钾,生成碘单质,生成的碘单质与硫代硫酸钠再发生氧化还原反应[24],进行测量的,反应方程式如下:



(1)
采用上述方法测量氯胺T有效氯含量为25.05%。
2.3.2 总余氯标准物质溶液配制
制备溶液称取氯胺T的质量与氯胺T中有效氯含量有关,根据式(2)进行计算:
(2)
式中:m为氯胺T取样质量,g;ρ为待配制总余氯溶液含量,mg/L;ρCl2为氯胺T中有效氯含量,%;V为待配制总余氯溶液的体积,L。
按照式(2)及测量的有效氯含量,计算不同浓度的溶液所需氯胺T的质量。分别称取相应质量的氯胺T置于2 000 mL容量瓶中,用检测过的超纯水溶解后,恒温至(20±1)℃,定容至刻线,充分摇匀。2种浓度总余氯标准物质需各配制2 000 mL。
2.4 总余氯标准物质分装
总余氯标准物质以氯胺T为原料制备,氯胺T暴露在空气中会缓慢分解,渐渐失去氯,因此需采用安瓿瓶封装。
混合均匀的溶液分装至20 mL透明安瓿瓶中,2种浓度总余氯标准物质各封装100瓶。熔封后在阴凉干燥处存放。
3 标准物质浓度测量方法
在ISO7393.3-1990及我国的水质检测标准GB/T 5750.11—2006中使用碘量法用于测定高浓度余氯[25,26]。
3.1 定值方法研究
3.1.1 10%碘化钾溶液用量研究
以500 mg/L总余氯溶液进行10%碘化钾溶液用量研究。在4个250 mL碘量瓶中依次加入10.00 mL总余氯溶液、10%碘化钾溶液、1 mol/L硫酸溶液,暗处放置10 min,以0.01 mol/L硫代硫酸钠滴定溶液进行测量。4个碘量瓶中10%碘化钾溶液用量分别为1、3、5、10 mL。经过测量表明,随着10%碘化钾溶液用量增加,测量结果逐渐增大,在加入量5 mL后测量结果保持不变(见表1)。因此,10%碘化钾溶液用量为5 mL。

表1 10%碘化钾溶液用量及测量结果
3.1.2 1 mol/L硫酸溶液用量研究
以500 mg/L总余氯溶液进行1 mol/L硫酸溶液用量研究。在4个250 mL碘量瓶中依次加入 10.00 mL 总余氯溶液、10%碘化钾溶液、1 mol/L硫酸溶液,暗处放置10 min,以0.01 mol/L硫代硫酸钠滴定溶液进行测量。4个碘量瓶中1 mol/L硫酸溶液用量分别为1、3、5、7mL。经过测量表明,随着 1 mol/L 硫酸溶液用量增加,测量结果逐渐增大,在加入量5 mL后测量结果保持不变(见表2)。因此,1 mol/L硫酸溶液用量研究为5 mL。

表2 1 mol/L硫酸溶液用量及测量结果
3.1.3 0.5%淀粉溶液用量研究
以500 mg/L总余氯溶液进行0.5%淀粉溶液用量研究。在4个250 mL碘量瓶中依次加入10.00 mL总余氯溶液、10%碘化钾溶液、1 mol/L硫酸溶液,暗处放置10 min,以0.01 mol/L硫代硫酸钠滴定溶液进行测量。4个碘量瓶中0.5%淀粉溶液用量分别为1、3、5、7 mL。经过测量表明,随着0.5%淀粉溶液用量增加,测量结果逐渐增大,在加入量5 mL后测量结果保持不变(见表3)。因此,0.5%淀粉溶液用量研究为5 mL。

表3 0.5%淀粉溶液用量及测量结果
3.1.4 放置时间研究
以500 mg/L总余氯溶液进行放置时间研究。在4个250 mL碘量瓶中依次加入10.00 mL总余氯溶液、10%碘化钾溶液、1 mol/L硫酸溶液,暗处放置,以0.01 mol/L硫代硫酸钠滴定溶液进行测量。4个碘量瓶放置时间分别为0、5、10、15 min。经过测量表明,随着放置时间增加,测量结果逐渐增大,在放置时间为10 min后,测量结果保持不变(见表4)。因此,反应放置时间为10 min。

表4 放置时间及测量结果
3.1.5 空白试验研究
为研究加入的10%碘化钾溶液、1 mol/L硫酸溶液及0.5%淀粉指示剂是否会对测试产生影响,进行了用以判断是否扣除溶剂空白的试验。
将国家二级碘标准滴定溶液GBW(E)082816移取1 mL,至100 mL容量瓶中,纯水定容至刻度。混合均匀后移取2~250mL碘量瓶中,依次加入 5 mL的10%碘化钾溶液,5 mL的1 mol/L硫酸溶液,水封后在暗处放置10 min,加入淀粉指示剂显色。采用0.001 mol/L硫代硫酸钠滴定溶液进行滴定测量,根据式(3)计算碘滴定溶液浓度。滴定后计算碘滴定溶液浓度结果见表5,与标准值进行比较后,发现试验测量值与标准值一致,故该方法无需扣除空白。
(3)

表5 空白中加入碘滴定溶液测量结果

3.2 定值过程
3.2.1 500 mg/L总余氯标准物质浓度测量
准确移取500 mg/L总余氯标准物质样品 10.00 mL置于250 mL碘量瓶中,加入5 mL的10%碘化钾溶液,5 mL的1 mol/L硫酸溶液,水封后在暗处放置10 min,以0.01 mol/L硫代硫酸钠溶液滴定至淀粉指示剂无色。
3.2.2 50 mg/L总余氯标准物质浓度测量
准确移取50 mg/L总余氯标准物质样品 10.00 mL,置于250 mL碘量瓶中,加入5 mL的10%碘化钾溶液,5 mL的1 mol/L硫酸溶液,水封后在暗处放置10 min,以0.001 mol/L硫代硫酸钠溶液滴定至淀粉指示剂无色。
3.3 结果计算
(4)
式中:CCl2为溶液中氯含量,mg/L;c为硫代硫酸钠溶液浓度,mol/L;V1为硫代硫酸钠溶液体积,mL;V0为移取余氯标准物质溶液体积,mL。
4 标准物质均匀性检验
4.1 均匀性检验方法及判据
样品均匀性是指物质的组分或状态相同的状态[27,28]。均匀性实验采用F法检验,依据《JJF 1006—1994一级标准物质技术规范》的规定进行抽样并确定抽取的样品数量[29]。由于最小单元数小于500瓶,因此对标准物质随机抽取个数为16,用定值氧化还原滴定法对所抽取的各个样品进行测定,每次取样10.00 mL,每瓶重复测定2次。分析数据通过组间方差和组内方差的比较来判断各组测量结果之间有无系统误差。
4.2 均匀性检验结果
使用标定好的硫代硫酸钠溶液对总余氯标准物质进行均匀性检验,检测数据见表6。
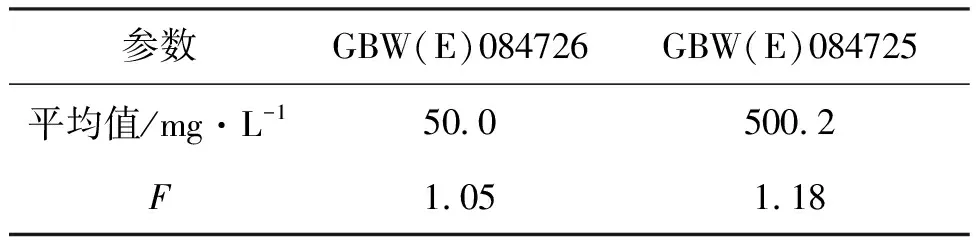
表6 标准物质均匀性检验结果
5 标准物质稳定性检验
5.1 稳定性检验方案
标准物质在储存期间量值需要稳定,因此需对样品稳定性进行监测。为了表现出样品稳定性是否发生变化,在多次测量过程中,尽量控制各种条件一致,并采用高精密度的准确可靠的方法[29]。根据《一级标准物质技术规范》的要求,对均匀性检验合格的总余氯标准物质,从2020年4月~2020年10月,共进行了6个月的稳定性检验。检验方法是采用先密后疏的原则,每次测量6个单元,每个单元重复测量2次,取2次重复测量的平均值作为一次测量结果。
短期稳定性检验,分别将样品放置在50 ℃和-20 ℃ 条件下,采用先密后疏的原则连续监测10天,每次每个温度随机取样3支,每瓶重复测量2次,取2次重复测量的平均值作为一次测定结果。
5.2 稳定性评价依据
依据JJF 1343—2012《标准物质定值的通用原则及统计学原理》的规定,对所测数据采用直线拟合法进行稳定性检验,当直线斜率和零没有显著性差异时,标准溶液候选物在考察时间内是稳定的。
5.3 稳定性检验结果
稳定性检验结果见表7、表8。

表7 标准物质稳定性检验结果

表8 标准物质短期稳定性检验结果
6 标准物质定值
6.1 数据处理方法[30]
进行可疑值检测,根据每个操作者测得的原始数据,使用狄克逊法或格拉布斯法分别进行统计处理,检查是否存在可疑值。
每个操作者分别计算平均值及标准偏差。针对每个操作者的结果,通过t检验方法进行显著性差异评价。检验方法按式(6)计算:
(6)
如果|t|
最后计算出有效数据总的算术平均值,即作为标准物质的标准值。
6.2 定值数据
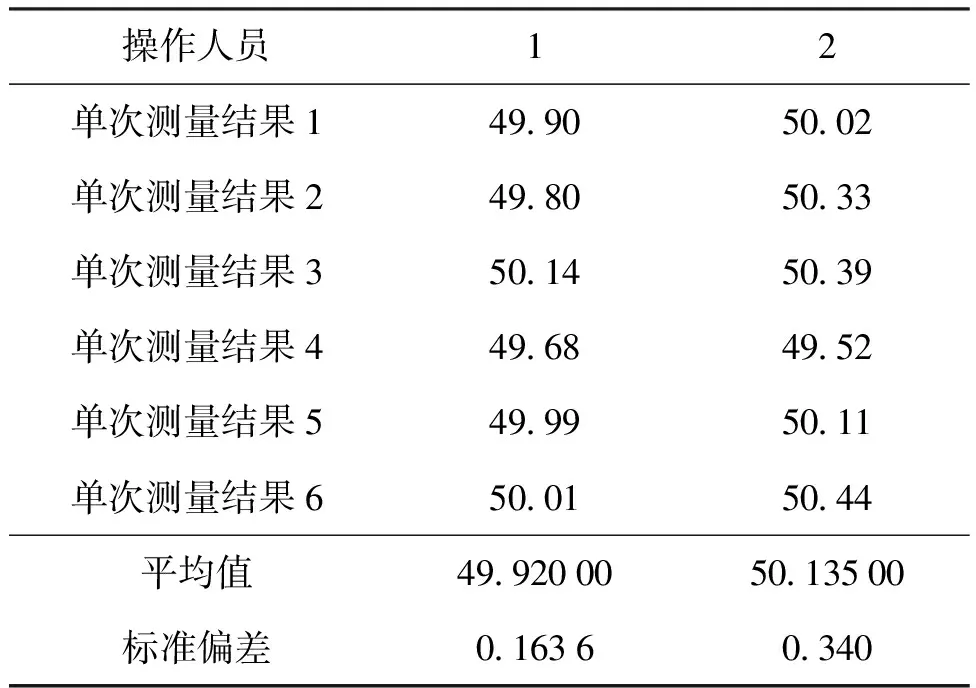
500 mg/L总余氯标准物质定值结果见表9,根据上述统计方法,进行狄克逊检验,组内r1,r6 表9 500 mg/L总余氯标准物质定值统计处理结果 表10 50 mg/L总余氯标准物质定值统计处理结果 根据HJ 586—2010《水质 游离氯和总氯的测定 N,N-二乙基-1,4-苯二胺分光光度法》[31],将所有样品根据已知浓度稀释至1.5 mg/L,测量吸光度。 将所有待测溶液根据浓度稀释至10 mg/L,在100 mL容量瓶中加入样品15 mL,加入1.0 mL硫酸溶液(第2.1.2节),1 min后加入1 mL氢氧化钠溶液(第2.1.3节),纯水稀释至刻度。在250 mL锥形瓶中加入15.0 mL缓冲溶液(第2.1.4节),5.0 mL DPD溶液(第2.1.5节),在1min内将容量瓶中的溶液倒入锥形瓶中,混合均匀后在515 nm处,以10 mm比色皿测量吸光度。 根据分光光度测量方法,测量不同溶液的吸光度,可以看出它们的吸光度基本一致,定值结果准确可靠。测量结果见表11。 表11 分光光度法量值核对 溶液标准物质的不确定度主要来源有3部分[32,33]:标准物质的均匀性引入的不确定度分量,标准物质的稳定性引入的不确定度分量以及标准物质定值过程引入的不确定度分量。 根据不确定度来源,将均匀性、稳定性和定值过程引入的相对标准不确定度汇总至表12。 表12 总余氯标准物质相对标准不确定度汇总表 可知,500 mg/L总余氯标准物质相对扩展不确定度为0.5%(k=2);50 mg/L总余氯标准物质相对扩展不确定度为0.9%(k=2)。 所研制的余氯标准物质经过均匀性检验和稳定性考察后,证明经过玻璃安瓿瓶封装制备的余氯标准物质是均匀的,量值是准确可靠的,其稳定性良好,符合国家二级标准物质的要求。经用户使用证明能够实现余氯测定仪校准等工作的要求。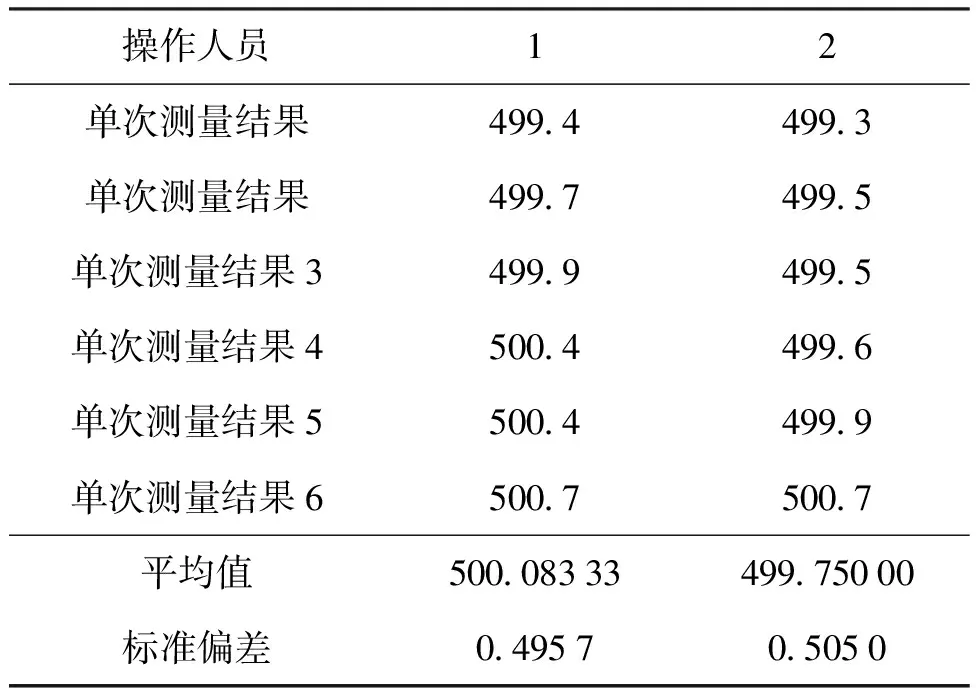
7 标准物质量值核对

8 不确定度评定

9 结 论
