钙通路基因预测结肠癌患者预后及其免疫状态
2024-01-06曾盛陈华杨颀
曾 盛 陈 华 杨 颀
1 徐闻县人民医院 广东徐闻 524100; 2 广东省人民医院//广东省医学科学院 广东广州 510080
结肠癌是全球第二致命的癌症,也是第三大常见的恶性肿瘤[1]。然而,由于缺乏有意义的生物标志物,早期诊断和治疗结肠癌患者变得异常困难,导致大多数患者在确诊时已经处于晚期[2]。此外,由于结肠癌位于人体内的特定位置,其诊断和治疗比直肠癌更具挑战性。遗憾的是,许多患者在确诊后错过了最佳的手术治疗机会,只能接受放疗和化疗,这导致了不良的预后和生存率[3-4]。尽管现代免疫治疗领域取得了一些进展,但结肠癌转移(包括淋巴转移和远处转移)仍然是新诊断结肠癌患者死亡的主要原因[5]。
肿瘤转移涉及多种生物学过程,包括细胞周期控制异常、正常细胞骨架破坏和细胞外基质改变。钙离子(Ca2+)作为人体内含量最丰富的金属元素,已被确定为所有细胞中的关键调节因子,能够调节多种生物学功能,如细胞增殖、代谢、迁移、凋亡和基因表达[6-7]。在过去的十年中,人们对癌症中钙信号通路基因的重组和钙信号在关键事件中的作用有了更深入的了解[8-10]。研究表明,无论是低浓度还是高浓度的钙都可以降低癌变细胞的增殖程度,从而有助于预防结肠癌[11]。CACNA1G是一个编码T型钙通道的基因,已被发现在人类肿瘤中高度甲基化,其失活可能通过调节钙信号通路在癌症的发生和发展中发挥作用,从而影响包括结肠癌在内的多种癌细胞增殖和凋亡[12]。在药物筛选方面,抑制钙-钙调蛋白激酶(CAMK)活性已被证明可以阻止11种抗结肠癌药物对基因的再激活和对癌细胞的杀伤作用,这表明靶向钙信号可能是一种前景广阔的癌症治疗方法[13]。因此,发展新的肿瘤特异性诊断生物标志物或前瞻性治疗靶点至关重要,它们可能有助于预测预后并指导更有效的治疗。
考虑到钙通路基因在结肠癌生长控制和癌症发展的关键作用,本研究旨在利用公共组学数据库挖掘并构建基于钙通路基因的结肠癌预后模型,对模型的预测效果进行初步评价,并探讨这些潜在的生物标志物及其风险模型对结直肠癌预后以及免疫状态的影响。为结肠癌的诊断和治疗策略提供支持。
1 方法
1.1 结肠癌数据收集与整理
收集来自TCGA公共数据库的结肠癌患者队列(TCGA-COAD)的454例结肠癌患者组织样本以及42例癌旁组织的RNA-seq数据及其对应的临床信息作为训练集队列。结肠癌验证集队列来源于GEO数据库中的GSE143985队列,其包含了85例结肠癌患者的RNA微阵列数据。在数据处理过程中,排除了那些基因表达值为0的数据,并将多个重复值取平均以获得最终的RNA表达值。log2(表达值+1)的方法用于标准化基因表达值。从kyoto encyclopedia of genes and genomes(KEGG)数据库获取了包含254个钙信号通路基因的信息(https://www.genome.jp/entry/map04020)。
1.2 差异分析
使用R语言中的“limma”包进行差异表达基因筛选。筛选的标准包括设置截断值为log|fold change| >2,并确保错误发现率(false discovery rate,FDR)小于0.05采用火山图和热图的可视化方法来呈现结肠癌样本与癌旁组织样本之间的基因表达差异。STRING数据库(https://cn.string-db.org/)用于进行蛋白-蛋白互作网络分析,以深入了解差异表达基因之间的相互作用关系。
1.3 构建以及验证风险评分预后模型
对差异表达的基因进行多因素Cox回归分析,随后通过迭代分析,利用Step函数挑选出最优模型作为最终模型。风险评分的计算公式如下:Risk score=(gene1的表达水平×系数1)+ (gene2的表达水平×系数2)…+ (geneN的表达水平×系数N)。根据中位风险评分的阈值,结肠癌患者被分为高危险组和低危险组。Kaplan-Meier曲线分析用于评估危险组之间的生存差异。R包“time ROC”用于分析判别模型的准确性。使用GSE143985队列数据对风险评分模型进行模型效能验证。
1.4 构建临床列线图
结合结肠癌患者临床信息,通过单因素变量和多因素变量的Cox回归确定了与预后风险相关的临床特征和风险基因。使用R包中的“forestplot”函数绘制了森林图。基于多因素回归分析的结果,使用了R包中的“rms”函数构建了临床预测列线图,用于预测结肠癌患者在1年、2年、3年和5年的总生存率。校准曲线用于分析模型的预测准确性。
1.5 风险评分模型与免疫细胞相关性分析
基于TIMER数据库,使用Spearman相关性分析探究单个基因以及风险评分与6种免疫细胞间的相关性。多基因相关性图通过R软件包pheatmap进行可视化呈现。R软件包“immunedeconv”中的CIBERSORT算法被用于进一步评估免疫情况,并通过网络连线图来展示结果。
1.6 统计分析
以上所有分析方法均由R v4.0.3实现。若无特殊说明,P<0.05被认为具有统计学意义。
2 结果
2.1 鉴定结肠癌患者中差异表达的钙通路基因
从TCGA数据库中下载了454例结肠癌患者的组织样本以及42例癌旁组织样本。如图1A所示,39个基因在结肠癌患者中表达上调,而11个基因表达水平显著下调。图1B展示了这些差异表达的钙通路基因在结肠癌组织和癌旁组织中的表达谱情况。蛋白质-蛋白质互作网络图(图1C)显示了50个差异表达的钙通路基因之间的蛋白互作关系,其中CACNA1S和CACNA1D与其他蛋白的互作关系最为密切,可能在结肠癌发生发展中扮演关键角色。
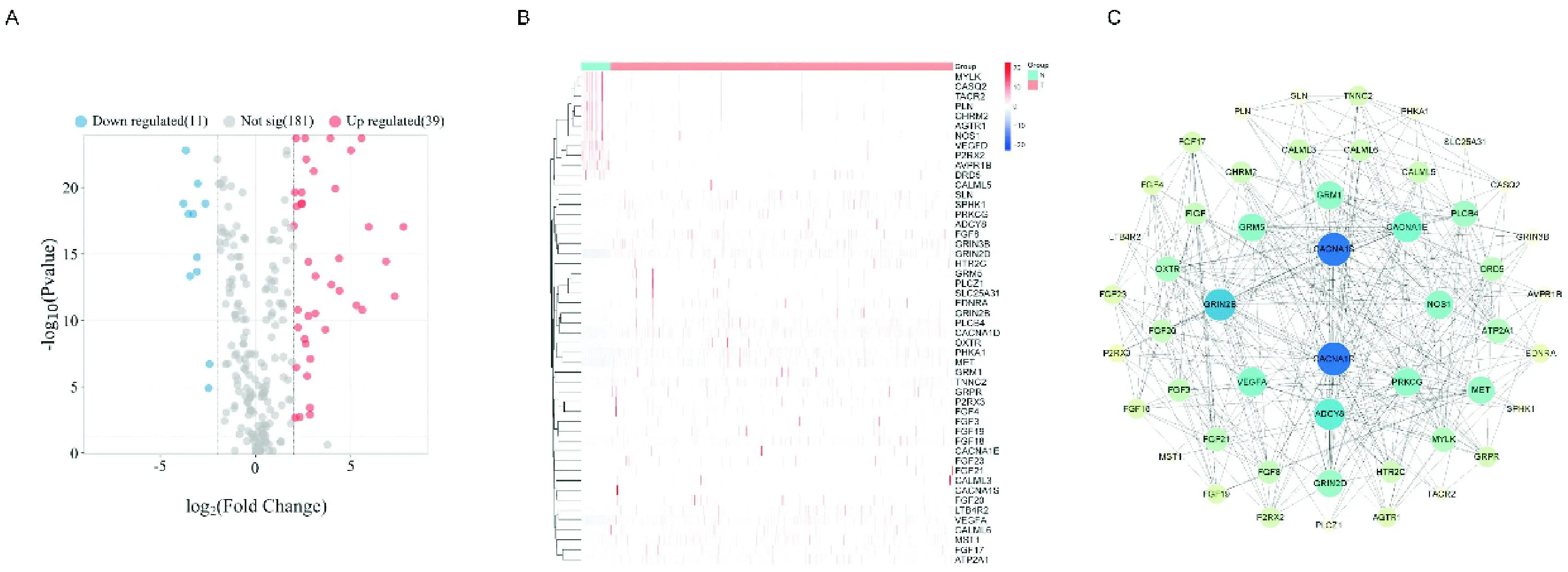
注:图A,火山图;图B,基因热图;图C,蛋白质-蛋白质互作分析网络图。
2.2 基于钙通路基因的结肠癌预后评分模型
为了构建结肠癌预后评分模型,多因素Cox回归分析结果筛选了50个钙通路基因。然后,通过使用Step函数进行迭代分析,最终确定了9个钙通路基因作为模型基因,它们分别是ATP2A1,CACNA1D,CALML6,FGF17,GRM5,HTR2C,P2RX2,PLN,VEGFA。风险评分的计算公式如下:
riskscore=(0.608 1)×ATP2A1+(-0.333 1)×CACNA1D+(0.642)×CALML6+(-0.719 4)×FGF17+(-7.545 3)×GRM5+(0.743 8)×HTR2C+(0.886 4)×P2RX2+(0.184 3)×PLN+(0.319)×VEGFA
根据中位风险评分(图2A),TCGA结肠癌患者队列被分为高危险组(227例)和低危险组(227例)。随着风险评分的增加,结肠癌患者的生存时间骤减,死亡人数增加,并且9个钙通路基因的表达也呈现明显差异。Kaplan-Meier曲线显示低危险组患者的总生存率明显高于高危险组(图2B,P=1.62×10-6)。另外,随时间变化的受试者操作特征(ROC)曲线评估结果表明,钙通路基因风险评分在预后预测中具有较高的准确性,其1年时曲线下面积(AUC)为0.689,3年时为0.751(图2C)。
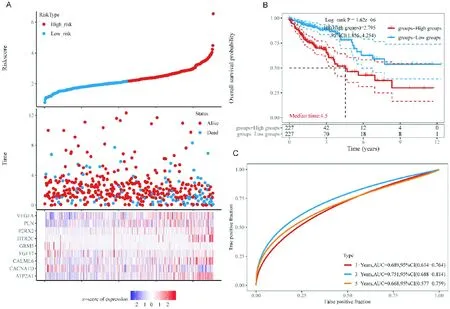
注:图A,TCGA结肠癌患者的风险评分、生存状态散点图以及钙信号通路风险基因随风险评分分布的基因表达热图;图B,Kaplan-Meier生存曲线显示高危险组(红色)的生存差于低危险组(蓝色);图C,钙通路基因风险模型在不同时间(1,3,5-年)的受试者操作特征曲线(ROC)曲线与曲线下面积(AUC)。
2.3 GEO结肠癌队列患者验证钙通路基因预后评分模型
为了验证模型的预测效能,使用了GEO结肠癌患者队列GSE143985进行外部验证。根据中位风险评分,GSE143985结肠癌患者被分为高危险组和低危险组(图3A)。同样,随着风险评分增加,结肠癌患者的死亡人数增加,生存时间降低。Kaplan-Meier曲线显示低危险组患者总生存率明显高于高危险组(图3B,P=0.003 436)。ROC曲线分析显示该风险评分在预后预测中具有极高的精度,其1年时曲线下面积(AUC)为0.946,2年时AUC为0.834,3年时AUC为0.819(图3C)。

注:图A,左图为GEO结肠癌患者的风险评分分布,其中以图中位风险值为截断点,红色代表高危险组,蓝色代表低危险组;右图为不同样本风险评分对应的生存时间和生存状态散点图分布;图B,Kaplan-Meier生存曲线显示高危险组(红色)的生存差于低危险组(蓝色);图C,钙通路基因风险模型在不同时间(1,2,3年)的受试者操作特征曲曲线与曲线下面积。
2.4 基于钙通路基因和结肠癌患者临床特征构建的临床列线图
接下来,采用单因素和多因素COX分析分析9个钙通路基因和结肠癌患者临床特征(年龄,性别,种族,TNM分期)与结肠癌预后之间的相关性,结果显示,CALML6、HTR2C、P2RX2、年龄TNM分期与预后独立相关(图4A~B)。基于多因素回归分析结果,构建了一个列线图,用于预测结肠癌患者在未来1、2、3和5年的总生存率(图4C)。患者可以根据不同因素对应的分数(Point)来计算总得分(Total Point),以估计其未来的生存率。该列线图的C-index为0.723,表明其预测准确度较高。校准曲线显示模型的预测准确性良好,接近理想虚线(图4D)。

注:图A,单因素COX分析鉴定与生存相关的钙通路基因和临床特征;图B,多因素COX分析鉴定与生存相关的钙通路基因和临床特征;图C,基于多因素回归结果构建的临床列线图预测结肠癌患者的1,2,3和5年总生存期;图D,列线图的校准曲线。对角虚线表示理想的列线图,红色线,蓝色线,橘色线,和紫色线表示观察到的1年,2年,3年和5年列线图校准曲线。
2.5 钙通路基因风险模型与免疫相关性
通过分析TIMER免疫数据库,发现了9个钙通路基因及其构建的风险模型与6个常见免疫细胞之间存在相关性。如图5A所示,除HTR2C外,其他8个钙通路基因与免疫细胞存在显著相关性。具体而言,ATP2A1、CALML6、FGF17、VEGFA与免疫细胞尤其是CD8+T细胞,呈现显著正相关,而PLN、P2RX2、GRM5与免疫细胞,特别是CD4+T细胞,中性粒细胞,巨噬细胞和髓样树突细胞,呈现显著负相关。如图5B所示,多种免疫细胞包括B细胞,CD4+T细胞,Neutrophil细胞,Microphage细胞,Myeloid dendritic细胞与风险评分呈现正相关性,这表明高危险组患者可能存在更高水平的肿瘤免疫细胞浸润。

注:图A,钙通路基因与六种免疫细胞相关性热图。红色代表正相关性,蓝色代表负相关性。颜色越深代表二者之间相关性越强,其中*P<0.05, **P<0.01。图B,钙通路基因模型风险评分与免疫评分间的Spearman相关性分析。横坐标为风险评分,纵坐标为免疫评分。上侧密度曲线代表风险评分分布趋势,右侧密度曲线代表免疫评分分布趋势。
2.6 钙通路基因风险模型与21种免疫细胞相关性
为了深入探究钙通路基因风险模型与免疫细胞的关联,采用了CIBERSORT算法进行可靠的免疫评分评估。如图6所示,风险评分与memory B cell、CD8+T cell、T cell follicular helper、T cell regulatory (Tregs)、activated Mast cell等免疫细胞呈显著正相关,而与resting memory CD4+T cell、activated Myeloid dendritic cell、resting Mast cell等免疫细胞呈显著负相关。这些结果反映了免疫系统对风险因素做出的复杂调节反应。
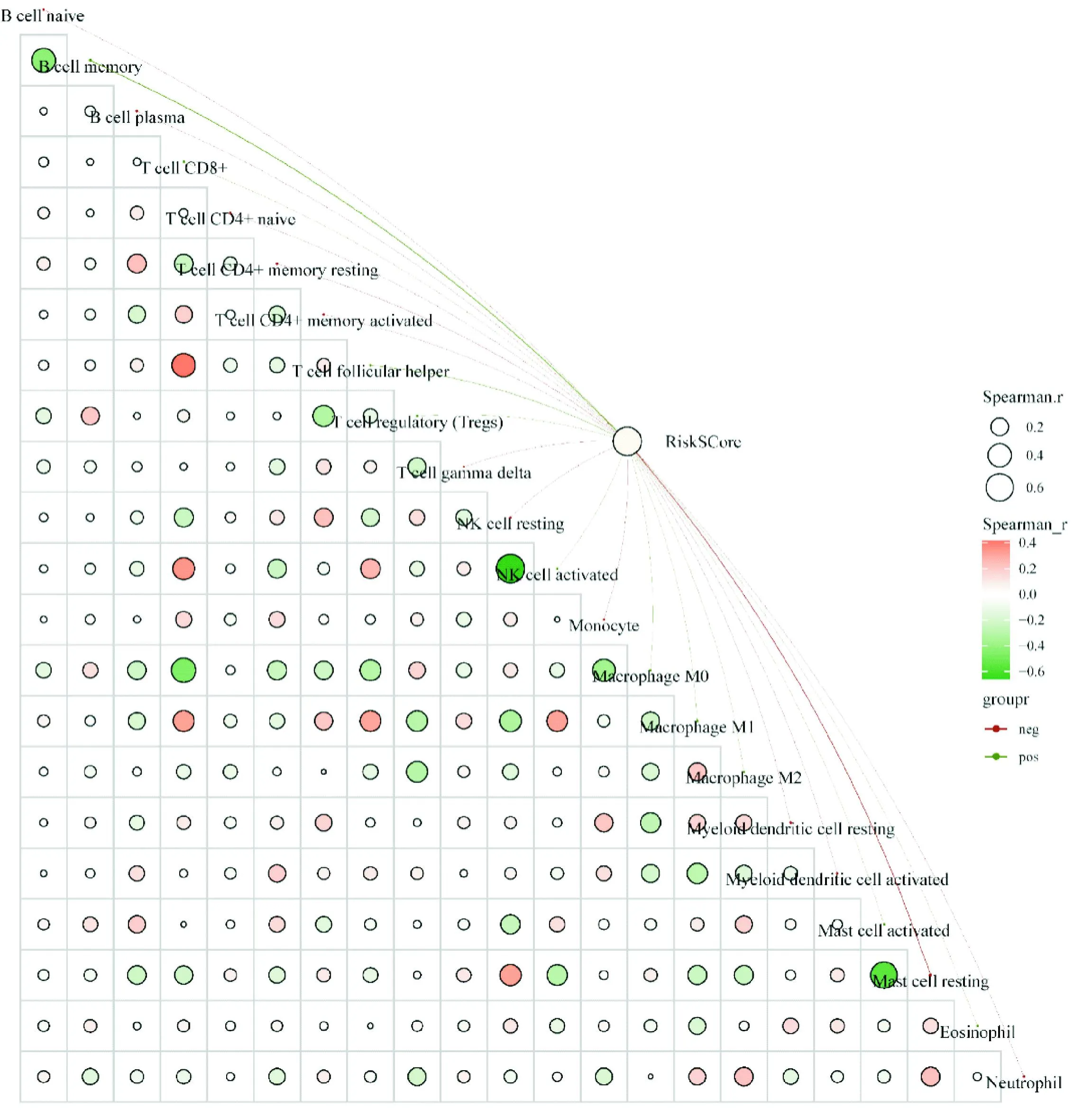
注:图中蓝色圆圈代表负相关性,红色圆圈代表正相关性。颜色越深或圆圈越大代表相关性越强。图中红色连线代表负相关性,绿色则代表正相关性。
3 讨论
作为全球第二大癌症相关死因,结肠癌的诊断和治疗一直是人类健康关注的焦点[14]。近年来,越来越多的研究致力于寻找结肠癌患者中差异表达的生物标志物候选物,以改善治疗效果和预后[15-17]。这些研究旨在发现新的分子特征和生物标志物,以更深入地了解结肠癌的发展和进展机制,为个体化治疗和预后评估提供有价值的信息。本研究分析了254个钙通路基因,筛选出了50个差异表达的钙通路基因。随后,STEP函数筛选了最优模型,并构建了一个由9个钙通路基因组成的风险评分模型。该预测模型能够将结肠癌患者分为不同风险层次,并显著表明高危险组的总生存率比低危险组低。ROC曲线分析显示,该模型预测TCGA结肠癌患者队列3年的生存AUC值大于0.7,而在GEO验证集中的1年AUC甚至高于0.9,这表明该模型具有较高的预后预测准确性和稳健性。此外两种免疫细胞算法,TIMER和CIBERSOFT,被用于分析钙通路基因及其风险评分模型与免疫评分之间的相关性,进一步拓展了钙通路基因在结肠癌预后及免疫调节方面的应用。
本研究具有几个优点。首先,使用了STEP函数构建逐步回归模型,以筛选最佳预测变量,并确定了9个钙通路基因作为结肠癌的预后生物标志物,包括ATP2A1、CACNA1D、CALML6、FGF17、GRM5、HTR2C、P2RX2、PLN、VEGFA。相对于常见的多元回归分析以及LASSO回归算法,STEP方法更加简便,它可以自动从众多可选的变量中挑选出最为重要的变量,以建立回归分析的预测模型[18]。在这9个钙通路基因中,ATP2A1、CACNA1D、CALML6、FGF17、GRM5、HTR2C以及VEGFA在TCGA结肠癌组织表达中呈现显著上调,而P2RX2和PLN则在结肠癌组织表达呈现明显下调。ATP2A1、CACNA1D、CALML6是激活钙离子结合活性和酶调节剂活性的主要基因。先前的研究表明,CACNA1D和ATP2A1在突变型腺瘤中具有特定的组织病理学表型[19],提示其在肿瘤细胞增殖中具有重要作用。FGF17是编码成纤维细胞生长因子(FGF)家族的一个成员,它具有广泛的有丝分裂和细胞存活活性,参与多种生物学过程如肿瘤生长和侵袭等[20]。GRM5和HTR2C属于G蛋白偶联受体蛋白家族,主要参与神经网络活动和突触可塑性的调节。研究表明,通过靶向假定的mu阿片样物质/ GRM5异构体可以有效抑制小鼠骨癌的发展[21]。另外,HTR2C可以通过激活WNT信号通路诱导上皮-间质转化,并促进人癌细胞的转移[22]。VEGFA是促进肿瘤增殖的一种血管内皮生长因子,细胞内Ca2+水平升高可促进CREB的磷酸化,从而激活VEGFA转录并最终促进内皮血管生成[23]。P2RX2和PLN与ATP的活性有关,但其在结肠癌中的作用仍未见广泛报道,但这值得进一步深入研究,因为它们可能成为新的诊断和治疗标志物。其次,本研究表明钙通路基因在免疫系统的各种细胞功能中起着关键作用。
已有研究表明,肿瘤微环境中浸润的免疫细胞对肿瘤的发生和发展产生影响[24- 25]。钙信号在免疫系统的各种细胞功能中发挥着关键作用。举例来说,T细胞和B细胞在抗原识别过程中需要细胞内Ca2+浓度的增加[26]。本研究研究了免疫浸润细胞与9个钙通路基因表达之间的相关性,结果显示这9个基因和6种免疫细胞水平存在一定的相关性。值得注意的是,PLN与这6种免疫细胞呈现出负相关性,这可能表明PLN低表达的患者肿瘤免疫浸润水平较高。此外,CIBERSOFT算法的结果显示,风险评分与memory B细胞、CD8+T细胞、T细胞辅助因子(Tfh)、T细胞调节因子 (Tregs)、活化肥大细胞等免疫细胞呈显著正相关。这些免疫细胞在抵御感染、清除异常细胞和调节免疫应答方面起着关键作用。例如,memory B cell能够产生高亲和力的抗体,提供持久的保护免疫[27];CD8+T细胞能够杀伤感染的细胞[28];Tfh细胞在淋巴结中激活B细胞,促进抗体产生[29];活化肥大细胞参与炎症和过敏反应[30]。Tregs则能够抑制免疫应答,维持免疫平衡。这些正相关的细胞提示高危险组患者可能处于免疫应答的状态。相反,低危险组患者与休息状态的记忆CD4+T细胞、活化的髓样树突状细胞以及休息状态的肥大细胞呈显著负相关,这表明低危险组患者可能在免疫应答方面处于较低的状态[31-32]。总之,这些结果表明钙通路基因相关风险评分与多种类型的免疫细胞之间存在相关性,进一步研究可能有助于更深入地理解免疫系统在不同钙通路基因相关风险环境下的功能和调控机制。
最后,本研究构建了一个包含钙通路基因和临床指标的列线图,以为临床医生的预后评估提供有益的指导。临床医生可以借助此列线图中的信息,结合患者的个体特征和病情发展,更准确地评估患者的预后情况。同时,通过深入了解钙通路基因在结肠癌中的作用机制,医生可以根据患者的基因表达水平来预测病情的进展和治疗反应。这种个性化的预后评估将协助医生制定更为精准的治疗方案,并提供更准确的治疗建议。
然而,本研究仍存在一些限制。首先,虽然本研究已经利用GEO数据库中的结肠癌患者数据对预后模型进行了外部验证,但仍需要更大规模的多中心结肠癌患者队列验证,以增强研究的临床意义。其次,需要进行更多的体内外实验,以进一步理解钙通路基因在结肠癌患者中的具体生物学功能,以及其在结肠癌发展中的作用机制。最后,其他因素,如遗传、环境和个体健康状况等,也可能对免疫细胞水平和风险评分产生影响,需要进一步分析。因此,对钙通路基因的深入研究将有助于更全面地了解其在结肠癌发展中的作用,为患者提供更准确的治疗策略和预后评估。
总之,本研究首次利用STEP函数构建了包含9个钙通路基因的风险评分模型。该模型可用于分析结肠癌患者的预后和免疫状况,这为进一步研究这些基因在结肠癌的诊断和治疗机制中的作用提供了临床基础。
