氢化物对Mg2Ni基合金储氢性能的影响
2024-01-06刘力杨天辉周曦孟冉浩
刘力, 杨天辉, 周曦, 孟冉浩
(1. 济源职业技术学院,河南 济源 459000; 2. 郑州大学, 郑州 450001)
目前,镁镍基储氢材料由于具有储氢容量高、价格低、吸放氢性能好和无污染等特点,在储氢材料体系中具有良好的应用前景[1]。由于镁镍基储氢材料的理论放电容量(约1 000 mA h/g)远高于目前商用的LaNi5型合金(放电容量370 mA h/g),研究者对Mg2Ni 基储氢材料进行了改性研究。邓剑锋等[2]研究了稀土化合物REMg2Ni (RE = La、Pr和Nd)添加剂对Mg2Ni 基储氢材料性能的影响,并证实添加稀土化合物有助于提升放氢速率和氢扩散性能,并且添加Pr 时储氢合金的放氢速率最快,氢扩散性能改善效果最好;郗玉平等[3]研究了LaMg2Ni 含量对Mg2Ni 基复合材料物相组成、显微形貌和储氢性能的影响,并证实LaMg2Ni 含量为20% (质量比,下同)时复合材料中弥散分布的LaH3相有助于提高复合材料中氢的吸附/脱附速率,提高储氢容量。近年来,李亚琴等[4]对Mg2Ni型合金微观组织结构和电化学性能的研究表明,Mg2Ni基储氢合金应用于燃料电池时可储氢90 kg/m3,然而,Mg2Ni 型合金较差的吸/放氢动力学性能、较高的热力学稳定性和较低的储氢密度(燃料电池要求9%以上)仍然在一定程度上限制了其应用范围[5]。目前的研究热点主要包括通过引入合金元素(Ti、Co、Cr、Zr 等)、添加具有催化活性的金属间化合物(TiFe、Cr2O3、MnO2等)等方式提升储氢合金的吸/放氢性能[6],并且已有的稀土改善Mg2Ni 合金储氢性能方面的研究[7-8]结果表明,加入稀土氢化物有助于降低Mg2Ni 合金的晶胞体积,并在吸/放氢过程中为储氢合金提供氢扩散通道,提高其吸/放氢动力学性能。而目前关于通过添加TiH2、NbH 氢化物改善Mg2Ni 合金的吸/放氢性能的研究报道较少,氢化物添加剂对Mg2Ni 储氢合金吸放氢性能的影响规律以及具体作用机制尚不清楚[9-10]。本研究采用机械球磨的方法制备了添加氢化物TiH2和NbH 的Mg2Ni 基储氢合金,并与纯Mg2Ni 合金进行了物相组成及储氢性能对比分析。本研究结果有助于揭示氢化物在Mg2Ni 储氢合金吸/放氢过程中的作用机理,并为高性能Mg2Ni 储氢合金的开发与应用及推动其在新能源汽车等领域的应用提供参考。
1 实验部分
1.1 材料与试样制备
以真空感应熔炼法制备Mg2Ni 合金。以分析纯TiH2和自制NbH 粉末为原料,首先对Mg2Ni 合金进行预处理: 室温空气中机械破碎Mg2Ni合金并过100目(100目=0.154 mm)筛,将Mg2Ni合金粉末置于H-Sorb 2600 型PCT 测试仪(北京金埃谱科技有限公司)中氢化处理(温度为350 ℃、 时间为2 h、 氢化压力为4 MPa),使其充分吸氢,然后在350 ℃进行动态真空处理,使其充分放氢,重复吸氢和放氢过程2次后,得到脆性更大的Mg2NiH4粉末,真空密封保存备用。将经过预处理的Mg2Ni 合金(Mg2NiH4粉末)与添加剂(TiH2和NbH 粉末)按比例称量后(前期工作优化出氢化物最佳添加量为10%),在Pulverisette 7 高能球磨机中进行充分混合,磨球为粒径6 mm 碳化物球、球料质量比8∶1,球磨3 h后制备得到Mg2Ni+10%TiH2、Mg2Ni +10%NbH储氢合金。
1.2 材料测试与表征
充分吸氢和放氢后的储氢合金在Empyrean锐影X射线衍射仪(荷兰帕纳科公司)上进行物相分析,靶材为铜靶(Kα辐射,λ=0.153 9 nm),测试电压30 kV、测试电流20 mA,扫描方式为连续扫描,速度为5(°)/min,测试完成后使用Jade-6.5 软件进行数据分析,获得晶胞参数;储氢合金的显微形貌采用VEGA3 型扫描电子显微镜(TESCAN 公司)进行观察,微区成分采用附带IE250X-Max50 能谱仪进行测定;储氢合金的压力-组成-温度曲线(PCT)和等温放氢曲线在H-Sorb 2600型PCT测试仪(北京金埃谱科技有限公司)上进行测试[11],前者需要将储氢合金进行300 ℃/3 MPa/60 min的吸氢和300 ℃/0.01 MPa/60 min 的放氢处理2 次后进行测试;后者在测试过程中设定放氢初始压力为0.01 MPa、温度分别为523 K 和573 K,测试过程中采用高纯氢(99.96%)。程序升温放氢曲线测试需要将试样预先进行573 K/3 MPa/120 min 的氢化处理,在氢气压力稳定后进行程序升温放氢测试,升温速率为2 K/min。
2 结果与讨论
2.1 物相组成和显微形貌
图1 所示为添加不同氢化物的Mg2Ni 储氢合金充分吸氢后的X 射线衍射图谱。对于纯Mg2Ni 储氢合金,充分吸氢后主要由Mg2NiH4相组成;对于Mg2Ni+10% TiH2储氢合金,充分吸氢后主要由Mg2NiH4、TiH2和TiNiH 相组成;对于Mg2Ni + 10%NbH 储氢合金,充分吸氢后主要由Mg2NiH4和NbH相组成。
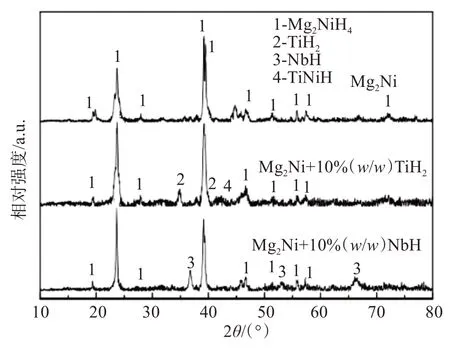
图1 添加不同氢化物的Mg2Ni储氢合金充分吸氢后的X射线衍射图谱Fig.1 X-ray diffraction pattern of Mg2Ni hydrogen storage alloys with different hydrides additions after full hydrogen absorption
图2 所示为添加不同氢化物的Mg2Ni 储氢合金充分放氢(573 K/2 h 真空处理)后的X 射线衍射图谱。对于纯Mg2Ni 储氢合金,充分放氢后主要由Mg2Ni 相组成;对于Mg2Ni + 10% TiH2储氢合金,充分放氢后主要由Mg2Ni、TiH2和TiNi 相组成;对于Mg2Ni + 10% NbH 储氢合金,充分放氢后主要由Mg2Ni和NbH相组成。
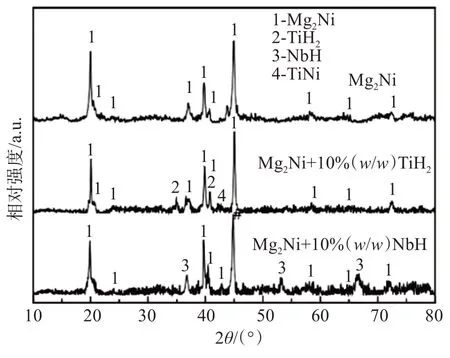
图2 添加不同氢化物的Mg2Ni储氢合金充分放氢后的X射线衍射图谱Fig.2 X-ray diffraction pattern of Mg2Ni hydrogen storage alloys with different hydrides additions after full hydrogen desorption
表1 所列为添加不同氢化物的Mg2Ni 储氢合金充分吸/放氢后的晶胞参数统计结果。纯Mg2Ni储氢合金充分吸氢后,Mg2NiH4相晶胞体积为0.592 nm3;Mg2Ni+10% TiH2储氢合金和Mg2Ni+10% NbH 储氢合金充分吸氢后,Mg2NiH4相晶胞体积分别减少至0.588 nm3和0.591 nm3,即分别减小了0.68% 和0.17%。充分放氢后,纯Mg2Ni 储氢合金Mg2Ni 相晶胞体积为0.320 nm3;Mg2Ni+10% TiH2储氢合金和Mg2Ni + 10% NbH 储氢合金的Mg2Ni 相晶胞体积分别减少至0.318 nm3和0.319 nm3,即分别减小了0.63%和0.31%。充分吸/放氢后晶胞体积减小的主要原因是加入的TiH2或NbH 在机械球磨过程中嵌入Mg2Ni/Mg2NiH4基体中,在使得Mg2Ni/Mg2NiH4发生形变的同时产生一定的晶体缺陷[12]。此外,对比分析加入TiH2和NbH 后Mg2Ni 储氢合金充分吸/放氢后的物相组成可知,TiNiH 会在充分放氢后形成TiNi,充分吸氢后形成TiNiH;NbH 在充分吸氢/放氢后仍然为NbH,这表明NbH 在吸氢/放氢过程中会稳定存在于Mg2Ni 储氢合金中。加入TiH2后,Mg2Ni 储氢合金在573 K 下的反应方程式可表示为[13]:
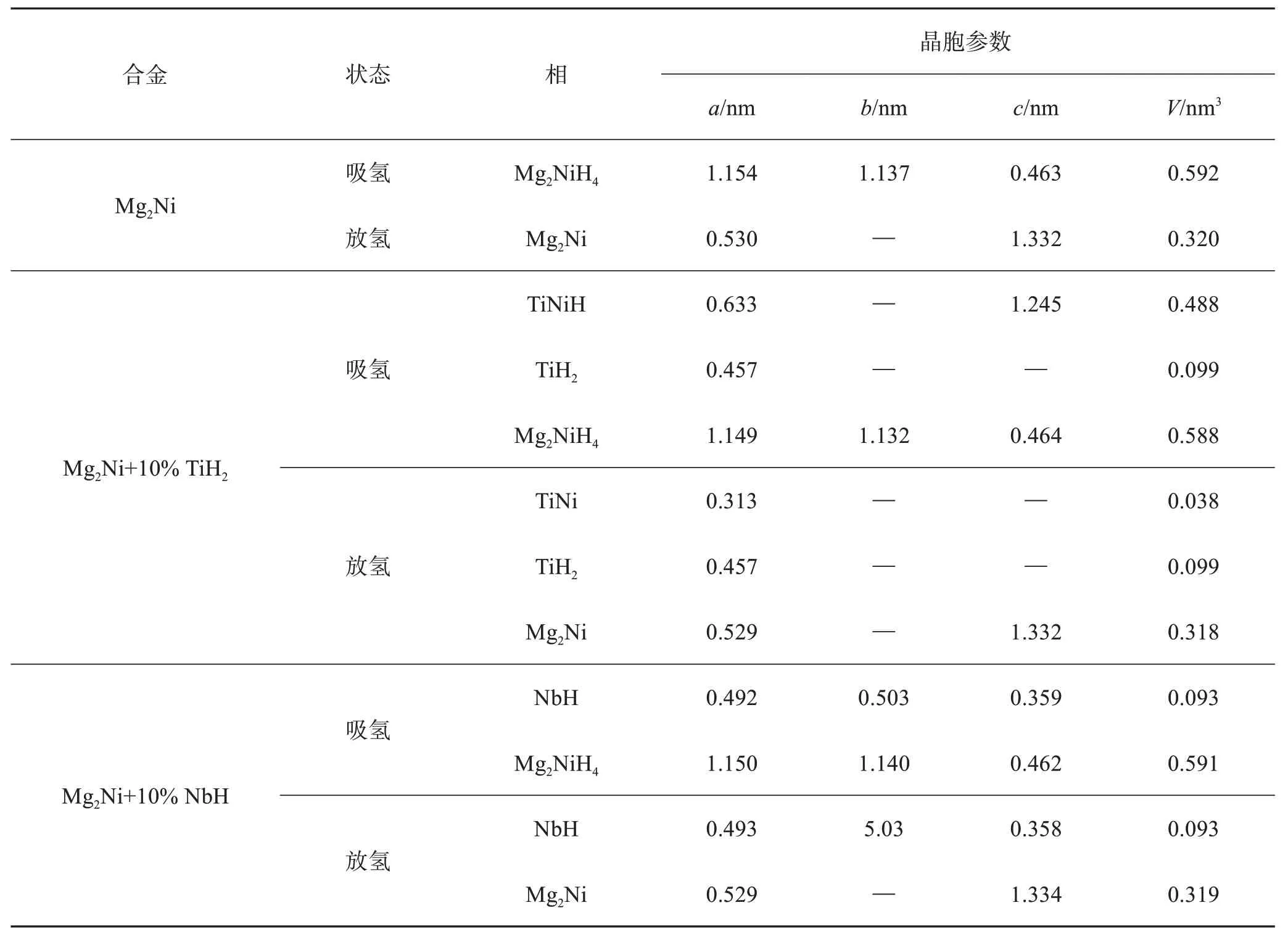
表1 添加不同氢化物的Mg2Ni储氢合金充分吸/放氢后的晶胞参数Table 1 Cell parameters of Mg2Ni hydrogen storage alloys with different hydrides additions after full hydrogen absorption/desorption
图3 所示为添加不同氢化物的Mg2Ni 储氢合金的SEM 形貌。对于添加了10% NbH 的Mg2Ni 储氢合金,Mg2Ni 和NbH 颗粒之间发生了一定程度团聚,局部可见尺寸不等的亮白色颗粒,能谱分析结果表明,亮白色区域含有85.65% Nb,颜色较暗的灰色区域约含有 6.17% Nb,机械球磨后NbH 在Mg2Ni 储氢合金中发生了局部偏聚;对于添加了10% TiH2的Mg2Ni储氢合金,未见明显亮白色颗粒存在,其中,颜色稍亮和颜色相对较暗的区域Ti含量分别为10.54%和8.96%,机械球磨后TiH2在Mg2Ni储氢合金中呈现均匀分布的特征。

图3 添加(a)NbH和(b)TiH2的Mg2Ni储氢合金的SEM形貌Fig.3 SEM morphology of Mg2Ni hydrogen storage alloy with the addition of (a) NbH and (b) TiH2
2.2 储氢性能
图4 所示为添加不同氢化物的Mg2Ni 储氢合金的压力-组成-温度曲线,测试温度为523~598 K。无论是添加10% TiH2,还是添加10% NbH,随着温度从523 K 升至598 K,Mg2Ni 储氢合金的吸/放氢平台都呈现逐渐上升的趋势;当温度为523 K 时,Mg2Ni+10% TiH2储氢合金和Mg2Ni+10% NbH储氢合金的吸氢平台分别为0.18 MPa和0.17 MPa,放氢平台分别为0.064 MPa和0.052 MPa,而纯Mg2Ni合金的吸氢平台和放氢平台分别为0.150 MPa 和0.047 MPa。整体而言,Mg2Ni+10% TiH2储氢合金和Mg2Ni+10% NbH 储氢合金的吸氢平台和放氢平台都高于纯Mg2Ni合金。这主要是因为加入氢化物TiH2和NbH 会减小Mg2Ni储氢合金的晶胞体积,进而导致吸氢平台和放氢平台压力升高[14]。此外,当温度从523 K 升至598 K 时,Mg2Ni+10% TiH2储氢合金和Mg2Ni+ 10% NbH 储氢合金的最大吸氢容量并未随着温度升高而发生明显改变,最大吸氢容量分别约为3.42%和3.43%,这主要是因为加入的TiH2或NbH在523~598 K时较稳定[15]。
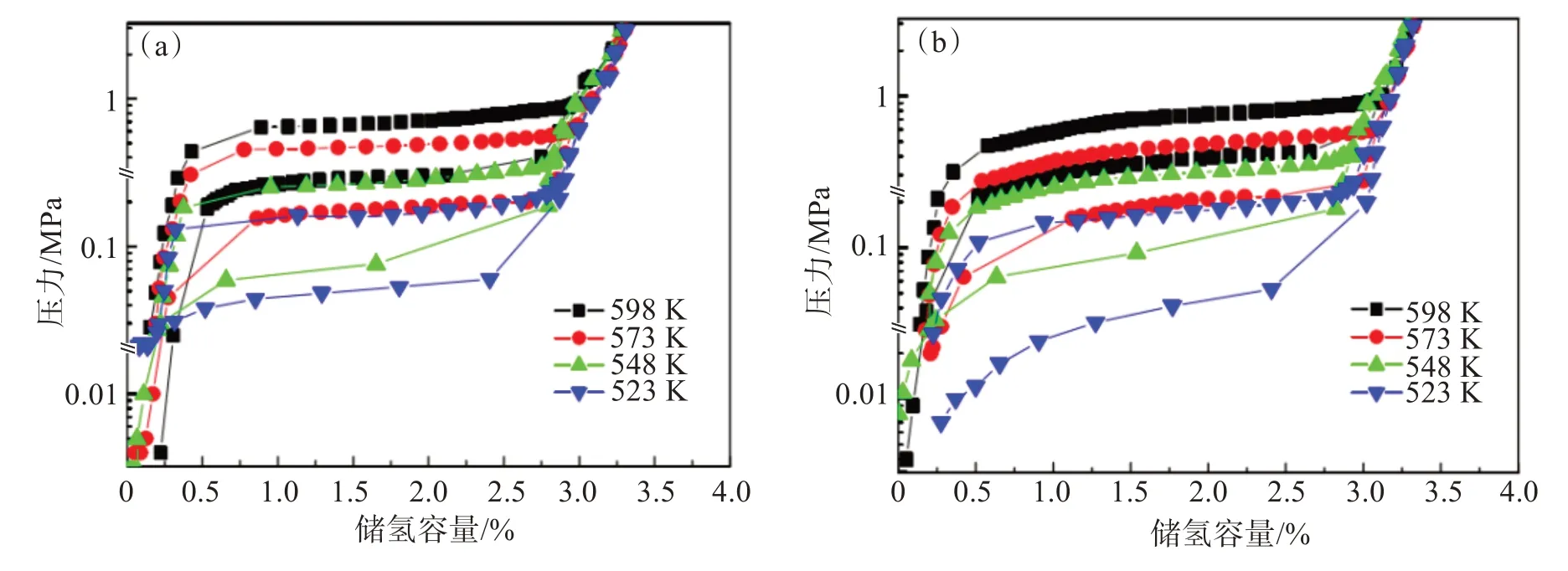
图4 添加(a)NbH和(b)TiH2的Mg2Ni储氢合金的压力-组成-温度曲线Fig.4 Pressure-composition-temperature curves of Mg2Ni hydrogen storage alloys with the addition of (a) NbH and (b) TiH2
纯Mg2Ni 合金、Mg2Ni + 10% TiH2储氢合金和Mg2Ni+10% NbH 储氢合金在不同温度下的放氢反应的焓变ΔH和熵变ΔS可用范特霍夫(Van 't Hoff)方程表示[16]:
式(3)中:Kɵ为反应的平衡常数(放氢过程中为放氢平台压力);T为温度;R为气体常数(8.314 J/(mol·K))。图5 所示为添加不同氢化物的储氢合金的放氢范特霍夫曲线,表2中给出了相应的热力学参数拟合计算结果。对于纯Mg2Ni 合金,放氢反应过程中的ΔH=64.61 kJ/mol, ΔS= 123.21 J/(K·mol);添加10% TiH2或10% NbH 后,Mg2Ni 储氢合金放氢反应过程中的ΔH和ΔS都不同程度地减小,其中,Mg2Ni + 10%NbH 储氢合金在放氢反应过程中的ΔH和ΔS最小,分别约为59.56 kJ/mol 和92.68 J/(K·mol)。这也就说明加入氢化物TiH2或NbH 有助于降低Mg2Ni储氢合金放氢反应过程中的ΔH和ΔS,即更容易在放氢反应过程中放氢[17]。

表2 添加不同氢化物的Mg2Ni储氢合金的热力学参数拟合计算结果Table 2 Thermodynamic parameter fitting calculation results of Mg2Ni hydrogen storage alloys with different hydrides additions

图5 添加不同氢化物的Mg2Ni储氢合金的放氢范特霍夫曲线Fig.5 Van't Hoff plots of hydrogen desorption for Mg2Ni hydrogen storage alloy with different hydride additions
图6 所示为添加不同氢化物的Mg2Ni 储氢合金的程序升温放氢曲线。对比纯Mg2Ni 合金、Mg2Ni +10% TiH2储氢合金和Mg2Ni + 10% NbH 储氢合金,当温度T高于475 K 时,3 种储氢合金都会发生放氢反应,在相同温度下,Mg2Ni + 10% TiH2储氢合金和Mg2Ni + 10% NbH 储氢合金的放氢量基本都高于纯Mg2Ni 合金。此外,放氢量为0.1%时,纯Mg2Ni 合金、Mg2Ni + 10% TiH2储氢合金和Mg2Ni + 10% NbH储氢合金对应的温度分别为492、488、482 K,这与放氢范特霍夫曲线拟合结果相吻合,即加入TiH2和NbH 有助于Mg2Ni 储氢合金放氢,并且NbH 对Mg2Ni储氢合金放氢的改善效果更好。
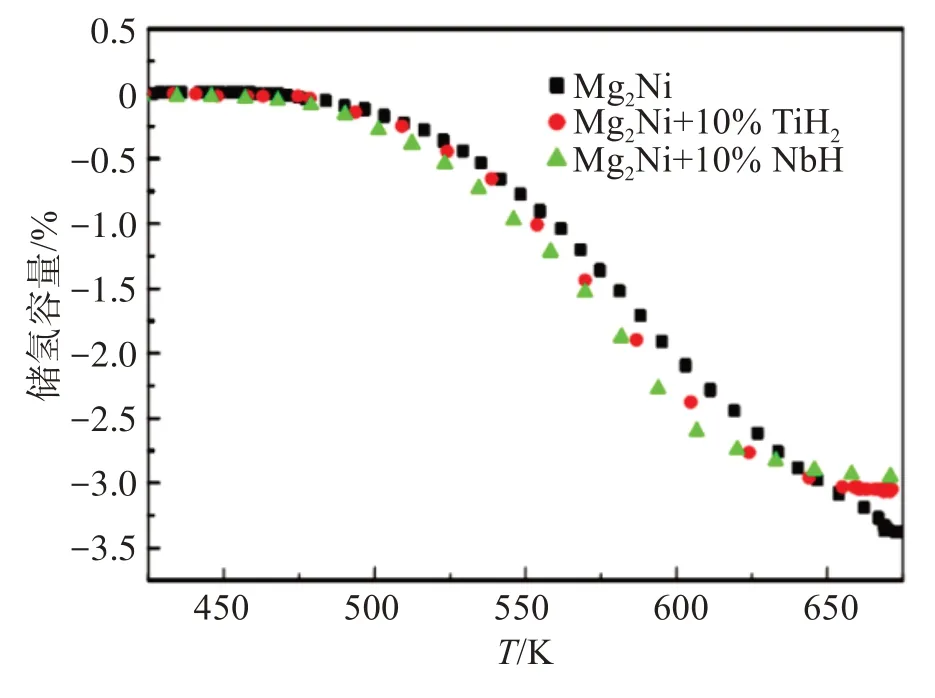
图6 添加不同氢化物的Mg2Ni储氢合金的程序升温放氢曲线Fig.6 Hydrogen desorption curve by programed heating of Mg2 Ni hydrogen storage alloy with different hydrides additions
图7 所示为添加不同氢化物的Mg2Ni 储氢合金的等温放氢曲线。当温度为523 K时(图7(a)),相同测试时间下,添加10% TiH2或10% NbH 的Mg2Ni 储氢合金的放氢量都高于纯Mg2Ni 合金,这主要因为加入的TiH2和NbH 有助于提升Mg2Ni储氢合金的放氢速率[18];当温度为573 K 时(图7(b)),添加不同氢化物的Mg2Ni 储氢合金的放氢容量的变化趋势与温度为523 K 时相同,即相同时间下Mg2Ni储氢合金的放氢容量从大到小顺序为:Mg2Ni+10% TiH2>Mg2Ni+10% NbH>纯Mg2Ni 合金。此外,温度为573 K 时,Mg2Ni储氢合金到达最大放氢容量时对应的时间从小到大顺序为:Mg2Ni+10% TiH2<Mg2Ni+10%NbH<纯Mg2Ni 合金,Mg2Ni+10% TiH2储氢合金到达最大放氢容量的时间(850 s)明显小于Mg2Ni+10% NbH 储氢合金(1 240 s)和 纯Mg2Ni 合金(1 460 s)。
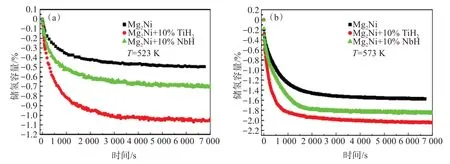
图7 添加不同氢化物的Mg2Ni储氢合金在(a)523 K和(b)573 K时的等温放氢曲线Fig.7 Isothermal hydrogen desorption curve of Mg2Ni hydrogen storage alloys with different hydrides additions at (a)523 K and(b)573 K
图8 所示为添加不同氢化物的Mg2Ni 储氢合金的放氢 Jander 拟合曲线,温度为523 K。采用Jander方程对纯Mg2Ni 合金、添加10% TiH2或10% NbH 的Mg2Ni储氢合金的放氢曲线进行三维扩散拟合[19],纯Mg2Ni 合金、Mg2Ni+10% TiH2储氢合金和Mg2Ni+10% NbH 储氢合金的反应速率常数k分别为6.83×10-5、8.79×10-5和7.24×10-5,即加入氢化物TiH2或NbH 会加快储氢合金的反应速率,使得放氢过程中氢在储氢合金中的扩散性能优于纯Mg2Ni 合金。此外,添加TiH2对储氢合金放氢过程中氢扩散性能的改善效果优于NbH,这主要是因为在储氢合金制备过程中NbH 会发生一定程度团聚而阻碍氢的扩散[20-22],而TiH2在储氢合金中弥散分布可以为氢的快速扩散提供通道。
3 结 论
1)相较于纯Mg2Ni 储氢合金,充分吸氢后,添加了10% TiH2或10% NbH 的Mg2Ni 储氢合金的Mg2NiH4相晶胞体积分别减小了0.68%和0.17%;充分放氢后,添加了10% TiH2或10% NbH 的Mg2Ni 储氢合金的Mg2Ni 相晶胞体积分别减小了0.63%和0.31%。
2)机械球磨后,TiH2在Mg2Ni储氢合金中呈现均匀分布的特征,而NbH 存在一定程度团聚。随着温度从523 K 升至598 K,储氢合金的吸/放氢平台都逐渐上升;添加10% TiH2或10% NbH 的Mg2Ni 储氢合金的吸氢平台和放氢平台都高于纯Mg2Ni合金。
3)纯Mg2Ni 合金在放氢反应过程中的焓变和熵变分别为64.61 kJ/mol 和123.21 J/K·mol;添加10%TiH2或者10% NbH 后,Mg2Ni 储氢合金放氢反应过程中的焓变和熵变都不同程度地减小。
4)温度分别为523、573 K 时,Mg2Ni 储氢合金的放氢容量从大到小顺序为:Mg2Ni+10% TiH2>Mg2Ni +10% NbH>纯Mg2Ni合金。温度为573 K 时,储氢合金到达最大放氢容量对应的时间从小到大顺序为:Mg2Ni+10% TiH2<Mg2Ni+10% NbH<纯Mg2Ni合金。纯Mg2Ni 合金、Mg2Ni+10% TiH2、Mg2Ni+10%NbH 储氢合金的反应速率常数k分别为6.83×10-5、8.79×10-5、7.24×10-5,即加入TiH2或NbH会增加储氢合金的反应速率。
