废旧锂离子电池正极材料中有价金属离子分离回收技术的研究现状
2024-01-06王露冯天意崔鹏媛沈庆峰林艳俞小花
王露, 冯天意, 崔鹏媛, 沈庆峰, 林艳, 俞小花
(昆明理工大学冶金与能源工程学院,昆明 650093)
在“碳中和”“5G 建设”等背景下,全球对动力电池的需求呈现出不断增长的趋势,动力锂离子电池已应用在各行各业,如消费电子、交通运输、智能电网、航空航天、现代智慧农业、可穿戴与医疗电子设备等领域。现有市场中的锂离子电池的正极材料可分为锰酸锂、钴酸锂、二元体系、三元体系、磷酸铁锂等。据高工产研锂电研究所(GGⅡ)调研数据显示,2021 年正极材料领域磷酸铁锂(LFP)正极材料市场占比由24%升至43%,三元正极材料(NCM)市场占比略降,由46%降至38%,而钴酸锂(LCO)和锰酸锂(LMO)正极材料的市场占比依然不大,甚至有减少的趋势。正极材料市场占比如图1[1]所示。由图1 可知,随着磷酸铁锂正极材料市场占比不断增加,未来磷酸铁锂电池将迎来重要的发展机遇。
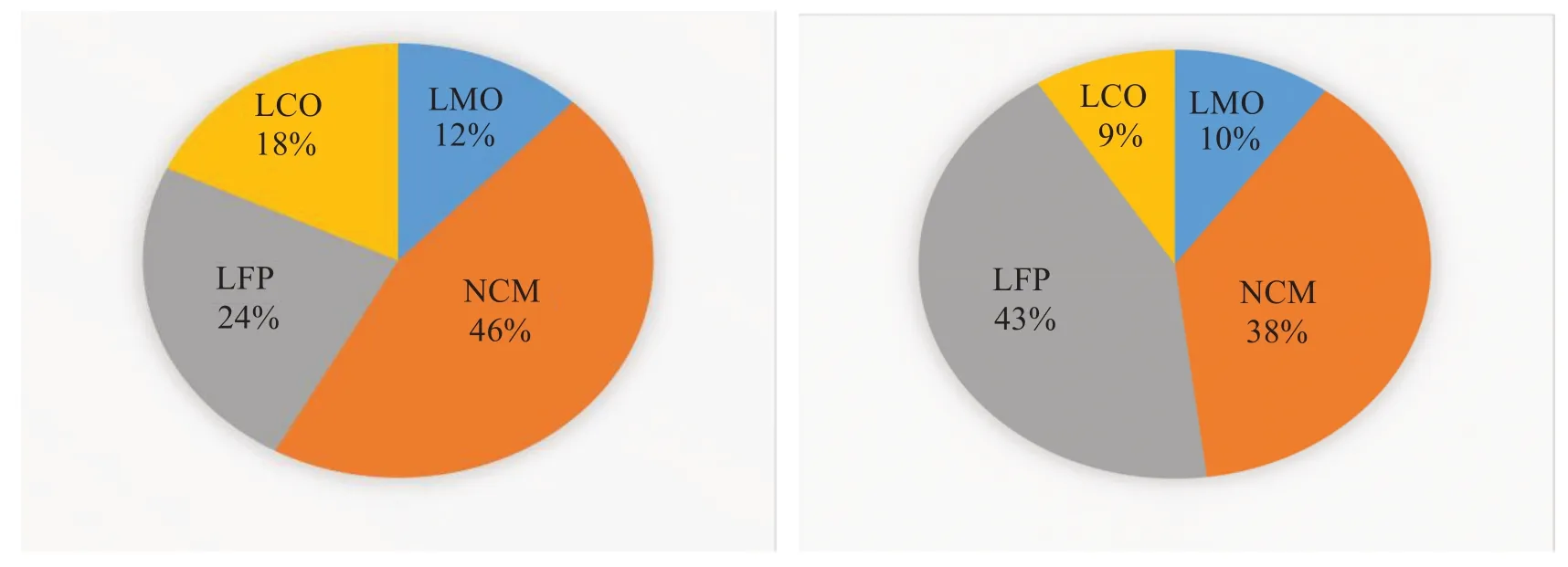
图1 2020年(左)—2021年(右)正极材料的市场份额[1]Fig.1 Market share of cathode materials, 2020 (left)—2021 (right)[1]
动力电池的组成主要有4 个关键材料:正极、负极、隔膜、电解液[2]。磷酸铁锂和三元材料是最主要的动力电池正极体系。根据中银证券预测,在磷酸铁锂电池的成本组成中,正极、负极、隔膜、电解液的占比分别为 40%、10%、8%、20%,在 811 三元电池中,占比分别为 57%、7%、4%、13%,如图2 所示[3]。由图2可见,无论是磷酸铁锂电池,还是三元电池,正极材料成本占比均最高,是动力电池的核心材料。
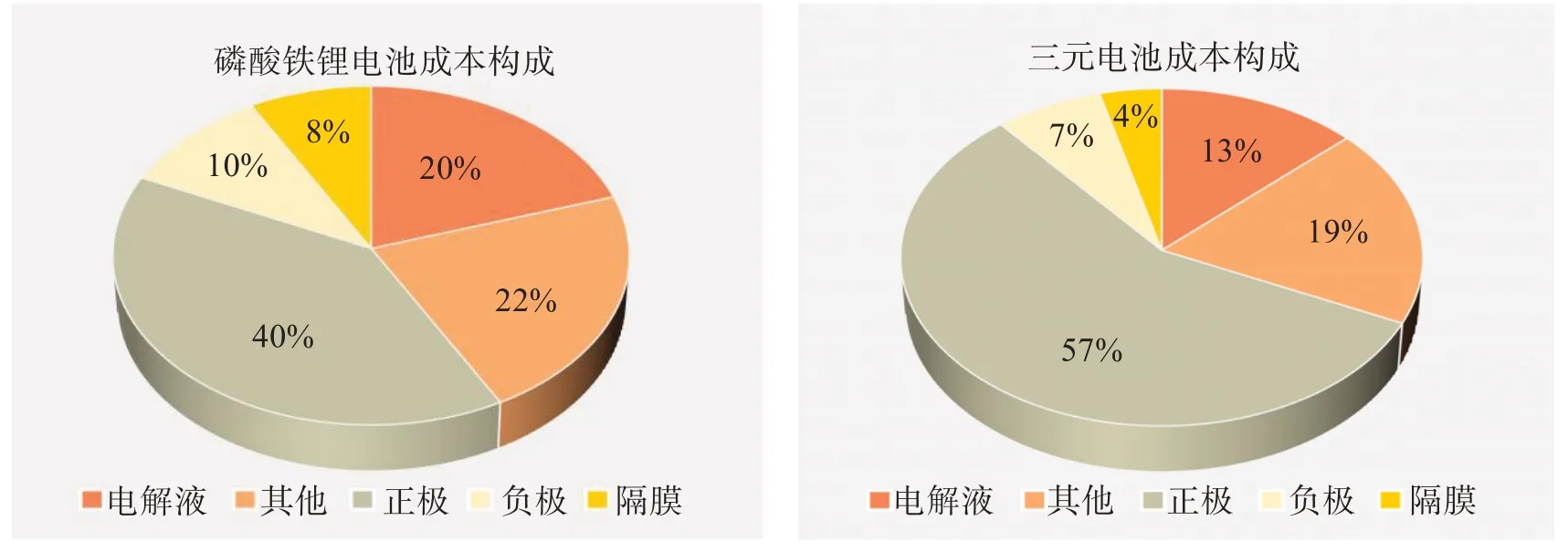
图2 动力锂离子电池的成本组成[3]Fig.2 Cost components of power lithium-ion batteries[3]
目前,在动力电池中常见的正极材料如表1[4-6]所列。
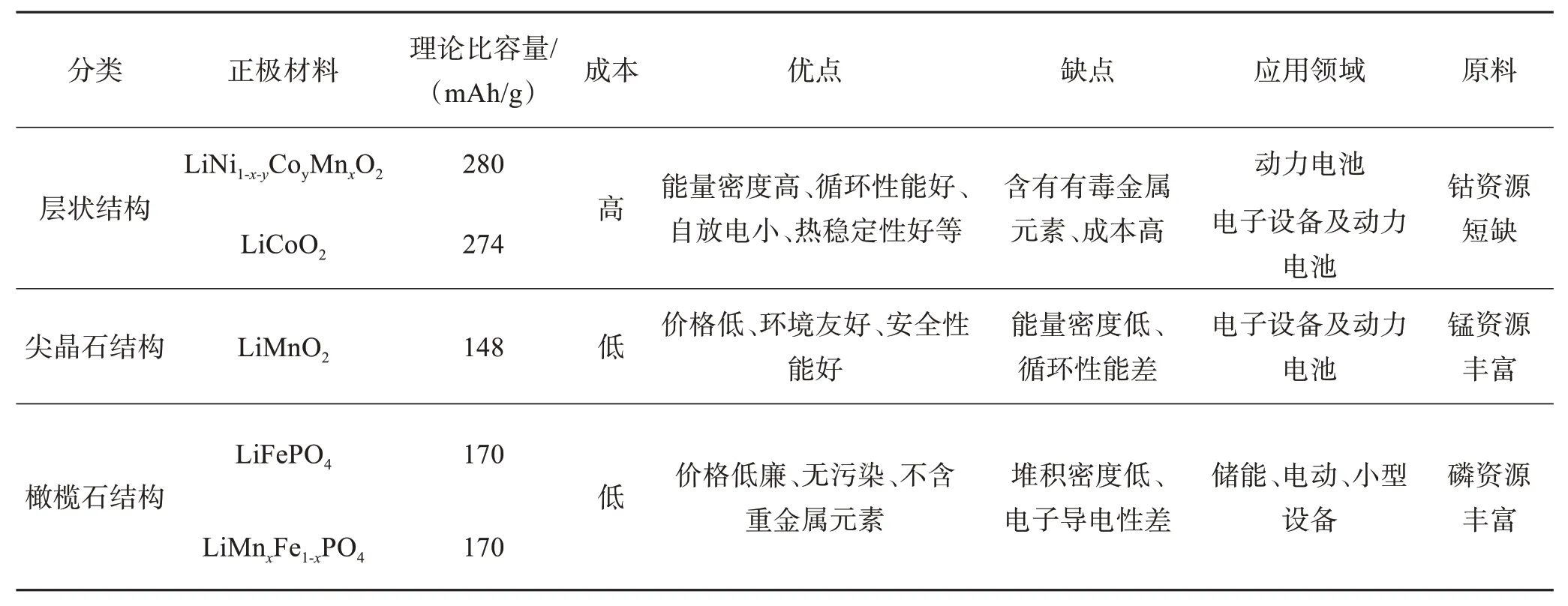
表1 动力电池中常见的正极材料[4-6]Table 1 Several cathode materials for power batteries[4-6]
发展锂离子电池可以有效缓解动力需求中不可再生能源的短缺问题,在未开发出可以取代二次电池的绿色环保新能源之前,锂离子电池仍会占据新能源电池的大部分份额。通常,动力锂离子电池的平均寿命为5~8年,预计到2029年全球将近有300万个退役新能源汽车动力电池[7]。随着动力电池退役期逐步到来,废旧电池回收管理体系的建立日益迫切。我国锂资源对外依赖程度高,本土矿产资源开采难度大,废旧锂离子电池回收立足于“城市矿山”、“绿色环保”的理念,使大量废旧锂离子电池“变废为宝”,实现资源循环利用,为锂电产业提供资源供给[8]。此外,作为丰富的有价金属矿藏,大量的Ni、Co、Mn、Al、Cu、Zn 等金属应用于锂离子电池的正极材料中[9]。我国钴资源匮乏,钴精矿储量极少,生产实践表明:每生产1 t 原生有色金属,平均需要开采70 t 矿石,而利用再生有色金属,能源节约85%~95%,生产成本降低50%~70%,综合考虑能源消耗和对环境的影响,废旧二次电池的资源化利用综合成本更低[10]。目前,从源头杜绝废旧电池污染,并实现废旧锂离子电池的清洁回收及循环再生,已成为影响全球能源战略格局的热点问题。
工作一定年限后的锂离子电池有2种处理办法:一是梯次利用,退役动力电池梯次利用流程如图3[11]所示,退役动力电池经过降级处理,成功应用于其他储能、通讯基站、低速动力等领域。进行梯次利用能够有效缓解回收压力、降低环境污染、提高经济效益;二是直接回收再生,常用方法是湿法回收的酸浸或碱浸,然后通过萃取或沉淀等方法对溶液中的有价金属元素进行提取或分离,最后重新合成新的电池应用于各个领域,从而实现了电池的循环利用。图4和图5所示分别是三元材料[12]和磷酸铁锂湿法[13]回收流程图。
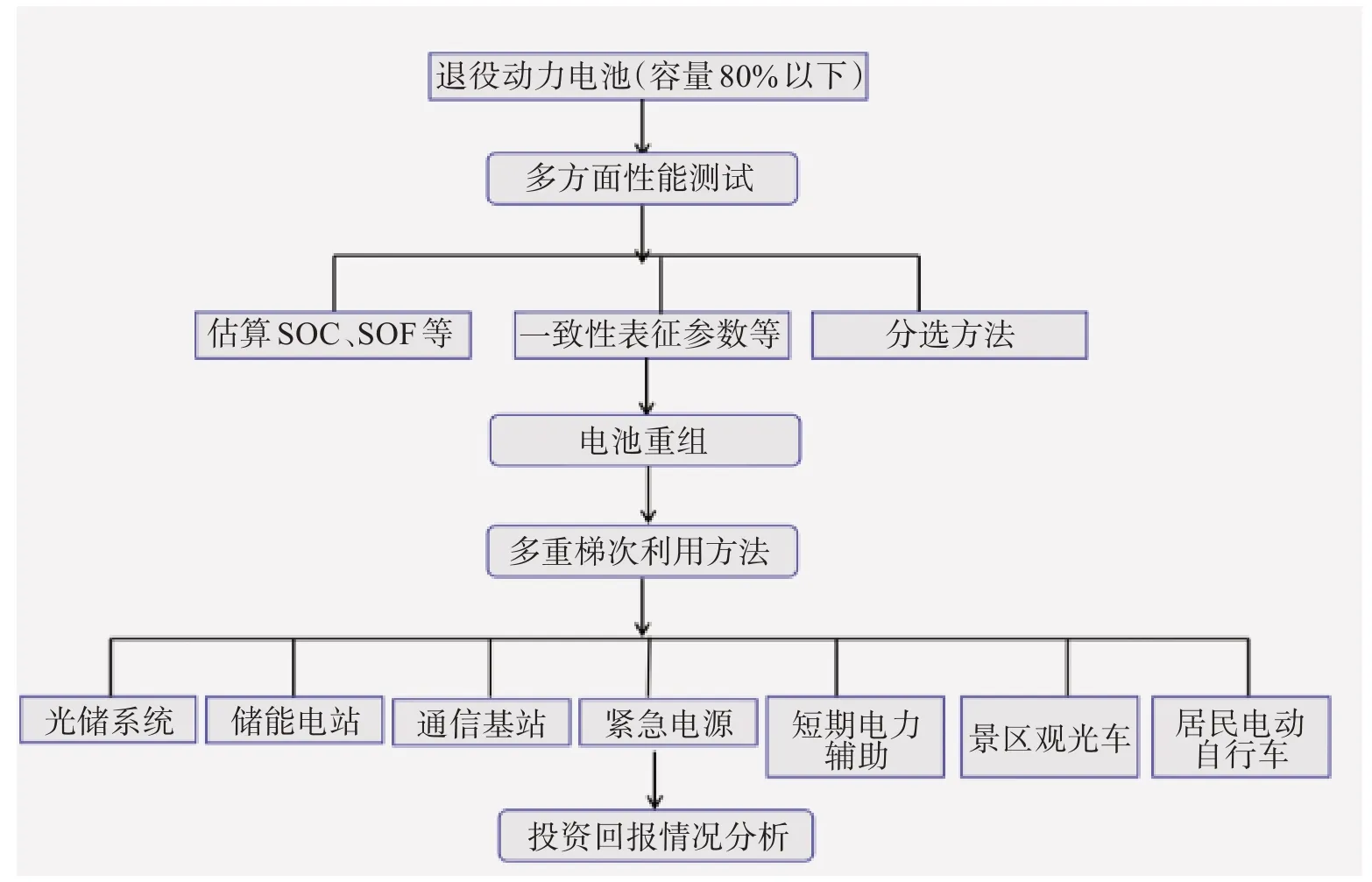
图3 退役动力电池梯次利用流程[11]Fig.3 Flow chart of echelon utilization of retired power battery [11]
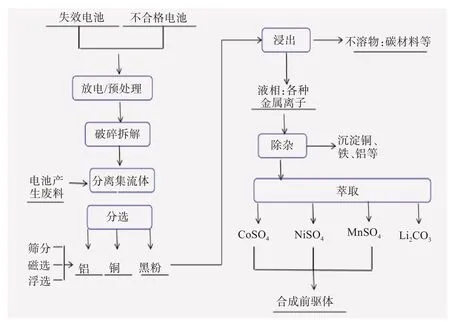
图4 三元电池湿法回收流程[12]Fig.4 Flow chart of hydrometallurgical recycling of ternary batteries[12]
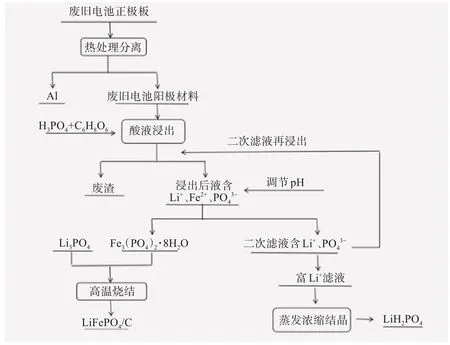
图5 磷酸铁锂电池湿法回收流程[13]Fig.5 Flow chart of hydrometallurgical recycling of lithium iron phosphate batteries[13]
由图4 和图5 可知,从三元体系和磷酸铁锂体系中分离有价金属元素,存在回收过程冗长、试剂投入量多、成本高等缺点。
因此,针对以多元体系为正极材料和以磷酸铁锂体系为正极材料的废旧电池,本文主要介绍溶剂萃取法、化学沉淀法等其他回收方法,并从经济性、环保性、效率性、操作复杂性等方面进行比较,总结废旧锂离子电池正极材料回收的技术路线。同时,展望未来废旧锂离子电池回收技术的发展走向,以期实现废旧锂离子电池资源利用最大化,使得这一行业向绿色环保和经济效益好的方向更好发展。
1 多元体系正极材料回收
我国钴镍资源短缺,资源分布不均匀,而钴酸锂、锰酸锂以及三元体系的正极材料中均含有Ni、Co、Mn重金属元素,因此,回收多元体系正极材料中的有价金属元素具有重大意义,不仅保护了环境,还减轻了资源压力。目前,多元体系正极材料中回收有价金属元素的方法有很多,普遍是将正极材料浸出,再以溶剂萃取法、化学沉淀法或电化学沉积法等方法获得Ni、Co、Mn有价金属元素。
1.1 溶剂萃取法回收Ni、Co、Mn
在多元体系正极材料中,溶剂萃取法具有选择性广、提取金属元素效率高等优点。研究者采用溶剂萃取法对Ni、Co、Mn进行提取分离,从而实现有价金属的富集。废旧锂离子电池回收时采用的萃取剂通常大致分为4 类:①中性萃取剂,如常见的磷酸三丁酯(TBP),通常叫改质剂;②酸性萃取剂,如二(2-乙基己基)磷酸(P204)、2-乙基己基膦酸单(2-乙基己基)酯(P507)、二(2,4,4-三甲基戊基)次磷酸(Cyanex272);③碱性萃取剂,如三辛胺(Alamine336/TOA)、三烷基胺(N325);④螯合萃取剂,如LiX63、Acorga M5640 等。溶剂萃取法具有方法简便、金属直收率高、能耗低、产品纯度高等优点,备受研究者青睐,但该方法存在萃取剂使用成本高、试剂易挥发、萃取不完全等缺点,所以要根据浸出液中金属元素的性质优选萃取剂,确定实验条件。
目前,应用于钴、镍、锰分离的萃取剂主要是磷类萃取剂,如P204、P507、Cyanex272。不同萃取剂的萃取效果不同,表2所列是常用萃取剂的主要介绍。
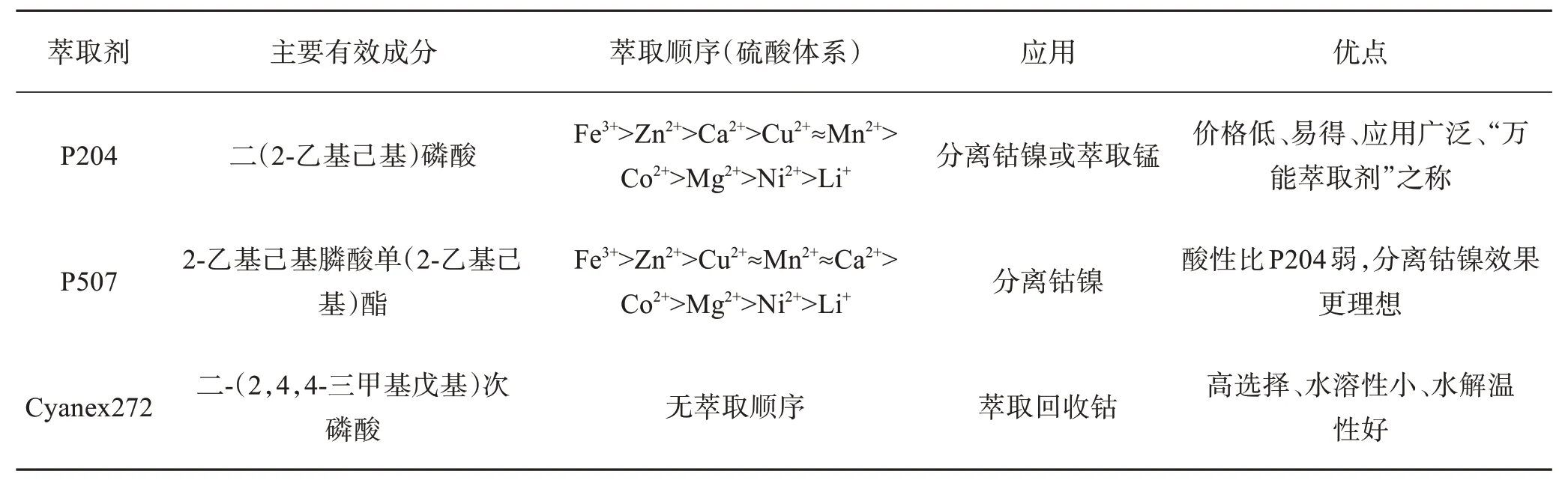
表2 常用萃取剂的主要介绍Table 2 Main introduction of commonly used extractants
由表2可知,P204和P507化学性质相似,萃取金属的范围相同,但萃取效果有一定的差异。图6和图7所示分别是在硫酸体系中不同pH 条件下P204 和P507对各金属离子的萃取率。
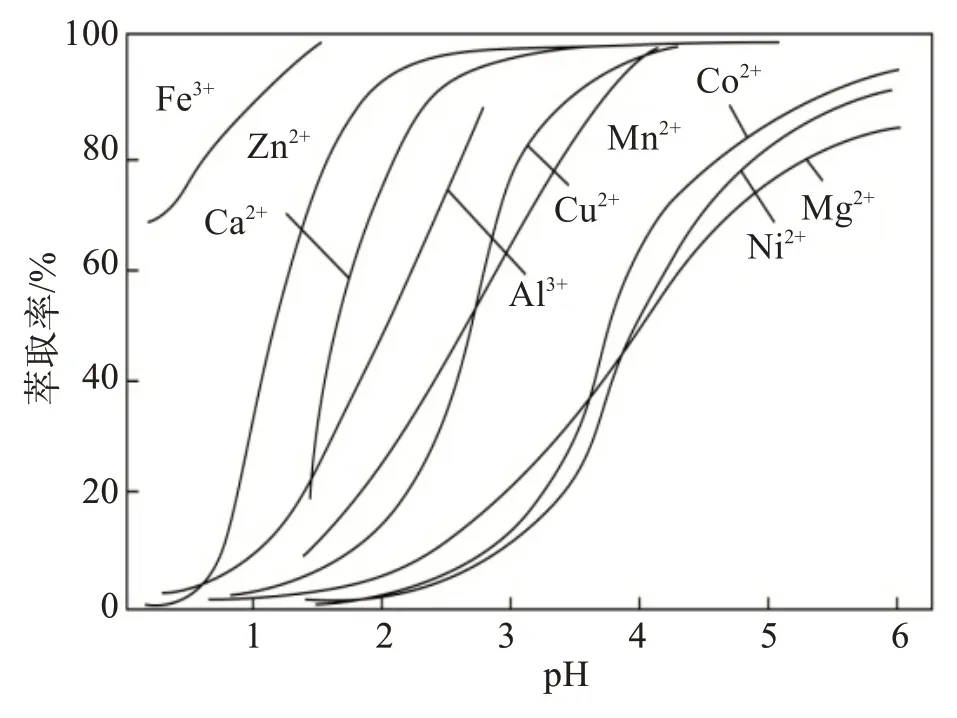
图6 不同pH条件下P204对各金属离子的萃取率[14]Fig.6 Extraction rate of each metal ion by P204 under different pH conditions[14]
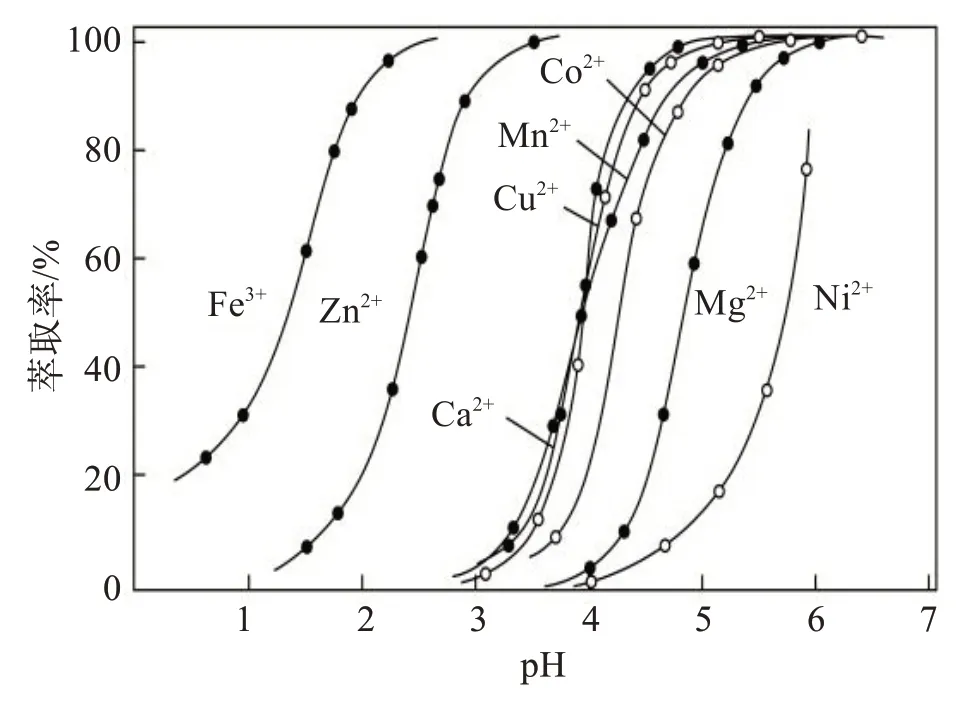
图7 不同pH条件下P507对各金属离子的萃取率[14]Fig.7 Extraction rate of each metal ion by P507 under different pH conditions[14]
对比P204 和P507 这两种萃取剂在不同pH 条件下萃取金属离子的效果,由图6可见,Mn与Ni、Co的曲线距离较大,所以P204 萃取分离Mn 的效果显著。图7 中Ni、Co 萃取曲线之间距离较大,故采用P507分离三元材料中的Ni、Co更为理想。
据报道,采用P204、P507、Cyanex272 萃取Ni 和Co 时,半萃取pH 差值分别为0.53、1.43 和1.93。这是因为萃取生成的Ni、Co 萃合物结构不相同, Co 的萃合物有四面体和八面体2 种结构,而Ni 的萃合物只有八面体一种结构,四面体萃合物的油性比八面体萃合物要强,所以优先萃取Co2+,易于Ni、Co分离。表3[15]总结了P204、P507、Cyanex272 三种试剂萃取钴镍的速度。由表3 可知,依次采用P204、P507、Cyanex272 萃取剂,Co2+的萃取速度总高于 Ni2+的萃取速度,并且Co2+、Ni2+的萃取速度均下降, 但 Ni2+的下降幅度更大。
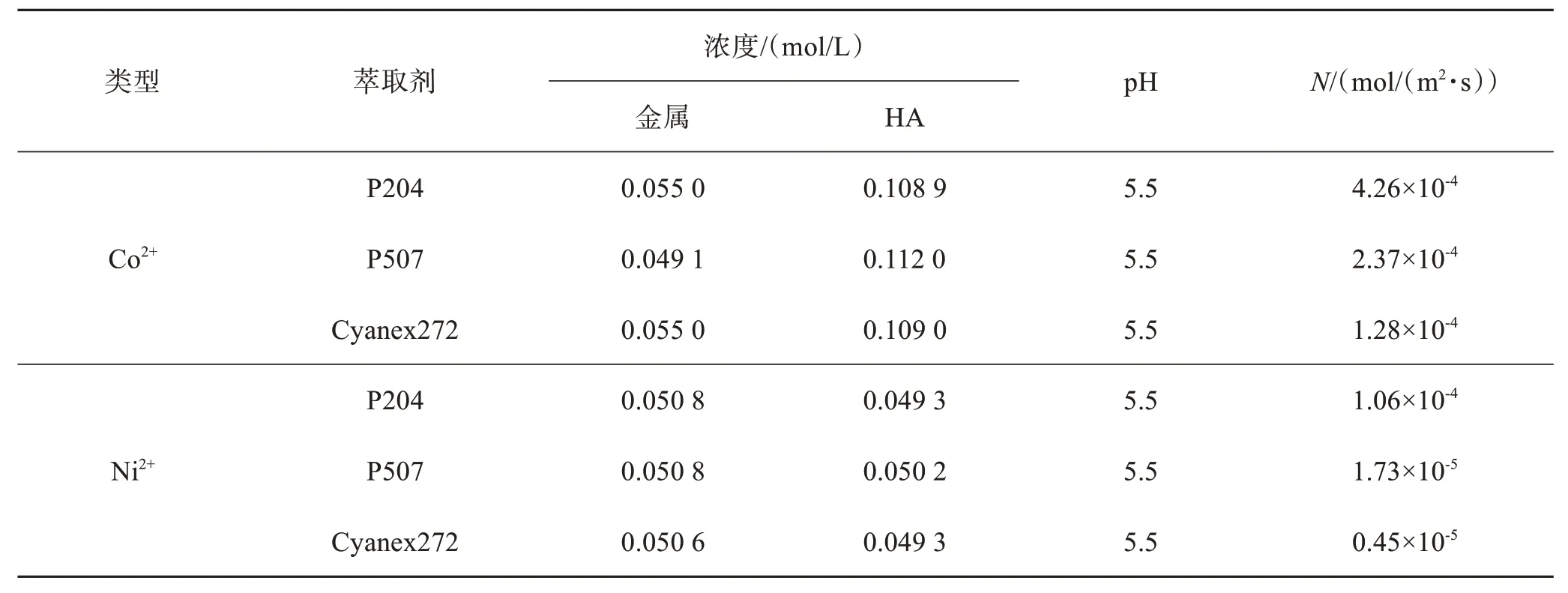
表3 不同萃取剂萃取Co、Ni的速度[15]Table 3 Extraction rate of Co and Ni by different extractants[15]
表4总结了采用萃取法回收Ni、Co或Mn的萃取效果及流程。
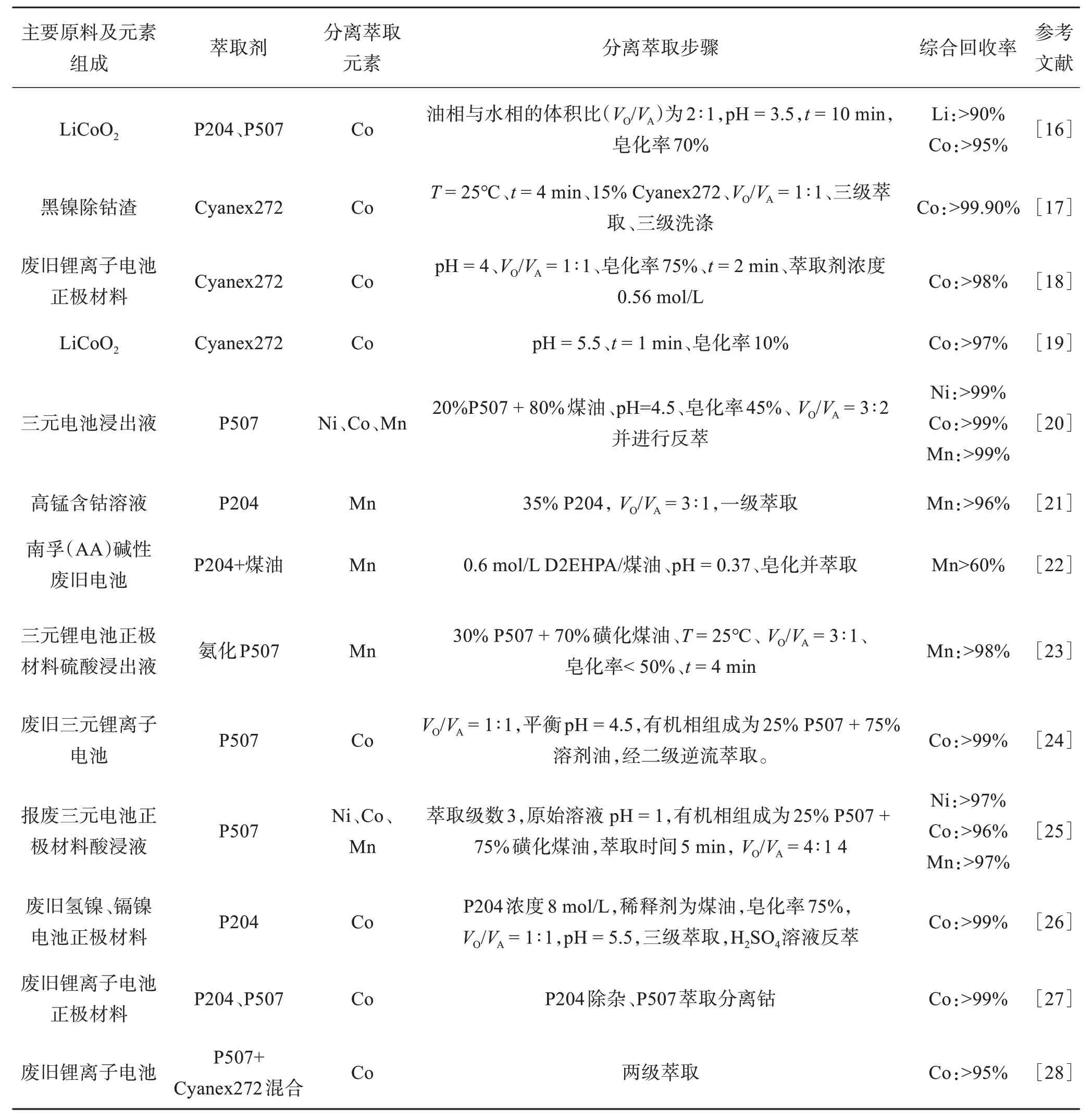
表4 萃取回收Ni、Co、MnTable 4 Recovery of Ni, Co, Mn by extraction
由表4 可知,对于多元体系正极材料,将已经过预处理、浸出、化学除杂后的电池废料,再通过溶剂萃取法等其他工序,将Ni、Co、Mn分离回收。溶剂萃取法回收Ni、Co、Mn 的效果好,回收率和产品纯度高,在工业生产中也会大量投入使用,但工艺步骤较为繁琐,萃取试剂成本高。未来应该将研究重心放在降低溶剂价格以及利用其他廉价溶剂代替当前应用的高价值溶剂方面[29]。
1.2 化学沉淀法回收Ni、Co、Mn
化学沉淀法是实验中常用的方法。对于回收废旧锂离子电池中的有价金属元素,一般将废料经过预处理之后,进行酸浸或者碱浸而获得金属离子溶液,通过加入化学试剂改变溶液的pH,目标金属离子以不溶于溶液的化合物形式沉淀下来,经抽滤、固液分离得到相应的金属沉淀化合物,从而达到金属分离的目的。常用的沉淀剂有酸性试剂(如草酸、高锰酸钾等)、碱性试剂(如氢氧化钠、碳酸钠、碳酸氢钠、氢氧化钙、氧化钙等)或有机沉淀剂。表5 总结了沉淀Ni、Co、Mn的沉淀剂以及相应的沉淀产物。
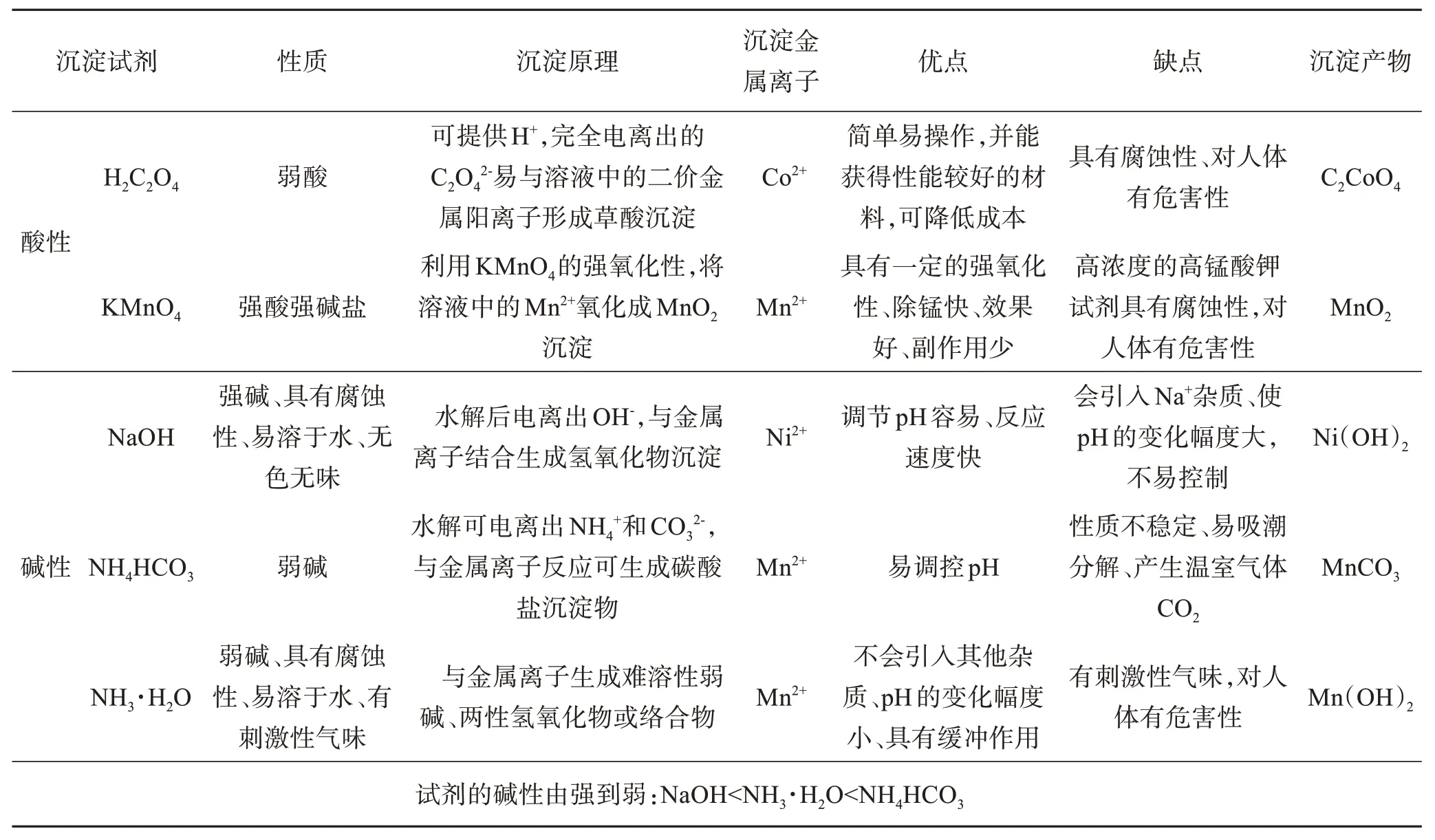
表5 沉淀Ni、Co、Mn的沉淀剂以及沉淀产物Table 5 Precipitat for precipitating nickel, cobalt and manganese and precipitated products
由表5 可知,回收Ni、Co、Mn 更倾向于使用碱性沉淀剂。石秋成等[30]采用分步沉淀法对报废三元锂离子电池中的金属离子进行回收,Mn2+采用NH3·H2O 沉淀,调节溶液的pH 至9,在碱性条件下,Ni2+、Co2+与NH3·H2O 反应生成络合物[Ni(NH3)6]2+、[Co(NH3)6]2+,而Mn2+可优先其他金属离子沉淀分离出来,生成Mn(OH)2,过滤后再加入Na2CO3将溶液pH 调至10,生成CoCO3和Co(OH)2沉淀,最后再加入NaOH 调节溶液pH 至11,生成Ni(OH)2沉淀,Ni2+、Co2+、Mn2+的回收率分别为98.28%、98.10%、98.32%。HUANG 等[31]从含有Mn、Fe、Li的浸出液中回收有价金属,采用离子液体浮选剂将Fe3+以沉淀的形式除去,再用HCl反溶回收得到FeCl3,再向溶液中添加饱和高锰酸钾溶液,Mn2+以氧化物的形式回收。郭丽萍等[32]在硫酸+双氧水体系中酸浸废旧锂离子电池中的LiCoO2,用氢氧化钠沉淀剂分离酸浸液中的Co2+和Li+,使得Co2+以Co(OH)2的形式沉淀下来,经过提纯后,在300 ℃的条件下进行煅烧,获得Co2O3,钴的回收率达到96%。
化学沉淀法操作流程短、工艺较简单、效果好,关键是选用合适的沉淀剂和沉淀条件提高回收镍钴锰等重金属的回收率[33]。
1.3 电化学沉积法回收Ni、Co、Mn
电化学沉积法的原理是利用电流通过电解质溶液施加的电压使得溶液在阴阳两极上发生氧化还原反应,电解液中的阳极区域发生氧化反应,将金属物质氧化分解为离子形式;电解液中的阴极区域发生还原反应,使得从阳极获得的金属离子在阴极还原的作用下得到金属单质,从而达到电沉积金属成分,获得需要回收的金属[34]。电流密度、电压、溶液pH和电解时间等参数是影响电沉积效果的主要因素。
电化学沉积技术多用于回收废旧电池中的Co。彭腾等[35]采用柠檬酸浸出-电化学沉积的方法回收废旧锂离子电池中的Co。用1.25 mol/L 有机柠檬酸、4.9 mol/L 过氧化氢,在T= 80℃、L/S= 8.5、t= 70 min的条件下,Co 的浸出率接近95%,并且在Co 的质量浓度为45 g/L 、T= 60~65 ℃、电流密度为435 A/m2、pH = 4 的电沉积条件下电沉积Co,电流效率大于90%,Co 的质量分数为99%。浸出过程采用的是有机弱酸-柠檬酸,不会引入其他杂质离子,也不会产生有害气体,比较环保,污染较小,通过对浸出液进行电沉积使得溶液中的Co2+以单质的形式回收,获得的样品纯度高,但需要进一步提高Co2+的回收率。FREITAS等[36]采用电化学技术沉积回收Co2+,设定合适的电压和电流密度,并调节pH至5左右,开始产生Co(OH)2沉淀,并且随着pH 增加,产生的Co(OH)2沉淀越多,Co2+的回收率达到了96%以上。
电化学沉积法具有成本低、产品纯度高、不易造成二次污染等优点,但对于还原电势较为相近的离子,如Co2+和Ni2+,采用电化学沉积法易产生共沉淀的现象,所以尽可能采用其他方法先将两者分离,再对其中一种离子进行电化学沉积。
2 磷酸铁锂体系正极材料回收
在近些年的新能源市场中,磷酸铁锂因具有循环性能优异、稳定性好、充电速度快等优点,市场占有率越来越高。锂资源在我国供应能力弱,对外依存度高,而磷酸铁锂体系的正极材料中含有大量的锂,所以通过处理回收废旧磷酸铁锂电池中的有价金属元素,将能有效缓解我国锂资源的供给约束,同时也可降低环境污染。目前,处理回收磷酸铁锂体系正极材料的主要方法为溶剂萃取法和化学沉淀法。
2.1 溶剂萃取法
磷酸铁锂体系正极材料回收所采用的溶剂萃取法多是对正极材料中的一些杂质金属进行除杂萃取。陈亮等[37]采用N902萃取剂萃取废旧锂离子电池中的Cu,N902作为酸性萃取剂,适于在酸性条件下对金属元素进行萃取,产生的H+有利于对Cu 的萃取。考察了水相pH、N902 萃取剂浓度对Cu 萃取率的影响。在有机相组成(体积分数)为10% N902 + 90%磺化煤油,调节水相料液pH = 1.25,油相水相体积比(VO/VA)为1∶1,一级萃取条件下,达到了分离除Cu的目的。朱萍等[38]的研究表明,N902萃取剂对Cu2+的萃取优于其他杂质金属离子。陈炎等[39]采用醛肟类萃取剂萃取废旧锂离子电池中的Cu2+,N902 和AD100 两种萃取剂分别分离萃取废锂离子电池浸出液中的铜,考察了初始pH、萃取剂浓度、VO/VA和萃取时间对铜回收率的影响。在初始pH = 3、萃取剂N902 和AD100 浓度分别为20%和25%、VO/VA= 1:1、萃取时间分别为6 min 和3 min 的条件下,对铜的一级萃取率分别为98.3%和97.1%。徐筱群等[40]采用P204萃取剂对废旧锂离子电池进行Al 除杂,在15% P204 + 80%磺化煤油+5% TBP,皂化率20%,萃取温度25 ℃,VO/VA=1∶1,萃取5 min条件下,控制pH=2.6,进行多次错流萃取,萃余液中的Al3+含量可降至0.4 mg/L以下。
其他萃取剂也可萃取回收废旧磷酸铁锂电池中的锂金属。赵天瑜等[41]将废旧锂离子电池浸出液视为特殊的“盐湖卤水”,以磷酸三丁酯(TBP)为萃取剂,探索较优萃取条件,结合理论分析,成功地采用盐湖提锂中常用的萃取法回收99%以上的锂。王艺博[42]以TBP 为萃取剂回收废旧磷酸铁锂电池中的Li,采用模拟的方法研究氯离子供给剂、Fe3+与Li+的摩尔比、Cl-浓度对萃取效果影响,并得出在Fe3+与Li+的摩尔比为1.5, Cl-浓度为5 mol/L, Li+浓度达到1 mol/L时,对Li+的萃取率达到了99%。经实验验证,在HCl + H2O2的酸浸体系中Li+的二级萃取率可达90%以上。
2.2 化学沉淀法
化学沉淀法一般常见于沉淀分离Li 和Fe,使用NaOH、H3PO4、NH3·H2O、H2S 等沉淀剂。Fe3+以Fe(OH)3、FePO4和FeS 的形式沉淀下来,Fe(OH)3经过煅烧后热分解生成Fe2O3,而沉淀生成的FePO4既可作为再生磷酸铁锂电池的前驱体,又可直接作为锂电池的正极材料,所以回收铁的沉淀剂中含有PO43-是常用的沉淀方法之一。对于从废旧锂离子电池中回收Fe,现在应用较多的方法是水热-化学沉淀法,以溶液作为物质合成的反应体系,加入适量沉淀剂,然后置于密闭的高压反应釜中,在适当的温度下反应一定的时间,即可获得相应的磷酸铁样品。一般的化学沉淀法要求原料具有相似的水解或沉淀条件,限制了原料的选择。通过水热-化学沉淀法获得的产品纯度高、合成的物质颗粒细小、具有良好的均匀性。
赵曼[43]以磷铁、H3PO4、HNO3为原料,采用水热-化学沉淀法在高压釜中一步合成电池级磷酸铁,并设计正交实验优化实验条件:硝酸浓度为3 mol/L、反应温度为110 ℃、反应时间为2 h、体系铁浓度为20 g/L。此方法制备的磷酸铁产品的纯度、结构等均符合电池级磷酸铁行业标准。
Li+以Li2CO3或Li3PO4的形式沉淀,Li+常用的沉淀剂有Na2CO3、Na3PO4、NaF 等。由Li2CO3溶解度的曲线见图8[44]可知,Li2CO3的溶解度随着温度升高而降低,故使用碳酸盐沉锂时需要在高温的条件下进行,更有利于Li2CO3析出。
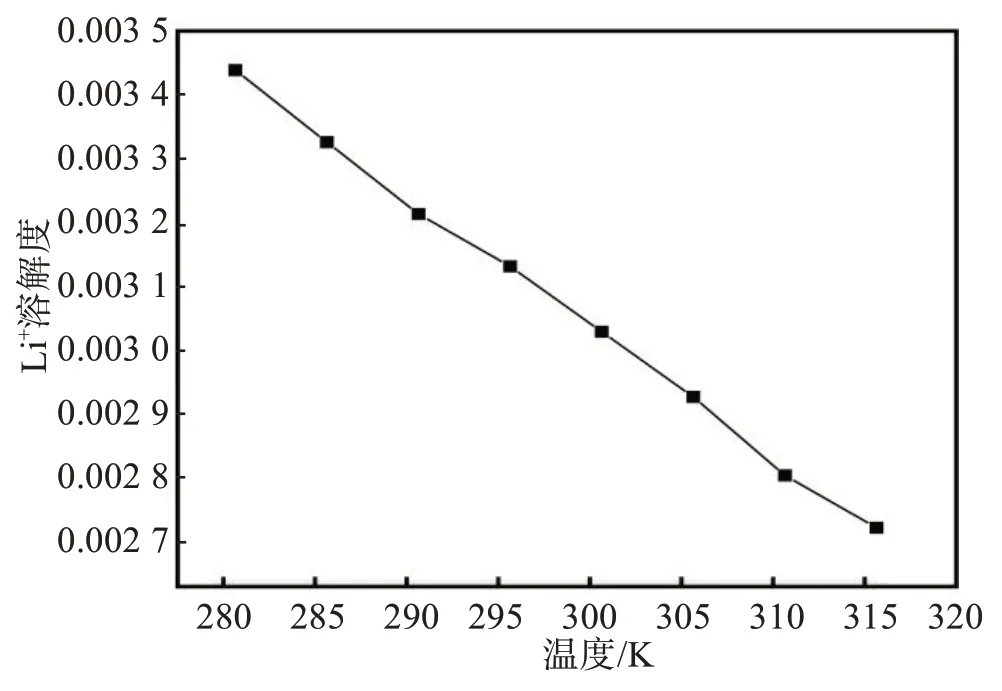
图8 Li2CO3在水溶液中的溶解度[44]Fig.8 Solubility of Li2CO3 in aqueous solution[44]
韩小云等[45]采用酸浸-沉淀法回收废旧磷酸铁锂电池中的锂,经NaOH 对溶液中的铁进行完全沉淀后,再用NaOH 将溶液调至pH 约为8,过滤杂质,加入饱和Na2CO3,Na2CO3的用量在80 g/L 时,Li+的沉淀率达到了98%以上。王百年等[46]以废旧锂离子电池的正极材料为原料,采用HNO3作为浸出剂,通过单因素实验以及正交实验获得了较优浸出条件,并用饱和Na2CO3对溶液中的Li+进行沉淀,Li2CO3的纯度均达到96%以上,符合电池行业标准。以上均是加入碱性试剂Na2CO3,会引入大量的Na+杂质。
LI 等[47]将含有Li+的溶液在高温95 ℃的条件下加入饱和Na2CO3进行回收,同时借助CO2促进化学反应的正向进行,获得高纯度的Li2CO3产品。Na3PO4对金属Li+沉淀的效果优于Na2CO3。伍德佑等[48]以Na3PO4为沉淀剂,研究了Na3PO4加入量、反应温度、Li+浓度、Na3PO4浓度、反应时间和初始pH 等因素对Li3PO4沉淀率的影响。由于Li3PO4的溶解度随着温度升高而逐渐减小,并且高Li+浓度下沉淀Li3PO4和低Li+浓度下沉淀Li3PO4的pH 有差异,实验结果表明:Na3PO4加入量为理论量的110%、反应温度为95 ℃、Na3PO4含量为100 g/L、反应时间为30 min、初始pH ≥ 4的条件下,Li3PO4沉淀率大于98.00%。
因为PO43-在酸性的条件下易与溶液中的H+结合生成HPO42-或H2PO4-,导致溶液中的PO43-减少,进一步降低了Na3PO4的沉淀量,故在实验的过程中需要加入过量的PO43-。
伍德佑等[49]对比了Na2CO3、Na3PO4、NaF这3种沉淀剂对废旧锂离子中回收锂的效果,实验表明:Na2CO3、Na3PO4沉淀较优化工艺条件下锂的沉淀率分别为70.11%和98.70%;以NaF为沉淀剂时, NaF加入量是主要影响因素。3种沉淀剂沉淀出的锂盐纯度均较高,结晶度好,形貌不同,在各自较优的条件下沉淀锂的效果由强到弱依次是Na3PO4> NaF > Na2CO3。
除了常规的沉淀剂沉淀回收金属化合物以外,还有一些其他方法回收浸出液中的金属离子。蔡云婷等[50]采用置换的方法对浸出液中的Cu2+进行去除,研究温度、pH、锌粉用量、反应时间等因素对Cu2+去除率的影响,使浸出液中的有价金属Cu2+以金属单质的形式进行回收,在置换的过程中,pH和反应温度对Cu2+的去除率有较大影响,在pH = 5、温度为70 ℃、反应时间为30 min、锌粉用量为理论量的条件下,Cu2+的去除率可达99.00%。
3 总结与展望
对溶剂萃取法、化学沉淀法和电化学沉积法[51]应用于废旧锂离子电池正极材料的回收时的优缺点进行总结,如表6 所列,考虑到回收过程操作的复杂性、成本及环保等问题,分离步骤多采用溶剂萃取法和化学沉淀法。

表6 3种分离回收有价金属元素的方法对比Table 6 Comparison of three methods for separation and recovery of valuable metal elements
此外,废旧锂离子电池材料的回收与利用研究多是关于对正极材料的探索,忽略了对负极以及电解液中物质的处理,不能完全对锂离子电池进行回收利用。选取价格低且高效的萃取剂,并探究多种萃取剂协同萃取提高有价金属元素的回收率已经成为目前研究的热点。对于化学沉淀法,现阶段的问题是所获得的产品纯度不高,不能有效地控制离子的沉淀顺序,在此方面需要加大力度进行研究。在回收的过程中易产生大量的废液和废渣,所以在实验的过程中应尽量实现资源的最大化利用,减少污染,努力实现研究方法的工业应用。回收废旧锂离子电池技术研究应朝着环保、绿色、高效率、低耗资、回收有价金属种类多、高产能的方向发展。
