多元醇法制备超细铜粉研究进展
2024-01-06何君鹏徐一特李晓凯王柯柯曹磊熊仕显
何君鹏, 徐一特, 李晓凯, 王柯柯, 曹磊, 熊仕显
(江西理工大学国际创新研究院,南昌 330000)
超细铜粉是一种具有活性高、比表面积大、导电性好等特点的金属材料,可作为高效催化剂、润滑油添加剂、导电材料、电极材料,广泛应用于化工、轻工、电子等领域[1-4]。有研究表明,纳米铜粉对治疗骨质疏松、骨折等效果明显[5]。随着近些年电子行业的迅猛发展,电化学性能优异、生产成本较低的导电铜浆备受青睐。为满足行业发展需要,制备符合工艺要求的纯度高、分散性好、球形度高、粒径均一、抗氧化性好的铜粉,成为超细粉体材料领域的研究热点[6-9]。
超细铜粉的制备方法可分为固相法、气相法和液相法[10-11]。固相法主要有高能球磨法和机械化学法,固相法工艺简单,产量大,效率高,但铜粉性能难以保证,纯度低,形貌粒径不可控。气相法有气相蒸发法、等离子体法、γ射线法等,其制备的铜粉纯度高,性能好,但是对设备要求高,工艺复杂,难以实现批量生产。液相法主要包括液相还原法、化学沉淀法、微乳液法、多元醇法等,是工业上制备高性能超细铜粉的常用方法,能够通过将晶粒的形核与长大过程分开进行来控制晶体的形貌粒径。液相法具有产品性能好、工艺简单、生产成本低、可实现批量生产等优点;但以水合肼为代表的无机还原剂制备工艺因毒性大、后处理难等原因制约了其工业化的生产[11-13]。
多元醇法以多元醇同时作为溶剂和还原剂制备超细铜粉,含碳链结构的多元醇还充当表面活性剂,具有一定分散作用。多元醇工艺是一种非常有趣的制备方法,液态有机醇既作为固体前驱体的溶剂,又是反应还原剂 ,还发挥分散作用,迅速吸引了金属粉体行业人员的关注。同时多元醇法兼具液相法的制备优点,能够通过改变实验条件来控制反应过程,实现对超细铜粉形貌、粒径的可控制备。另外,得益于多元醇自身独特的理化性质(高沸点、高黏性、低介电系数、无毒无害),使得该方法的制备工艺和生产设备简单,废物毒性小,产品质量好,易于实现规模化,工业生产潜力大。本文主要介绍乙二醇、丙三醇(甘油)等多元醇制备超细铜粉的研究进展,讨论了可能存在的反应机理,探讨了各个因素对反应的影响,着重介绍了NaOH 与多元醇发挥的重要作用,最后对多元醇法合成超细铜粉作出总结并对今后的研究方向与发展趋势进行展望。
1 多元醇法简介及反应机理
多元醇法一般是指多元醇为反应溶剂和还原剂,在一定温度(一般不高于醇沸点)下进行还原前驱体化合物制备金属颗粒的方法[14-15]。该方法最早被提出于20 世纪80 年代,经过30 多年的发展优化,多元醇法已成为制备金属纳米颗粒的重要手段,常用于贵金属、铁磁性金属、过渡金属和半金属的制备[16]。在多元醇法中,多元醇一般是指一类以乙二醇为代表的二元醇有机物,主要包括乙二醇、丙二醇、丁二醇、戊二醇、二乙二醇、四乙二醇及其同分异构体,同时也包含两个羟基以上的有机物,如甘油、季戊四醇等。
多元醇具有独特的理化性质(参数见表1[17]),如具有较强的极性和优异的溶解性,可以溶解大多数金属盐和常见的碱,因而可作为反应溶剂;沸点高,能够不使用高压釜在328 ℃下进行常压反应,这是其他工艺难以实现的;黏度高(甘油黏度(η)高达934 mPa·s),介电常数低(四甘醇的介电常数仅为水的1/4),有助于降低颗粒间的团聚。多羟基的存在赋予其一定的还原和配位能力,能够用于还原高价前驱体并得到稳定的配合物中间体;同时多元醇分子吸附到金属表面,碳链结构能够发挥空间位阻效应,调控晶体形貌和降低粒子间的相互作用力,有效降低团聚程度。
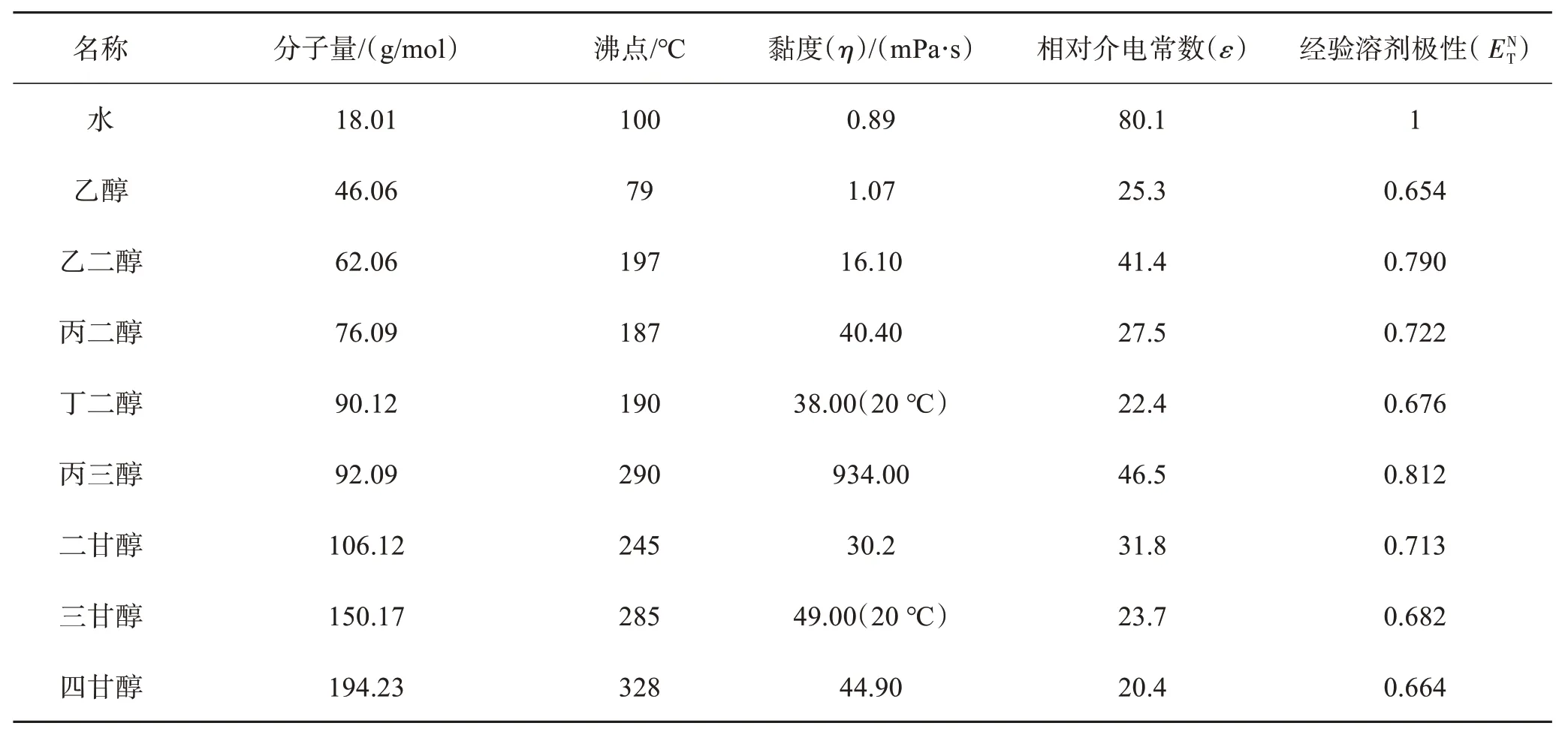
表1 水、乙醇及各种多元醇的物理性质参数[17]Table 1 Physical parameters of water, ethanol and various polyols[17]
总的来说,多元醇凭借其独特的性质在金属颗粒合成过程中展现出明显的优势:①高沸点属性允许反应能在较高温度下进行且不需要借助其他高压设备,高温能保证金属具有良好的晶型;②还原剂作为反应介质能提供还原性氛围,保护金属粒子能在不通入保护气体下稳定形成,不被氧化;③醇分子可作为封盖剂,吸附并包裹粒子,防止其团聚并调控颗粒形貌;④高黏度特性降低粒子的接触,保证单晶稳定生长,这有利于晶体结构与形态的控制。
国内关于多元醇法制备超细粉体的研究较少,其中以乙二醇研究最多。多元醇法的制备工艺和实验参数已进行初步探讨,反应机制机理还需深入研究。 SUN 等[18]以CuSO4作为铜源,在强碱NaOH 的作用下,通过乙二醇加热还原制备超细铜粉,并以此对乙二醇法的反应历程、实验机理、反应中间体进行了详细的阐述。具体反应如下:
实验过程中伴随着明显的颜色变化(蓝紫色-绿色-黄色-红褐色,出现红褐色沉淀即为反应终点)。实验结果证实反应过程中存在中间体[Cu(OCH2CH2O)2]2-和Cu2O。大致反应历程可概括为:首先Cu2+与过量的NaOH 反应先后生成Cu(OH)2沉淀和四羟基合铜酸盐的前驱体[Cu(OH)4]2-,见式(1)和式(2);乙二醇在NaOH 的作用下被氧化成还原性更强的醛类有机物,见式(3),最终变成双乙酰化合物。随后,前驱体[Cu(OH)4]2-与乙二醇高温下反应后并分解,依次得到中间相有机铜盐[Cu(OCH2CH2O)2]2-和立方体Cu2O,最终 Cu2O 经CH3CHO 的彻底还原合成出单质Cu 颗粒,见式(4)—式(6)。该研究系统地阐述了整个反应过程,提出了有机铜盐[Cu(OCH2CH2O)2]2-和Cu2O 2 种中间体,是目前普遍认同的反应机理,也为多元醇法后续研究提供重要参考。甘油法的反应机理与之类似,迟聪聪等[19]在研究甘油/水二元溶剂体系制备抗氧化性纳米铜过程中提出了先络合再还原的反应历程,并指出反应过程中存在[Cu(OH)4]2-与甘油铜两种中间体(如图1 所示[19])。类似的,在NaOH 提供的碱性环境中,Cu2+先后转变成Cu(OH)2胶体和[Cu(OH)4]2-,而甘油通过自水解反应产生O2-与[Cu(OH)4]2-发生自由基聚合反应得到中间体甘油铜。甘油是具有强配位能力的双齿配体,能与铜离子配位形成一种稳定的配合物甘油铜。甘油铜中的有机端体积占比大,能提供一定空间位阻,有利于颗粒的分散,这是甘油法制备的纳米铜在不添加表面活性剂下仍能保持较好分散性的原因之一。

图1 甘油铜的形成过程[19]Fig.1 Formation process of intermediate copper glycerin[19]
为进一步探究中间体配合物形态结构的建立过程,CARROLL 等[20]对多元醇在碱性条件下的反应机理进行研究,通过对比分析实验数据与建模计算结果,提出铜盐溶解在乙二醇内会结合2个乙二醇分子形成铜乙醇酸盐中间产物,在回流和蒸馏条件下均能得到单质铜。他们通过将乙二醇分子与金属铜结合,并监测与形成的配合物相关的增量结合能(IBE,通常,IBE 越大结构越稳定)。从图2 显示的球棍模型和IBE 计算数据来看,结合3 个乙二醇分子的五配位结构由于IBE 值小,几乎可以忽略不计,此结构难以稳定存在;而结合2 个乙二醇分子结构的IBE 值高,更加稳定,反应中间体铜络合物更加倾向于结合2 个乙二醇分子,证实了中间体[Cu (OCH2CH2O)2]2-双配位结构的稳定存在。该工作最主要是给出了反应配合物稳定常数的热力学数据,为配合物溶液的热力学行为研究提供有力支撑。OREL 等[21]用乙二醇和四甘醇还原乙酸铜制备超细铜粉,实验过程中观测到Cu2O 中间体,并对Cu2O 生成单质Cu 颗粒的转化机理展开研究。他们否定了FIEVET 等[22]提出的Cu2O 先溶解再结晶的还原机制。实验结果表明单质铜颗粒是在Cu2O 内部均匀地生成,可以理解为Cu2O 被原位还原为单质铜,这一过程与电子在组成亚基之间的迁移有关。同时高沸点的多元醇还原制备的金属铜结晶度更高,且高结晶度的铜单质往往更加稳定,抗氧化能力强。

图2 第一性原理建模计算出反应中间体的最优几何构型和以千卡/摩尔为单位的增量结合能(IBEs)[20]Fig.2 The optimal geometry of the reaction intermediate and the incremental binding energy (IBEs) in kcal/mole were calculated by first-principles modeling[20]
以上研究工作表明,多元醇还原法主要是醇分子在高温和碱性条件下被氧化成醛,还原能力得到增强;同时Cu2+先发生络合再被还原,依次得到Cu2O和Cu。整个过程有明显的反应顺序,这与反应液颜色变化相对应;而每个阶段的中间产物比较稳定,保证了实验具有较好的重现性和产品性能的高稳定性。可以确定是,多元醇过程包括金属前驱体的溶解 、金属离子的络合、Cu2O的形成与溶解、Cu晶体的形成与生长等几个基本步骤。这一过程中金属离子与多元醇的配位提升了金属离子的溶解度,而中间相Cu2O 则多作为Cu2+的储备方,控制溶液中Cu2+浓度,在反应机理中发挥着动力学作用。此外,反应中生成的纳米铜被证明会发挥金属催化剂作用,用于促进多元醇的氧化。研究人员似乎对多元醇的氧化过程兴趣不足,开展的研究较少,而对氧化产物的深入研究与分析或许能开发出更有价值的信息。
2 影响因素
2.1 强碱的影响
相较于水合肼、次亚磷酸钠等中强无机还原剂,多元醇的弱还原性导致反应速率慢、时间长、产物纯度低等问题,难以满足超细铜粉的工业化生产要求。提升多元醇还原能力、加快反应速率常用的2种方法是提高反应pH 和升高反应温度。升高温度能够克服多元醇与金属之间的能量屏障,增大分子能量,加快反应速率。但反应温度的升高不仅增大了能源消耗,也受多元醇沸点温度的限制;同时过高的温度导致反应设备要求高和增加合成工艺的复杂性[23]。
目前,研究人员通常选择加入强碱提升体系的反应pH,增加多元醇的还原性,实现较低温下合成超细铜粉。一般地,对于氧化还原反应,电对的电极电势越高,其氧化型的氧化性越强;电对的电极电势越低,其还原型的还原性越强。依据能斯特方程,见式(7),反应液pH 的增加能够有效降低氢电位,从而降低还原电对的电极电势,增强还原型多元醇的还原能力,提升总反应的还原程度[24]。
式(7)中:F、R和T均为常数;φ为电对的电极电势;φθ为电对的标准电极电势;Ox为电对中的高价态氧化型物种;Red为低价态还原型物种;a为活度;n为电子转移数。
KAWASAKI 等[25]指出高反应温度和加入NaOH是多元醇法还原制备纳米铜的必要条件;在没有NaOH的情况下,即使将温度升高至185 °C也难以形成单质铜。这归因于在多元醇体系下加入一定浓度的NaOH有利于[Cu(OH)4]2-和[Cu(OCH2CH2O)2]2-的生成,改变反应历程,极大地提高反应速度;同时在NaOH 的作用下,乙二醇在高温下被氧化成还原性醛,增加体系还原能力。CHOKRATANASOMBAT等[26]通过实验证明,当不加入NaOH 时,选用甘油在相对较低温度(140 ℃)下还原反应超过20 h 仍无法得到纯净的单质铜。王显鸿等[27]研究发现,以甘油作为还原剂、不添加NaOH 的条件下制备超细铜粉,温度必须控制在202 ℃以上才能得到纯铜粉;而温度低于140 ℃时,还原反应将无法进行。李文娟[28]从能量的角度展开讨论,经过实验测试与理论分析,提出铜离子在NaOH的作用下得到的甘油铜中间体,能够使反应体系的活化能降低,从而提高还原反应速率,缩短总反应时间。
总而言之,向体系中加入NaOH这一类强碱能够提升多元醇的还原能力,是减少反应时间和提高产物纯度的有效手段。相较于升高反应温度,直接引入NaOH 更加简单高效、安全可靠,同时能够提高生产效率,保障铜粉品质,这是实现工业化生产的前提。
2.2 铜离子浓度的影响
多元醇法兼具液相法合成的优点,就是可以通过调节实验条件控制粒子的形成过程,实现晶粒成核与生长分开进行。粒子的生成与长大过程是调控形貌与粒径的关键环节,溶质浓度是影响晶粒形成和生长的重要因素。
依据冯·韦曼提出Weimarn 理论,晶核的形成速度(v1)可表示为:
式(8)中:K1为比例系数;S为晶体的溶解度;C为溶质离子总浓度;C-S为溶质的过饱和浓度。晶核的形成速度与晶体的溶解度和过饱和浓度有关。
晶体的生长速度(v2)表示为:
式(9)中:D为溶质分子扩散系数;K2为比例系数。升高反应温度可以加快溶液粒子的布朗运动,增大溶质分子的扩散速度,晶体生长速度快,有利于晶体长大,得到大尺寸粒子。
v1、v2与过C-S均成正比关系,但由于沉淀物的S往往很小,导致C-S对形核速度的影响要大于生长速度,过饱和浓度越大越有利于形成晶核,也就是说增加溶质离子浓度或者降低沉淀溶解度更有利于形成小尺寸颗粒。
在反应初始阶段,增大溶质离子的总浓度,过饱和浓度升高,晶核形成速度加快,产生大量细小的晶核。HOSSEINI 等[29]指出铜颗粒的尺寸随Cu2+浓度的增大而减小至纳米颗粒,并且其各向异性不断增加,形貌更加不规则。TEICHERT等[30]发现一系列中间体醇盐化合物和Cu2O 的产生降低了反应溶液中Cu2+的浓度,导致在形核初期只产生少量的核,从而产生得到微米而不是纳米大小的铜颗粒。在碱性反应条件下,如加入NaOH,颗粒尺寸能够有效降低。强碱对形貌粒径的调控作用可归因于其对体系中铜离子浓度的影响。FIEVET 等[22]以乙二醇还原铜无机前驱体制备超细铜粉,并探究各实验因素对粒子形貌粒径的影响,认为铜颗粒形貌与尺寸主要通过调节NaOH 的浓度和铜与多元醇的摩尔比2 个参数来实现的。图3 显示了不同NaOH 浓度下制得铜粉的微观形貌,从中可以看出NaOH的加入能够显著减小粒子尺寸,并且随着碱量的增加,铜颗粒的平均尺寸不断减小,并通过实验证明了NaOH能增加前驱体(CuO)和中间体(Cu2O)的溶解度,进而增大反应液中铜离子的浓度。依据Weimarn 理论,对于溶解度(S)很小的沉淀物,过饱和浓度(C-S)的变化对于晶核形成过程影响更大。具体来说,碱量的增加会导致溶质铜离子浓度(C)增加,使得过饱和浓度加大,晶体形成速度加快,溶液中形成大量的晶核,最终导致铜粒子尺寸减小。NaOH 通改变铜离子浓度进而对铜粒子尺寸的调控机制在甘油法中同样适用。CHOKRATANASOMBA 等[26]在甘油体系中探究了Cu(NO3)2和NaOH 不同摩尔比对铜颗粒形貌粒径的影响 。图4 显示了不同铜/碱比例下制得铜粉的微观形貌,可以看出铜粒子的尺寸随着NaOH的增加而减小,从十微米减至数百纳米,但团聚程度也随着粒径的减小更加严重;同时颗粒球形度得到提升,由不规则块状转变为类球形纳米粒子。当Cu(NO3)2与NaOH 摩尔比为1∶3时效果最好,制得产品的纯度高、分散性好、尺寸约为320 nm的球形铜颗粒,如图4(d);但当摩尔比大于1∶3 时,粒子形貌无明显差异,均为类球形团聚体结构,NaOH对颗粒形貌的调控能力失效,见图4(e)与图4(f)。

图3 不同NaOH浓度下制备铜粉的扫描电镜像[22]:(a)不添加NaOH;(b) 0.01 mol/L NaOH;(c) 0.05 mol/L NaOH;(d) 0.10 mol/L NaOHFig.3 SEM images of copper powder prepared at different concentrations of NaOH[22]:(a) non NaOH; (b) 0.01 mol/L NaOH; (c) 0.05 mol/L NaOH; (d) 0.10 mol/L NaOH

图4 在NaOH:Cu(NO3)2不同摩尔比例下制得铜粉的扫描电镜像[26]:(a) 0∶1;(b) 1∶1;(c) 2∶1;(d) 3∶1;(e) 4∶1;(f) 5∶1Fig.4 SEM images of copper powder prepared at different molar ratios of NaOH∶ Cu(NO3)2[26]∶(a) 0∶1; (b) 1∶1; (c) 2∶1; (d) 3∶1; (e) 4∶1; (f) 5∶1
简单来说,粒子尺寸会随着铜离子浓度和碱量的增加而减小,而粒子尺寸越小越容易引发团聚。借助Weimarn 理论能够很好地解释铜离子浓度对铜微粒形貌与尺寸的调控作用。依据这一规律,研究者们可以通过不断改变铜离子浓度和铜碱的比例,选择性地制备不同尺寸的铜微粒,这对超细铜粉的生产与性能调控具有重要的指导作用。
2.3 多元醇的影响
多元醇与水都是极性溶剂(物理性质参数见表1),具有优良的溶解性,自身含有多个羟基使其具备一定的还原性,因此可以在还原反应中作为溶剂与还原剂。此外,多元醇独特的结构和理化性质还使其发挥封盖剂作用,与金属颗粒表面结合阻碍团聚与聚集,对粒子形貌和粒径进行调控。从大量文献结果来看,想要获得数纳米的单分散铜微晶需要借助其他分散剂来实现,例如聚乙烯吡咯烷酮、聚乙二醇等高分子聚合物。
水是造成微粒团聚的重要因素,非水溶剂能够很好地克服传统水溶剂中粒子因羟基、毛细管力与静电力等作用下造成的团聚问题[24]。多元醇作反应介质,与水溶剂体系不同,多元醇的低介电常数、较少的带电离子和较小的表面张力能够有效降低粒子间的各种吸附作用引起的软团聚;同时多元醇的高黏度特性和较大的黏滞阻力能降低溶质分子的布朗运动,减少粒子碰撞接触的概率,降低二次团聚的发生[31-32]。所以研究人员大多选择在多元醇为溶剂体系下进行还原,以增强粒子的稳定性和分散性[33-35]。
多元醇是具有多羟基结构的一类有机物。由之前探究的多元醇反应机理可知,在碱性环境下生成的铜络合物会与多元醇反应生成含碳链的有机铜化合物中间体(如甘油铜)。依据空间位阻效应,这类含碳链结构的中间体会提供一定的空间位阻,为微粒间的分散提供辅助作用,能在反应过程中减少团聚的发生[19]。
需要强调的是,反应初期形成大量尺寸小、表面能高、不稳定的微晶容易与多元醇末端羟基的孤对电子相结合,使得醇分子吸附在晶体表面,并将晶体粒子包裹隔离产生空间位阻避免其因毛细管力、范德华力以及更强的氢键作用和化学键作用导致的硬团聚[36-37]。这种吸附能会随醇链长度的增加而增加,也随着金属的亲氧性增强而增大。晶体表面吸附的多元醇分子能发挥封盖剂作用,控制晶体定向生长,从而形成不同的形貌。CARROLL 等[20]研究了不同链长的多元醇对铜粒子生长与形貌的影响。选用的多元醇还原剂由短链乙二醇、丙二醇、丁二醇到长链二甘醇、四甘醇,可分别合成球形、五边形、三角形、六边形、棒状等不同形貌的单一分散铜晶体(如图5 所示)。实验与理论计算证明,不同链长的多元醇通过改变反应体系中配体的交换速率和控制晶面的生长以影响纳米颗粒的形貌。具体来讲,具有碳链结构的多元醇吸附在粒子表面产生一定的空间位阻,有利于形成单一分散的晶体结构。同时这种空间效应会影响反应中配体的交换速率,导致晶体沿不同晶面的生长速度不同,实现晶粒的各向异性生长,最终获得不同形状的粒子。多元醇的链长越长,空间效应越强,配体交换速率越慢,导致粒子不同晶面的生长速度差异越大,晶体球形度越低,粒子由球形转变为长棒形。该工作将理论计算与实际结果结合,揭示多元醇对铜晶体形貌的调控机理与规律。依据实验规律,研究人员可以选择合适的多元醇对铜晶体的形貌进行自主设计与合成。此外,多元醇在一定程度上也能够提高高活性铜微粒的抗氧化温度。王显鸿等[27]指出在甘油体系中合成的铜粒子,其表面会包裹上一层有机薄膜,该有机薄膜能够阻止铜颗粒间的团聚同时提高其抗氧化性。

图5 不同种类多元醇制备的铜晶体扫描电镜像[20]:(a)乙二醇在回流条件下;(b)乙二醇在蒸馏条件下;(c)丙二醇在回流条件下;(d)丁二醇在回流条件下;(e)二甘醇在蒸馏条件下;(f)四甘醇在蒸馏条件下Fig.5 SEM images of copper crystals prepared by different polyols[20]: (a) ethylene glycol under reflux conditions;(b) ethylene glycol under distillation conditions; (c) propylene glycol under reflux conditions;(d) butanediol under reflux conditions; (e) diethylene glycol under distillation conditions; and(f) tetraethylene glycol under distillation conditions
综上,多元醇的分散作用主要概括为以下3点:
1) 多元醇作溶剂,弱化了水体系下粒子间静电力、毛细管力和氢键作用,降低了溶质分子的布朗运动,减少了粒子间碰撞接触的几率。
2) 含碳链结构的有机铜中间体自身存在一定的空间位阻,在反应过程中减少团聚。
3) 多元醇吸附在粒子表面形成空间位阻效应有效阻止其硬团聚,同时可以控制晶体沿不同晶面的生长速度,合成不同形状的铜粒子。
2.4 铜源的影响
铜化合物在多元醇体系中的溶解度与氧化能力的不同导致其被还原得到的铜颗粒存在一定的差异。SINHA 等[38]通过改变铜源的种类制备了不同结构的铜粉。以CuO 作为铜源合成出的铜晶体平均尺寸最小,形貌最差;由Cu(CH3COO)2作铜源可制备出多面体状铜晶体,且纯度高达99.7%。杨瑞卿[39]探究了CuCl2、CuSO4、Cu(CH3COO)2、Cu(OH)2、Cu(NO3)24 种铜盐对所制得纳米铜性质的影响。实验结果表明,CuCl2和CuSO4的氧化能力较弱,无法彻底还原,产物中分别检测出CuCl、Cu2O的存在。
虽然研究者已经发现了不同铜源被还原得到的结果不同,但是造成以上结果的原因还不清楚。结合其他相关文献结果表明,体系中的阴离子或许也发挥着重要作用。TEICHERT 等[30]对铜(II)盐在多元醇中的还原过程进行了系统的实验研究,实验发现乙二醇还原的过程很大程度上取决于溶液中存在的阴离子。单质Cu 只能从Cu(CH3COO)2、Cu(OH)2或Cu(NO3)2中获得高收率,而不是CuCl2或CuSO4。这可能与阴离子配体和Cu2+之间的配位亲和力有关。在乙二醇溶剂体系中,各阴离子与Cu2+的配位亲和力从高到低依次为:OH->CH3COO->Cl->NO3-/SO42-。选用Cu(CH3COO)2作为铜源往往能得到形貌和尺寸较好的纳米铜,这归因于阴离子CH3COO—的封盖作用,能够控制铜颗粒的生长与聚集行为[40]。而Cl-可以通过与晶体相结合来降低(100)面的表面能量,从而导致纳米立方铜的形成[41]。另有研究显示,体系中Cl-和CH3COO-的存在会加速铜粉的氧化过程[42]。
目前对于铜源种类和阴离子影响的研究较少,并且大多数停留在对实验规律的总结和反应机理的猜测阶段,对其作用机理并未提供有效的科学论断,希望今后的研究者能对这一问题进行有效解决。
2.5 反应温度的影响
多元醇法反应温度的设定与多元醇种类、碱的浓度和铜源种类等因素有关。一般地,在不加入碱的纯有机醇溶剂体系下,为缩短反应时间和提高产物纯度,反应所需的温度往往很高,一般设定为多元醇的沸点温度;但过高的温度容易导致铜颗粒团聚[21]。通常是选择加入强碱加快反应速率与提升还原剂的还原能力,既可以降低反应温度,又可以提高金属铜纯度。
依据微粒形成与生长原理,根据冯·韦曼经验公式,高温不利于获得小尺寸颗粒。但由于多元醇反应中温度对多元醇的还原速率影响大,升高反应温度能够大大提高反应速度,而快速反应有利于小尺寸铜粉的形成。FIEVET 等[43]认为温度主要影响多元醇的成核步骤。他们在乙二醇法制备铜粉实验发现中,颗粒的平均尺寸在160 ℃到210 ℃温度范围内降低至1/10,如图6所示。这是因为温度的升高加快了中间相的溶解速率和还原反应速率,导致自发成核的速率增加。在成核爆发期间形成的核数增加,对于一定数量的析出金属,平均颗粒尺寸减小,而粒子的分散性也有所降低。在甘油法还原硝酸铜实验中,将温度由120 ℃提升至160 ℃,其反应时间降低6 倍,铜粒子尺寸由0.40 μm 降低至0.06 μm,并出现严重团聚[26]。

图6 在相同的实验条件下,不同的温度制得铜粉的扫描电镜像[43]:(a) 160 ℃;(b) 175 ℃;(c) 195 ℃;(d) 210 ℃Fig.6 SEM images of copper powder prepared at different temperatures under the same experimental conditions[43]:(a) 160 ℃; (b) 175 ℃; (c) 195 ℃; (d) 210 ℃
与传统的金属粉体制备规律不同,在研究温度对多元醇反应的作用中,主要考虑温度变化对反应速率的影响。温度升高会加快还原速率而形成小尺寸晶体,但是温度太高、反应过快导致尺寸太小,容易诱发粒子间的团聚问题。值得一提的是,由于多元醇的高沸点和较强极性(表1),微波加热技术是适用于多元醇法的;同时多元醇中羟基的增加也能够提升辐射加热的能力。相较于传统油浴加热,微波加热合成具有反应速率快、时间短、粒径小、分布窄等优点。微波辐射产生的分子间的强烈摩擦和碰撞,实现热量的快速高效传递,避免温度梯度和浓度梯度的产生,为成核提供均匀的环境,是快速制备高性能超细铜粉的有效方法[44-45]。
3 总结与展望
目前超细铜粉的大规模工业化生产还存在一定距离。水合肼等传统方法虽然起步早、研究多,但毒害大、污染重、工艺复杂的问题难以满足可持续发展,制约了其工业化。相较之下,多元醇法以绿色无毒、溶解性优异的多元醇为溶剂,多羟基的碳链结构使其具备一定的还原和分散能力,展现出明显的原料优势。多元醇反应伴随着一系列的醇盐化合物、有机铜盐络合物和Cu2O 中间体的产生。在强碱的作用下,多元醇的还原能力增强,能够与Cu2+配位形成铜盐络合物,改变反应历程。同时强碱能够促进有机铜盐络合物和Cu2O 中间体的溶解,通过改变溶液中铜离子浓度,实现对晶体的形貌粒径可控调节。铜源的选择对铜粉的形貌、尺寸和纯度有一定影响,可以从阴离子的作用进行分析,目前主要以实验分析为主。反应温度对多元醇反应的影响需要考虑其对反应速率的作用。与一般的规律不同,多元醇的反应温度升高,铜颗粒的平均尺寸往往是减小的,而这种温度的改变对颗粒尺寸的变化影响显著。
超细铜粉的多元醇法制备具有较好的发展与应用前景,但国内对多元醇合成工艺的关注度不高,开展的相关研究少,机理机制理解尚浅,制备的铜粉在形貌粒径分散性等性能方面还存在明显不足:①需要对反应历程、阴离子的影响、氧化还原产物的种类与行为等问题深入研究;②如何实现对铜粉形貌粒径可控制备和防止颗粒团聚是重要的研究内容;③多元醇高黏度特性导致后处理难也是亟顺解决的实际生产问题。除此之外,小尺寸的铜粉活性高能量大,在空气中易氧化问题严重制约了超细铜粉的应用。开发先进的抗氧化性技术,提升超细铜粉的抗氧化性而又不影响导电性能仍是极具挑战和备受关注的热点问题,也是其生产与应用的重要研究方向与今后发展趋势。
