高铁赤泥熔融还原过程中钠铝硅的行为研究
2024-01-06朱忠南吕国志李晓飞蒋志刚张廷安
朱忠南, 吕国志, 李晓飞, 蒋志刚, 张廷安
(东北大学多金属共生矿生态化冶金教育部重点实验室,沈阳 110819)
氧化铝生产过程中所产生的强碱性废渣被称为赤泥。因生产方法和铝土矿品位的不同,每生产一吨氧化铝大约要产生0.5~2.0 吨的赤泥[1]。2019 年中国氧化铝产量7 230.16万吨,伴随产生的赤泥高达1亿吨,累计堆存量超过13亿吨,占地超过12万亩[2]。目前,世界上对赤泥采用的主要处置方法是对其进行筑坝堆存,长期堆积存在溃坝风险。赤泥堆放占用大量土地的同时其中存在的大量碱会污染地下水体与土壤。此外,干燥赤泥遇风会造成空气污染。如何对赤泥进行规模化、无害化处理,仍是急需解决的问题[3]。
赤泥作为氧化铝行业产生的大宗固废之一[4],各国研究人员对其综合利用进行了大量研究,研究方向主要包括:建材领域、有价金属元素提取、化工领域、环保领域[5-6]。其中在建材方面的应用与从赤泥中提取有价金属是目前应用最为成熟的领域,对化工与环保领域的探索则还在进行中。在建材领域应用研究中,赤泥被用来与粉煤灰、砂石混合后制备墙砖[7],以及通过钙化-碳化法将赤泥中碱含量降低后用于部分替代生料制备水泥熟料[8],还有通过熔融法将赤泥与钢渣混合制成微晶玻璃[9]。但由于赤泥中Na元素的存在,制成的产品会出现“反碱”的现象[10],因此,赤泥在建材领域的应用应重点关注Na 元素。高铁赤泥中含有多种有价元素,其中的氧化铁含量更是高达30%以上。因而,从赤泥中提取铁是现今研究的重点方向之一,在国内外学者对高铁赤泥的大量提铁研究中,目前主流的提铁方式共有3种:物理磁选、湿法浸出与火法熔炼[11-13]。物理磁选法操作方便,但是磁选效率低,铁精矿杂质较多,还会产生大量废渣[14]。湿法浸出则主要存在酸耗大、铁的溶出率低和酸浸液的分离提纯困难等问题[15]。火法冶金是目前应用较多的工艺,一般采用煤基还原回收铁,其中先焙烧后磁选法可获得铁精矿,金属收得率较高,操作简便;熔融还原法可直接得到生铁,可直接用于炼钢[16-17]。
基于以往研究,东北大学特殊冶金与过程工程研究所发明了“一种高铁赤泥提铁及直接水泥化的方法”[18],该方法是将赤泥与还原剂和造渣剂混料后进行涡流熔融还原,还原后的熔融渣经高温调质制备水泥熟料,以此实现赤泥规模化资源化消纳。赤泥还原渣的主要成分为铝氧化物、硅氧化物、钙氧化物以及钠铝硅钙共同形成的复杂物质,铝酸盐水泥熟料的化学成分主要为Al2O3、CaO、SiO2、TiO2和Fe2O3,两者的化学成分较为相似。铝酸盐水泥主体部分是以Al2O3和CaO 结合而成的矿物,两者的质量分数占整个水泥熟料的80%以上。铝酸盐水泥的水化强度主要取决于水泥熟料的化学组成和关键物相的结晶情况,铝酸盐水泥的要求尽可能多地获得CA(CaO·Al2O3,),避免C2AS(CaO·2Al2O3·SiO2)和其他杂相的结晶。因此,研究还原过程中Al、Si元素的含量变化及物相转化的规律对水泥熟料的成分调配及铝酸盐水泥的水化强度有着直接性、关键性的意义。为了实现赤泥涡流熔融还原渣的水泥化,需对还原过程中赤泥中主要造渣元素Al、Si 以及有害元素Na的行为进行研究[19]。本文通过对还原渣进行成分分析、物相分析以及微观形貌分析,研究了赤泥熔融还原过程中Na、Al、Si 3 种元素的行为变化,为赤泥涡流熔融渣水泥化提供理论依据。
1 实验部分
1.1 实验原料
原料来自于我国某氧化铝厂的高铁赤泥,其化学成分由XRF测定,结果如表1所列。图1所示为原料XRD 图谱,分析可得其主要组成为 Fe2O3、TiO2、CaO、NaAlSiO4、SiO2及CaSiO3。还原剂选用了秸秆炭,将计算出应添加的碳质量定为1,控制配碳比为1.1,使用秸秆炭182.5 g,其成分如表2 所列。本实验在熔融还原过程中分别使用分析纯CaO 210 g 和分析纯CaF28.4 g 作为添加剂来调节渣的黏度和流动性。
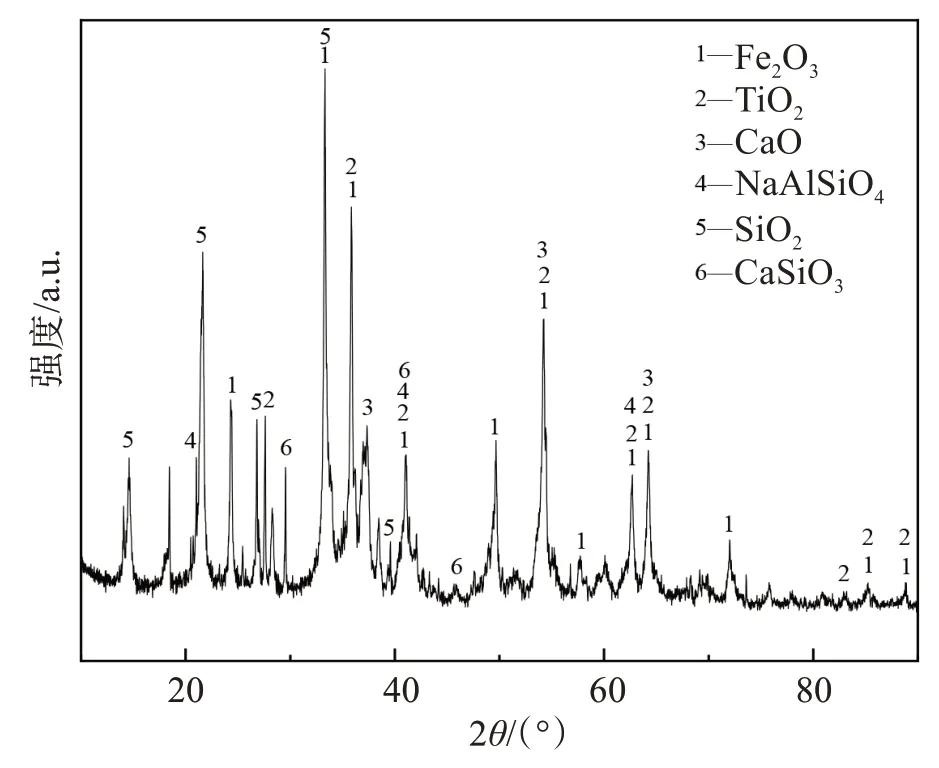
图1 高铁赤泥XRD图谱Fig.1 XRD pattern of high-iron red mud

表1 高铁赤泥的化学成分组成Table 1 Chemical composition of high-iron red mud单位:%(质量分数)

表2 秸秆炭的成分组成Table 2 Composition of stalk carbon单位:%(质量分数)
1.2 实验方法
先将经过粉碎后的赤泥烘干,待高铁赤泥干燥后,研磨过筛备用,取出1 000 g的高铁赤泥及根据配比已计算好的秸秆炭、CaO 和CaF2,混合均匀。将混合原料放入石墨坩埚中,随中频感应炉一同升温,观察到加入的原料出现熔化时,记录此时的温度与现象,待物料完全融化后开始计时。开始时反应较为剧烈,故前3 min 每隔1 min 取样一次,进行水淬,分别记为样品1、样品2、样品3。待到实验进行到一半时间时,再取样一次后水淬,记为样品4。计时结束后,将坩埚内剩余物料倒出后水淬,得到水淬还原终渣,记为样品5。具体工艺流程如图2所示。
本实验使用的仪器主要有:如图3所示的中频感应炉SPZ-160、红外测温枪AR992、电热鼓风干燥箱101。
图3 中频感应炉SPZ-160Fig.3 Medium frequency induction furnace SPZ-160
中频感应炉SPZ-160的最大输入功率为160 kW,振荡频率为1~20 kHz,输入电流为30~320 A,输出电压为70~550 V。
红外测温枪AR992的测温范围为200~2 500 ℃,精确度为±2 ℃,测量物距比为80∶1,使用9 V电池。
电热鼓风干燥箱101 的温度设定范围为50~300 ℃,容积为43 L,温度波动率为±1 ℃,输入电压为220 V,功率为800 W。
本实验使用X 射线荧光光谱仪和X 射线衍射仪分别对实验原料、还原渣等样品进行化学成分分析和物相分析,所需要的检测仪器如表3 所列。
表3 检测仪器Table 3 Testing instrument
2 实验结果与分析
2.1 Na元素在还原过程中的走向及矿物转型
Na 元素在铝土矿中含量较低,一般不高于5%[20],在高温下经过拜耳法铝酸钠溶液的强碱溶出作用下,一部分的Na 会进入固相形成复杂、多样的铝硅酸钠矿物。根据图1 所示的本实验所使用的高铁赤泥XRD图,可以看出Na元素在本研究使用的原料中多以NaAlSiO4形式存在。根据图4 可以看出,Na 元素含量在还原过程中不断降低, 这是因为在1 000 ℃时高铁赤泥中含有的Na2O 发生了还原反应,产生了金属Na。而金属Na 的沸点(883 ℃)很低,因此还原出的金属Na 有一部分在高温下迅速挥发为钠蒸气。从图5 中可以看出,物料中剩余的Na元素则与CaO 和SiO2一同生成了NaCaAlSi2O7留在尾渣中。发生的主要反应如下:
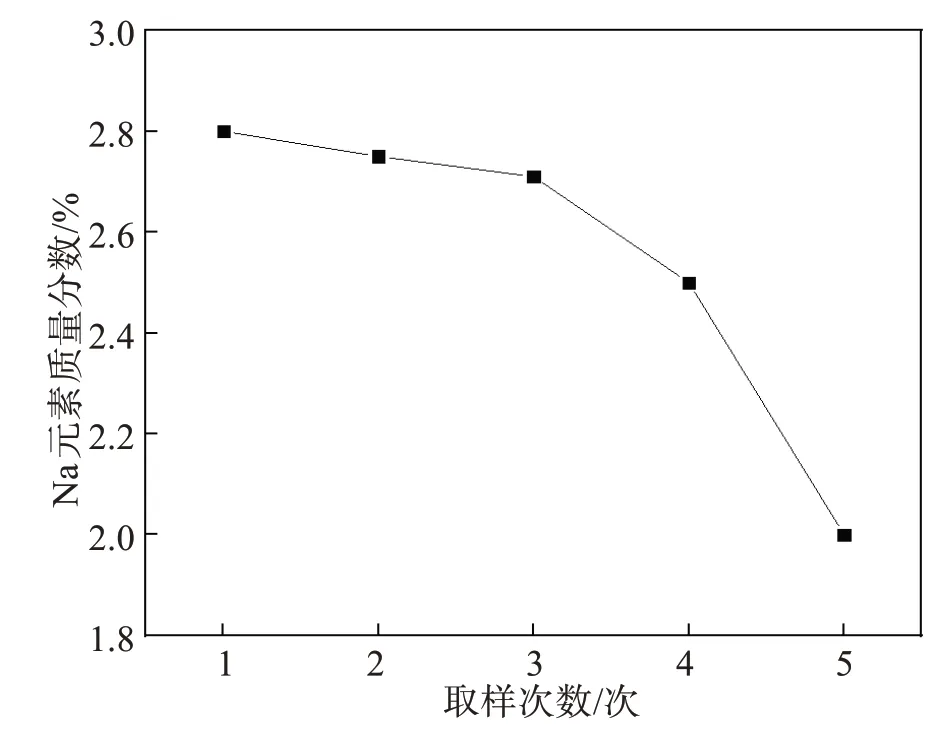
图4 还原过程中Na元素含量的变化Fig.4 Change of Na content during reduction
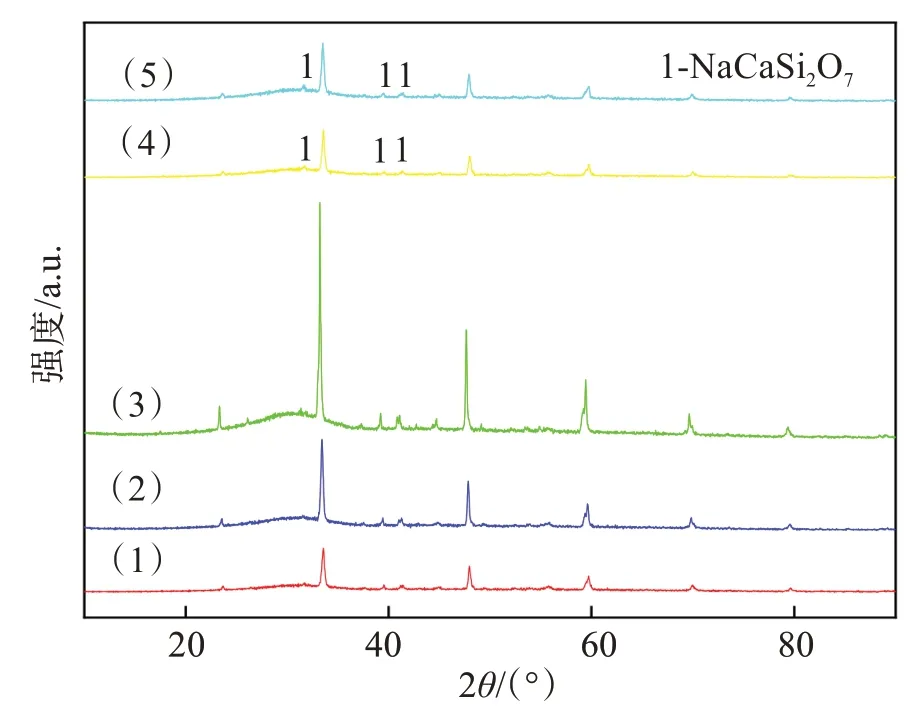
图5 还原过程中含Na元素的物相Fig.5 Phase containing Na element in reduction process
从图6 中可以看出,在尾渣中大部分的Na 元素存在于Al 元素与Si 元素的重合区域,剩余的则弥散分布在渣中,在此重合区域内,碳热还原反应后剩余的Na 元素会与Al、Si、O、Ca 元素结合,由图5 可知,生成的物相主要为NaCaAlSi2O7。
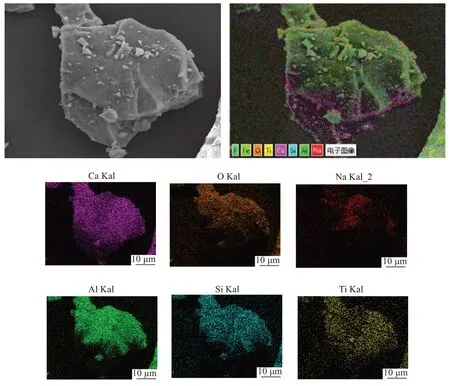
图6 水淬还原渣SEM-EDS图AFig.6 SEM-EDS figure A of water quenching slag
2.2 Al元素在还原过程中的走向及矿物转型
氧化铝碳热还原反应温度一般为2 000~2 300 ℃[21],因而在本研究所设定的温度范围内(1 300~1 600 ℃),氧化铝很难与碳发生还原反应生成金属Al。从图1 可以看出Al元素在原料中多以氧化物形态与Na 和Si 共同组成复杂氧化物(NaAlSiO4)。从图7可以看出,在反应整体进行的过程中,氧化铝的含量变化范围是29.5%~31.0%,并未发生较大的变化。图8 说明了在反应进行过程中Al 元素则主要以氧化铝的形式存在(3CaO·Al2O3);在反应后段有一部分的Al 与剩余的Na 元素形成NaCaAlSi2O7,另一部分则以Ca2Al(AlSi)O7的形式留在尾渣中。综上,反应过程中Al元素的含量并未发生较大变化,只是在过程中转化成3CaO·Al2O3、NaCaAlSi2O7和Ca2Al(AlSi)O7等几种不同的物相。发生的主要反应如下:
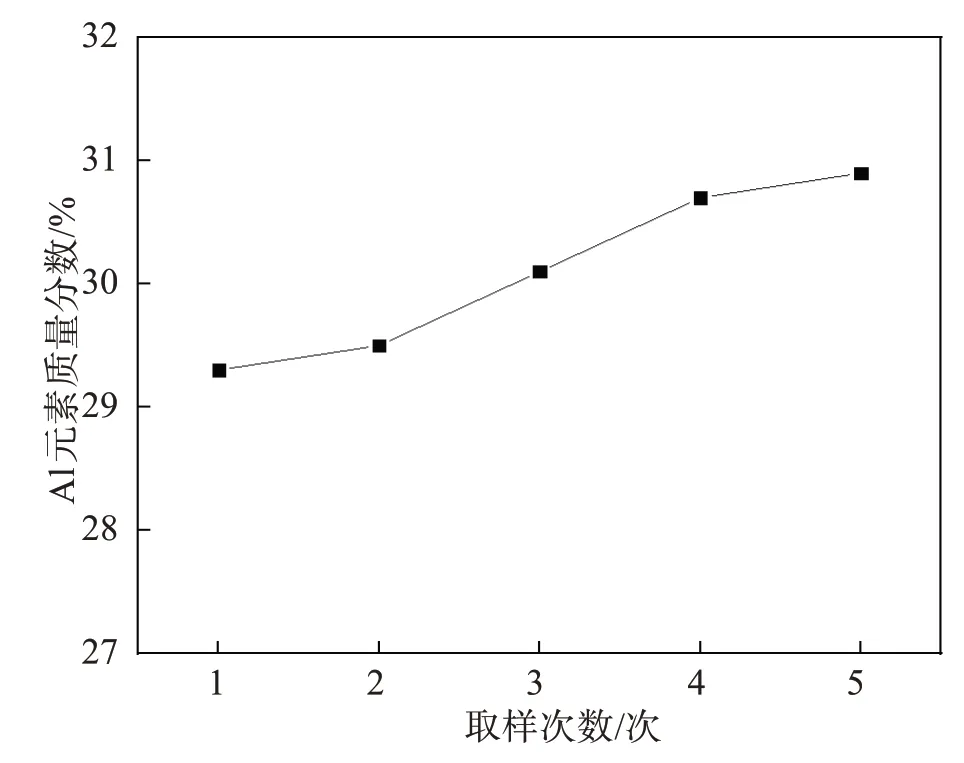
图7 还原过程中Al元素含量的变化Fig. 7 Change of Al content during reduction
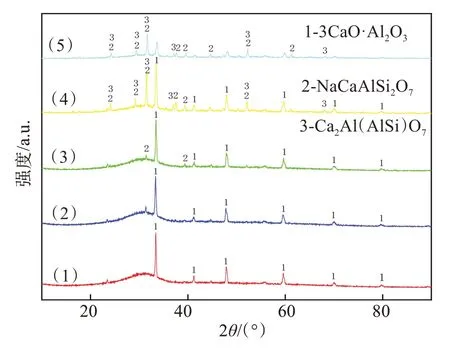
图8 还原过程中含Al元素的物相Fig.8 Phase containing Al element in the reduction process
Al元素与Si元素在元素周期表上处在相邻的位置,且均处于金属与非金属的分界线附近,因而虽然Al 是金属元素,Si 是非金属元素,但2 种元素有着相似的化学性质。由图8 可知,Al 元素与Si 元素会与Ca、O 及少量的Na 元素结合,形成复杂的氧化物组合相,如3CaO·Al2O3、NaCaAlSi2O7和Ca2Al(AlSi)O7等。从图9 中也可以看出,Al 元素和Si 元素在还原渣中的分布相似,存在大量的重合分布区域。
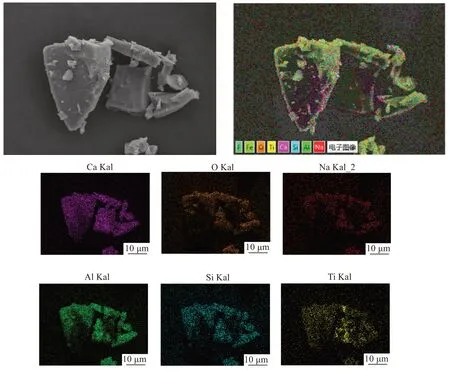
图9 水淬还原渣SEM-EDS图BFig.9 SEM-EDS figure B of water quenching slag
2.3 Si元素在还原过程中的走向及矿物转型
Si在原料中存在形式较复杂,多以SiO2、CaSiO3、NaAlSiO4、Fe2.454O4Si0.546等形式存在,由于氧化硅与碳的直接碳热还原温度较高,起始还原温度达到了1 600 ℃以上,这意味着在本实验反应进行中很难出现氧化硅被碳直接还原出硅单质的现象。从图10中可以看出氧化硅含量在整体反应进行中的变化范围是9.0%~9.5%,并未发生大范围的变化,只是存在不同物相间的转化。由图11 可知,在反应进行的过程中,Si 主要与CaO 发生反应生成 Ca2SiO4,而在尾渣中Si 则以NaCaAlSi2O7、Ca2Al(AlSi)O7、Ca2Al2SiO7、Ca3Al2Si3O12等形式存在。发生的主要反应如下:
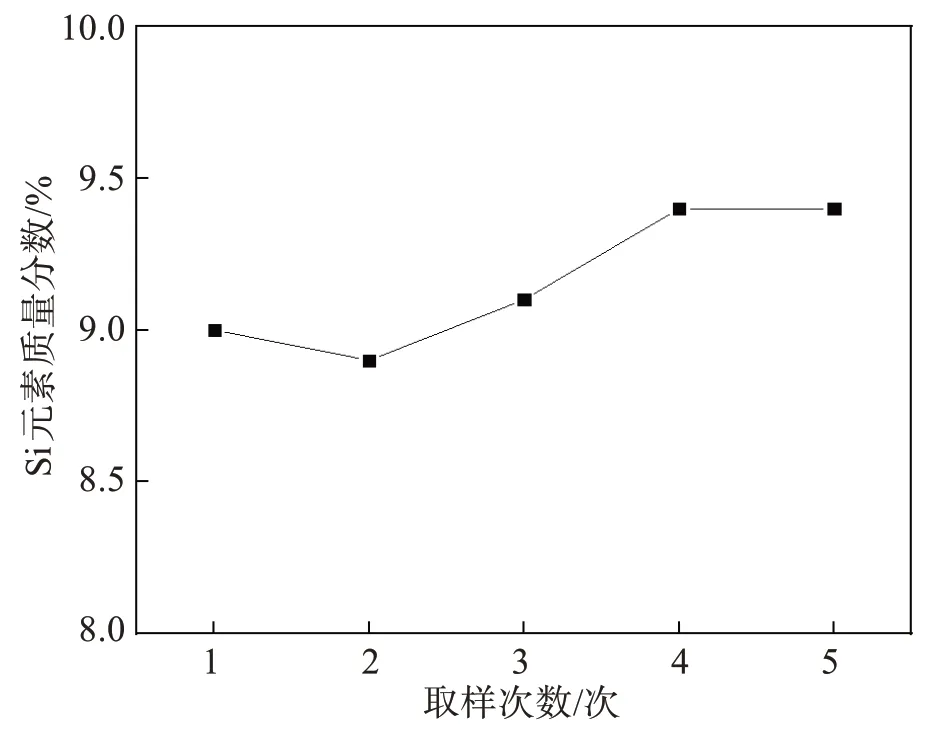
图10 还原过程中Si元素含量的变化Fig.10 Change of Si content during reduction
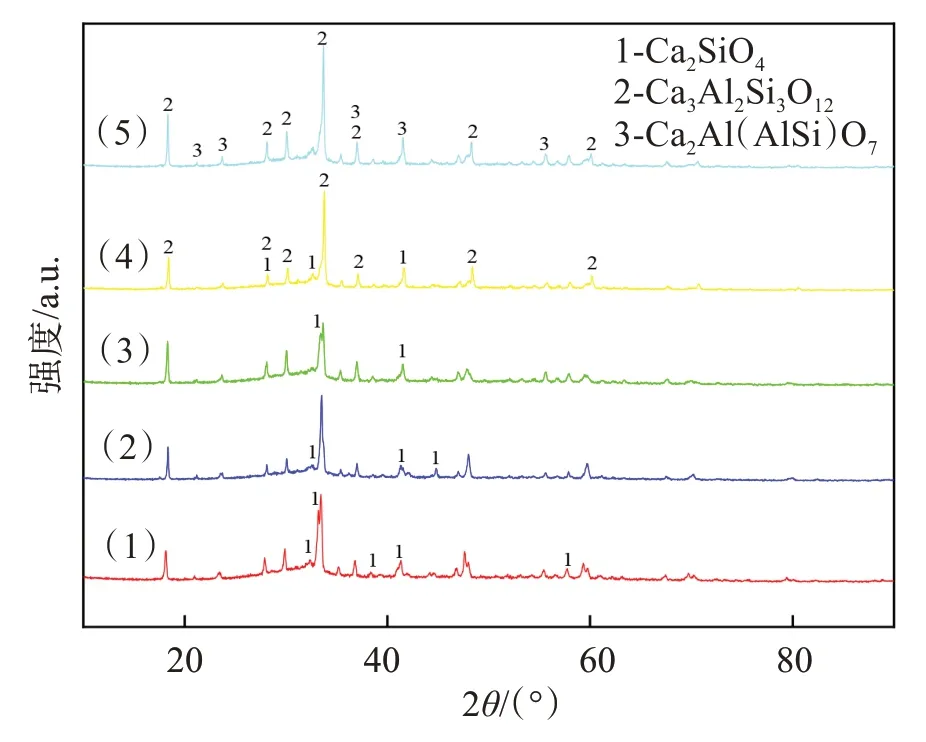
图11 还原过程中含Si元素的物相Fig.11 Phases containing Si element in the reduction process
由图11 可知,在Al 元素与Si 元素的重合区域内,Si 以NaCaAlSi2O7、Ca2Al(AlSi)O7、Ca2Al2SiO7、Ca3Al2Si3O12等形式存在。从图12 中可以看出,还原渣的微观形貌呈不规则的块状分布,渣中主要含有Ca、O、Al、Si 元素,此外还有Ti 和少量的Na 元素。Ca元素和O 元素弥散分布在整个渣中。由于实验过程中发生了氧化钠的碳热还原反应,因此Na 元素的含量不高,均匀分布在整个渣中。

图12 水淬还原渣SEM-EDS图CFig.12 SEM-EDS figure C of water quenching slag
3 结 论
1) 由于在反应过程中发生了还原反应,Na 元素含量不断降低,其余的Na 元素则多从NaAlSiO4转化为了NaCaAlSi2O7留在了尾渣中。
2) Al元素在实验温度范围内很难发生碳热还原反应,因而含量没有太大变化,物相主要从3CaO·Al2O3转化成尾渣中的NaCaAlSi2O7、Ca2Al(AlSi)O7等。
3) 因为此反应最高温度也未能达到Si元素的碳热还原反应起始温度,所以Si元素在反应过程中含量变化不大,过程中主要由Ca2SiO4转化为NaCaAlSi2O7、Ca2Al(AlSi)O7、Ca2Al2SiO7等。
4) 水淬还原渣的微观形貌呈不规则的块状分布,渣中的Ca、O 以及少量的Na 元素在整个渣中均匀弥散分布,Al和Si元素存在大量的高度重合区域,重合区域内存在着如3CaO·Al2O3、Ca2Al(AlSi)O7、Ca2Al2SiO7、Ca3Al2Si3O12等的Ca、O、Al、Si 4 种元素的结合相。Ti 元素则存在一些单独的区域与Ca、O 元素结合。
