双能CT定量参数联合CT特征预测结直肠腺癌周围神经浸润
2024-01-05黄豆豆陈峻帆罗银灯刘欣杰
黄豆豆,陈峻帆,韦 鑫,罗银灯,刘欣杰
(重庆医科大学附属第二医院放射科,重庆 400010)
结直肠癌是常见的恶性肿瘤之一,死亡率高[1],其组织类型多为腺癌。周围神经浸润(perineural invasion, PNI)为肿瘤细胞包绕至少33%神经周长或肿瘤细胞侵犯神经外膜、束膜和内膜任一层[2],是结直肠癌侵袭性表现之一。PNI阳性的结直肠癌患者局部复发和远处转移发生率较高[3],术前放射、化学治疗能提高生存率。目前,评估PNI状态仅能通过术后组织病理学检查获得。双能CT定量分析技术在结直肠癌分期、淋巴结转移及评价新辅助治疗疗效等方面具有良好的临床价值[4-5]。本研究观察双能CT定量参数结合CT特征术前预测结直肠腺癌PNI状态的价值。
1 资料与方法
1.1 研究对象 回顾性分析2021年12月—2023年10月于重庆医科大学附属第二医院接受全腹双能CT检查的79例结直肠腺癌患者,男47例、女32例,年龄30~84岁、平均(62.7±10.9)岁,根据患者PNI状态分为PNI组(n=31)和无PNI组(n=48)。纳入标准:①术前2周内均接受全腹部双能CT增强扫描;②均经手术病理确诊结直肠腺癌,并获得PNI状态;③临床资料完整。排除标准:①术前曾接受相关抗肿瘤治疗,如新辅助治疗或放射、化学治疗等;②图像质量差,病灶太小(<2 cm)难以测量者;③病理检查证实为多发病灶或非腺癌。记录患者临床资料,包括治疗前癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原(carbohydrate antigen 19-9, CA19-9)及临床症状。检查前患者均签署知情同意书。
1.2 仪器与方法 嘱患者检查前禁食12 h,检查前10 min口服1 000 ml温水;行屏气训练;检查时取仰卧位。采用Siemens Somatom Drive双源CT机扫描全腹,范围自膈顶至耻骨联合下缘。先采集平扫图像,后以剂量1.5 ml/kg体质量、流率3 ml/s经肘静脉注射非离子型对比剂碘海醇(370 mgI/ml),以流率3.5 ml/s跟注30 ml生理盐水,之后采用能谱成像模式行增强扫描,以自动阈值触发,监测腹主动脉CT值,达阈值120 HU后延迟15 s触发动脉期扫描,而后延迟18 s行静脉期扫描,A、B球管管电压分别为100、140 kVp,管电流350 mAs,螺距1,转速0.5 s/rot,层厚1 mm。扫描结束后自动重建能量100、140 keV的能谱原始图像及二者的混合能量图像,层厚均为1 mm。
1.3 图像分析
1.3.1 CT表现 由具有9年及12年腹部影像学诊断经验的主治及副主任医师各1名分析图像,观察病灶CT表现,包括原发病灶位置、形态学特征(环周比、病灶累及长度、病变肠壁最大厚度)及有无肠周淋巴结转移、瘤周系膜条索影、肿瘤沉积,2名医师意见不一致时经商议决定。
1.3.2 双能CT定量参数 将双能增强CT导入Siemens Syngo.via后处理工作站(版本VA30A),由上述2名医师分别重建动脉期、静脉期的单能量图像、碘图及电子密度(electron density, Rho)/有效原子序数(effective atomic number, Eff-Z)图。根据组织病理结果及CT确定肿瘤位置,于40 keV单能量CT、碘图、Rho/Eff-Z图上病灶最大层面避开坏死及血管放置3个面积20~30 mm2的圆形ROI,测量其CT值、碘浓度(iodine concentration, IC)、Rho、Eff-Z及双能指数(dual energy index, DEI)。软件自动生成能谱衰减曲线,以50、140 keV单能量CT值计算能谱曲线斜率(λHU):λHU=(CT值50 keV-CT值140 keV)/(140 keV-50 keV);计算病灶标准化碘浓度(normalized iodine concentration, NIC):NIC=IC病灶/ICL3水平腹主动脉×100%。对定量参数均重复测量3次,取2名医师测值的平均值进行分析。
1.4 统计学分析 采用SPSS 26.0统计分析软件。以组内相关系数(intra-class correlation coefficient, ICC)评价2名医师测量双能CT定量参数的一致性:ICC<0.40为一致性较差,0.40≤ICC≤0.75为一致性中等,ICC>0.75为一致性良好。采用Kolmogorov-Smirnov检验评价计量资料的正态性,以±s表示符合正态分布者,行独立样本t检验;以中位数(上下四分位数)表示符合偏态分布者,行Mann-WhitneyU检验。以Mann-WhitneyU检验比较等级资料。采用χ2检验或Fisher精确概率法比较计数资料。将差异有统计学意义的CT特征及双能CT定量参数纳入二元logistic回归分析,构建联合模型。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC),评价单一CT参数及联合模型预测结直肠腺癌PNI阳性的效能。P<0.05为差异有统计学意义。
2 结果
2.1 患者资料 组间病理所示T分期、淋巴结转移、肿瘤沉积差异均有统计学意义(P均<0.05),其余资料差异均无统计学意义(P均>0.05)。见表1。
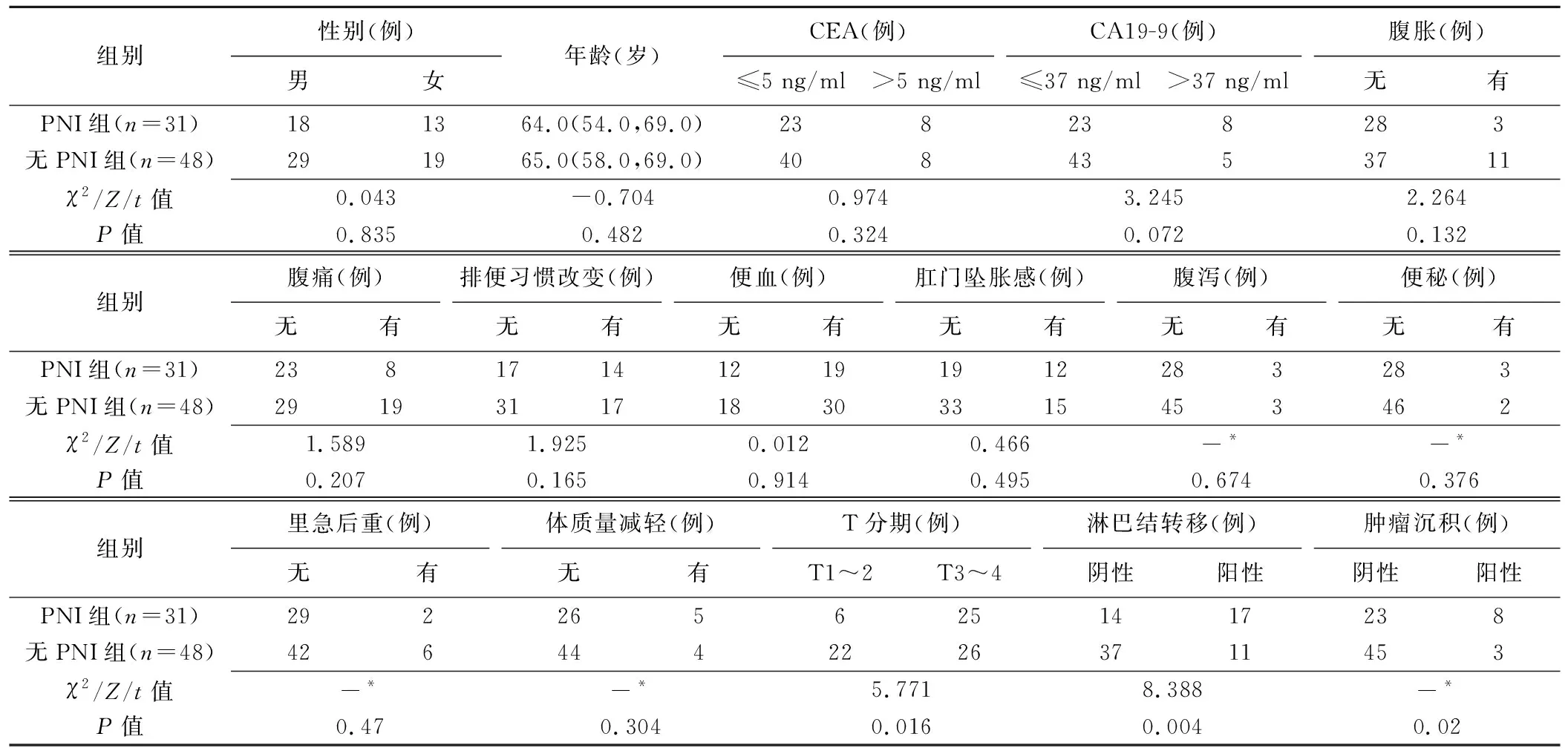
表1 有无PNI的79例结直肠腺癌患者资料及病理所见
2.2 CT表现 组间原发灶位置、病变肠壁最大厚度、肠周淋巴结转移与否、有无瘤周系膜条索影及肿瘤沉积差异均有统计学意义(P均<0.05),其余CT表现差异均无统计学意义(P均>0.05)。 见表2。

表2 有无PNI结直肠腺癌CT表现
2.3 双能CT定量参数 2名医师测量动脉期λHU、IC、DEI及静脉期λHU、IC、NIC、Rho、Eff-Z、DEI结构的一致性均良好(ICC:0.76~0.87),所测动脉期NIC、Rho、Eff-Z的一致性均为中等(ICC:0.73、0.72、0.73)。PNI组动脉期λHU、IC、NIC及DEI均大于、而静脉期NIC小于无PNI组(P均<0.05),组间其余双能CT定量参数差异均无统计学意义(P均>0.05)。见表3及图1、2。

图1 PNI组患者,男,63岁,直肠腺癌 A.动脉期能谱衰减曲线,λHU=1.333; B.全腹轴位动脉期40 keV单能量CT图示肿瘤沉积(箭); C.全腹轴位动脉期碘图,IC=2.95 mg/ml,NIC=32.50%; D.全腹轴位动脉期Rho/Eff-Z图,Rho=41.73 HU,Eff-Z=8.80,DEI=21.50 (白色圆圈为病灶ROI)
2.4 预测PNI效能 以原发灶位置、病变肠壁最大厚度、肠周淋巴结转移、瘤周系膜条索影、肿瘤沉积,以及动脉期λHU、IC、NIC、DEI及静脉期NIC预测结直肠腺癌PNI阳性的AUC为0.615~0.698,联合模型的AUC为0.864。见表4及图3。

表4 单一CT参数及联合模型预测结直肠腺癌PNI的效能
3 讨论
PNI为多种恶性肿瘤的生物学特征之一,也是结直肠癌患者预后不良的重要因素[6-7];同时存在血管浸润、淋巴转移和PNI的高危结直肠癌患者的长期生存率低于低危患者[8]。术前明确结直肠癌患者PNI状态有利于指导临床决策。
本研究不同PNI状态结直肠腺癌患者临床资料差异无统计学意义,原因或在于结直肠癌临床症状缺乏特异性,且受原发肿瘤部位、伴发疾病及基因表达等因素影响[9]。本组CT显示PNI组原发灶以位于直肠为主,可能与右半结肠至左半结肠肠系膜、尤其直肠下段厚度逐渐变薄,致区域内神经分布密度相对增加、更易出现PNI有关;PNI组病变肠壁最大厚度大于无PNI组,提示肿瘤浸润越深则PNI发生率更高,与病理所示高T分期结直肠腺癌患者PNI发生率更高相符。肿瘤生长依赖于血管生成,而PNI参与血管生成相关内皮代谢综合作用过程[10],有利于形成肿瘤组织增殖扩散的微环境,为结直肠癌淋巴结转移和肿瘤沉积提供了条件。本研究PNI组肠周淋巴结转移、瘤周系膜条索影及肿瘤沉积占比均高于无PNI组,与既往研究[11]相符;而组间肿瘤环周比和累及长度差异无统计学意义,表明PNI可能与肿瘤浸润肠壁深度相关,而与肿瘤环肠壁生长无明显相关。
双能CT定量参数可评估组织血管分布及灌注,以表征结直肠癌异质性及侵袭性[12]。结直肠腺癌具有动脉期高强化特点,动脉期双能CT定量参数更能反映肿瘤血管情况[13]。对IC进行标准化处理所获NIC可减轻对比剂给药时间、流速和浓度等的干扰,更精确地反映肿瘤异质性。本研究PNI组动脉期λHU、IC、NIC及DEI均高于无PNI组,与既往研究[14-15]结果相似;而PNI组静脉期NIC低于无PNI组,可能与受对比剂扩散后期流入血管外间隙的影响有关。本研究以单一CT参数预测结直肠腺癌PNI的AUC为0.615~0.698,而联合模型为0.864,提示后者诊断效能佳,为术前预测结直肠腺癌PNI的可靠方式。
综上,双能CT定量参数结合CT特征可有效预测结直肠腺癌PNI。但本研究样本量有限,仅基于病灶最大层面勾画ROI,未能全面反映整体肿瘤异质性,且目前结直肠癌双能CT检查尚无统一扫描协议,有待完善。
