艾曲泊帕治疗儿童免疫性血小板减少症的临床研究进展
2024-01-05王志法王晓玲吴润晖成晓玲
王 南,王志法,王晓玲,吴润晖,成晓玲*
0 引言
免疫性血小板减少症(Immune thrombocytopenia,ITP)是一种获得性免疫疾病,以血小板生成减少和破坏增多为主要特征,其成人年发病率约为(1.6~3.9)/10万,儿童年发病率约为(3~5.3)/10万,高于成人[1-3]。尽管儿童ITP存在一定的自限性,但约20%~30%的儿童会发展为慢性ITP,需要长期用药治疗[2]。
艾曲泊帕(Eltrombopag)在国内上市前,糖皮质激素、静脉注射免疫球蛋白、免疫抑制剂、脾切除等方法通过减少血小板破坏,成为儿童ITP的主要治疗手段[4-8]。不同于传统治疗,艾曲泊帕与血小板生成素(Thrombopoietin,TPO)受体的跨膜结构域结合[9-12],增强内源性血小板生成信号通路的传导,增加血小板的产生[13-16]。由于这种独立的结合位点,艾曲泊帕不与内源性TPO竞争TPO受体,故不易产生自身抗体[13-14,16-18],表现出确切的临床疗效及良好的安全性,在对激素、免疫球蛋白、脾切除等传统治疗无效的成人和儿童ITP患者群体中被广泛应用。
近年来,在儿童临床试验的基础上,艾曲泊帕在儿童ITP患者中的临床病例观察、病例报告及病例系列研究等真实世界研究中已有较多报道,本文纳入整理国内外艾曲泊帕治疗儿童ITP临床试验研究和真实世界研究结果,并就艾曲泊帕在儿童ITP患者中的临床疗效和安全性进行全面的整理,为艾曲泊帕临床合理使用提供参考。
1 艾曲泊帕治疗儿童ITP的临床疗效
1.1 艾曲泊帕在儿童临床试验中的临床疗效 PETIT和PETIT-2是艾曲泊帕在儿童ITP患者中进行的II期和III期临床试验,研究结果提示,艾曲泊帕对1~17岁ITP患者治疗有效性主要体现在改善血小板计数、减少出血的发生及严重程度、减停ITP的伴随治疗3个方面[19-20]。PETIT试验中艾曲泊帕组和安慰剂组分别有28例(62%)和7例(32%)患者达到主要终点(即在没有任何抢救治疗的情况下,治疗期间血小板计数≥50×109/L至少1次),且与安慰剂组相比,艾曲泊帕组的临床显著出血和抢救药物的使用减少[19]。PETIT-2试验中治疗组和对照组分别有25例(40%)和1例(3%)患者达到主要终点(即治疗期间血小板计数>50×109/L,持续至少6~8周),出血症状(WHO1-4级)在治疗组和对照组中的发生率分别为37%和55%[20]。
ICON1是一项前瞻性、多中心、观察性研究,研究共纳入120例开始接受ITP二线治疗的ITP患儿[43例(36%)利妥昔单抗、19例(16%)口服免疫抑制剂、31例(26%)罗米司亭和20例(17%)艾曲泊帕][21-22],如表1所示。研究结果显示,4种二线药物在改善血小板计数、出血症状、救援药物的使用和健康相关生活质量上都较基线有显著提升。经静脉给药的罗米司亭和利妥昔单抗在长期反应上优于口服的艾曲泊帕和免疫抑制剂,而后两者在早期升高血小板计数上反应迅速,通常到达阈值后血小板计数趋于稳定,并且艾曲泊帕较免疫抑制剂起效快。此外,在生活质量改善方面,以艾曲泊帕组和利妥昔单抗组的效果最为明显。结合不同二线治疗药物的有效性特点,对于需要在1个月内快速改善血小板计数,或有改善疾病生活质量需求的患儿,推荐使用艾曲泊帕作为二线治疗的首选[21-22]。

表1 艾曲泊帕治疗儿童ITP的临床试验
1.2 艾曲泊帕在儿童真实世界研究中的临床疗效 在真实世界研究中,艾曲泊帕治疗儿童ITP的临床疗效与PETIT、PETIT-2和ICON1临床试验结果整体一致:使用艾曲泊帕治疗的患者可在提高血小板计数、减少临床出血症状、减少伴随药物的使用和提高患者生活质量等方面获益。但艾曲泊帕的临床疗效在儿童真实世界研究中又得到了扩展,具体表现在:①使用艾曲泊帕的儿童患者不只局限在慢性或持续性ITP患者[23-33],对其他治疗无效或难治性患者[31,33-36]、重症患者[37-38]及新诊断的患者[24-25,38],使用艾曲泊帕也能获得反应,这提示艾曲泊帕可用于ITP不同持续时间和严重程度的儿童患者;②在头对头的真实世界研究中,艾曲泊帕与一线治疗药物(丙种球蛋白±糖皮质激素)[32,39-40]及同为TPO-RAs的罗米司亭[23-24]相比,艾曲泊帕的疗效确切,安全性高;③艾曲泊帕可与其他ITP药物联合治疗,以提高ITP的临床疗效。艾曲泊帕与丙种球蛋白联合治疗可用于难治性ITP患儿[35];艾曲泊帕联合糖皮质激素在提高患儿反应应答率方面优于单药治疗[41];艾曲泊帕联合高剂量地塞米松和利妥昔单抗可降低复发率,提高治疗应答率[42-43]。
2 艾曲泊帕治疗儿童ITP的安全性
2.1 艾曲泊帕治疗儿童ITP常见不良反应 使用艾曲泊帕的ITP儿童患者总体耐受性良好,这在临床试验[19-22]与真实世界研究[23-43]中均得到证实。关于艾曲泊帕在临床试验及真实世界研究中不良反应(Adverse drug reaction,ADR)发生情况的差异,结果显示,在PETIT和PETIT-2临床试验[19-20]中,不良反应的发生情况以头痛、上呼吸道感染、出血、腹痛和鼻咽炎为主;在真实世界[23-25,27,30,32,36-37,39-40]中,不良反应的发生情况以上呼吸道感染、碱性磷酸酶升高、丙氨酸氨基转移酶/天冬氨酸氨基转移酶升高、胆红素升高和血小板增多(>400×109/L)为主。
2.1.1 艾曲泊帕临床试验 在PETIT和PETIT-2随机试验期间[19-20],共157例受试者发生不良反应(艾曲泊帕组107例,安慰剂组52例),艾曲泊帕组严重不良反应发生率为8%,安慰剂组为12%。在随机试验期间最常见的不良反应为头痛(艾曲泊帕组为18%,安慰剂组为24%)、上呼吸道感染(艾曲泊帕组为17%,安慰剂组为6%)、出血(艾曲泊帕组为16%,安慰剂组为36%)、腹痛(艾曲泊帕组为13%,安慰剂组为14%)和鼻咽炎(艾曲泊帕组为12%,安慰剂组为4%),见表2。

表2 艾曲泊帕用于儿童ITP临床试验中主要不良反应发生情况
2.1.2 真实世界研究 在艾曲泊帕治疗儿童ITP的真实世界病例系列研究中[23-25,27,30,32,36-37,39-40],纳入使用艾曲泊帕治疗ITP的儿童患者共350例,不良反应发生情况如表3所示。没有患儿发生严重不良反应或因药物不良反应而停药。
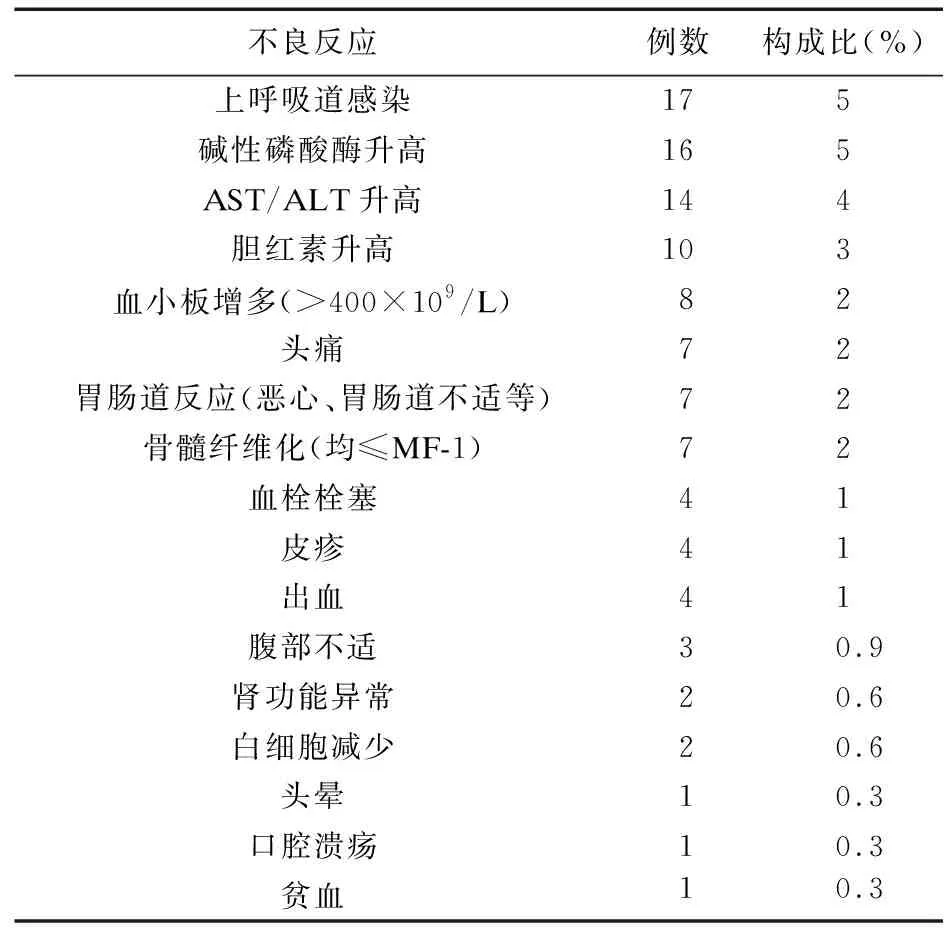
表3 艾曲泊帕用于儿童ITP真实世界中不良反应发生情况
2.2 艾曲泊帕治疗儿童ITP需重点关注的不良反应 美国食品药品监督管理局(U.S.Food and Drug Administration,FDA)和欧洲药品管理局(European Medicines Agency,EMA)对艾曲泊帕可能导致的严重不良反应(如肝功能异常、血栓栓塞、骨髓纤维化、白内障等)提出预警及预防,在用药过程中需要重点关注[44-45]。
2.2.1 肝胆实验室检查异常 FDA对艾曲泊帕可能引起的严重和危及生命的肝毒性予以黑框警告[45],但在儿童临床试验及真实世界中未见严重肝毒性和潜在致病性肝损伤。艾曲泊帕的肝胆不良反应大多表现为轻症(CTCAE 1~2级),具有可逆性,可自行恢复或经停药、对症处理后恢复[19-20,23-25,27-32,34,36-37,39-40]。
艾曲泊帕主要在肝脏经细胞色素P450酶(CYP)1A2、CYP2C8、尿苷二磷酸葡萄糖醛酸基转移酶(UGT)1A1、UGT1A3等代谢[46-48],是乳腺癌耐药蛋白(BCRP)的底物,由ABCG2基因编码[48-49]。考虑到艾曲泊帕的药代动力学特点,个体药物代谢差异及遗传学差异可能影响艾曲泊帕的临床疗效及安全性。艾曲泊帕可抑制UGT1A1和有机阴离子转运多肽(OATP)1B1,导致高间接胆红素血症。若胆红素水平升高,应进行胆红素分类检测,3~5 d内复查并评价肝功能。碱性磷酸酶(Alkaline phosphatase,ALP)作为一种非特异性肝酶,在儿童的生长发育过程中可能生理性增加,大多数患者ALP升高后自发下降,未观察到其他显著临床症状[30]。由于艾曲泊帕主要经肝脏代谢,在用药期间应密切关注患者血清ALT、AST水平,当肝功能正常的患者中的ALT水平升高≥3倍基线值时,应停用药物[15,19-20]。
Marano等[49]报道了一例3岁慢性ITP女性患儿服用标准剂量的艾曲泊帕后出现急性肝衰竭的病例。该患者治疗药物监测(Therapeutic drug monitoring,TDM)结果显示,艾曲泊帕血药浓度为387.5 μg/ml,药代动力学与药物遗传学分析显示,该患者存在UGT1A1*28、CYP2C8*3纯合突变和ABCG2杂合突变,导致药物消除减慢,药物体内蓄积。尽管目前对于艾曲泊帕治疗儿童ITP有效血药浓度范围的探索有限,但有研究发现,在44例成人再生障碍性贫血的患者中,使用艾曲泊帕治疗的中位剂量为75(IQR 50.0~100.0)mg/d,有效血药浓度的临界值为12.50 μg/ml,且药物不良反应的增加可能与艾曲泊帕血药浓度相关[50]。这一病例观察结果提示,由于不同个体间可能存在药代动力学差异,对于使用艾曲泊帕标准治疗方案的儿童患者,仍可使用TDM、药代动力学和药物遗传学方法来管理和指导患者个体化用药,从而减少因个体遗传和代谢差异导致的药物不良反应。
2.2.2 血栓栓塞 使用促血小板生成类药物时,应密切监测血小板的水平,以防止血栓形成及血栓栓塞相关并发症的风险。不同于成人存在合并疾病及血栓形成的危险因素,儿童患者不属于血栓栓塞易发人群,在儿童临床试验中未发生血栓栓塞相关不良反应[19-20],但在真实世界研究中,共报告了4例血栓事件[23-24,27],均存在血栓栓塞相关因素,包括遗传性因素(因子V Leiden突变,缺乏C蛋白、S蛋白、抗凝血酶等)和/或获得性因素(抗凝血酶III缺乏、抗磷脂综合征、长期制动、恶性肿瘤、避孕和激素替代疗法、手术/外伤、肥胖等)[15-16]。对于有血栓栓塞风险的患者,在开始艾曲泊帕治疗之前,应该权衡药物治疗的获益与风险,治疗期间应根据指南要求密切监测血小板计数,必要时考虑减少艾曲泊帕剂量或停止治疗[15]。
2.2.3 骨髓纤维化 骨髓纤维化是由髓内释放转化生长因子β(TGF-β)和碱性成纤维细胞生长因子(b-FGF)等促纤维化细胞因子介导的,TPO-RAs可刺激巨核细胞释放细胞因子,导致网状蛋白在髓内沉积[51-52]。但在部分成人临床试验中.发现艾曲泊帕与骨髓蛋白异常沉积无显著相关性[52-54]。PETIT和PETIT-2两项临床试验未进行骨髓活检,但相关实验室检查和外周血涂片未见骨髓异常[19-20]。在报告骨髓纤维化不良反应的儿童真实世界研究中[23-24],共对82例使用TPO-RAs(艾曲泊帕和罗米司亭)的患儿进行骨髓活检,发现20例患儿骨髓网状蛋白增加,其中3例患儿在治疗前或开始治疗后几天内出现网状蛋白增加,7例患儿在治疗期间MF分级未改变,3例患儿骨髓纤维化评分由MF-0升至MF-1,1例患儿由MF-1降至MF-0,4例患儿在最后一次骨髓活检前停药,2例患儿随访失访。尽管TPO-RAs与骨髓纤维化之间的关系尚未阐明,但仍建议在使用艾曲泊帕治疗期间,密切监测血常规、外周血涂片,如发现血细胞数量或形态异常,可进行骨髓活检,必要时停止治疗[15]。
2.2.4 白内障 在儿童真实世界研究中,没有艾曲泊帕导致白内障的病例报告,但在PETIT-2中发现2例患儿出现白内障(1例患儿为新发白内障,1例患儿已有白内障进展),2例患儿均接受糖皮质激素治疗[20]。尽管艾曲泊帕单药治疗可能不会增加儿童白内障发展或进展的风险,但对于既往或同时接受糖皮质类激素治疗的儿童,应考虑筛查和随访白内障风险[15-16,18,55]。
2.2.5 铁缺乏 艾曲泊帕结构与铁螯合剂相似,对细胞内外的铁均有螯合作用[56]。在成人与儿童临床试验中尚无艾曲泊帕导致铁缺乏(Iron deficiency,ID)或缺铁性贫血(Iron deficiency anemia,IDA)的报道,Lambert等[57]首次在儿童中发现,使用艾曲泊帕治疗ITP可能会降低患者平均红细胞体积(Mean corpuscular volume,MCV)和铁蛋白水平,严重时可导致IDA。一般情况下,检测铁蛋白水平不是ITP的常规检查,且在临床没有贫血的情况下,MCV的下降可能会被忽略。在儿童真实世界研究中,Koca等[58]研究显示,在接受艾曲泊帕治疗的患者中,有1/4的患者存在ID/IDA,这提示监测血红蛋白、红细胞平均指数和铁蛋白水平,对启动补铁治疗和预防IDA有重要意义。
2.2.6 血小板增多症 在艾曲泊帕治疗儿童ITP的真实世界研究中,有8例患者因血小板增多(>400×109/L)而停止艾曲泊帕治疗[27,30,37],未发现有因血小板增多导致的不良事件(如血栓形成等),大多患者在停药后血小板降至正常范围。血小板增高超正常范围后突然停药可能会导致血小板迅速下降,发生潜在出血,因此,建议在艾曲泊帕使用过程中,密切监测血小板水平,及时调整艾曲泊帕的给药剂量,避免血小板大幅波动。此外,拥有东亚血统的患者的艾曲泊帕血浆暴露量比欧美患者高43%[55],提示有东亚血统的患者应使用较低起始剂量,并根据血小板监测情况灵活调整用药剂量[15-16]。
3 展望
艾曲泊帕可有效增加慢性ITP患者的血小板计数并减少出血症状,可推荐用于对其他治疗(如皮质类固醇、丙种球蛋白等)效果不佳的ITP患者的二线治疗[19-20,59-63]。艾曲泊帕作为目前国内唯一获批用于儿童ITP适应证的TPO-RAs,总体耐受性良好,在儿童应用中具有较好的安全性。
在实际临床应用中,缺乏预估艾曲泊帕临床疗效的预测因素,如对预测艾曲泊帕疗效的生物标志物进行检测,则可以提高艾曲泊帕的临床应答率,促进ITP患儿临床个体化用药。如Barsam等[64]通过比较血小板反应前后的平均绝对未成熟血小板分数(The mean absolute-immature platelet fraction,A-IPF),评估血小板生成的变化,并通过A-IPF数值预测对治疗方案无反应的患者;Basciano等[65]研究显示,β1微管蛋白中的SNP与血小板的产生及功能相关,其中,β1微管蛋白SNP(R307H)可能导致ITP患者的血小板更新增加,可作为ITP患者的生物标志物;Chen等[66]研究发现,巨核细胞计数≥100个和调节性T淋巴细胞(Regulatory cells,Treg)<4.5%的患者更有可能获得初始反应及更高的持久应答率;IL-10、IL-4、TNF-α和骨桥蛋白基线水平较高的患者对艾曲泊帕可能有较低的反应应答[67]。
综上,评估艾曲泊帕在ITP儿童群体中的有效性和安全性,可为临床合理用药、患者个体化用药指导、医生和患者及家属治疗决策提供参考依据。尽管艾曲泊帕在临床上的应用较为广泛,有越来越多的研究证实了艾曲泊帕在儿童ITP患者中的临床疗效及安全性,但由于其在国内上市较晚,在儿童患者中的应用时间短,仍需开展长期的临床研究,补充说明艾曲泊帕在ITP患儿中的持续应答及长期应用的安全性。
