基于FAERS数据库的奥拉帕利和尼拉帕利不良事件信号对比与评价
2024-01-05李舒悦郝志英
李舒悦,王 佳,郝志英
0 引言
卵巢癌是病死率最高的妇科恶性肿瘤,严重威胁着妇女健康[1]。近年来,新型靶向药物的出现为卵巢癌的治疗提供了新的可能。多腺苷二磷酸核糖聚合酶(PARP)是一类DNA损伤修复酶,当细胞DNA发生断裂时,PARP可结合到断裂处,寡集包括组蛋白在内的烟酰胺腺嘌呤二核苷酸依赖的腺苷二磷酸核糖聚合酶以及其他DNA修复酶,完成受损DNA的修复[2]。PARP抑制剂通过合成致死模式,对具有同源重组修复缺陷的肿瘤细胞起到较强的杀伤作用,能大大提高卵巢癌患者的无进展生存期与总生存期[3-4]。2014年,首个PARP抑制剂奥拉帕利先后在欧盟和美国获批上市,2018年8月,奥拉帕利作为中国首个卵巢癌靶向药物获批。尼拉帕利于2017年3月在美国首次上市,同年11月在欧洲获批,2019年在中国上市[5]。奥拉帕利和尼拉帕利在我国上市时间不长,临床使用数据较少。为提高PARP抑制剂药物临床使用的安全性,对其进行上市后评价,分析药物不良反应(Adverse drug reaction,ADR)并加以监测和管理是十分必要的。
美国FDA不良事件报告系统(FDA adverse event reporting system,FAERS)数据库是公开发布的数据库,收集了由不同地区医疗保健专家、制药厂商、患者等自发上报的ADE报告,其数据每季度更新1次。本研究拟对FAERS数据库中奥拉帕利和尼拉帕利不良事件数据进行对比和分析,为奥拉帕利和尼拉帕利的临床安全用药提供循证依据。
1 资料与方法
1.1 数据提取 本研究数据来自FAERS数据库。OpenVigil 2.1 (http://openvigil.sourceforge.net)是经过德国基尔大学Böhm等学者验证的药物警戒工具,提供了一个Web界面来分析药物警戒性数据[6]。本研究通过OpenVigil 2.1数据平台查询FAERS数据库,分别以“Olaparib”“Niraparib”为检索词进行检索,收集2种药物从在美国上市(奥拉帕利上市时间为2014年12月,尼拉帕利上市时间为2017年3月)至2022年9月30日的不良事件,收集患者性别、年龄、适应证、给药途径、剂量、不良事件名称、结局、上报国家和日期等信息。
1.2 数据标准化 《监管活动医学词典》(Medical Dictionary for Regulatory Activities,MedDRA)是为药事管理过程提供的经过医学确认的术语集,FAERS数据库中ADE均由MedDRA中的首选术语(Preferred terms,PT)进行编码。将收集到奥拉帕利和尼拉帕利的ADE根据MedDRA 25.0版中的系统器官分类(System organ class,SOC)进行分类和描述,合并中文含义相同的PT,统计各PT的报告数。
1.3 数据分析 本研究通过比例失衡法中的报告比值比(Reporting odds ratio,ROR)法和比例报告比值(Proportional reporting ratio,PRR)法进行数据挖掘,筛选潜在ADE信号。当目标ADE出现频率高于整个数据库背景频率时,则代表出现ADE信号,且ROR和PRR越大,ADE信号越强,说明目标药物与目标ADE之间统计学关系越强。ROR与PRR的计算是基于四格表(表1),ROR法中报告数a≥5、且ROR的95%CI下限>1,则为1个信号;PRR法中报告数a≥5、PRR≥2且χ2≥4时,则为1个信号。见表2。本研究纳入同时满足上述ROR和PRR信号要求的ADE,并分别按照ADE发生频次和信号强度(ROR值)进行排序。
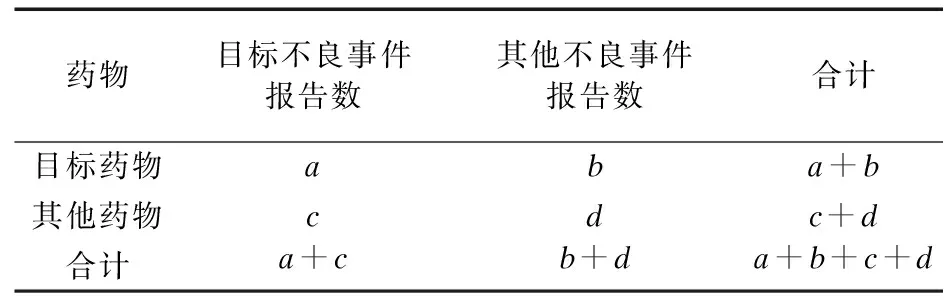
表1 比例失衡法列表

表2 ROR和PRR的计算公式
2 结果
2.1 ADE报告基本信息和人口学特征 截至2022年第3季度,FAERS数据库中共检测到ADE报告11 684 377份,其中涉及奥拉帕利7 811份,尼拉帕利14 421份。删除重复以及不良事件不详的报告后,筛选得到以奥拉帕利为首要怀疑药物的报告6 935份,以尼拉帕利为首要怀疑药物的报告2 568份,报告人口学特征见表3、表4。自2种药品上市以来,ADE报告数量大致呈逐年上升趋势,以美国、日本报告最多。由于奥拉帕利和尼拉帕利主要用于卵巢癌的治疗,因此,ADE报告以女性患者(74.5%)为主,且ADE报告患者的主要年龄范围为55岁以上。
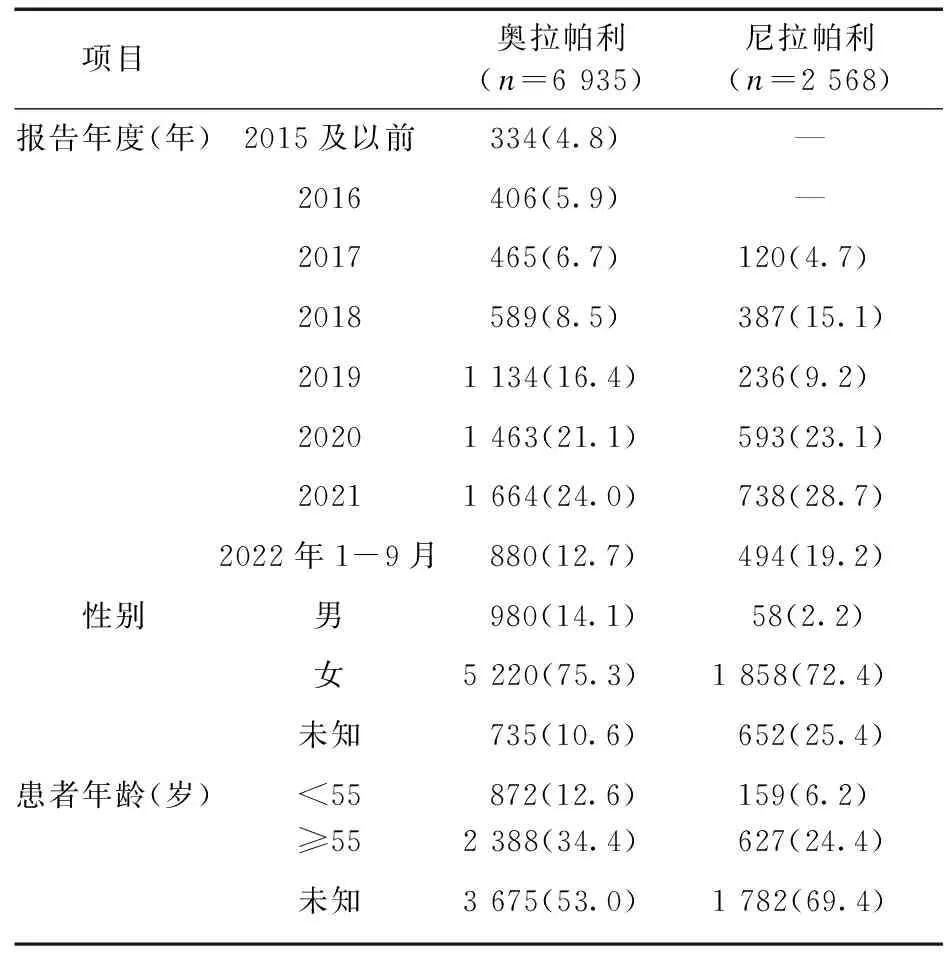
表3 奥拉帕利和尼拉帕利ADE报告年度以及患者性别、年龄[例(%)]
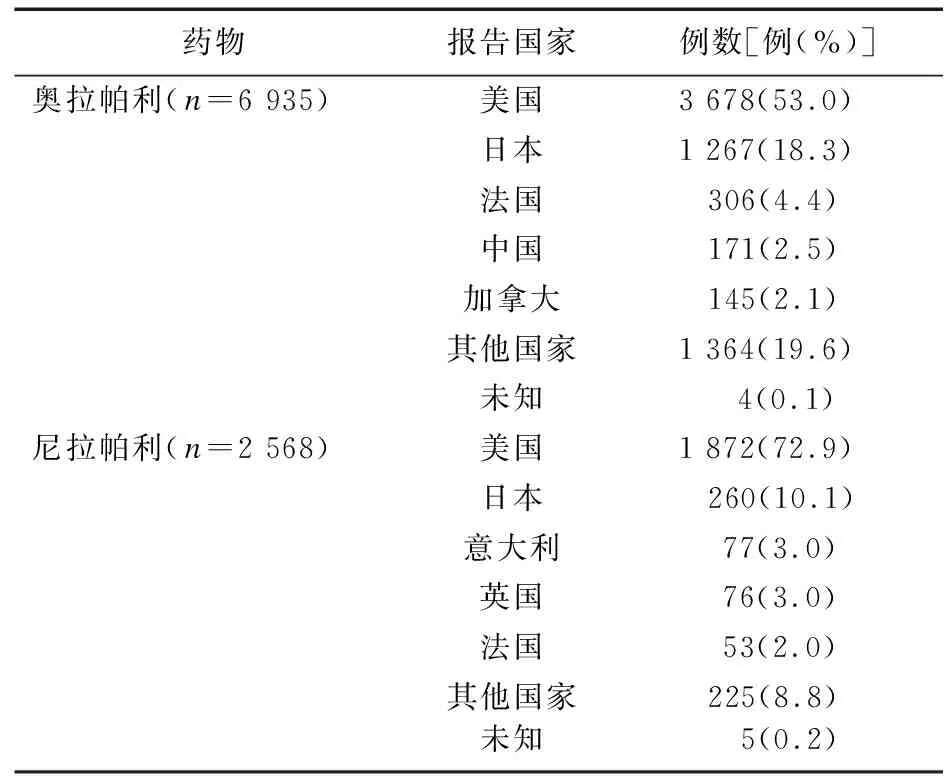
表4 奥拉帕利和尼拉帕利ADE报告国家(前5位)
2.2 ADE发生频次 将ADE按照发生频次进行排序,奥拉帕利发生频次排名前20位的ADE如表5所示,主要涉及:全身性疾病及给药部位各种反应,良性、恶性及性质不明的肿瘤,胃肠系统,血液及淋巴系统疾病,各类检查,呼吸系统、胸及纵隔疾病,代谢及营养类疾病,肾脏及泌尿系统疾病,共9个SOC,其中发生频率最高的ADE为“死亡”。其中8个信号未在奥拉帕利药品说明书中提及。
尼拉帕利发生频次排名前20位的ADE如表5所示,主要涉及:各类检查,全身性疾病及给药部位各种反应,良性、恶性及性质不明的肿瘤,胃肠系统,血液及淋巴系统疾病,精神病类,代谢及营养类疾病,外科及内科的各种操作与治疗,肾脏及泌尿系统疾病,各类神经系统疾病,外科及内科的各种操作与治疗,共11个SOC,其中“疲劳”的发生频率最高。其中8个信号未在尼拉帕利药品说明书中提及。
2.3 ADE信号强度 经ROR法和PRR法共检测到124个奥拉帕利ADE信号(累及14个SOC)及144个尼拉帕利ADE信号(累及18个SOC)。信号强度排名前10位的ADE见表6。ADE信号的SOC分布见图1。奥拉帕利和尼拉帕利的ADE信号主要集中在血液及淋巴系统疾病、胃肠系统、各类检查等方面。其中奥拉帕利的生殖系统及乳腺疾病、免疫系统疾病、外科及内科各种操作与治疗、精神病类ADE信号少于尼拉帕利。
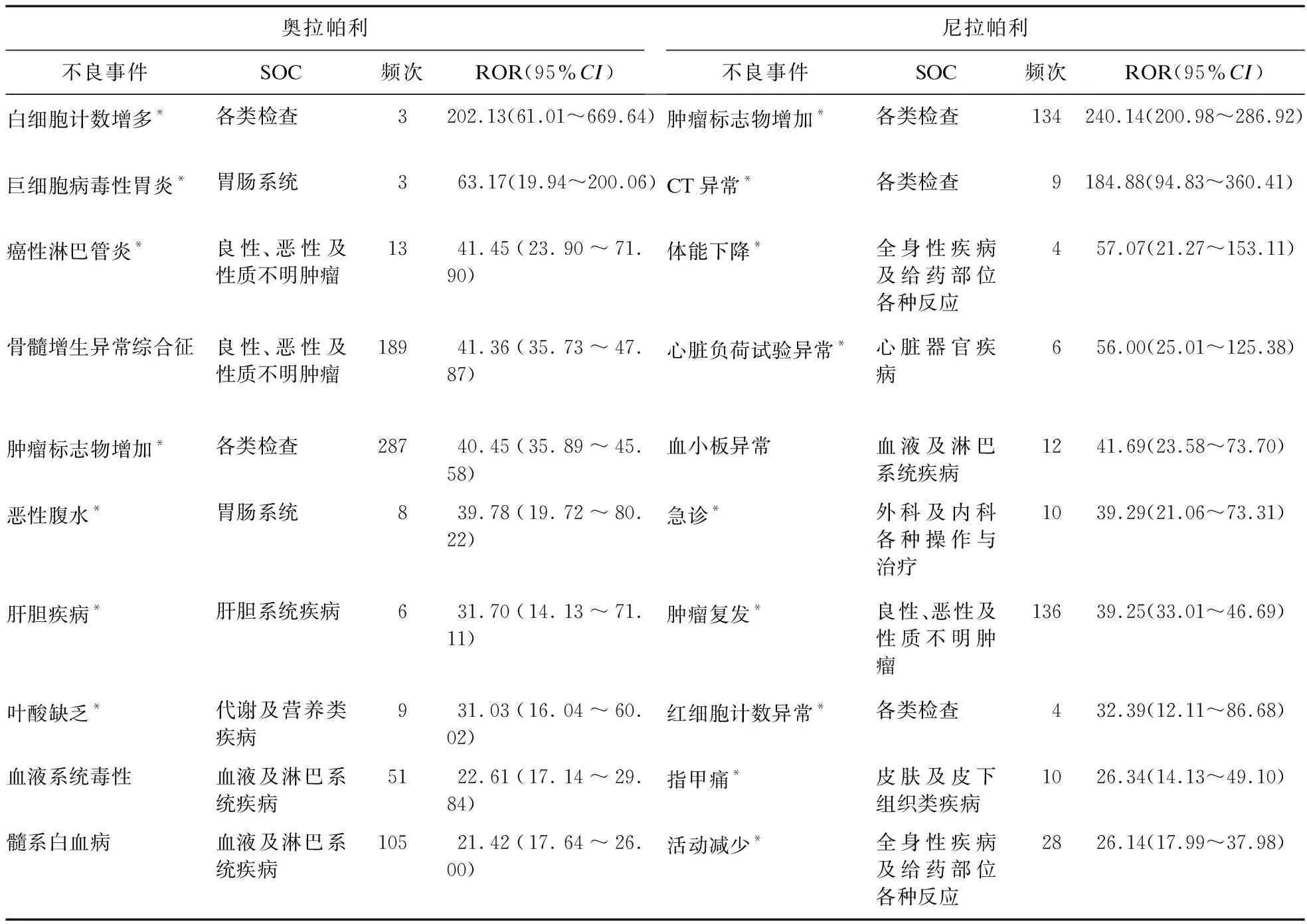
表6 奥拉帕利和尼拉帕利信号强度排名前10位的ADE
3 讨论
3.1 ADE报告检索与筛选结果 FAERS数据库初始检索到奥拉帕利相关ADE报告7 811份,尼拉帕利14 421份,尼拉帕利的ADE报告数约为奥拉帕利的2倍。尼拉帕利的上市时间晚于奥拉帕利,且年销量仅为奥拉帕利的1/3,因此,在真实世界中尼拉帕利的ADE发生频率更高。然而,考虑到ADE相关内容信息不完整的ADE报告可能会影响数据的质量和分析的结果,本研究排除了信息不完整的报告。6 935份(88.8%)奥拉帕利ADE报告不良事件信息完整,纳入研究。但尼拉帕利的ADE报告仅有2 568份(17.8%)纳入后续统计。尼拉帕利报告缺失值较多的原因尚不明确,但排除低质量报告后,大大增加了后续分析的可靠性。本研究合并了中文含义相同的ADE,但部分PT如肿瘤进展、肿瘤转移、全血细胞减少、血液系统毒性、骨髓衰竭等存在语义交叉,不能简单合并,对其分别统计后,根据SOC进行分类。
3.2 奥拉帕利高频次ADE 奥拉帕利发生频次在前20位的ADE大多被药品说明书记载,包括:恶心、贫血、疲劳、血小板计数下降、食欲下降、全血细胞减少、血红蛋白降低、白细胞计数下降和中性粒细胞计数下降,与药品说明书较为一致,主要表现在血液系统以及胃肠系统2种SOC中。超过20%的患者会出现上述不良反应[7],后者属于抗肿瘤治疗的普遍不良反应,一般反应较轻,在患者可以耐受的情况下,可继续进行抗肿瘤治疗[8-9]。
奥拉帕利说明书中,“注意事项”下提及骨髓增生异常综合征/急性髓系白血病(MDS/AML)不良反应。一项荟萃分析结果显示,PARP抑制剂可增加MDS/AML的风险,发生率为0.73%[10]。发生MDS/AML的患者多为BRCA基因突变携带者[11]。研究显示,奥拉帕利的暴露时间和年龄可能是MDS/AML发生的危险因素[12-13]。在奥拉帕利治疗期间需特别注意MDS/AML的发生,特别是疗程较长的老年患者,一旦确诊应停止奥拉帕利治疗,并进行适当治疗。
奥拉帕利发生频次较高但未被说明书提及的ADE包括肠梗阻、间质性肺病、肾功能损害等。目前,尚无奥拉帕利致肠梗阻和肾功能损害的文献报道,有1例间质性肺病的文献报道[14]。“肾功能损害”的概念较广,目前尚不明确奥拉帕利损伤肾功能的具体表现。然而,有研究表明,奥拉帕尼可能使肌酐水平升高,但不影响肾小球滤过率(GFR),因此,用肌酐计算eGFR,将会低估患者的肾功能[15]。综上,提示医生需在治疗期间对患者进行全面的监测,特别是肾功能的评估,尽早识别ADR的发生。
另外,频次较高的ADE还包括抗肿瘤治疗失败导致的肿瘤进展、肿瘤转移、肿瘤复发等肿瘤相关SOC的信号。这些信号与肿瘤患者原患疾病的症状出现重叠,提示患者肿瘤的进展或者复发情况,因此,说明书不良反应中未收录。
3.3 尼拉帕利高频次不良事件 尼拉帕利发生频率前20位的不良事件中,血小板计数下降、疲劳、恶心、高血压、贫血、便秘、失眠、呕吐、食欲下降、肾功能损害、白细胞计数下降、血肌酐升高已记载于说明书中。此外,尼拉帕利的高频次不良事件包括住院和治疗中断,表明尼拉帕利的ADE对患者治疗的影响较大,且可能较严重。
尼拉帕利说明书中未提及的高频次不良事件中,排除与肿瘤控制相关的肿瘤进展、肿瘤复发、肿瘤标志物增加等,新的ADE包括红细胞计数下降和外周神经病变。虽然说明书和文献中未明确提出,但考虑红细胞计数下降与尼拉帕利治疗导致的贫血等血液毒性相关。有研究表明,PARP抑制剂会影响红细胞的寿命,导致红细胞减少[16],因此,对PARP选择性更高的尼拉帕利对红细胞的毒性可能更大。目前,尚无尼拉帕利导致外周神经病变的报道,但卵巢癌化疗所导致周围神经病变较为常见[17],在尼拉帕利等靶向治疗中应注意此类ADR的发生。
3.4 新的ADE风险信号 本研究采用PRR法和ROR法计算ADE信号强度,筛选出与目标药物相关性较高的124个奥拉帕利ADE信号和144个尼拉帕利ADE信号。但计算方法只能表明药物与ADE信号有统计学关联,仅具提示作用,明确的因果关系还需要进一步研究和评估才可用于指导临床制定和调整治疗方案。
奥拉帕利ADE信号前10位的ADE中,出现了7个新的高风险信号:白细胞计数增多,巨细胞病毒性胃炎,癌性淋巴管炎,肿瘤标志物增加,恶性腹水,肝胆疾病,叶酸缺乏。尼拉帕利信号强度前10位的ADE中,出现了9个新的高风险信号:肿瘤标志物增加,CT异常,体能下降,心脏负荷试验异常,急诊,肿瘤复发,红细胞计数异常,指甲痛,活动减少。由于PRR法和ROR法具有灵敏度高,特异性低,可能出现假阳性结果的特点[18],考虑奥拉帕利的“白细胞计数增多”和“巨细胞病毒性胃炎”,以及尼拉帕利的“心脏负荷试验异常”信号强度高但出现频次较低,且目前尚无研究支持,可能为假阳性信号。其余ADE作为新的高风险信号,提示医师需予以高度关注,在临床实践中应引起高度警惕。
3.5 奥拉帕利与尼拉帕利的不良事件信号对比 尼拉帕利的ADE发生频率可能更高,涉及的SOC更多,影响的器官系统更广泛,具有失眠、高血压、肾功能损害等奥拉帕利没有的不良事件。而奥拉帕利血液毒性更强,MDS/AML发病率更高,可能会出现感染及侵染类疾病,如呼吸道感染、间质性肺病以及关节痛/肌痛等特殊不良事件。
在治疗过程中应特别注意两种药物对各个器官系统的影响,密切监测,预防不良事件的发生。两种药物在临床使用中应当权衡利弊,谨慎使用,针对患者不同的身体状况以及可能发生的不良反应合理选择药物。PARP抑制剂总体上毒性低于化疗药物,但仍需对其可能会发生的不良反应进行严格管理,除了对常见的血液毒性做好监测外,对少见的MDS/AML、感染类疾病等不良反应的发生也应引起足够的重视。
3.6 局限性 本研究存在一些局限性,如FAERS数据库来源冗杂,数据信息缺失较多,筛除大部分尼拉帕利的ADE报告可能会造成数据的偏倚。FAERS报告大部分来源于欧美国家,可能存在种族偏倚。同时,在信号挖掘方法上,可能会出现一些假阳性信号等。期待后续真实世界临床大数据研究对两种药物的不良反应数据进行深入对比和评价,以提高奥拉帕利和尼拉帕利在临床使用中的安全性和有效性。
