胃癌化疗病人生物电阻抗相位角与营养状况的关系
2024-01-04黄阿美尚美美王兴莉庞增粉许子涵陈艳红侯文红孟英涛
黄阿美,尚美美,王兴莉,庞增粉,杨 静,许子涵,陈艳红,侯文红,王 迪,孟英涛
山东第一医科大学附属肿瘤医院(山东省肿瘤防治研究院 山东省肿瘤医院),山东 250117
胃癌是消化道常见的恶性肿瘤之一,也是全球第三大最常见的癌症死亡原因。据2020 年全球相关数据统计,胃癌新增病例超过100 万例,约占所有癌症诊断人数的6%,新增死亡例数约76.8 万例,约占所有癌症死亡人数的8.2%[1]。由于胃癌缺乏特异性临床表现,很多病人确诊时已处于胃癌中晚期,丧失手术治疗时机,化疗成了首选治疗方法,但由于肿瘤机械性因素造成的消化道梗阻、肿瘤本身直接导致的消化吸收不良以及化疗带来的食欲缺乏、恶心呕吐等不良反应,导致机体组织及器官正常的生理功能严重紊乱[2]。研究表明,晚期胃癌化疗病人营养风险或可疑营养不良发生率可达84.27%[3]。而营养不良会直接影响病人的临床结局,包括化疗耐受性差、生活质量下降,甚至影响病人的预后[4]。
生物电阻抗技术(bioelectrical impedance analysis,BIA)被广泛用于人体成分分析、营养状况评估、干预效果监测等[5-6]。其主要是利用人体细胞内外液及细胞膜的电学性质测量不同电频率下的电阻和容抗,通过预测公式估算人体成分及其变化。相位角(phase angle,PA)是生物电阻抗技术衍生出的一项指标,是根据人体细胞内外液实际测得的电阻和容抗计算所得,反映细胞膜的完整性和细胞内外水分分布情况,可用于评估营养状况[7]。PA 可预测疾病营养状况已在不少疾病中得到验证[8-10],然而在不同疾病以及种族中PA 的临界值有着不同的界定,但在胃癌化疗病人中还未进行报道。本研究分析胃癌化疗病人PA 与营养状况的关系,探讨PA 对营养不良的预测价值。
1 资料与方法
1.1 一般资料
选取2021 年8 月—2022 年6 月在我院治疗的180例胃癌化疗病人为研究对象。纳入标准:1)经病理确诊为胃恶性肿瘤;2)行化学治疗;3)病人知情同意。排除标准:1)安装心脏起搏器或动脉支架术后的病人;2)体内有金属物体;3)伴有不同程度的腹水、四肢水肿者;4)无法配合完成本研究者。所有病人均签署知情同意书,并经医院伦理委员会批准。
1.2 研究方法
1.2.1 病人一般资料
包括年龄、性别、体重、肿瘤分期、行为状态评分(Karnofsky Performance Score,KPS)等。
1.2.2 营养筛查与评估
营养筛查工具选用营养风险筛查-2002(Nutrition Risk Screening,NRS-2002),NRS-2002 包括疾病状态、营养状态、年龄得分≥3 分即有营养风险[11];营养评估工具选用病人主观整体评估(Patient-Generated Subjective Global Assessment,PG-SGA),PG-SGA 是专门针对肿瘤病人设计的特异性营养评估量表,能主观反映病人营养相关症状与需求。PG-SGA 由病人自我评估和医务人员评估2 部分组成,第1 部分由病人自己评估,包括体重、饮食、症状、体征、活动和功能;第2部分由医务人员评估,包括疾病、年龄、代谢应激状态、体格检查。PG-SGA 定性评价评估结果为:0~1 分为营养良好(A);2~8 分为可疑或中度营养不良(B);≥9分为重度营养不良(C)[12-13]。
1.2.3 人体成分分析
使用AiNST 多频临床营养检测分析仪测定人体成分,测量PA 数据。由接受过统一正规操作流程培训的工作人员完成测量。选定10:00~12:00、14:00~17:00 2 个时间段检测,病人在检测前2 h 不能进食、大量饮水,保持赤足站立位进行测量。测量指标包括基础代谢、身体细胞量、体脂百分比、去脂体重、体脂肪、腰臀比、内脏脂肪面积、蛋白质、骨骼肌、上臂围度、上臂肌肉围度、四肢骨骼肌质量指数、肌肉量、躯干肌肉量、细胞外水分、细胞内水分和总水分。
1.2.4 生化学指标
包括血清白蛋白、前白蛋白、总蛋白、三酰甘油、总胆固醇、超敏C 反应蛋白、血糖、血红蛋白、淋巴细胞计数、白细胞计数。
1.3 统计学方法
将所得数据录入SPSS 21.0 统计软件进行分析,符合正态分布的定量资料用均数±标准差(±s)表示,定性资料用例数、百分比(%)表示,两组间比较采用独立样本t检验,多组间比较采用方差分析,定性资料采用χ2检验进行比较。采用受试者工作特征(ROC)曲线来评估诊断效能,相关分析采用Pearson相关分析,计算低PA 组发生营养不良的相对危险度(risk ratio,RR)。以P<0.05 表示差异有统计学意义。
2 结果
2.1 180 例胃癌化疗病人PA 值影响因素的单因素分析
180 例胃癌化疗病人整体PA 值为(5.32±1.00)°,影响胃癌化疗病人PA 值单因素分析结果见表1。
表1 180 例胃癌化疗病人PA 值的单因素分析结果(±s)单位:°
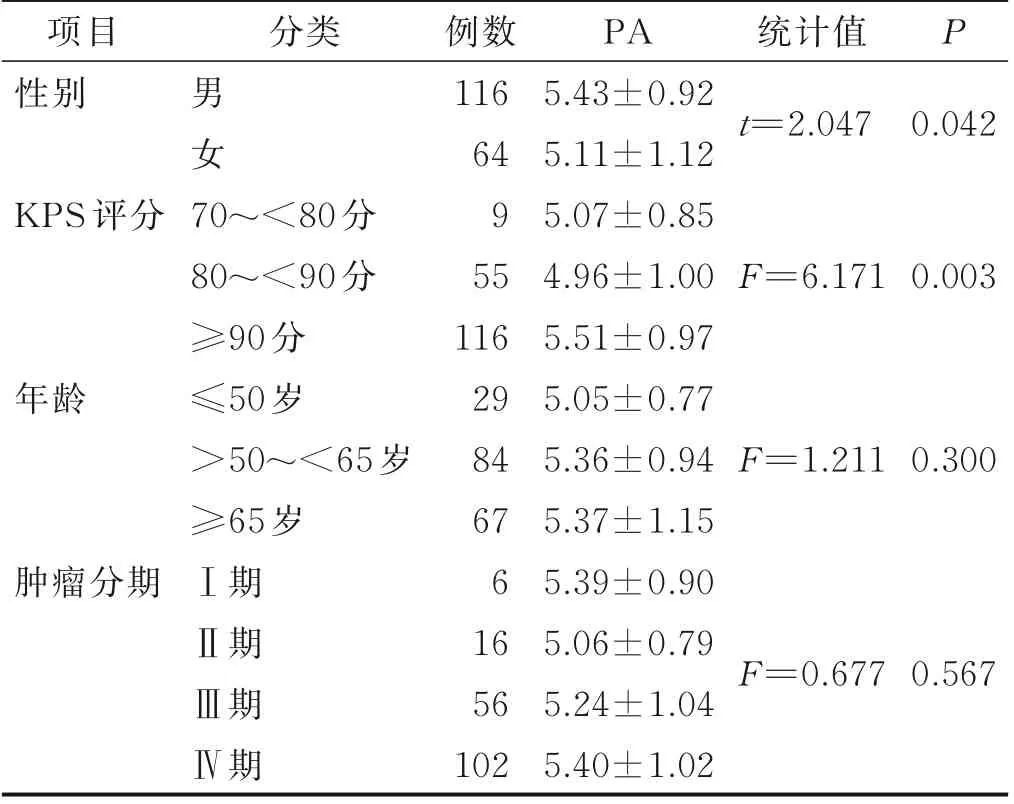
表1 180 例胃癌化疗病人PA 值的单因素分析结果(±s)单位:°
项目性别分类P男女统计值t=2.047 0.042 KPS 评分F=6.1710.003年龄F=1.2110.300肿瘤分期70~<80 分80~<90 分≥90 分≤50 岁>50~<65 岁≥65 岁Ⅰ期Ⅱ期Ⅲ期Ⅳ期例数116 64 9 55 116 29 84 67 6 16 56 102 PA 5.43±0.92 5.11±1.12 5.07±0.85 4.96±1.00 5.51±0.97 5.05±0.77 5.36±0.94 5.37±1.15 5.39±0.90 5.06±0.79 5.24±1.04 5.40±1.02 F=0.6770.567
2.2 PA 与营养指标的相关性
PA 与体重、体质指数、总白蛋白、血红蛋白、白蛋白、前白蛋白、上臂围、骨骼肌质量指数、骨骼肌、肌肉量、去脂体重、体脂肪和腰臀比呈正相关(P<0.05)。PA 与NRS-2002、PG-SGA 评分呈负相关(P<0.05),详见表2。
2.3 PA 的ROC 曲线分析
以PG-SGA 评分为标准,绘制PA 的ROC 曲线,得到PA 诊断营养不良的ROC 曲线下面积为0.859,进一步寻找最佳截断值,当以PA<5.26°作为截断值时,敏感度为0.892,特异度为0.908,约登指数为0.8,见图1。
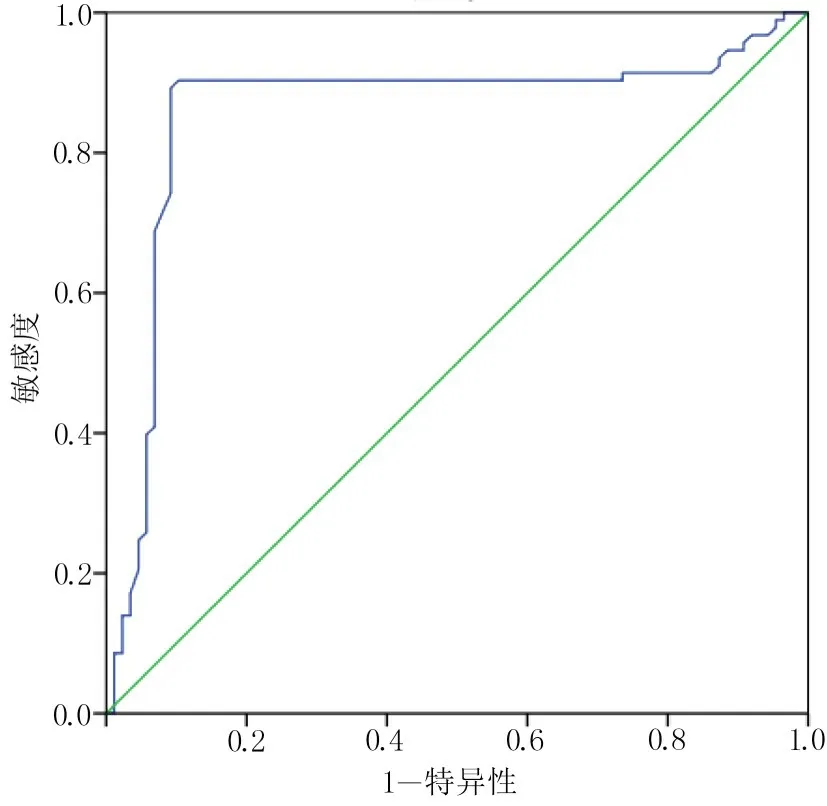
图1 PA 对胃癌化疗病人营养不良的诊断ROC 曲线
2.4 低PA 组与正常PA 组胃癌化疗病人营养状况比较
根据截断值5.26°进行分组,其中低PA 组91 例,正常PA 组89 例。低PA 组病人的体重、体质指数、肌肉量、白蛋白、去脂体重、骨骼肌质量指数、骨骼肌、血红蛋白、前白蛋白、总白蛋白、腰臀比、体脂肪和基础代谢率低于正常PA 组;低PA 组病人NRS-2002和PG-SGA 高于正常PA 组,差异有统计学意义(P<0.05),见表3。
表3 两组营养状况比较(±s)单位:°
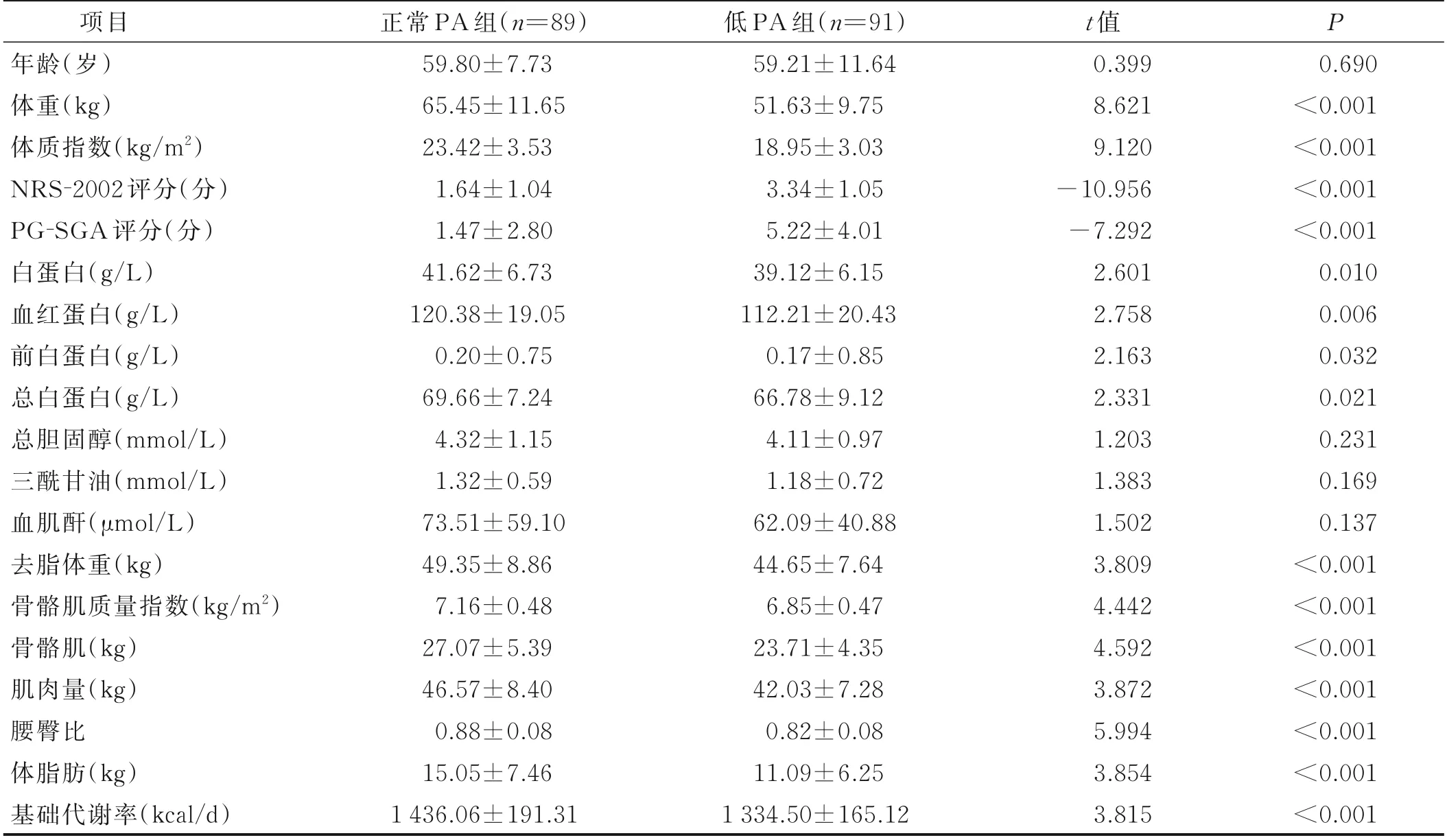
表3 两组营养状况比较(±s)单位:°
项目年龄(岁)体重(kg)体质指数(kg/m2)NRS-2002 评分(分)PG-SGA 评分(分)白蛋白(g/L)血红蛋白(g/L)前白蛋白(g/L)总白蛋白(g/L)总胆固醇(mmol/L)三酰甘油(mmol/L)血肌酐(μmol/L)去脂体重(kg)骨骼肌质量指数(kg/m2)骨骼肌(kg)肌肉量(kg)腰臀比体脂肪(kg)基础代谢率(kcal/d)正常PA 组(n=89)59.80±7.73 65.45±11.65 23.42±3.53 1.64±1.04 1.47±2.80 41.62±6.73 120.38±19.05 0.20±0.75 69.66±7.24 4.32±1.15 1.32±0.59 73.51±59.10 49.35±8.86 7.16±0.48 27.07±5.39 46.57±8.40 0.88±0.08 15.05±7.46 1 436.06±191.31低PA 组(n=91)59.21±11.64 51.63±9.75 18.95±3.03 3.34±1.05 5.22±4.01 39.12±6.15 112.21±20.43 0.17±0.85 66.78±9.12 4.11±0.97 1.18±0.72 62.09±40.88 44.65±7.64 6.85±0.47 23.71±4.35 42.03±7.28 0.82±0.08 11.09±6.25 1 334.50±165.12 t 值0.399 8.621 9.120-10.956-7.292 2.601 2.758 2.163 2.331 1.203 1.383 1.502 3.809 4.442 4.592 3.872 5.994 3.854 3.815 P 0.690<0.001<0.001<0.001<0.001 0.010 0.006 0.032 0.021 0.231 0.169 0.137<0.001<0.001<0.001<0.001<0.001<0.001<0.001
2.5 低PA 与营养不良的关系
低PA 组营养风险的比例(75.82%)高于正常PA组(11.24%),与正常PA 组相比,低PA 组的RR 为6.179[95%CI(3.431,11.128)],差异有统计学意义(P<0.05);低PA 组营养不良的比例(91.12%)高于正常PA 组(11.24%),与正常PA 组相比,低PA 组的RR 为8.445[95%CI(4.684,15.224)],差异有统计学意义(P<0.05);低PA 组前白蛋白偏低的比例(82.22%)稍高于正常PA 组(72.73%),差异无统计学意义(P>0.05),见表4。
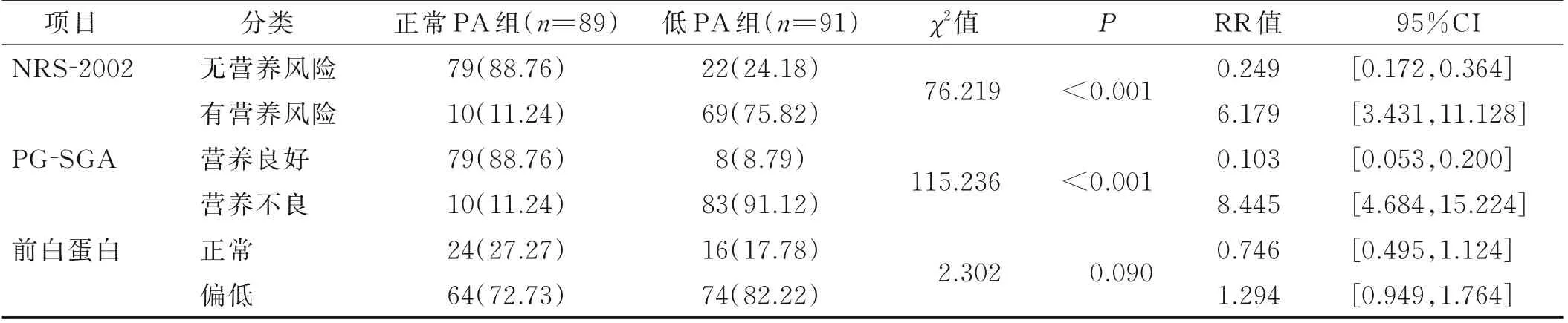
表4 两组相位角与不同营养状况组间的关系单位:例(%)
3 讨论
PA 是由生物电阻抗技术衍生出的营养状况测量指标[13],是反映细胞膜的完整性及细胞外与细胞内水分分布情况,基本原理是将人体看作导电的圆柱体,细胞内、外液视为电阻、细胞膜因其具有电压差视为电容,对电流产生容抗。而PA 是表示电阻与容抗之间关系的一项指标。高PA 被认为是细胞增多、细胞膜完整性和细胞功能良好的标志[14-15],低PA 表示细胞膜完整性和功能降低,进而提示病人营养不良,因此,PA能够作为人体的营养学指标,反映细胞的营养和健康状况,同时又因其结果客观,不受研究者测量的影响,在国内外被广泛应用[14-15]。研究显示,PA 是许多疾病,如透析病人[16-18]、炎症性肠病病人[19-20]、慢性乙型肝炎病人[21]、恶性肿瘤病人[22-24]、肺结核病人[25]、慢性阻塞性肺疾病病人[26-27]的预后指标,不同种类的肿瘤有不同的PA 临界值,如喉癌病人PA 临界值为5.89°[24],肺癌病人为6.00°[28]。本研究根据ROC 曲线,PA 的临界值为5.26°,低PA 组病人NRS-2002 评分和PG-SGA评分高于正常PA 组,且PA 与NRS-2002和PG-SGA 评分均呈负相关,即胃癌化疗病人PA 值越低,NRS-2002评分和PG-SGA 评分越高,表明病人营养状况越差。在效度评价方面,敏感度为0.892,特异性为0.908,且ROC 曲线下面积为0.859,提示本研究探索的PA 临界值作为营养不良的预测值有较高的诊断价值,是早期发现胃癌病人营养不良的敏感指标。
本研究结果显示,PA 与体重、体质指数、总白蛋白、血红蛋白、清蛋白、前白蛋白、上臂围、骨骼肌质量指数、骨骼肌、肌肉量、去脂体重、体脂肪和腰臀比呈正相关,与NRS-2002、PG-SGA 得分呈负相关。低PA组病人的体重、体质指数、总白蛋白、血红蛋白、清蛋白、前白蛋白、骨骼肌质量指数、骨骼肌、肌肉量、去脂体重、腰臀比、体脂肪和基础代谢率低于正常PA 组。骨骼肌质量指数降低是营养不良的显著特征,也是肌肉减少症的重要特点,PA 与骨骼肌质量指数变化意味着胃癌化疗病人营养风险增加,这与周红等[29]研究食管癌病人营养状况的研究结果一致。
美国肠外肠内营养学会(America Society for Parenteral and Enternal Nutrition,ASPEN)指出,营养诊疗的3个关键步骤为营养筛查、营养评估和营养干预,且营养筛查与评估与营养干预同等重要[30]。NRS-2002不仅作为住院病人营养筛查的首选工具[31],还可动态监测病人营养变化,及时筛选有营养风险的病人[32]。PG-SGA 是肿瘤病人营养评估工具,通过由病人自我评估部分及医务人员评估部分2 部分组成的定性及定量评估[33-34]。此外,前白蛋白水平也可作为营养状态的评估手段[35]。本研究结果显示,低PA 组有营养风险的比例高于正常PA 组;低PA 组营养不良的比例高于正常PA 组,与高飞等[35]的研究结果不一致,分析原因可能与样本量有关。常规的NRS-2002 和PG-SGA营养筛查和评估工具各有优缺点,如评估量表问题条目多、耗时多,体格检查需专业人员进行,且容易受到主观因素影响,PA 通过多频营养检测分析仪测量得出,测量数据准确。因此,PA 可作为胃癌病人营养风险筛查和评估的指标。
4 小结
本研究中人体成分检测PA 与营养筛查评估指标NRS-2002 评分、PG-SGA 评分、体质指数及生化学指标等具有较好的相关性,并且测量省时、数据精确、不受主观因素影响,可作为早期预测胃癌病人营养不良的有效指标。未来将严格进行质量控制,进一步扩大样本量,深入研究PA 对临床预后的预测价值,以期及时识别营养不良,及早对病人进行营养干预,改善病人营养状态,继而改善临床结局。
