手性农药的环境行为及毒理学研究进展
2024-01-04郭远选卓海华金士威
郭远选,王 静,周 佳,马 慧,彭 姣,卓海华,金士威*
1. 中南民族大学催化转化与能源材料化学教育部重点实验室,催化材料科学湖北省重点实验室,湖北 武汉 430074;2. 临海市工投产业服务有限公司,浙江 临海 317000;3. 生态环境部长江流域生态环境监督管理局生态环境监测与科学研究中心,湖北 武汉430010
随着农业生产活动的不断发展,大量不同种类的农药被用在农作物的生长过程中。农药的施用,能够有效防治病虫害的发生,提高作物产量。但是,农药的大量施用不仅会导致土壤板结、病虫对农药的抗药性增加,还会导致农药在土壤、水体、农作物等环境介质中残留,最终进入人体内,威胁人体健康。手性农药作为一类具有特殊结构的农药,一般在生物活性、生态毒性和环境行为等方面表现出对映选择性差异[1]。
在20 世纪,手性农药常常被视作单一的化合物进行分析研究,但由于立体性是构成世界生命活动的重要性质,世界上大部分的参与生命活动的高聚分子都会存在着手性特征,比如核酸、蛋白质和多糖等大分子,在自然界的活动中(正常生长和代谢的过程中),参与活动的分子会逐渐在自然界的选择中向其中的某一种构型发生累积和转变。而且越来越多的研究表明,在农业生产活动的过程中,残留在自然界的手性农药会逐渐进入各种生命体内,在生命体的代谢过程中,这些手性农药的对映体会经过各种介质,存在着不同的降解和富集方向。而不同的手性对映体药物,在生命活动过程中与生物体内的各种酶或其他介质发生反应,在反应过程中手性农药对映体会与介质发生不同的代谢反应,具有不同的药理性和生理作用。立体选择性会存在于生命活动的过程中,是必然存在的过程。由于手性农药在自然界中的对映体分布不同,由此可以推断手性农药对映体会被自然界中的生命体选择性地吸收、代谢和降解。而且手性农药对映体会存在着不同的致畸、致癌、致突变等不同的潜在生物效应。由于评估和限制与接触手性农药相关风险的必要性,该领域的研究在过去几年中有所增长,手性农药被认为是新兴污染物[2]。
手性农药对映体在药理作用中,一般表现为某个对映体对靶标物有着高效作用,而其他的对映体则作为干扰杂质,或者更加低效、无效甚至有害地作用存在于手性农药外消旋体中[3]。由于这些干扰物质的存在,手性农药外消旋体在农业生产活动中的作用被降低,并且一定程度上给环境带来了负担。一般手性农药在环境中的含量较低,并且在不同的环境介质中会持续向着不同的对映体转变。在长期的低水平暴露下,手性农药对动物或人体具有潜在毒性。目前拟除虫菊酯、有机磷、有机氯、苯氧丙酸及咪唑啉酮类农药引起的非靶标毒性都呈现不同程度的对映体选择性。手性农药可以通过各种模式进入生态系统,手性农药残留及其代谢物在温和条件下具有很强的生物抗逆性和稳定性,而在常规条件下不能有效降解,因此在环境中存在手性农药残留及其代谢物已被广泛报道[4]。
1 手性农药的环境行为
目前有关于手性农药在水体环境中的选择性行为的研究主要集中于有机氯类农药。在环境污染监测中,有机氯类农药是被监测研究最多的环境污染物,由于有机氯类的农药在环境中危害较大,在早年间已经被禁止使用,但由于之前被大量施用,使得它们时常会在生态系统食物链中被检测出来。在拟除虫菊酯类手性农药中部分品种也具有手性特征。苯氧羧酸类手性农药的活性主要集中在R-对映体上,体现出了高度的立体选择性。而对于酰苯胺类手性农药对映体一般是作为内吸型的高效抑菌剂,有着预防和治疗霜霉目真菌病害的作用,但是对该类手性农药的研究很少涉及在对映体水平。
1.1 手性农药在水体中的环境行为
1.1.1 手性农药在海水中的环境行为 早期于1991 年,用毛细管气相色谱法测定了北海海水中的α-六六六,证明了该手性污染物在环境中存在着选择性降解行为,随后在波罗的海和德国湾中的海水检出的对映体比率(enantiomeric ratio,ER)值为0.85,证明了在该区域水体中,(-)-α-六六六被优先降解[5]。α-六六六在楚科奇海和白令海的水中的(-)-α-六六六会被优先降解,而在格陵兰海和北冰洋的水中则与之相反[6]。敌百虫在海水中的不同存在条件下会向着不同的方向降解[7],其对映体在光照、黑暗及自然培养模式下均是S体构型被优先降解,但在去光灭菌条件下未观测到选择性降解现象。
1.1.2 手性农药在淡水中的环境行为 在1995 年于北极Amituk 湖中的淡水里也发现了α-六六六存在着立体选择性降解,ER 值为0.77[8]。在我国首次检测了新港港湾水域和海河河口中α-六六六的ER 值,在新港港湾水体中(+)-α-六六六被优先降解,而海河河口水中α-六六六的ER 值近似为1[9]。表明同一种手性农药在不同的环境水体中存在着不同选择性降解行为。Huang 等[10]在珠江三角洲流域的城市污水及河流中进行了手性农药的分布监测,其中发现了3 种咪唑类(益康唑、酮康唑、咪康唑)及1 种三唑类(戊唑醇),其监测结果表明,在该次研究的手性农药在原水中一般以外消旋体的形式存在,其对映体组成和馏分(enantiomeric compositions and fractions,EF)值为0.450~0.530,而戊唑醇在河流中基本上以非外消旋体的形式存在,尤其是夏季的河流中会存在较多的(+)-戊唑醇构型。不同种类的手性农药也会产生不同的选择性降解行为。如Zipper 等[11]利用气相色谱与质谱联用技术测定了地下水中的2-甲-4-氯丙酸对映体,并且定量检测其含量,结果表明在沥出液中该手性农药以外消旋体的形式出现,而在下游的地下水中的ER 值增加。可以推测出是2-甲-4-氯丙酸在环境水体中存在选择性的生物降解。Sun等[12]监测等马拉硫磷在上庄水库水、京密引水渠水以及其地下水和河水等水体中的降解行为,结果表明S-(-)-马拉硫磷降解快于R-(+)马拉硫磷,其对映体R 构型在研究区域中相对富集,并且同时还证明了马拉硫磷对映体之间是相互转化的。吡氟禾草灵对映体不同的水体条件下,会有着不同的选择性降解行为,例如水体的pH 等条件[13],在自然界中的条件下,其S-毗氟禾草灵构型会被优先降解,而在其他条件水样中,研究人员尚未观测到吡氟禾草灵的对映选择性降解行为。氟虫睛对映体在通过沉积物-水模拟系统研究[14]中发现R-氟虫腈优先降解,表明其对映体在水中存在显著的选择性降解行为。可以推测出,大部分的手性农药在环境水体中存在一定程度的立体选择性降解行为。
1.1.3 手性农药在饮用水中的环境行为 环境水体中存在的手性农药,最终会出现在各类饮用水中被人类摄入。孙彦[15]检测了市政自来水、桶装水和瓶装水3 种不同类型的饮用水中的6 种手性农药,其结果表明检出的手性农药在不同类型饮用水中其对映体选择性一致,但不同类型饮用水中对映体选择性程度有一定的差异。腈菌唑在三类饮用水中的EF 均值均为0.57。而已唑醇、戊唑醇以及甲霜灵在其检测的3 种水体中的对映体分布程度存在明显的差异,结果表明检出的对映体选择性程度与饮用水类型有关。甲霜灵在桶装水中的对映体选择性不明显,但R-甲霜灵在自来水中相对较多,相对而言,手性农药中S-甲霜灵对人体的危害更大[16]。
1.2 手性农药在土壤中的环境行为
1.2.1 手性农药在不同物理性质土壤的环境行为土壤存在着能量交换和物质循环的发生,也存在着农药分解的现象。公开数据显示,农药施用之后,其80%以上会以不同的形式进入土壤。土壤中的理化性质较为复杂,针对于不同物理性质土壤对手性农药的影响的研究也陆续地开展。Qin等[17]对氯菊酯在两种不容类型的土壤及一种沉积物中的立体选择性降解的探究中发现,R-对映体的降解速率都明显高于S-对映体。Liu 等[18]对加州苗圃地土壤中顺式-联苯菊酯和顺式-氯菊酯的降解研究情况中可以发现,土层的深度影响着手性氯菊酯的降解方向,表层土壤的氯菊酯对映体未发生明显的立体选择性降解行为,而随着手性农药在土壤中的深度的增加,不同的对映体会呈现出显著的立体选择性降解行为。以上研究表明,手性农药在土壤中一般均会有选择性降解行为,但是却存在较多的可能性因素影响其对映体立体选择性降解行为。
1.2.2 手性农药在不同化学性质土壤的环境行为手性农药的立体选择性密切相关包括土壤本身的性质(如pH 值等)以及微生物结构等条件。Buser等[19]使用气质联用技术研究甲霜灵在土壤中的降解行为,结果表明其R-对映体降解速度快,从而导致了非活性的S-对映体富集,说明了甲霜灵在土壤中的降解是与土壤中的微生物相关的;在其后来进一步的研究中表明,光学纯单体实验结果显示R-对映体和S-对映体之间没有互相转化,并且甲霜灵在好氧土壤中的选择性降解与土壤的pH值有直接的关系。2010 年刁金玲[20]将外消旋乳氟禾草灵在多种不同条件的土壤中进行降解模拟,研究外消旋乳氟禾草灵在土壤中有氧或者无氧条件下的选择性降解情况。在有氧/无氧条件下,S-(+)-乳氟禾草灵均优先降解。该手性农药立体选择性的量度[a measure of enantioselectivity,ES,ES=(kS-kR)/(kS+kR)]值与土壤的有机质无明显线性关系而与土壤质地和pH 值呈线性相关,均表现为pH 值越大ES 值越小。
1.2.3 手性农药在不同生物性质土壤的环境行为手性农药不同的对映体同样对土壤的性质和土壤中的微生物产生影响[21]。在灭菌条件下,该外消旋乳氟禾草灵在土壤中的降解极为缓慢,并且没有明显的立体选择性行为,说明微生物作用会对该手性农药在土壤中的选择性行为产生影响。在3 种土壤在自然和无菌条件下,吡唑硫磷农药对映选择性降解行为,手性吡唑硫磷在自然环境土壤下的立体选择性降解行为为S-(+)-吡唑硫磷的半衰期t1/2为2.6、13.4、7.8 d,而R-(-)-吡唑硫磷的半衰期为9.2、9.3 和8.2 d。在灭菌条件下的土壤中,外消旋体吡唑硫磷的半衰期为21.5、55.9 和14.4 d,表明天然土壤中的手性农药降解速率大大提高,说明在土壤中微生物调节过程对降解产生很大的积极作用[20]。同样的,在未灭菌的土壤样品中,草铵膦外消旋体在土壤中降解较快,且存在立体选择性降解,在灭菌的土壤中草铵膦外消旋体降解缓慢且无立体选择性行为。早期于1991 年,Mueller 等[22]在生产α-六六六的工厂附近的土壤中检测到α-六六六存在立体选择性降解行为,ER值为1.099 9。Falconer 等[23]在菲沙河Fraser 谷地农场的腐殖型土壤中检测发现(-)-α-六六六优先降解。而Buser 等[24]研究了好氧条件下在污泥中的选择性降解,发现(+)-α-六六六降解明显快于(-)-α-六六六,生物降解是六六六在污泥中的主要降解方式,因此(-)-α-六六六会在土壤中表现出明显的富集现象。
1.3 手性农药在植物体内的环境行为
1.3.1 手性农药在野生植物中的环境行为 手性农药的立体选择性行为在自然界中广泛存在,立体选择性行为会存在于植物对手性农药的吸收、代谢等过程,由于此过程中存在立体选择性,所以会有不同浓度的对映体在植物体内累积,手性农药对植物产生对映选择性毒性或生态毒性,这些手性农用化学品可以被植物吸收和对映选择性代谢。在大多数的阔叶杂草中手性农药2-(2,4-二氯苯氧基)-丙酸和2-(4-氯-2-甲基苯)丙酸的S-对映体均表现出优先降解的现象,导致R-对映体的相对累积。在草地早熟禾和高羊茅体内乙氧呋草黄对映体中的左旋体的降解速率大大快于右旋体,最高ER 值达到3.0 左右[25]。
1.3.2 手性农药在农作物中的环境行为 不同类型的食物中的手性农药代谢降解及残留的对映体选择性规律也不同。禾草灵在白菜和油菜中也存在着立体选择性降解,在2 种植物中,该手性农药都是S-对映体被优先降解,同时研究发现禾草灵被代谢之后产生的代谢物的生成与降解也具体由立体选择性,S-禾草酸的生成与降解速度明显快于R-禾草酸[26]。
戊唑醇在黄瓜和白菜中均表现为S-对映体优先降解,R-对映体在植物体内相对累积,而在苹果中S-对映体却相对富集,在白菜中,具有高毒性低活性的R-氟虫腈对映体会优先降解,使得低毒性高活性的S-对映体在白菜中富集[27]。检测白菜中3 种氟虫腈代谢物结果中发现,氟虫腈在白菜体内主要靠氧化还原光解作用降解[28],其中该对映体在白菜中的主要降解原因可能是氧化还原作用。甲霜灵在水稻、番茄、黄瓜、菠菜等植物中的对映体选择性也不同,在温室的黄瓜中R-甲霜灵对映体降解比S-对映体快,而菠菜和小白菜中均是S-对映体优先降解[29],在水稻中EF 值在14 d 的时候能达到0.7,而番茄中的EF 值在14 d 时为0.26[30];而甲霜灵在甘蓝中并没有出现其对映体的立体选择性降解。以上结果表明,植物的种类也与手性农药的立体选择性降解有着一定的关联,同种手性农药在不同植物中可能会出现相反结果的立体选择性行为,同时手性农药的EF 值在植物体内并非固定值,会随着其生命活动变化。
1.3.3 手性农药在同种植物中不同部位的立体选择性 手性农药的立体选择性行为在同一植物体内也会有不同的表现。同种手性农药在植株的不同的部位会有不同程度的立体选择性,比如氯丹在南瓜植株根系附近土壤中的残留会低于非根系土壤,并且氯丹对映体的EF 值在土壤中未发生明显的变化,表明氯丹在被南瓜从土壤中吸收时并未有明显的选择性吸收[31]。而将南瓜的不同部位进行分段检测,发现根部氯丹残留较多,南瓜果实氯丹残留较少,且EF 值有所区别。手性农药对映体的选择性还表现在对植物生长的抑制等方面。咪唑乙烟酸R和S对映体对水稻根产生较大的抑制生长的作用,其最大的相对抑制率分别为80.4%和67.0%,水稻幼苗经过R-咪唑乙烟酸对映体暴露过后,其植株体内氧化物歧化酶(superoxide dismutase,SOD)、氧化物酶(peroxidase,POD)、过氧 化 氢 酶(catalase,CAT)活 性 以 及 丙 二 醛(malondialdehyde,MDA)的含量分别是经S-咪唑乙烟酸对映体暴露过的1.8、3.3、1.4 和2.2 倍[32],以上均表明咪唑乙烟酸的R-对映体对水稻的胁迫作用比S-对映体要强。而R-咪唑乙烟酸对映体对玉米幼苗根直径、体积、侧根数、根系活力、根毛生长等的抑制及伤害能力远远大于S-对映体。而多效唑对映体对油菜和玉米幼苗具有不同的调节作用,其外消旋体和S-对映体会使玉米幼苗的茎横向延伸,而R-对映体抑制玉米幼苗茎的横向延伸。多效唑不同的对映体对玉米幼苗MDA 含量、蛋白含量、SOD 和POD 酶等的活性的影响也具有选择性[33]。手性农药在植物体内的立体选择性行为还可以体现在不同的施药方式上。南瓜在叶面喷施模式下施用氯丹,并未表现出明显的立体选择性吸收或降解,而在灌根施药模式下表现出明显的立体选择性降解[34];而在叶面施药模式下,黄瓜和番茄中的(-)-RS-啶菌噁唑和(-)-RR-啶菌噁唑会被优先降解,而在灌根施药模式下,番茄仍旧是其中的(-)-RS-啶菌噁唑和(-)-RR-啶菌噁唑优先,在黄瓜中却是(+)-SR-啶菌噁唑(-)-RR-啶菌噁唑优先降解[35]。说明部分手性农药的立体选择性还与施药模式存在较大的关系。
2 手性农药的潜在毒性
2.1 手性农药的慢性毒性
2.1.1 手性农药的神经毒性 手性农药一般通过模拟或拮抗内源性激素、调整激素受体水平、改变天然激素的代谢模式和合成等方式产生内分泌干扰作用而引起了研究者的广泛关注。已公布87 种具有内分泌干扰作用的化合物中,有57 种农药,且大部分具有手性中心。手性农药对映体能够选择性引起内分泌干扰效应,主要是由于作为类雌激素,不同对映体与雌激素受体结合时的亲和力具有差异性[36]。同样的手性农药能够引起对映体选择性的神经毒性,手性有机磷农药诱导的神经毒性,不同对映体能够引起迟发性神经毒性的立体选择性[37]。早于1996 年,对异马拉硫磷不同对映体引起的神经毒性进行研究,各对映体对母鸡大脑乙酰胆碱酯酶的抑制作用强弱相差达到15 倍。甲基氯胺磷的各个对映体对SHSY5Y 神经细胞轴突生长的半数轴突抑制在数量上具有不同的体现,抑制效果相差达60 倍以上[38]。S-(+)-三氯杀虫酯比R-(-)-三氯杀虫酯对小鼠PC12 细胞产生更强的细胞毒性。而神经-内分泌-免疫网络学说阐明了3 个系统之间存在着相互调节作用,其中某个系统产生毒理效应也可能会引起其他系统的连锁效应[39]。
2.1.2 手性农药的细胞毒性 针对于手性农药对映体选择性内分泌干扰作用的研究始于对拟除虫菊酯类农药的研究。与trans-氯菊酯相比,cis-氯菊酯能够对精子数量、能动性及睾酮水平产生抑制效果,影响外周型苯二氮卓类受体、StAR、细胞色素P450 侧链裂解酶等相关性激素合成分泌蛋白的基因表达,氯菊酯的生殖内分泌干扰效应主要是由于cis 构型的作用。将MCF-7 细胞暴露于联苯菊酯和功夫菊酯的对映体中,相比于其他对映体,S-cis-联苯菊酯和(-)-功夫菊酯可以诱导细胞增殖、雌激素响应蛋白pS2 基因表达和抑制ERα 基因表达等方面,具有更高的活性。而手性农药对映体的选择性免疫毒性的存在也已经得到证实,三氯杀虫酯对映体可以抑制小鼠巨噬细胞RAW246.7 的生长,激活p53 介导的凋亡通路引起免疫毒性,并且S-(+)-三氯杀虫酯具有更强的免疫毒性;(-)-功夫菊酯和1S-cis-联苯菊酯相比于另一个对映体和外消旋体,能够更强地诱导免疫细胞凋亡[40]。
2.2 手性农药的急性毒性
手性农药对映体在施用过程中,可能会对非靶标生物造成危害。早期手性农药对映体的毒理性效应研究大多数以急性毒性为主。研究者主要以斑马鱼、大型蚤等水生生物为主,如表1,大部分手性农药都表现出明显的急性毒性,各对映体之间急性毒性存在一定的差异。
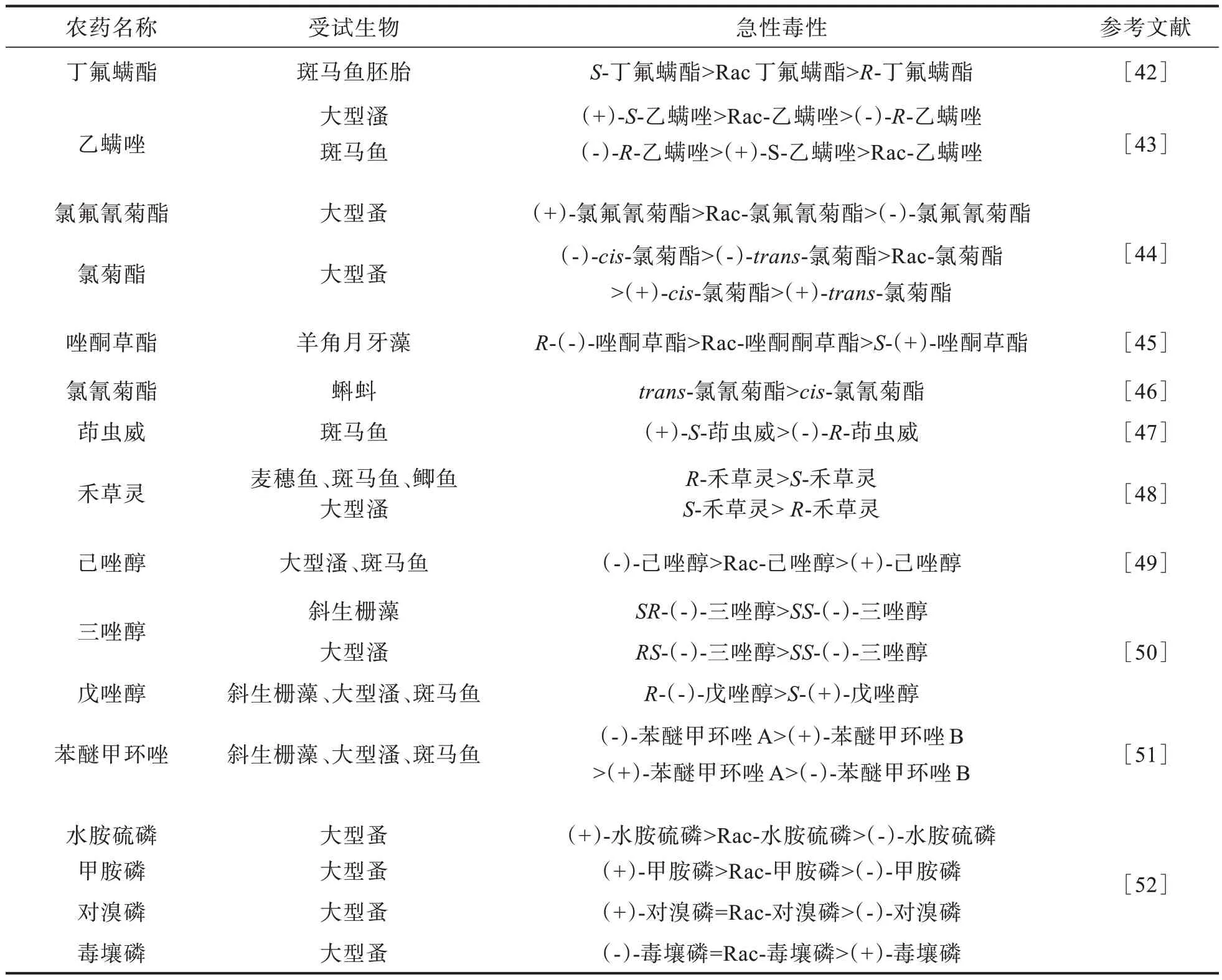
表1 手性农药的急性毒性Tab.1 Acute toxicity of chiral pesticides
部分手性农药外消旋体的毒性来自于其某个对映体,但是也存在一些农药,如噻唑磷和氯胺磷,相较于对映体,其外消旋体显示出更低的毒性,表现出拮抗作用;法莫沙酮对映异构体存在杀真菌活性、生态毒理学效应和降解行为。也有部分手性农药,如甲基异柳磷、禾草灵、乙螨唑、三唑醇、锐劲特[41]等,在不同的生物中,对映体的急性毒性强弱不同,体现出手性农药对映体的急性毒性具有物种选择性。
3 展 望
环境中的各个生物体、介质都会存在手性特征,不同的环境介质和生物体会对手性农药对映体产生不同程度的立体选择性代谢行为。并且随着仪器设备和研究技术的进步,从单一农药对映体的分析到多种农药对映体的同时分析,从简单影响因素到复杂的环境介质,从对映体的简单分离测定到探究各个对映体的代谢途径及特征均可以逐渐实现。近年来,公众愈发关注环境问题,手性农药在环境中的立体选择性研究也愈发的紧迫和关键。并且手性农药对映体选择性毒性较为复杂,同一对映体对不同的物种的毒性作用不同,对同一物种的不同部位也可以产生不同的毒理性效应。所以需要将各个因素综合全面地评价,提供更加有效的理论指导绿色安全农药的研发。
