茶多酚-淀粉纳米颗粒稳定Pickering乳液的特性
2024-01-03王然
王 然
(1.长春职业技术学院食品与生物学院,吉林 长春 130033;2.吉林大学生物与农业工程学院,吉林 长春 130022)
乳液是一种胶体体系,由不相容的两相(通常是油和水)组成,其中一相(分散相)以小液滴的形式分散在另一相(连续相)中[1]。乳液主要由3 部分构成:分散相、连续相以及油-水界面。根据分散相和连续相的构成不同,乳液分为水包油、油包水、水包油包水和油包水包油等类型。乳液具有较高的界面能,属于热力学不稳定体系,在乳液体系中,由于分散相与连续相之间存在极性和密度等差异,所以乳液易发生相分离而降低体系的界面能[2]。在食品工业中,普遍采用乳化剂维持乳液的稳定,常用的乳化剂主要为小分子表面活性剂,其能够作用于油水界面,通过降低界面能,使分散相以微滴的形式分散在连续相中,保持乳液稳定[3]。乳化剂主要包括传统乳化剂和颗粒乳化剂。传统乳化剂一般是由两亲性分子组成,即分子的一端能连接亲水基团,另一端能连接亲油基团,两亲性分子能在油水界面形成吸附层,阻止分散相聚集,以维持乳液稳定[4]。颗粒乳化剂是一类具有界面活性的固体颗粒,具有较高的界面能,能够快速地吸附到油水界面,降低界面张力,并在界面上形成一层紧密的物理屏障,抑制分散相聚集;由于吸附到界面上颗粒具有极高的解吸能,所以颗粒吸附几乎为不可逆吸附,形成的乳液能够保持长期稳定[5],这种由颗粒稳定的乳液称为Pickering乳液[6]。由于Pickering乳液具有良好的稳定性、应用范围广、后期可分离并且对环境友好等优点,受到不同领域研究者的广泛关注。
淀粉因其来源广、价格低廉、易于改性并且具有良好的生物相容性而被广泛研究。不同生物源的淀粉颗粒如藜麦淀粉、大米淀粉、木薯淀粉、土豆淀粉、玉米淀粉等[7-9]均被改性作为颗粒乳化剂。对淀粉的改性主要包括2 个方面,一是减小淀粉颗粒的粒径,因为粒径较小的颗粒能够快速吸附到油水界面并有助于形成小乳滴乳液;二是提高淀粉颗粒的表面润湿性[10],目前普遍采用化学改性的方式,利用酯化剂(例如辛烯基琥珀酸酐)为淀粉分子接枝亲脂基团以提高其疏水性[11]。食品研究领域对具有疏水性的淀粉颗粒用于稳定Pickering乳液进行广泛且深入的研究,但还需要认识到乳液是油水混合体系,易于发生油脂氧化,油脂氧化会产生羟自由基等,并导致脂溶性生物活性物质降解甚至功效丧失[12]。对于既能作为颗粒乳化剂稳定乳液,又能在界面上发挥抗氧化功能的生物源淀粉颗粒的报道还相对较少。
茶多酚(tea polyphenols,TP)是从茶叶中提取的一类多羟基酚类化合物,其具有多种生理功能[13],是天然的抗氧化剂。目前,关于TP生理活性开发的研究主要集中在与蛋白质之间的相互作用[14];然而,TP作为抗氧化剂与淀粉进行相互作用,同时赋予淀粉颗粒乳化性和抗氧化性的研究还鲜见报道。Zhang Die等[15]将TP与淀粉纳米纤维交联制备食品包装膜,发现TP与淀粉分子的羟基能发生氢键相互作用,使淀粉分子表面的羟基减少,进而增强淀粉疏水性。本课题前期采用高直链玉米淀粉、普通玉米淀粉、蜡质玉米淀粉分别与TP结合,制备TP-高直链玉米淀粉纳米颗粒(starch nanoparticles,SNP)、TP-普通玉米SNP、TP-蜡质玉米SNP,然后将3 种颗粒分别用于稳定Pickering乳液,研究发现,TP-蜡质玉米SNP制备的Pickering乳液的稳定效果明显优于另外2 种颗粒,因此,本研究以蜡质玉米淀粉为原料,结合TP制备纳米颗粒,考察TP对SNP结构性质和颗粒性质的影响,并研究TP-SNP对其稳定的Pickering乳液性质的影响,揭示TP与淀粉的相互作用,旨在为开发新型具有抗氧化功能的食品级淀粉基颗粒乳化剂提供理论参考。
1 材料与方法
1.1 材料与试剂
蜡质玉米淀粉 中粮生物科技股份有限公司;油茶籽油 玉山县大成仓食品有限公司。
TP 杭州禾田生物技术有限公司;尼罗蓝 西格玛奥德里奇(上海)贸易有限公司;尼罗红 上海阿拉丁生化科技股份有限公司;实验所用试剂均为分析纯。
1.2 仪器与设备
Zetasizer Nano ZSE激光纳米粒度仪、Mastersizer3000激光粒度仪 英国马尔文仪器有限公司;FA25高剪切分散乳化机 上海弗鲁克科技发展有限公司;Nexus670傅里叶变换红外光谱仪(Fourier transforminfrared spectroscopy,FT-IR)美国热电集团尼高力仪器公司;JSM-6700冷场发射扫描电子显微镜(scanning electron microscope,SEM)日本电子株式会社;UVmini-1240紫外-可见分光光度计 岛津仪器(苏州)有限公司;FV3000激光共聚焦荧光显微镜 奥林巴斯(中国)有限公司;SL200KS光学法接触角仪 美国科诺工业有限公司。
1.3 方法
1.3.1 TP-SNP制备
参考Peng Shanli等[16]和王然[17]的方法并稍作修改。用去离子水将蜡质玉米淀粉配制成质量分数为2%的悬浮液,并置于100 ℃恒温水浴中连续搅拌加热40 min,然后加入基于淀粉质量10%的TP,并置于95 ℃恒温水浴中连续搅拌加热20 min。加热结束后,将淀粉与TP的混合液冷却至25 ℃,然后逐滴滴入体积为混合液5 倍的无水乙醇溶液中进行沉淀。将混合液于3 500 r/min离心15 min,回收上清液,将沉淀物用无水乙醇溶液洗3 遍,并回收醇洗液,于-70 ℃进行真空干燥,制得TP与蜡质玉米SNP复合物(TP-SNP)。
采用相同方法制备蜡质玉米SNP作为对照组,淀粉悬浮液在100 ℃恒温水浴中连续搅拌加热60 min,不添加TP。
1.3.2 TP保留率的测定
参考Li Songnan等[7]方法,略有修改。在制备TP-SNP过程中,将TP-SNP经醇沉和醇洗处理后离心得到的上清液进行混合,并记录上清液体积。根据TP质量浓度-吸光度标准曲线,利用紫外-可见分光光度计在274 nm波长处检测上清液的吸光度,计算得到TP质量浓度。TP保留率按式(1)计算:
式中:mt为TP最初添加质量/mg;C为上清液中TP的质量浓度/(mg/mL);V为上清液的体积/mL。
1.3.3 FT-IR测定
将样品在真空条件下干燥至质量恒定,然后将其与KBr以1∶75(g/g)的比例混合并压制成直径5 mm、厚度1 mm的圆片,在4 000~400 cm-1范围内进行光谱扫描,设置光谱分辨率4 cm-1,经32 次扫描获得样品FT-IR谱图。
1.3.4 SEM观察
将经过无水乙醇溶液沉淀后的SNP、TP-SNP样品湿基滴加到硅片上,进行冻干处理。将样品固定在样品台上,经过喷金处理后,置于扫描电子显微镜样品室中,抽真空,当真空度达到5×10-3Pa时,对样品的表面形态和尺寸进行观察并拍照。
1.3.5 接触角的测定
利用接触角测定仪检测SNP、TP-SNP样品的界面接触角。利用压片机(设置压强35 MPa,压制时间3 min)将样品压成平整、致密的圆片(直径2 cm,厚度2 mm),然后采用液滴法测定淀粉样品的水相静态接触角,测量范围为0°~180°。由仪器控制带有毛细针头的微量进样器,将2 μL超纯水滴在样品圆片表面,待水滴在淀粉圆片表面平衡后进行拍摄,通过仪器自带软件采用Young’s方程分析接触角。每个样品至少在圆片表面取5 个点进行检测,测量结果取5 个数值的平均值。
1.3.6 SNP粒度分布和Zeta电位的测定
将SNP与去离子水配制成质量分数为0.05%的悬浮液,超声处理15 min,再将其置于纳米粒度仪中,设置分散剂为水,颗粒折光率为1.530,在20 ℃条件下分别对样品的粒度分布和Zeta电位进行检测,检测重复3 次,结果取平均值。
1.3.7 水包油Pickering乳液的制备
将SNP、TP-SNP样品分别以不同的比例置于纯净水中,然后将油茶籽油以体积比1∶5的比例加入纯净水中,采用高速剪切乳化机在19 000 r/min剪切乳化3 min,制得SNP质量浓度分别为0.5、1、1.5、2 g/100 mL的Pickering乳液。将制备完成的Pickering乳液置于4 mL透明样品瓶中,放置1 d,然后利用数码相机记录乳液样品表观。
1.3.8 乳化指数(emulsification index,EI)的测定
将新制备的乳液置于透明样品瓶中,采用数码相机分别记录乳液静置1 d和15 d的表观,并测量乳液乳化层高度和乳液总高度。EI用于表征乳液样品的乳化性能。EI按式(2)计算:
式中:He为乳液中乳化层的高度/cm;Ht为乳液的总高度/cm。
1.3.9 Pickering乳液粒度分布
利用激光粒度仪分别对不同浓度SNP、TP-SNP样品制备的Pickering乳液进行粒度分布检测,油相的折射指数和吸收指数分别设置为1.449和0.010,水相的折射指数设置为1.330。每个样品检测3 次,结果取平均值。
1.3.10 激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)观察
将10 μL 0.01%尼罗蓝和尼罗红依次加入到1 mL乳液样品中,避光对乳液进行染色处理2 min,然后将乳液样品注入玻底平皿中,再将玻底平皿置于CLSM载物台上;设置尼罗蓝的发射波长为488 nm,激发波长为513 nm,尼罗红的发射波长为633 nm,激发波长为660 nm,对乳液的微观结构进行观察并拍照。
1.3.11 Pickering乳液脂质过氧化产物的测定及氧化稳定性
将制备的Pickering乳液样品密闭存放于45 ℃恒温箱中15 d,测定乳液中初级氧化产物的生成量,参考Kargar等[19]的测量方法,并略作修改。在1.5 mL混合溶液(异辛烷∶异丙醇=3∶1,V/V)中加入不同贮藏时间的Pickering乳液0.2 mL,并以4 000 r/min离心5 min。然后取0.2 mL上清液与2.8 mL混合溶液(甲醇∶正丁醇=2∶1,V/V)混合,再依次加入15 μL 3.94 mol/L硫氰酸铵溶液与15 μL 0.072 mol/L亚铁离子溶液(0.132 mol/L BaCl2和0.144 mol/L FeSO4离心取上清液),避光静置20 min,于510 nm波长处测量吸光度,利用过氧化氢异丙苯标准曲线计算Pickering乳液氢过氧化物的浓度,其中氢过氧化物的含量以过氧化值(peroxide value,POV)表示。
1.4 数据处理
2 结果与分析
2.1 TP-SNP性质分析
2.1.1 FT-IR分析
利用FT-IR对TP、SNP和TP-SNP的结构进行表征。如图1a所示,3 600~3 200 cm-1处是羟基(—OH)伸缩振动形成的特征吸收峰,反映分子间或分子内氢键的形成[20];1 700 cm-1处的吸收峰反映羰基(C=O)的伸缩振动;1 236 cm-1处的吸收峰为醚键(C—O—C)的不对称振动[21]。从图1b可以看出,与SNP的红外谱图相比,TP-SNP在3 600~3 200 cm-1处羟基吸收峰的峰形发生明显变化,同时吸收峰向波数减小的方向平移;与TP的红外谱图相比,TP-SNP在1 700 cm-1处也出现C=O吸收峰,并在1 203 cm-1处出现向低波数方向平移的C—O吸收峰。Miao Zhikun等[22]将玉米淀粉与TP复合制备食品级包覆膜,发现淀粉与TP复合物在3 292 cm-1处的红外特征峰向低波数方向平移,这是分子间羟基(—OH)发生相互作用。Lü Yaozhong等[21]将TP与土豆淀粉进行混合湿磨处理,其红外谱图中出现TP于1 695 cm-1处的C=O吸收峰和1 242 cm-1处的C—O—C吸收峰,并发生轻微移动,说明TP和淀粉分子的羟基通过氢键进行相互作用,这与本研究的结果一致。
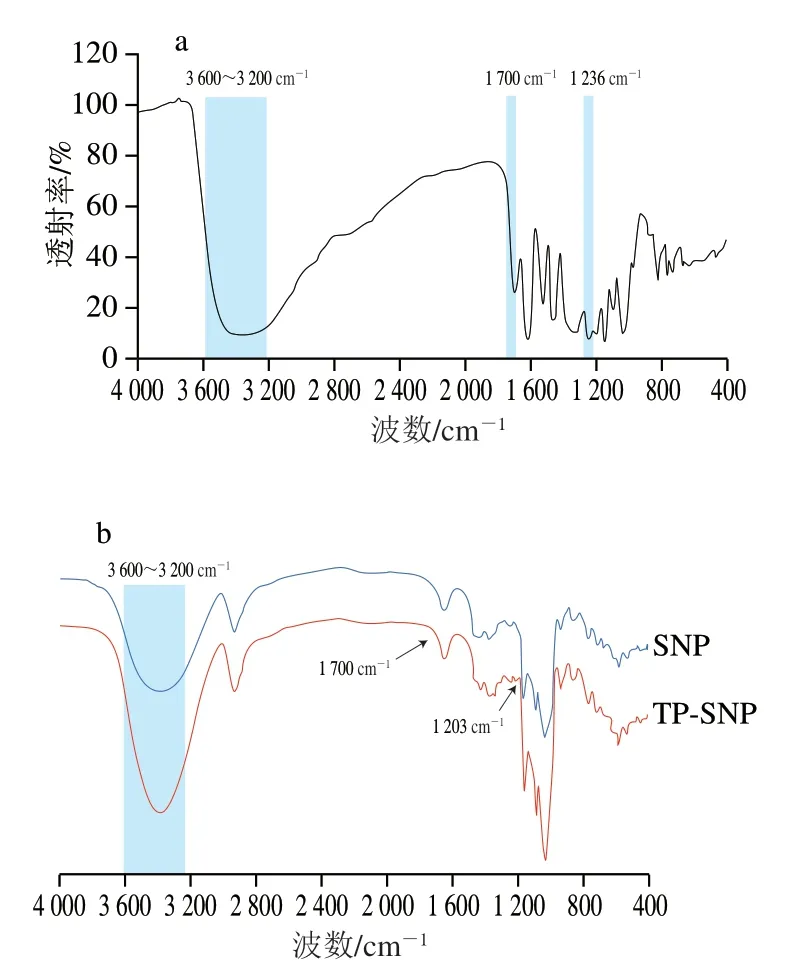
图1 TP(a)、SNP和TP-SNP(b)的FT-IR图Fig.1 Infrared spectra of TP (a),SNP and TP-SNP (b)
2.1.2 TP-SNP的微观结构及颗粒性质
如图2所示,与SNP的微观形态相比,添加TP后,SNP的颗粒尺寸明显增大,并且颗粒的尺寸变得不均匀,TP-SNP呈现不规则的形状,并且颗粒之间有相连的迹象。

图2 SNP(a)和TP-SNP(b)的SEM图Fig.2 SEM images of SNP (a) and TP-SNP (b)
如图3所示,与SNP相比,TP-SNP的平均粒径相对较大,并且颗粒分散指数(particle dispersion index,PDI)也相对较大。PDI值表示颗粒的均匀程度,PDI值越小表明颗粒的粒度分布越均匀。SNP的粒度分布呈单峰分布,而TP-SNP粒度分布为双峰分布,说明SNP的均匀程度明显优于TP-SNP,这些结果均与颗粒微观形态观察(图2)结果一致。此外,与SNP相比,TP-SNP与水相的界面接触角较大,颗粒表面所带负电荷数较多。与水相的接触角反映颗粒能被水相的润湿程度,TP-SNP与水相的界面接触角增大,说明与SNP相比,TP-SNP疏水性增强[23-24]。有研究报道利用酶改性的淀粉制备颗粒乳化剂,颗粒的油水界面接触角趋近90°,能长期保持Pickering乳液稳定[25]。颗粒表面所带电荷也会对稳定Pickering乳液产生重要影响[26],颗粒表面的同种电荷有助于在颗粒之间形成静电斥力,抑制颗粒包裹的乳滴聚结,发挥稳定Pickering乳液的作用。
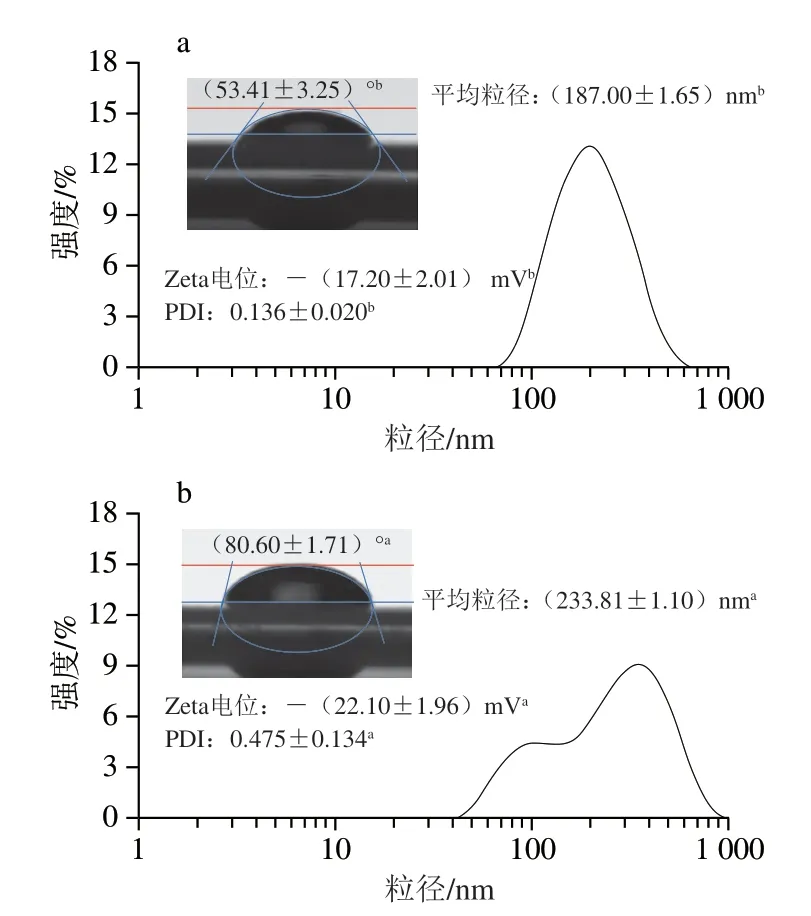
图3 SNP(a)和TP-SNP(b)的接触角、Zeta电位以及粒度分布Fig.3 Contact angle,zeta potential and particle size distribution of SNP (a) and TP-SNP (b)
2.2 不同颗粒质量浓度SNP和TP-SNP稳定的Pickering乳液
2.2.1 乳液的粒径分布
乳滴粒径分布是表征Pickering乳液性质的重要指标,而颗粒的尺寸和浓度是影响乳液粒径分布的重要因素[27]。如图4a所示,当SNP质量浓度从0.5 g/100 mL增加至2.0 g/100 mL时,Pickering乳液的乳滴粒径分布曲线均呈单峰分布,并且随着SNP质量浓度的增加,Pickering乳液的乳滴粒径分布曲线峰向粒径减小的方向平移。如图4b所示,随着TP-SNP质量浓度从0.5 g/100 mL增加至2.0 g/100 mL,Pickering乳液的乳滴粒径分布曲线呈现多峰分布,并且随着TP-SNP质量浓度的增加,Pickering乳液的乳滴粒径分布主峰表现出先向大粒径方向平移,而后又向小粒径方向平移的趋势;与SNP制备的乳液相比,TP-SNP稳定的乳液生成大量粒径小于10 μm的乳滴,并且随着TP-SNP质量浓度的增加,乳滴的粒径减小。
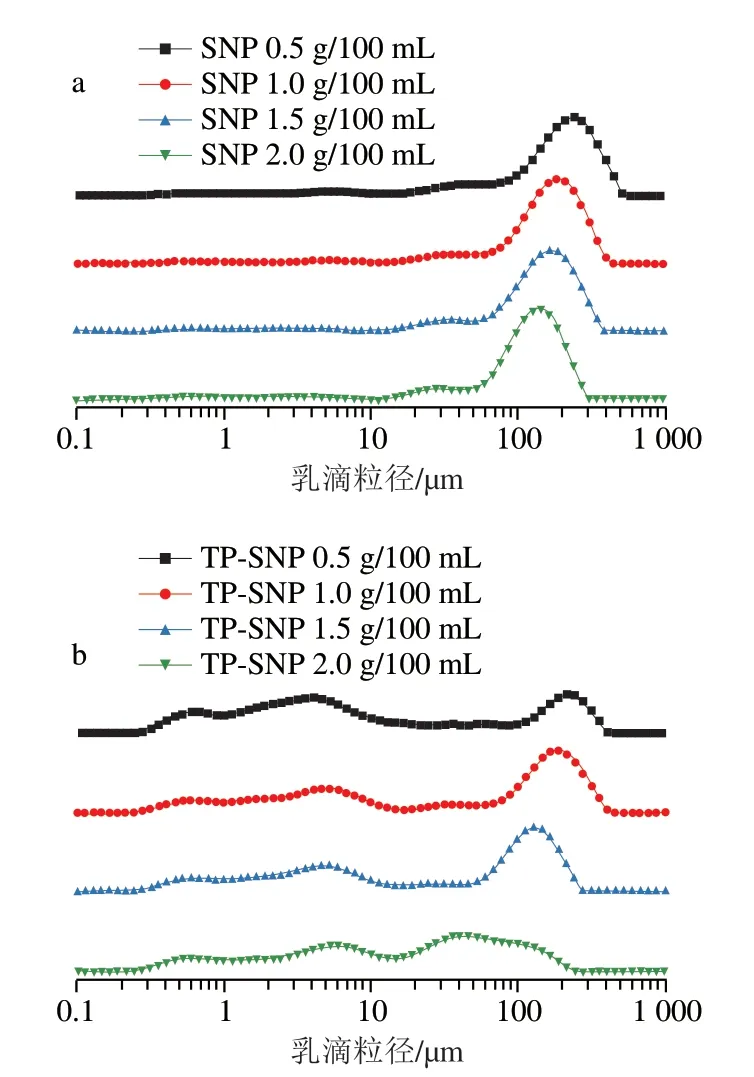
图4 不同颗粒质量浓度SNP(a)和TP-SNP(b)稳定的Pickering乳液的乳滴粒径分布Fig.4 Droplet size distribution of Pickering emulsions stabilized by different concentrations of SNP (a) or TP-SNP (b)
如表1所示,与SNP相比,TP-SNP稳定的Pickering乳液的乳滴平均直径明显减小,并且,随着TP-SNP质量浓度的增加,乳液的平均直径D[4,3]、D(50)和D(90)明显降低。通常,在乳液油水体积比确定的情况下,乳液中分散相乳滴的尺寸越小,油水之间的界面面积越大[28],乳液的D[3,2]和比表面积也相应越大,因此,当乳液中有效的颗粒乳化剂浓度增加时,其所稳定的油水界面面积会增大。由SNP稳定的乳液,其乳滴粒径分布D[4,3]、D(50)和D(90)均较大,但是D[3,2]和比表面积却较小,这是由于SNP几乎不具有界面活性,不能吸附在油水界面阻隔乳滴聚结,因此由SNP制备的乳液乳滴平均直径较大。
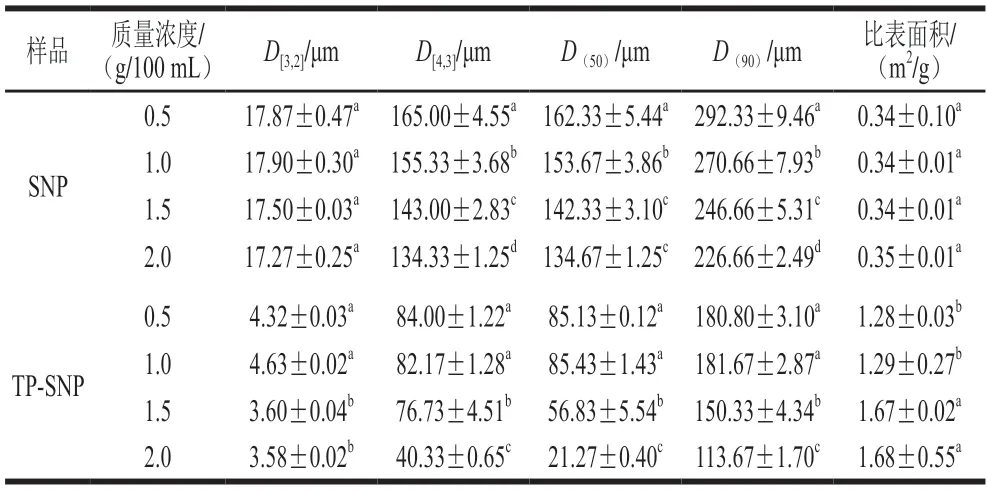
表1 不同颗粒浓度的SNP和TP-SNP稳定的Pickering乳液的乳滴平均直径Table 1 Mean droplet size of Pickering emulsions stabilized by different concentrations of SNP or TP-SNP
图5为放置1 d不同质量浓度SNP和TP-SNP制备的Pickering乳液的表观形态。如图5a所示,由SNP制备的4 个乳液样品,其最上层均出现明显的油相层,即乳液发生油水分离,说明SNP不适用于稳定Pickering乳液。如图5b所示,在TP-SNP质量浓度为0.5 g/100 mL时,乳液样品上层出现油相层,这可能是因为当TP-SNP质量浓度较低时,其在乳滴表面覆盖范围较小,不能在油水界面上形成紧密的阻隔层,因此导致乳滴聚结并浮到乳液表面。当TP-SNP质量浓度不小于1.0 g/100 mL时,其稳定的Pickering乳液未出现油水分离现象,并且随着TP-SNP质量浓度的增加,乳液质地愈加稠厚,乳化层(乳液白色部分)体积增加。当TP-SNP质量浓度从1.0 g/100 mL增加至2.0 g/100 mL时,乳液的EI值从50%增加至75%,这表明适宜浓度的TP-SNP能够作为颗粒乳化剂用于稳定Pickering乳液。

图5 不同颗粒质量浓度的SNP(a)和TP-SNP(b)稳定的Pickering乳液的表观Fig.5 Appearance of Pickering emulsions stabilized by different concentrations of SNP (a) or TP-SNP (b)
2.2.2 乳液微观结构观察
利用CLSM观察Pickering乳液的形貌以及SNP、TP-SNP在乳液体系中的分布情况。如图6所示,由不同浓度的SNP和TP-SNP制备的Pickering乳液,其微观结构形态呈现明显差异。从图6a、b可以看出,随着SNP(标记为红色)质量浓度从0.5 g/100 mL增加至2.0 g/100 mL,乳液中油滴(标记为绿色)的直径减小,但是SNP在乳液中吸水膨胀并形成较大的胶块结构,其没有吸附到油水界面上,而是与油滴分离成各自独立的体系,因此SNP没有乳化能力,不适用于稳定Pickering乳液。如图6c、d所示,随着乳液中TP-SNP质量浓度从0.5 g/100 mL增加至2.0 g/100 mL,越来越多的TP-SNP吸附在油滴表面,致使油滴的尺寸减小,并且油滴的形态从椭圆形等不规则的形状逐渐变为圆形,说明油滴的聚结得到有效抑制,表明质量浓度为2.0 g/100 mL的TP-SNP能吸附在油水界面上有效稳定Pickering乳液。
2.3 Pickering乳液的脂质氧化稳定性
油茶籽油中含有大量的不饱和脂肪酸,其在高温条件下易发生氧化酸败。通过对油脂的POV进行检测,有助于了解乳液的氧化稳定性。图7为不同质量浓度SNP和TP-SNP制备Pickering乳液的POV与贮藏时间的关系曲线。随着贮藏时间的延长,不同质量浓度SNP和TP-SNP制备的Pickering乳液中氢过氧化物生成量均逐渐增加,这是由油脂的自动氧化导致。从图7a可以看出,SNP质量浓度变化对乳液POV没有产生明显的影响。如图7b所示,随着TP-SNP质量浓度的增加,乳液的POV明显降低,表明TP-SNP具有延缓油脂氧化的效果,这是因为TP-SNP可以吸附在油水界面并形成物理屏障,抑制氧化剂向油水界面传递氧,有效延缓油脂氧化;此外,TPSNP中TP的保留率为(18.10±0.62)%,TP赋予TP-SNP抗氧化活性,使其在油水界面阻断油脂氧化反应,提高乳液的氧化稳定性[29]。Wu Hejun等[30]利用柚子皮粉复合TP制备可食生物复合膜,研究发现复合膜能显著降低乳液中氢过氧化物的生成量,有效延缓油脂氧化,这与本研究结论相符。
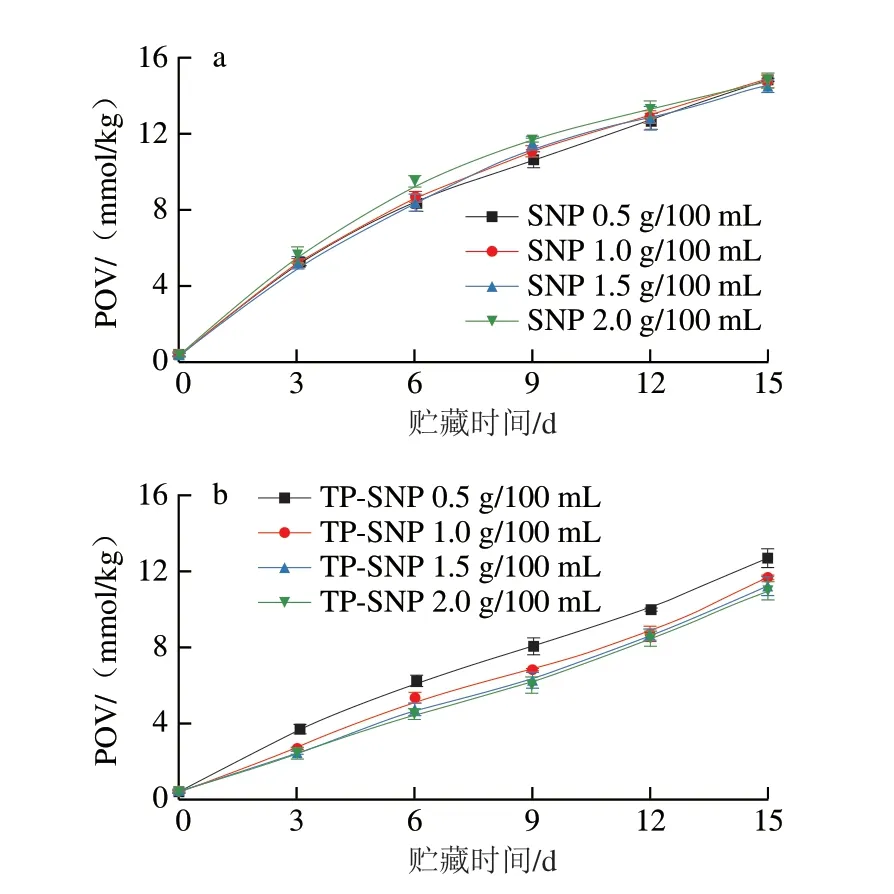
图7 不同颗粒质量浓度SNP和TP-SNP稳定的Pickering乳液贮藏15 d的POVFig.7 POV of Pickering emulsions stabilized by different concentrations of SNP or TP-SNP during 15-day storage
3 结论
在蜡质玉米淀粉中添加TP,然后利用乙醇沉淀法制备TP-SNP。通过FT-IR研究TP-SNP的结构性质,发现富含羟基的TP和蜡质玉米淀粉主要通过氢键连接;通过SEM观察和粒径分布检测,研究TP-SNP的微观形态变化和颗粒性质,发现添加TP导致SNP的颗粒形态变得不规则,并且导致其平均粒径增加、粒度分布变得不均匀;通过接触角测量仪和激光纳米粒度仪研究TP-SNP的乳化性质,发现与SNP相比,TP-SNP和水相的接触角增加,并且TP-SNP表面负电荷数增加,说明添加TP后,SNP的疏水性增强,较多的同种电荷有助于TP和SNP之间形成静电斥力,这些因素均能促进TP-SNP在油水界面的吸附效果;通过激光粒度仪检测乳液中油滴分布发现,与SNP稳定的乳液相比,TP-SNP稳定的Pickering乳液中产生大量的小乳滴,并且随着TP-SNP质量浓度的增加,Pickering乳液中乳滴的尺寸明显减小;利用CLSM观察乳液的微观结构发现,SNP在乳液中吸水形成胶块,不能吸附到油水界面,因此不能用于稳定Pickering乳液,而TP-SNP则能紧密地吸附到油水界面,并且随着TP-SNP质量浓度的增加,其在油滴表面的覆盖面积增大,有助于稳定Pickering乳液。在乳液15 d贮藏期中,通过检测乳液POV发现,与SNP制备的乳液相比,TP-SNP稳定的乳液POV明显减小,并且乳液POV随着TP-SNP质量浓度的增加而降低,说明TP-SNP具有延缓油脂氧化的作用。TP-SNP可以作为一种新型具有抗氧化功能的颗粒乳化剂用于稳定食品级Pickering乳液,其在构建食品级淀粉基Pickering乳液载体方面具有潜在应用价值。
