花色苷-硫酸软骨素共色物复合普鲁兰多糖稳态体系构建与评价
2024-01-03鲍义文任广宇李佳欣田金龙杨曙方杨一鋆
鲍义文,任广宇,李佳欣,田金龙,杨曙方,杨一鋆,司 旭,,李 斌,
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.浙江蓝美技术股份有限公司,浙江 诸暨 311800)
花色苷是一种广泛分布于植物中的水溶性天然功能色素,属黄酮多酚类化合物,是浆果中重要的活性成分,具有抗氧化、缓解视力疲劳、延缓衰老、调节糖脂代谢、防御神经退行性疾病等多种生理功能,广泛应用于饮料、药品、化妆品和营养药品的制造中[1-2]。随着蓝莓等浆果产业的迅速发展,特色浆果制品市场迎来热潮,蓝莓花色苷(blueberry anthocyanins,BA)作为重要功能色素,在加工中可以赋予制品色泽、提供营养价值。然而,由于花色苷稳定性差,易受环境胁迫(pH值、光、热等)发生降解,导致其在加工过程中损失严重,体内吸收利用率低,限制了蓝莓深加工制品的产业化应用[3-4]。因此,寻求提高蓝莓制品中花色苷稳定性技术,构建花色苷稳态体系研究尤为重要。
共色技术和包封技术是提高花色苷稳定性的重要手段。共色是指花色苷与生物聚合物、酚酸类物质和金属离子等共色物自缔合或形成复合物的现象[5-6]。这一作用机制可以增强花色苷的色泽强度,保护有色的黄烊阳离子免受水分子的亲核攻击,稳定花色苷结构[7-9]。硫酸软骨素(chondroitin sulfate,CS)是一种独特的带负电荷的酸性黏多糖,广泛分布在动物组织的细胞外基质中,其分子链由β-1,4连接的葡萄糖醛酸以及β-1,3-N-乙酰乙酰基-D-氨基葡萄糖交替单元组成[10-11]。与低分子质量酚酸辅色花色苷相比,CS分子质量较大、具有较高的电荷密度可以保持与花色苷的π-π堆积构型,起到更加稳定的作用[12]。包封技术可以稳定共色物结构,最大限度地保留花色苷含量,以阻止其受环境胁迫带来的负面效应。普鲁兰多糖(pullulan,PU)是一种天然的水溶性微生物细胞外多糖,由α-1,4和α-1,6糖苷键连接的麦芽三糖单元组成,具有良好的生物相容性、可食用性和优异的成膜性能,有利于形成稳定的凝胶体系,此外由于PU作为非离子多糖不会对BA-CS共色物之间的电荷相互作用产生干扰,因此其可作为天然生物大分子包埋活性成分的理想材料[13-15]。共色与包封技术的联合使用可以最大限度增强花色苷色泽并提高其稳定性,在食品工业中具有广阔应用前景。
本研究基于共色与包封结合技术,采用CS离子络合BA形成共色复合物,利用PU包封共色物,构建负载BA的稳态体系(BA-CS-PU)。利用紫外-可见光谱和色度参数评价共色物增色效果,通过傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)及热重分析(thermogravimetric analysis,TGA)等对稳态体系进行结构表征,解析其共色包埋机制,探究加工条件及体外模拟消化对稳态体系中BA的稳定性影响,从而评价BA-CS-PU体系在蓝莓深加工制品中的应用潜力。
1 材料与方法
1.1 材料与试剂
蓝美I号BA(纯度40%)浙江蓝美技术股份有限公司;CS(纯度90%)鑫瑞生物科技有限公司;PU(纯度99%)北京索莱宝科技有限公司;胰酶、胃蛋白酶、α-淀粉酶 上海瑞恩生物科技有限公司;胆汁提取物 北京奥博生物科技有限公司;VC、盐酸、氢氧化钠(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
Evolution 201紫外-可见分光光度计、FTIR光谱仪 赛默飞世尔科技公司;pH计、TGA仪 梅特勒-托利多仪器(上海)有限公司;NS 800分光测色仪 深圳市三恩时科技有限公司;DK-S26水浴锅 上海精宏实验设备有限公司;磁力恒温搅拌器 郑州南北仪器设备有限公司;SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;Centrifuge 5804R高速冷冻离心机 德国Eppendorf公司。
1.3 方法
1.3.1 BA-CS共色物的制备
取适量CS将其溶解于超纯水中制备成质量浓度分别为1.5、2.0、2.5 mg/mL的CS溶液,用1 mol/L的盐酸溶液将pH值调节至3.0。将一定量的BA溶于pH 3.0柠檬酸-柠檬酸钠缓冲溶液,将BA溶液加入制备好的CS溶液中,使BA终质量浓度为0.2 mg/mL,磁力搅拌30 min,得到CS质量浓度分别为1.5、2.0、2.5 mg/mL的BA-CS共色物溶液。
1.3.2 色度测定
通过分光测色仪测定溶液的色泽参数(L、a、b),并根据式(1)计算ΔE值:
式中:L为色泽的明亮度;a为色泽的红绿度;b为色泽的黄蓝度。L0、a0、b0为对照样品的色度值。
1.3.3 紫外-可见光谱测定
测量BA溶液、CS溶液及BA-CS共色物溶液在pH 3条件下的紫外-可见光谱,扫描波长为380~780 nm。同时,用相机记录BA溶液和BA-CS共色物溶液的色泽变化。
1.3.4 BA-CS-PU稳态体系构建
将PU溶解于pH 3.0的柠檬酸-柠檬酸钠缓冲溶液中,磁力搅拌制备得到质量浓度为2.0、3.0、4.0 mg/mL的PU溶液。将制备的BA-CS共色物溶液与PU溶液等体积混合,在磁力搅拌器的作用下室温搅拌40 min得到BA-CSPU稳态体系,根据PU的添加质量浓度将其命名为BACS-PU2、BA-CS-PU3和BA-CS-PU4。以单独BA溶液作为实验的对照组。
1.3.5 FTIR
采用FTIR光谱仪测定BA、CS、PU、BA-CS、BA-PU和BA-CS-PU的吸收光谱,分析基质组分之间的相互作用。光谱的扫描范围为400~4 000 cm-1,分辨率为4 cm-1。
1.3.6 TGA
将冷冻干燥的BA、CS、PU、BA-CS、BA-PU和BA-CS-PU粉碎,然后使用TGA仪进行检测。分析范围为25~600 ℃,加热速率为10 ℃/min,氮气流速为100 mL/min。记录TGA和微商热重(derivative thermogravimetrc,DTG)曲线。
1.3.7 BA保留率测定
采用pH示差法测定BA的含量。将样品用pH 1.0和pH 4.5柠檬酸缓冲溶液稀释一定倍数,使用紫外-可见分光光度计测量BA的吸光度,使得BA吸光度在0.2~0.8之间。避光显色1 h后,分别于520 nm和700 nm波长处测定BA溶液的吸光度,每个样品做3 次平行实验。样品中BA质量浓度(C)及保留率分别按式(2)、(3)计算:
式中:A=(A520nm-A700nm)pH1.0-(A520nm-A700nm)pH4.5;DF为稀释因子;M为矢车菊素-3-葡萄糖苷(C3G)的相对分子质量(449.2);ε为C3G的摩尔消光系数(26 900 L/(mol·cm));L为光程长(1 cm)。
式中:Ct为BA在t时刻的质量浓度/(mg/mL);C0为BA的初始质量浓度/(mg/mL)。
1.3.8 体外模拟消化
参考Guo Ruixue等[16]的体外模拟方法并稍作修改。用6 mol/L的HCl溶液和0.9 mol/L的NaHCO3溶液对消化过程pH值进行调节。消化过程使用恒温水浴摇床于37 ℃、120 r/min振荡进行。口腔消化:将样品装入锥形瓶并加入1 mL唾液模拟液(32.5 mgα-淀粉酶和2.775 mg CaCl2溶于25 mL超纯水中)消化10 min,取样。胃消化:唾液消化结束后,pH值调至3并加入1 mL胃液模拟液(1 g胃蛋白酶溶于25 mL超纯水中)于样品中,消化2 h,每隔1 h取样1 次。小肠消化:胃消化结束后,pH值调至7.5,并加入10 mL肠液模拟液(0.5 g胰酶、3.125 g胰蛋白酶、3 g胆汁盐、0.21 g NaHCO3溶于25 mL超纯水中)消化2 h,每隔1 h取样一次。以单独BA样品作为空白对照。样品中BA质量浓度及保留率分别通过公式(2)和(3)计算得到。
1.4 数据处理
2 结果与分析
2.1 CS辅色BA效果评价
2.1.1 CS质量浓度对BA的色泽影响
CS与BA以不同比例复合的色泽参数、色差值及表观色泽如表1所示。结果表明,随着CS的加入溶液的L值和b值降低,说明其溶液亮度变暗,黄色色度降低。值得注意的是,CS的加入使得溶液的a值显著增加(P<0.05),说明溶液的红色色度显著增强,证明了CS与BA复合后共色物的形成增强了BA溶液原本的红度。从表1可以清晰看到,色泽增强现象,由鲜红转变为深红色,表明CS已与BA复合形成共色物。其中,CS质量浓度为2 mg/mL时,复合溶液的a值(5.77±0.04)最大,此时与单独BA溶液相比ΔE值(3.97±0.80)显著增加。因此,CS质量浓度为2 mg/mL时与BA复合表现出了最佳共色效果,后续选定此质量浓度进行共色物评价及稳态体系构建。

表1 BA及不同质量浓度CS辅色BA的色度参数及色泽变化Table 1 Color parameters and color changes of BA and BA complexes with different concentrations of CS
2.1.2 BA-CS共色溶液的色泽及紫外-可见光谱分析
BA及BA-CS共色物溶液在pH 3的条件下色泽变化及紫外-可见光谱如图1所示,对比单独的BA溶液,BA-CS共色物溶液产生的离子络合现象使色泽强度显著增加。单独BA溶液的最大吸收波长在520 nm左右,加入CS之后形成的共色复合物最大吸收峰移动到540 nm附近,与单独BA溶液相比,波长向长波长方向发生移动,产生红移现象。然而单独的CS溶液在此波长范围内没有吸收峰的产生,说明是二者共色物的产生使波长发生移动。此外BA-CS共色物在最大吸收峰位置的吸光度显著增加(0.99→1.67),进一步证明了共色现象的发生,这与Xie Chenjing等[17]的研究结果一致,表明CS的加入与BA产生离子络合物发生共色作用从而增强了BA溶液的色泽,使得最大吸收峰发生红移[17-18]。
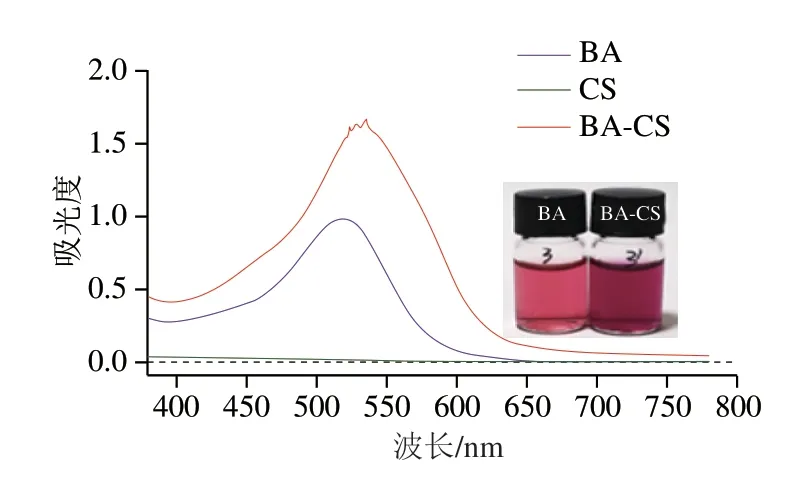
图1 BA、CS及BA-CS共色物紫外-可见光谱图Fig.1 UV-vis spectra of BA,CS and BA-CS co-pigmentation complex
2.1.3 BA-CS共色物色度及色泽稳定性评价
BA溶液及BA-CS共色物溶液在pH 2~8条件下的色泽变化参数及图像对比如表2所示,随着pH值增加,BA溶液色泽发生变化,是由于花色苷的结构变化导致的(黄烊阳离子→查耳酮、甲醇甲碱→醌式碱)[19-20]。随着CS的加入,在pH 2~3时,L、a值无显著差异,b值降低。从结果看出,BA溶液在较稳定的pH值范围内(pH 2~3),CS的加入对BA的红值无显著影响,但从图像色泽可以看出CS与BA发生络合使共色物色度增强。然而,在pH 4~6的条件下,CS的加入使溶液的L、a、b值均发生显著变化。值得注意的是,相同pH值条件BA-CS复合溶液的a值显著高于BA溶液,结果表明CS对花色苷的红色起到显著保护作用,并增强了溶液的色泽。当pH值在中性及碱性条件下时,BA溶液的L值较酸性条件有所降低,表明溶液色泽整体偏暗。同时a值及b值呈现小于0的趋势,表明溶液红色、黄色逐渐消失并分别向绿色及蓝色域转移。综上,CS的加入与BA产生共色作用,使得BA在较不稳定的酸性条件下(pH 4~6)红值显著增强,同时在广泛pH值范围内(pH 2~8)均显著增强了溶液色泽,证明了共色物的形成。
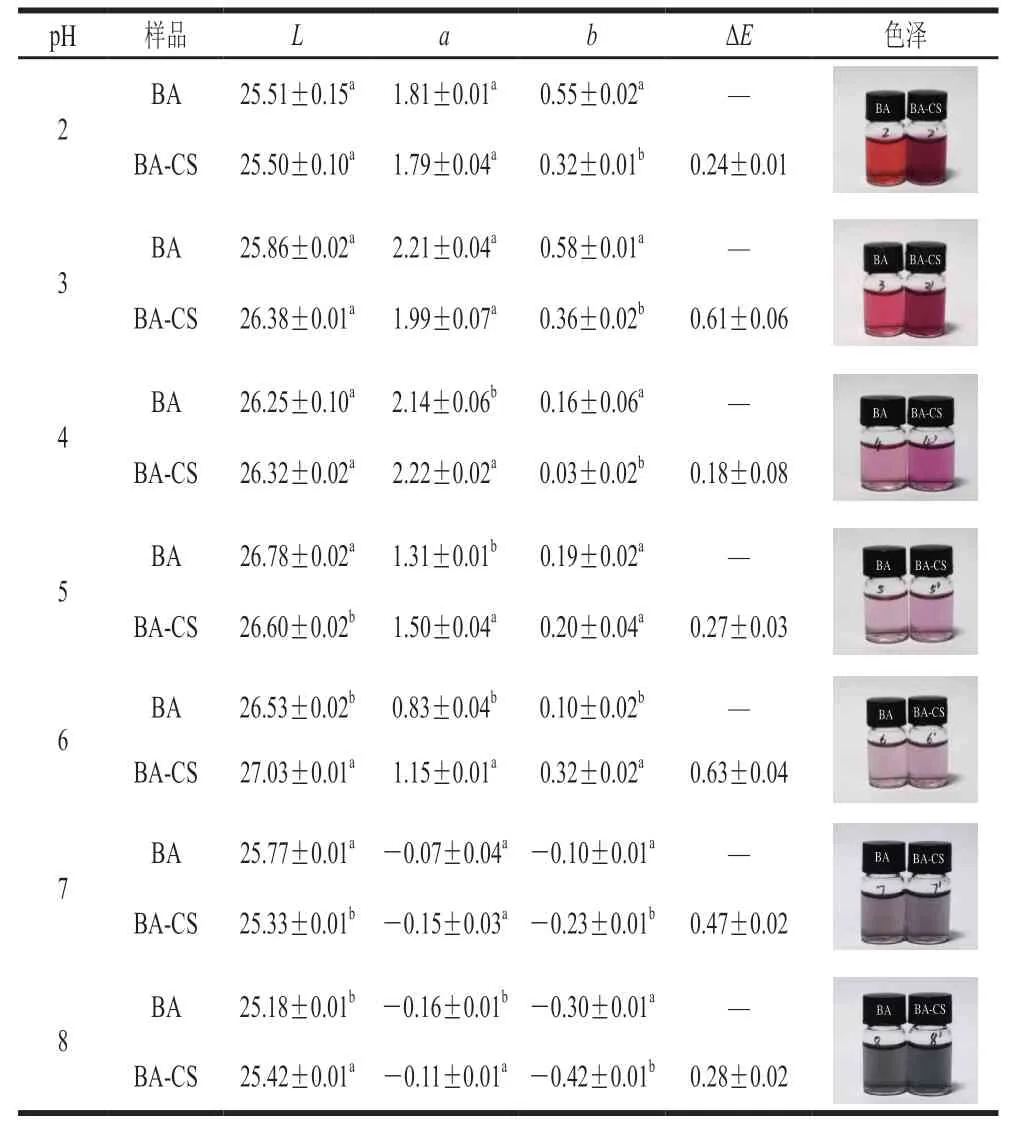
表2 BA及BA-CS在pH 2.0~8.0下的色泽参数及图像Table 2 Color parameters and visual color of BA and BA-CS at pH 2.0–8.0
将BA溶液(图2A)及BA-CS共色物溶液(图2B)在室温下存放14 d评价天然色素及添加生物聚合物后的色泽稳定性。每2 d测定一次色泽参数(L、a、b)并以第1天色泽参数为对照计算∆E。BA和BA-CS溶液在pH 2~3时显色最稳定,在贮藏14 d内具有最低的色差值,且整体趋于稳定状态,说明在此pH值范围内花色苷的色泽最稳定。当溶液pH值在4~9时,随着贮藏时间延长,色差值增加,色泽稳定性减弱,贮藏超过10 d后色差值趋于稳定。相比于单独的BA溶液,CS的加入降低了溶液的色差值,提高了天然花色苷的色泽稳定性。
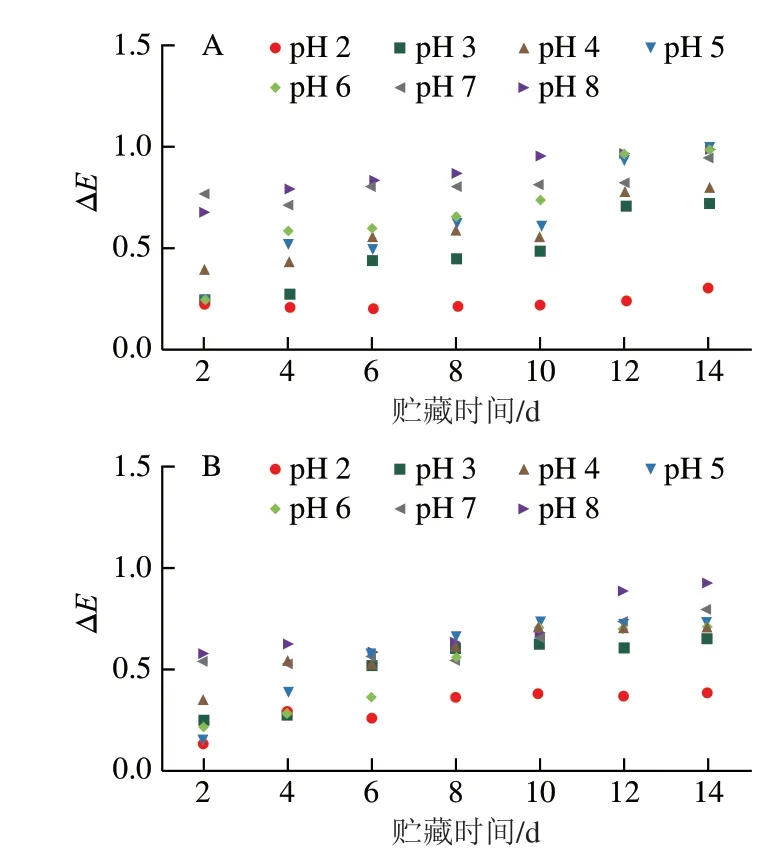
图2 BA溶液(A)和BA-CS溶液(B)在pH 2~8条件下的∆E变化Fig.2 ∆E values of BA solution (A) and BA-CS solution (B) at pH 2–8
2.2 BA-CS-PU稳态体系结构表征
2.2.1 FTIR分析
为确认复合体系的形成,分析BA、CS和PU三者之间存在的相互作用,通过FTIR对各组分进行表征,结果如图3A所示。FTIR光谱在3 431(BA)、3 445(CS)、3 411(PU)、3 434(BA-CS)、3 422 cm-1(BA-PU)及3 423 cm-1(BA-CS-PU)处的谱带是由于—OH的存在。在BA的光谱中,1 638 cm-1和1 413 cm-1处的特征峰归因于苯并吡喃芳香环的振动(C—C环伸展),是黄酮衍生物的象征[21]。CS光谱的特征峰出现在1 632、1 341 cm-1和1 226 cm-1处,分别为酰胺I带、O—H变角度振动和S=O伸展[22]。PU光谱在1 153、1 021 cm-1处的特征峰分别归因于PU的α-1,4糖苷键和C—O的拉伸振动,在851 cm-1处观察到的峰值是PU的α-吡喃葡萄糖单元[23-24]。
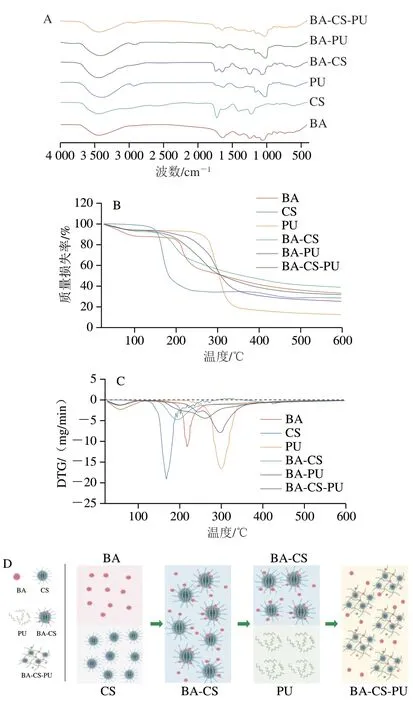
图3 BA-CS-PU稳态体系的表征Fig.3 Characterization of BA-CS-PU
在BA-CS共色物光谱中,CS在S=O处的1 226 cm-1特征峰移动到1 235 cm-1处,BA的特征峰被掩蔽。因此,结合Xie Chenjing等[17]的结果,合理推测CS和BA的结合方式为BA的活性酚羟基和CS的自由羧基之间发生氢键结合,共色作用是由CS和BA之间通过硫酸基团和BA黄烊阳离子形成离子络合产生[17,25]。在BA-CS-PU复合物体系中,—OH位置特征峰与单独物质相比均发生偏移,推测各组分之间存在氢键相互作用。此外各组分的特征峰出现移动,峰强发生变化,说明各物质之间发生结合,BA被嵌入到复合物中,成功构建负载BA的稳态体系。
2.2.2 TGA结果
通过TGA方法评价BA-CS-PU体系的热稳定性,TGA(图3B)和DTG(图3C)曲线反映出BA-CS-PU的热降解过程主要有3 个阶段。第1阶段发生在25~100 ℃范围内,质量损失约10%,质量变化为每分钟下降1.0 mg,这可能是由于复合体系中表面附着的BA降解造成。第2阶段发生在160~220 ℃,热质量损失约9%,质量变化为每分钟下降2.0 mg,这可能是由于BA-CS-PU体系中自由水的蒸发和解吸作用,与包封材料固有的亲水性有关[17,26]。第3阶段发生在220~265 ℃,由于多糖结构的分解,质量损失率约为17%,质量变化为每分钟下降1.6 mg,此时体系中BA大部分被降解和释放[27]。此外,从DTG图可以看出,BA、BA-CS、BA-PU及BA-CS-PU的吸热峰温度分别为218.4、194.2、297.5 ℃及262.5 ℃。因此,从热质量损失率及吸热峰温度变化综合考虑,BACS-PU体系具有更好的耐热性。由于CS中的硫酸盐基团与BA黄烊阳离子相互作用(图3A),增强了胶体的表面稳定性,从而在BA-CS共色物上产生了大量的亲水表面[12]。为了增强稳态体系对BA的保护作用,使用PU包裹BA-CS共色物,形成类似凝胶网络结构,将共色物嵌入其中,通过共色与包封技术的结合更大程度保护BA的稳定性,结合FTIR分析其作用机理示意图如图3D所示。
2.3 BA-CS-PU稳态体系的加工稳定性评价
2.3.1 热加工
BA很容易受到温度的影响,导致其降解。因此研究大分子稳态体系对BA的保护作用具有重要意义。BA溶液和BA-CS-PU体系在不同温度处理条件下的保留率及a值分析如图4所示。在食品常用加工温度范围内,随着热处理温度的升高,BA保留率降低,90 ℃处理后BA保留率最低(66.24%)。这可能是因为在热加工过程中BA受热发生水解反应,糖苷键断裂,破坏了BA的结构。值得注意的是,在各个温度处理条件下,BA-CS-PU复合体系中的BA保留率均显著高于游离BA组。其中,在70、80 ℃和90 ℃处理组中,3 mg/mL的PU形成的BA-CS-PU3组对BA的保护作用最明显,保留率比对照组分别提高了7.68%、4.97%和7.17%(图4A)。稳态体系中BA热稳定性提高可能与BA与壁材之间的非共价键相互作用有关,除吸收较高能量外,BA均不容易被破坏[28]。
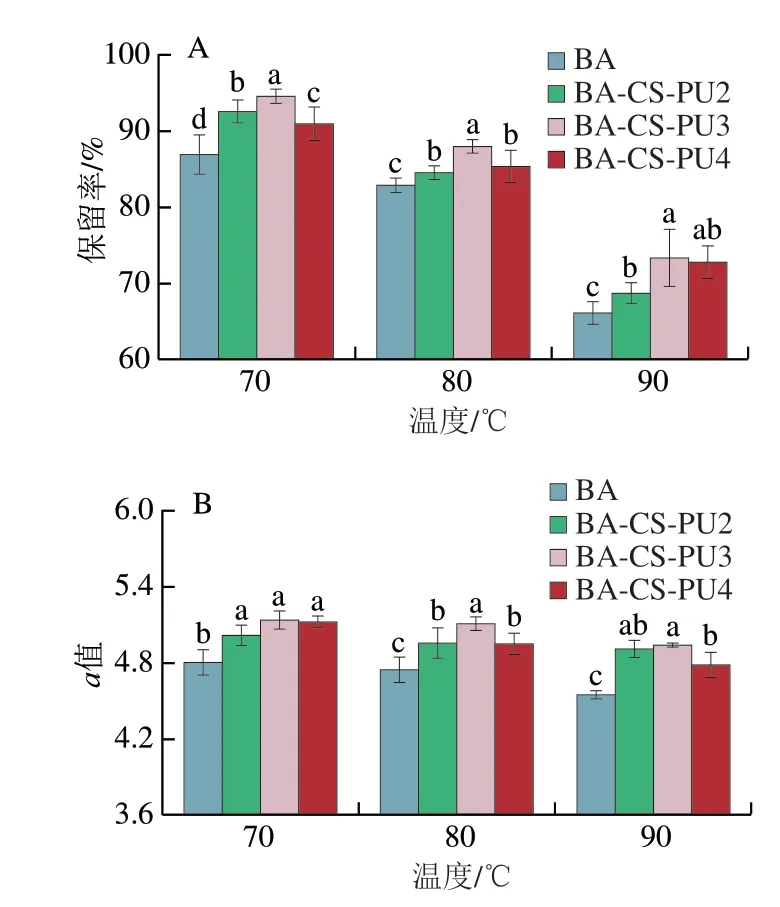
图4 不同温度处理时BA-CS-PU体系对BA保留率(A)和a值(B)的影响Fig.4 Effect of BA-CS-PU system on BA retention rate (A) and a value (B) at different temperatures
BA溶液的红色域强度是评价其感官色泽的重要指标。由于花色苷自然状态下色泽为红色域,因此通过a值的大小可以评价BA溶液红色的强弱,以证明复合体系对BA色泽的保护作用。从a值结果看出,不同温度处理组单独的BA溶液具有最低的a值,而BA-CS-PU复合体系的a值显著高于对照组,其中以3 mg/mL的PU形成的BA-CS-PU3组对BA的色泽保护作用最明显(图4B)。综上分析,PU质量浓度在3 mg/mL时,形成的复合体系可能最佳。
2.3.2 酸碱强度
食品加工过程不同体系中往往伴随着pH值的变化,然而BA受pH值影响显著,因此模拟加工的广泛pH值范围内BA的保留率情况具有重要意义。热处理30 min后,避光贮藏24 h,BA保留率如图5A所示。在pH 2~4范围内BA的保留效果较佳,在此pH值范围内,BA以黄烊阳离子形式存在,具有稳定的母核结构,此范围内不易受外界环境胁迫导致失稳。其中pH 3时BA的保留率最高。在pH 5~6时,BA保留率显著降低,此范围内BA由黄烊阳离子结构逐渐转化为甲醇甲碱或查耳酮形式,导致其母核结构不稳定,易受亲水核攻击,BA保留率降低。值得注意的是,在广泛pH值条件下BA-CS-PU体系的处理后BA的保留率均比对照组显著提高(P<0.05)。因此,加工过程为最大限度保留BA含量,在加工体系中尽量选择pH 3体系。值得注意的是,在弱酸环境下BA-CS-PU体系可以显著提高BA的保留率,以3 mg/mL PU形成的BA-CS-PU3体系对BA的保留率最为显著。
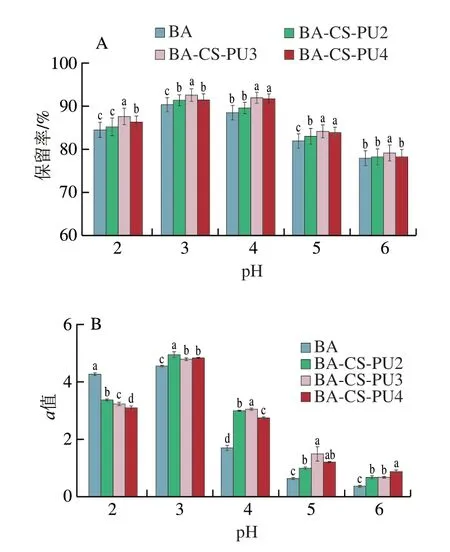
图5 不同pH值处理时BA-CS-PU体系对BA保留率(A)和a值(B)的影响Fig.5 Effect of BA-CS-PU system on BA retention rate (A) and a value (B) at different pH levels
BA的pH值变化与其形成的色泽显著相关,BA溶液在pH 2~4时呈现红色,此时BA主要以黄烊阳离子形式存在;pH 5~6时,BA逐渐转化为接近无色的甲醇甲碱或查耳酮形式;pH 7~10时,BA转化为蓝色的醌式碱形式;在pH 11~12时,BA降解产生酚酸类物质使溶液呈现出黄褐色[19]。如图5B所示,BA在pH 3时a值最大,随着pH值升高a值降低,说明BA的红色度逐渐下降。然而,与对照组相比BA-CS-PU体系显著提高了BA的a值,保护了其有色结构的稳定性。因此BA-CS-PU所形成的稳态体系在保护BA的色泽,提升相关加工食品的色泽稳定性中具有重要价值。
2.3.3 VC共存
然而,因其本身表现的强还原性,对BA的稳定性具有破坏作用。Chung等[29]发现VC会加速BA的降解。在不同质量分数VC处理条件下游离BA及BA-CS-PU体系中BA的保留率如图6A所示。随着VC质量分数增加,BA保留率呈下降趋势,这可能是由于VC在有氧条件下氧化生成了H2O2或BA与VC之间发生了缩合反应,从而降低BA的稳定性[30]。值得注意的是,与对照组相比,任意VC含量下BA-CS-PU体系中BA的保留率显著增加(P<0.05)。其中,以3 mg/mL PU形成的BA-CS-PU3体系对BA的保留率最为显著。结果表明,VC共存条件下,BA-CS-PU体系可以有效保护BA的稳定性。
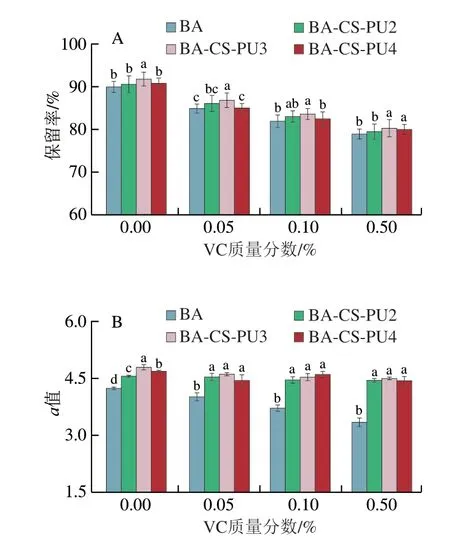
图6 不同质量分数VC处理时BA-CS-PU体系对BA保留率(A)和a值(B)的影响Fig.6 Effect of BA-CS-PU system on BA retention rate (A) and a value (B)in the presence of different concentrations of VC
如图6B所示,在VC共存条件下,随着其含量增加,BA的a值逐渐减小,说明其溶液红色逐渐淡化。与单独BA相比,BA-CS-PU体系在0.05%~0.5% VC条件下,a值均显著增加(P<0.05),说明体系中共色物的存在结合PU的包封效果可以显著提高BA溶液色泽稳定性,在富含VC与BA的液态饮品中,BA-CS-PU体系可以最大程度保护BA的色泽,提升食品的感官品质。
2.4 BA-CS-PU稳态体系的消化稳定性评价
在模拟加工稳定性实验中,综合比较发现BA-CSPU3体系对BA具有最优的保护效果。因此进一步利用体外模拟消化实验,探究BA-CS-PU3稳态体系对BA的保护作用效果。样品在模拟口腔、胃1 h、胃2 h、肠1 h和肠2 h条件下BA的残留率情况如图7所示,BA对照组经过唾液、胃、小肠后保留率逐渐降低,唾液、胃1 h、胃2 h、肠1 h及肠2 h消化后的保留率分别为96.47%、92.71%、91.87%、22.41%和15.12%,而对应的实验组BA-CS-PU3体系,在消化过程中的保留率分别为98.81%、96.78%、95.94%、31.02%和23.75%。可以看出BA在唾液中降解不明显,这是由于在唾液阶段停留的时间较短。BA经过胃消化后降解仍不明显,这是由于胃环境pH值较低,此时BA以其稳定的黄烊阳离子结构存在。然而消化至小肠时,BA的损失严重,这是由于BA在小肠时处于极不稳定的碱性条件,其结构由有色的黄烊阳离子转化为无色的查耳酮或甲醇甲碱形式,破坏了BA的稳定性[31]。值得注意的是,在小肠消化1 h和2 h后,实验组BA-CS-PU3体系中BA的保留率较对照分别提高了8.61%和8.63%,进一步证明BA-CS-PU稳态体系对BA的正向保护作用。
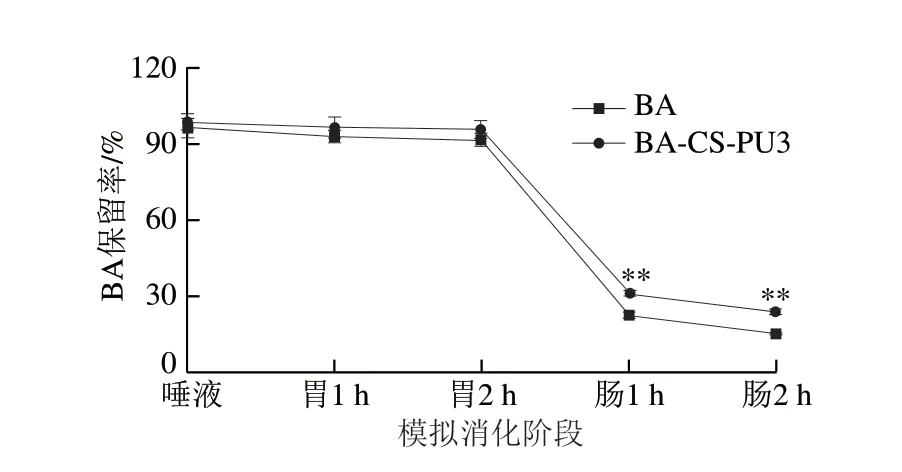
图7 BA和BA-CS-PU复合物体外模拟消化后的残留率变化Fig.7 Changes in retention rates of BA and BA-CS-PU complex during simulated digestion in vitro
3 结论
BA易受环境胁迫影响色泽稳定性,限制其在食品加工中的应用。本研究通过共色技术与物理包埋相结合,以CS与BA离子络合形成共色物再与PU复合制备了负载BA的BA-CS-PU稳态体系。紫外-可见光谱及色度结果表明了BA-CS共色物的形成。FTIR和TGA结果表明各组分之间存在氢键相互作用,共色作用发生在CS的硫酸基团和BA黄烊阳离子之间的离子络合。BA-CS-PU显著提高了BA的热加工、酸碱强度、VC共存条件下的保留率和色泽稳定性,同时提高了胃肠消化稳定性。综上,基于共色与物理包埋技术结合所制备的BA-CS-PU稳态体系在富含花色苷的食品中具有广阔应用前景。
