复合酶辅助提取荷叶多糖工艺优化及其体外抗氧化活性
2024-01-03余捷李亚娜夏瑾瑾闫普普刘佳丽郭利伟杨小林刘国平易提林
余捷,李亚娜,夏瑾瑾,闫普普,刘佳丽,郭利伟,杨小林,刘国平,易提林
(长江大学 动物科学技术学院,湖北 荆州 434000)
荷叶为睡莲科植物莲(Nelumbo nucifera Gaertn.)的干燥叶,具有多种生理功效,如预防高脂血症、高血压、肥胖等[1-2],同时具有抗氧化、抗癌、保肝、抗炎等作用[2]。荷叶中富含多种活性成分,如多糖、黄酮类化合物和生物碱等[3]。目前,国内外学者对荷叶的研究主要集中在黄酮类化合物[4-6]、生物碱等活性物质方面[7-10],对荷叶多糖的研究较少,而多糖作为一种广泛存在的生物活性物质,具有抗氧化、降血糖、抗糖基化、免疫调节等作用[11-14]。我国荷叶年产量超过7 000 t,然而只有1%被用于茶叶和餐饮行业,大部分被作为副产品丢弃[2]。因此,为了促进荷叶在食品工业中的应用,开发绿色高效的荷叶多糖制备方法是必要的。
目前,植物多糖的提取方法有溶剂法、酶解法、微波提取法、超声辅助提取法、超临界流体萃取法等。酸碱溶剂提取法易破坏多糖结构[15],超声辅助提取法和超临界流体萃取法则具有设备要求高、提取成本高、消耗能源大等缺点[16]。酶辅助可以提高多糖的提取效率和生物活性[17]。目前已有酶解法提取荷叶多糖的研究,但并未对其提取工艺进行优化[18],有关多种酶复合后酶解荷叶多糖的研究鲜有报道。因此,本文选择纤维素酶和木瓜蛋白酶按照质量比为1∶1 复合,在考察pH 值、温度、液料比、复合酶添加量、提取时间5 个单因素对荷叶多糖得率影响的基础上,进一步采用响应面分析法优化荷叶多糖的提取工艺,并对其抗氧化性进行研究,以期为荷叶资源的深度开发利用提供参考。
1 材料与方法
1.1 原料及试剂
荷叶饮片:市售;纤维素酶(50 U/mg)、木瓜蛋白酶(800 U/mg)、1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH):上海源叶生物科技有限公司;无水磷酸氢二钠、一水合柠檬酸、丙酮、浓硫酸、苯酚、无水葡萄糖标准品、乙醚、硫酸亚铁、水杨酸、双氧水(均为分析纯):上海国药集团化学试剂有限公司。
1.2 仪器与设备
ME204 电子天平:上海书培实验设备有限公司;HS-800D 恒温水浴锅:太仓市华利达实验设备有限公司;5804R 高速台式离心机:德国艾本德股份公司;RE-5286A 旋转蒸发仪:上海亚荣生化仪器厂;UV5500PC 紫外可见分光光度计:上海元析仪器有限公司;Spectra Max 多功能酶标仪:美谷分子仪器(上海)有限公司;SCIENTZ-12N/B 冷冻干燥机:宁波新芝生物科技股份有限公司;ST300 酸度计:奥豪斯仪器(上海)有限公司。
1.3 试验方法
1.3.1 提取方法
荷叶饮片用粉碎机粉碎,过60 目筛,索氏提取器乙醚脱脂,挥干有机溶剂后65 ℃烘干。按照液料比30∶1(mL/g)配制pH 值为6.8 的碳酸氢二钠-柠檬酸缓冲液,加入质量分数为0.6%的复合酶(纤维素酶∶木瓜蛋白酶质量比=1∶1),50 ℃水浴活化10 min,加入5.0 g荷叶粉,50 ℃水浴100 min。沸水浴5 min 使酶失活,抽滤后旋转蒸发,加入4 倍体积的无水乙醇,4 ℃静置24 h。3 000 r/min,离心5 min 得沉淀,无水乙醇和丙酮洗涤后冷冻干燥即得荷叶多糖。
1.3.2 荷叶多糖含量的测定
1.3.2.1 标准曲线的绘制
精密称取100 mg 无水葡萄糖标准品,于100 mL容量瓶中配制成质量浓度为1 mg/mL 的对照品溶液。分别精密移取对照品溶液0.1、0.2、0.3、0.4、0.5 mL 于具塞试管中,蒸馏水补至2.0 mL,再依次精密加入1 mL质量分数为5%的苯酚溶液,摇匀后迅速加入5 mL 浓硫酸,再次摇匀。50 ℃水浴30 min,流水冷却至室温[19]。采用紫外可见分光光度计在490 nm 处测定吸光度。以葡萄糖质量浓度和吸光度关系作标准曲线,得回归方程为Y=6.693X+0.018 6,相关系数R2=0.999 5。
1.3.2.2 多糖得率的测定
准确吸取稀释后的溶液2.0 mL,按1.3.2.1 的方法,测定荷叶多糖的吸光度,重复测定3 次,取平均值,代入标准曲线回归方程计算荷叶多糖得率。荷叶多糖得率计算公式如下。
式中:Y 为荷叶多糖得率,%;C 为多糖质量浓度,mg/mL;V 为提取液体积,mL;N 为测定样品稀释倍数;M 为干粉质量,g。
1.3.3 单因素试验
精密称取经处理的荷叶粉5.0 g,置于250 mL 的具塞锥形瓶中,考察pH 值、温度、液料比、复合酶添加量、提取时间对荷叶多糖得率的影响,各因素分别设置5 个水平,进行单因素试验设计见表1。
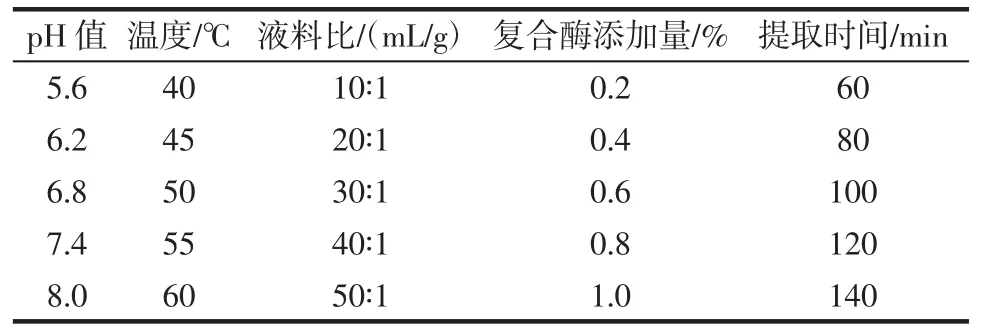
表1 单因素试验设计Table 1 Factors and levels of single factor tests
1.3.4 响应面法试验设计
根据单因素试验的结果,选取pH 值(A)、温度(B)、液料比(C)、复合酶添加量(D)、提取时间(E)为自变量,以多糖得率为响应值Y,采用软件Design-Expert V12.0 进行五因素三水平的响应面试验,响应面试验设计因素水平见表2。

表2 Box-Behnken 试验因素与水平Table 2 Factors and levels of Box-Behnken test
1.3.5 荷叶多糖抗氧化试验
将采用最佳提取工艺提取的荷叶多糖配制成浓度为0.1、0.2、0.4、0.6、0.8、1.0、2.0、3.0、4.0 mg/mL 的溶液,通过分光光度法测定其对DPPH 自由基和羟自由基的清除能力,考察荷叶多糖的抗氧化作用。
1.3.5.1 荷叶多糖对DPPH 自由基清除率的测定
参考刘晓鹏等[20]的方法,并稍作修改。将100 μL测试样品与100 μL 新配制的DPPH 溶液(0.1 mmol/L)混合,轻微振荡后在室温下避光孵育30 min。混合物在517 nm 处测定吸光度。DPPH 自由基清除率(X1,%)计算公式如下。
式中:Ab为对照组的吸光度;As为样品组吸光度;Ac为未添加DPPH 溶液的空白对照组吸光度。
1.3.5.2 荷叶多糖对羟自由基清除率的测定
参照Chen 等[21]的方法,并稍作修改。将1 mL 测试样品置于5 mL 离心管中,分别快速向离心管中加入1 mL FeSO4溶液(0.009mol/L)和水杨酸乙醇溶液(0.009mol/L),混匀后快速加入1 mL H2O2溶液(0.009 mol/L),37 ℃水浴30 min,冷却至室温后测定吸光度。羟自由基清除率(X2,%)计算公式如下。
式中:Ab为对照组的吸光度;As为样品组吸光度;Ac为多糖溶液本身吸光度。
1.4 数据分析
采用Graphpad Prism 8.0 进行绘图,Design-Expert V12.0 进行响应面设计试验和方差分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 pH 值对多糖得率的影响
pH 值对荷叶多糖得率的影响见图1。

图1 pH 值对荷叶多糖得率的影响Fig.1 Effect of pH on the yield of lotus leaf polysaccharide
由图1 可知,随着pH 值的升高,荷叶多糖得率整体呈先升高后降低的趋势,当pH 值为6.8 时,荷叶多糖得率达到最大值,为2.37%。因此选择pH 值为6.2、6.8、7.4 进行响应面优化试验。
2.1.2 温度对荷叶多糖得率的影响
温度对荷叶多糖得率的影响见图2。
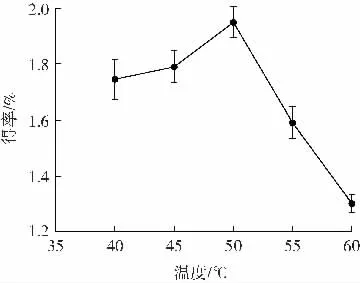
图2 温度对荷叶多糖得率的影响Fig.2 Effect of temperature on the yield of lotus leaf polysaccharide
由图2 可知,多糖得率在40~50 ℃之间随温度的升高而增加,当温度为50 ℃时,荷叶多糖的得率达到最大值,为1.95%。这可能是由于复合酶在50 ℃时活性最强,分解细胞壁的效果最佳。当温度进一步升高时,酶蛋白开始受热变性,使得酶活性逐渐降低,导致多糖得率下降[22-23]。因此选择温度为45、50、55 ℃进行响应面优化试验。
2.1.3 液料比对荷叶多糖得率的影响
液料比对荷叶多糖得率的影响见图3。

图3 液料比对荷叶多糖得率的影响Fig.3 Effect of liquid-to-solid ratio on the yield of lotus leaf polysaccharide
由图3 可知,多糖得率呈先增后减的趋势,当pH 值为6.2 时,得率达到最大值,为1.99%。这可能是因溶剂增加扩大了反应体系中荷叶粉与复合酶的接触面积,随着溶剂体积的增加,提取液黏度降低,多糖分子更多地被溶出。当溶剂用量超过一定范围时,使得酶的浓度明显降低,从而影响到酶的催化效率,这可能是后期随着溶剂用量不断增加,荷叶多糖得率反而降低的原因[24-25]。此选择液料比为20∶1、30∶1、40∶1(mL/g)进行响应面优化试验。
2.1.4 复合酶添加量对荷叶多糖的影响
复合酶添加量对荷叶多糖得率的影响见图4。

图4 复合酶添加量对荷叶多糖得率的影响Fig.4 Effect of complex enzyme addition on the yield of lotus leaf polysaccharide
由图4 可知,随着复合酶添加量的增加,荷叶多糖得率不断增加,当复合酶添加量为0.6%时,荷叶多糖得率达到最大值,随后得率不断下降。因此选择复合酶添加量为0.4%、0.6%、0.8%进行响应面优化试验。
2.1.5 提取时间对荷叶多糖得率的影响
提取时间对荷叶多糖得率的影响见图5。

图5 提取时间对荷叶多糖得率的影响Fig.5 Effect of extraction time on the yield of lotus leaf polysaccharide
由图5 可知,随着提取时间的增加,荷叶多糖得率呈现先升高后下降的趋势,并在100 min 时达到最大值。因此选择提取时间为80、100、120 min 进行响应面优化试验。
2.2 响应面优化结果
2.2.1 响应面模型的建立
利用软件Design-Expert V12.0 对5 个自变量进行二次多元线性回归分析,得到结果见表3。
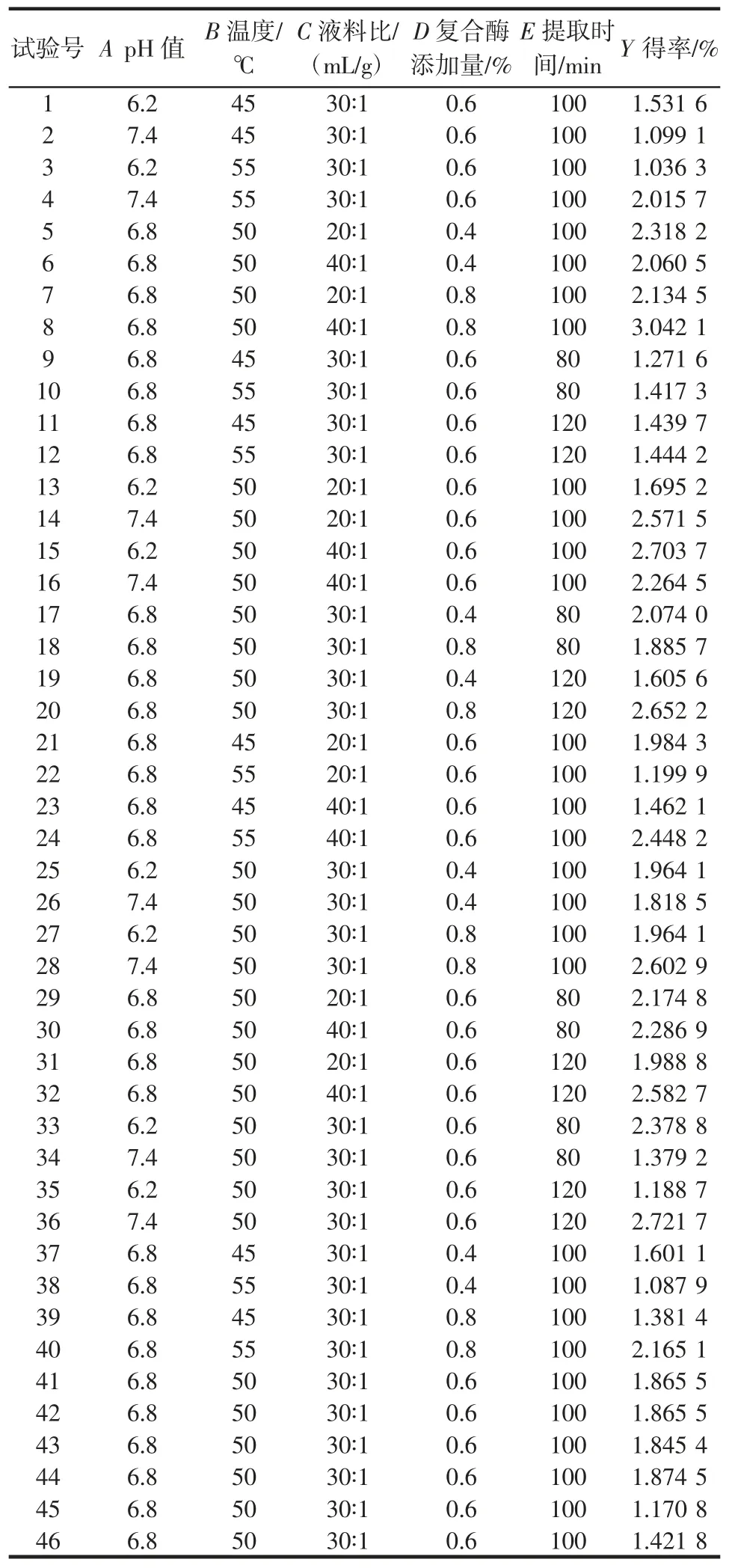
表3 响应面试验设计及结果Table 3 Response surface testresults
建立二次回归方程,对响应因素和多糖得率进行二次多元方程拟合,得到回归方程为Y=1.67+0.125 6A+0.065 2B +0.174 0C +0.206 1D +0.047 2E +0.353 0AB-0.328 9AC+0.196 1AD+0.633 1AE+0.442 6BC+0.324 2BD-0.0353BE+0.291 3CD+0.120 5CE+0.308 7DE+0.144 2A2-0.384 9B2+0.476 1C2+0.262 8D2+0.107 3E2。
2.2.2 响应面模型的方差分析
回归方差分析见表4。

表4 回归方差分析Table 4 Results of analysis of variance
2.2.3 响应面条件优化及验证
回归方程的三维响应面和二维等高线如图6 所示。

等高线图的形状越呈椭圆说明两个影响因素之间的交互作用越显著,反之则为不显著。由响应面优化得到荷叶多糖的最佳提取工艺条件为pH7.027、温度51.665 ℃、液料比39.163∶1(mL/g)、复合酶添加量0.739%、提取时间115.787 min。考虑到试验操作的可行性,对预测工艺条件修正为pH7.0、温度52 ℃、液料比39∶1(mL/g)、复合酶添加量0.7%、提取时间116 min。在此条件下,重复提取荷叶多糖3 次,结果荷叶多糖的得率均值为3.26%,与预测值接近,说明模型有效合理,可以用于荷叶多糖提取工艺的优化。
2.3 抗氧化活性
2.3.1 DPPH·清除能力
荷叶多糖的DPPH 自由基清除率如图7 所示。

图7 荷叶多糖的DPPH·清除率Fig.7 DPPH free radical scavenging ability of lotus leaf polysaccharide
由图7 可知,荷叶多糖在0.1~4.0 mg/mL 的范围内对DPPH 自由基的清除率随着浓度增大而升高,IC50值为2.355 mg/mL。DPPH 自由基清除能力测定是一种快速、简便的评价天然产物抗氧化活性的方法,该结果表明荷叶多糖具有较好的清除DPPH 自由基作用。
2.3.2 羟自由基清除能力
荷叶多糖的羟自由基清除率如图8 所示。
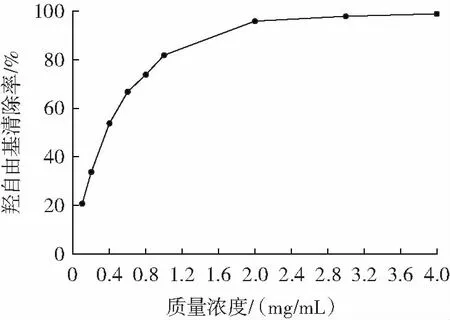
图8 荷叶多糖的羟自由基清除率Fig.8 Hydroxy radical scavenging ability of lotus leaf polysaccharide
由图8 可知,羟自由基随着荷叶多糖浓度的增加而增加,在2.0 mg/mL 时清除率接近100%,IC50值0.331 2 mg/mL。活性氧中,羟自由基活性最强,可引起组织损伤或细胞死亡。因此,清除羟自由基对细胞或机体的抗氧化防御很重要,该结果表明荷叶多糖具有较好的清除羟自由基作用。
3 结论
本研究通过响应面法优化酶辅助提取荷叶多糖的最佳工艺条件为pH7.0、温度52 ℃、液料比39∶1(mL/g)、复合酶添加量0.7%、提取时间116 min,荷叶多糖得率可达3.26%,说明采用Box-Behnken 响应面法优化复合酶提取荷叶多糖的方法可行,具有较强的实际意义,可用于提取荷叶多糖。
荷叶多糖抗氧化试验结果显示,荷叶多糖对自由基的清除能力与浓度呈现一定的剂量依赖效应,多糖浓度越大,抗氧化能力越强,清除DPPH 自由基和羟自由基的IC50值分别为2.355、0.331 2 mg/mL,表明荷叶多糖对羟自由基的清除能力强于对DPPH 自由基的清除能力,说明荷叶多糖具有良好的抗氧化活性,可作为天然抗氧化剂加以开发利用。因此,本研究结果为荷叶多糖的开发利用提供了实践基础和理论支撑。
