桑椹采后致腐真菌的分离鉴定及其内生酵母保鲜效果
2024-01-03万松陈泰辉林长锦王宁张建芬
万松,陈泰辉,林长锦,王宁,张建芬
(浙江树人学院 生物与环境工程学院,浙江 杭州 310015)
桑椹味道鲜美、营养丰富,含有对人体有益的多糖、氨基酸、花青素、维生素、黄酮等成分[1]。桑椹具有增强人体免疫力、防止动脉硬化、降血脂、降血糖和预防癌症等功能[2]。桑椹是一种药食两用的水果,市场需求广,具有很高的开发利用价值。近年来,我国果桑产业发展快速[3-4],桑椹的年产量逐年提高。桑椹为柔软多汁的浆果,且缺乏保护性外皮,容易腐烂。桑椹真菌性病害主要包括果实成熟前的菌核病害和采后的腐生性病害[5-6]。桑椹菌核病的病原菌主要为核盘菌科真菌[7],引起桑椹腐生性病害的微生物主要有链格孢属(Alternaria sp.)、灰霉属(Botrytis sp.)和毛霉属(Mucor sp.)等[6,8],这些真菌在环境中广泛存在,极易引起桑椹采后的霉变腐烂。
目前桑椹保鲜研究主要集中于低温保鲜法、化学试剂保鲜法和生物保鲜法等[2,9]。拮抗微生物具有成本低、安全性高、环境污染小等特点,更具有应用前景。目前,对于桑椹的微生物保鲜主要集中在拮抗细菌,如枯草芽胞杆菌(B.subtilis)[5]、贝莱斯芽孢杆菌(B.velezens)[10]、甲基营养型芽孢杆菌(B.methylotrophicus)[11]等,鲜有酵母用于桑椹采后保鲜的研究。拮抗酵母菌是公认安全的微生物,容易被市场接受,是理想的水果采后保鲜剂[10],是一种很有前景的化学杀菌剂替代品[12]。目前,已经有一些拮抗酵母被广泛研究,如假丝酵母属(Candida spp.)、隐球菌属(Cryptococcus spp.)、梅氏菌属(Metschnikowia spp.)、毕赤酵母属(Pichia spp.)、红酵母属(Rhodotorula spp)和酵母样真菌(A.pullulans)[12-15]。并且橄榄假丝酵母(C.oleophila)、清酒假丝酵母(C.sake)、水果梅氏菌(M.fructicola)、酿酒酵母(S.cerevisiae)和白色隐球菌(C.albidus)等已开发为商业产品[12-16]。目前学者更倾向于通过从果蔬表面分离来筛选拮抗微生物,因为它们能够更好地适应果实表面的生长环境,从而有效抑制病原真菌[17]。
本文从腐烂桑椹中分离鉴定致腐菌,然后研究前期从桑椹中分离得到的3 株内生酵母菌[拟粉红锁掷孢酵母(Sporidiobolus pararoseus)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum) 和异常威克汉姆酵母(Wickerhamomyces anomalus)]对桑椹致腐真菌的拮抗效果,为开发一种天然、安全、高效的桑椹微生物保鲜剂提供参考。
1 材料与方法
1.1 材料
1.1.1 供试样品新鲜桑椹:市售,用塑料盒运至实验室后剔除机械伤、病虫果,于4 ℃贮藏。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基(1 000 mL):马铃薯200 g、葡萄糖20 g,若制备固体培养基,加入20 g 琼脂粉。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基(1 000 mL):酵母膏10 g、蛋白胨20 g、葡萄糖20 g,若制备固体培养基,加入20 g 琼脂粉。
1.2 桑椹采后致腐真菌的分离
桑椹样品在实验室中25 ℃放置2~3 d,将发生病害的桑椹在75%乙醇中浸泡30 s,用灭菌水漂洗3 次,用无菌刀从病果切取大小约为3 mm×3 mm 的组织块,植入PDA 平板上,于28 ℃培养。待切口处长出菌丝后将菌丝转接至新鲜的PDA 平板纯化,多次纯化直至获得纯菌株。
1.3 分离真菌的致病性测定
分离真菌的致病性测定按照柯赫法则进行验证,具体参考周建华等[4]方法,每组实验重复3 次。将分离的真菌接种到PDA 平板上,于28 ℃暗培养10 d。用灭菌打孔器取菌落边缘菌丝块,用无菌接种针针刺表面消毒的新鲜桑椹,将菌丝块接种于针刺部位,以接种PDA 培养基的桑椹为空白对照。然后将桑椹置于铺有3 层灭菌吸水纸的培养皿中,28 ℃下暗培养,每隔1 d观察桑椹的发病情况。待桑椹出现明显霉变症状后再进行真菌分离,观察再次分离的真菌与原接种真菌的平板菌落形态和显微镜观察形态是否一致。
1.4 桑椹采后致腐真菌的鉴定
致腐真菌的形态学观察:观察分离菌株在PDA 平板上的菌落形态、色泽以及是否产生孢子,在光学显微镜(400 倍)下观察菌丝及分生孢子形状。
分子生物学鉴定:将菌株接入PDA 平板,28 ℃条件下培养7 d 后收集菌丝。采用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)法提取真菌基因组DNA。利用通用引物ITS1/ITS4 对菌株的内源转录间隔区(internally transcribed spacer,ITS)进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。扩增产物经1.0%琼脂糖凝胶电泳分析后,委托上海生工生物有限公司进行测序。将测序得到的DNA 序列提交GenBank 进行Blast 比对。比对后,下载同源序列,采用MEGA 7 软件构建系统进化树。
1.5 酵母菌对致腐菌的体外拮抗实验
酵母于YPD 培养基平板活化后,接入YPD 液体培养基(50 mL/250 mL)中,于28 ℃下振荡培养4 d,即得酵母发酵液。发酵液在4 ℃、8 000 r/min 离心10 min,得到的菌体沉淀用灭菌生理盐水洗涤2 次,将菌体沉淀用无菌水重悬制成酵母菌悬液,并用血球计数板计数。酵母菌浓度分别调整为1×103、1×104、1×105、1×106个/mL,分别取0.1 mL,涂布PDA 平板,无菌水作对照。用打孔器从致腐菌菌落边缘取直径为6 mm 的菌丝块,放在每个平板的中心,每组实验重复3 次。28 ℃下培养5 d 后测量并记录致腐真菌生长区的直径。
1.6 酵母对桑椹的保鲜效果实验
参照韩蓓蓓[6]的处理方法,挑选健康的桑椹鲜果放入酵母菌悬液(1×106个/mL)中浸泡3 min,取出后放在通风处自然风干,存放在塑料保鲜盒内于4 ℃冰箱贮藏,以无菌蒸馏水处理为空白对照(Control)。酵母菌悬液处理和无菌水处理均为40 颗桑椹。以桑椹变软或表面出现白色或灰色霉菌菌丝为腐烂,每3 d 观察1 次,记录腐烂桑椹的数量,计算腐烂率。腐烂率的计算参照文献[11]方法,腐烂桑椹数量除以桑椹总数量即为腐烂率。
1.7 数据处理
每组实验平行3 次,采用Excel 进行数据处理,采用Origin 8.0 软件进行作图。
2 结果与分析
2.1 致腐真菌的分离、形态鉴定
从腐烂桑椹中分离得到3 株真菌(分别编号MFR-1、MFR-2、MFR-3)。在PDA 培养基上培养5 d,各菌株的菌落形态如图1 所示。

图1 桑椹致腐真菌的形态特征Fig.1 Morphological characteristics of rot-causing fungi from mulberry fruit
由图1 可知,MFR-1 在PDA 平板上生长迅速,菌丝发达,呈白色细密绒毛状;MFR-2 菌落为黑色粗地毯状,在其上密生黑色粉粒;MFR-3 菌丝较为稀疏,菌落内肉眼可见鼠粪样菌核。利用显微镜观察3 株菌丝形态,发现MFR-1 菌丝发达,菌丝无隔膜,分生孢子呈卵圆形且具有横隔;MFR-2 菌丝发达,分生孢子头为放射状,有球形顶囊;MFR-3 分生孢子梗细长,丛生,顶端簇生椭圆形分生孢子。
2.2 致病性测定
致病性测定结果如图2 所示。

图2 不同菌株对桑椹的致病性检测(接种第6 天)Fig.2 Detection of pathogenicity of different strains to mulberry fruit(day 6 of inoculation)
3 株真菌均可引起桑椹腐烂病发生,接种第3 天可观察到桑椹病斑和菌丝生长,第5 天时,桑椹的菌丝块接种周围发生明显的霉变腐烂,第6 天时(图2),整颗桑椹腐烂,周围形成肉眼可见的白色霉层或灰黑色霉层。因此,分离到的3 株真菌均可引起桑椹的霉变腐烂,其中菌株MFR-2 引起的桑椹腐烂最为严重。
2.3 致腐真菌的分子鉴定
以致腐真菌的基因组DNA 为模板,以ITS1 和ITS4 为引物,成功扩增ITS 区序列,进行测序后,提交GeneBank 经Blast 比对分析和系统发育分析,结果如图3 所示。

图3 桑椹致腐真菌的ITS 区系统进化树Fig.3 Phylogenetic tree of rot-causing fungi from mulberry fruit based on their ITS sequence
如图3 所示,结合形态学特征和系统发育分析结果,菌株MFR-1 鉴定为链格孢菌(Alternaria alternata);菌株MFR-2 鉴定为黑曲霉(Aspergillus niger);菌株MFR-3 鉴定为富克尔核盘菌(Botryotinia fuckeliana)。链格孢菌可引起包括小麦、马铃薯、玉米、烟草、番茄、苹果、梨、草莓等几十种农作物的真菌性病害[15]。黑曲霉分布广泛,常引起蔬菜、水果等腐烂。核盘菌是引起桑椹菌核病的病原菌,肖建京等[18]从浙江省淳安县的桑叶中分离鉴定出病原菌富克尔核盘菌(Botryotinia fuckeliana)。郑泽林等[19]从陕西省周至县桑园土壤中分离到一株核盘菌(Sclerotinia sclerotiorum)。周建华等[4]研究发现,引起湖北省桑椹腐烂病的病原菌为灰霉菌。富克尔核盘菌(Botryotinia fuckeliana)是灰葡萄孢(Botrytis cinerea)的有性型,灰葡萄孢寄主范围广泛,可引起多种蔬菜、果树及观赏作物发生灰霉病[20]。此外,也有其它桑椹致腐真菌分离的报道,如葡萄孢属(Botrytis spp.)霉菌、匐枝根霉(Rhizopus stolonifer spp.)菌、毛霉属(Mucor spp.)霉菌[6]和层出镰刀菌(Fusarium prolifertum)[17]等。
2.4 酵母菌对致腐真菌的体外拮抗实验
课题组前期从桑椹中分离得到酵母菌3 株,分别为拟粉红锁掷孢酵母(S.pararoseus)、葡萄汁有孢汉逊酵母(H.uvarum)、异常威克汉姆酵母(W.anomalus),考察3 株酵母菌对桑椹致腐真菌的体外拮抗作用,结果如图4 所示。

图4 酵母菌对致腐真菌的体外拮抗实验Fig.4 In vitro antagonistic experiments of yeasts against rotcausing fungi
由图4 可知,拟粉红锁掷孢酵母对MFR-2 的抑制作用不明显,对MFR-1 的抑制作用较强,而对MFR-3的抑制作用最强,当酵母菌浓度为1×106个/mL 时,对MFR-3 的抑制率为100%。葡萄汁有孢汉逊酵母和异常威克汉姆酵母对3 株桑椹致腐真菌均具有强烈的抑制作用,当酵母菌浓度为1×106个/mL 时,对3 株桑葚致腐真菌的抑制率达90%以上。综上拟粉红锁掷孢酵母对桑椹致腐真菌的体外拮抗作用有选择性,而葡萄汁有孢汉逊酵母和异常威克汉姆酵母的体外拮抗作用更为广谱,具有更好的拮抗作用。
2.5 酵母菌对致腐真菌的体内拮抗实验
考察拟粉红锁掷孢酵母、葡萄汁有孢汉逊酵母和异常威克汉姆酵母对桑椹致腐真菌的体内拮抗作用,结果如图5 所示。
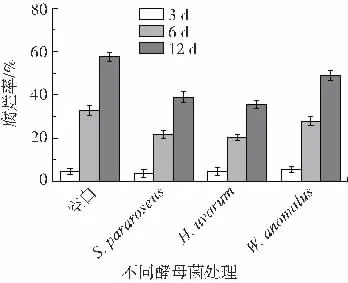
图5 酵母菌对致腐菌的体内拮抗实验Fig.5 In vivo antagonistic experiments of yeast against rotcausing fungi
由图5 可知,经3 种酵母菌悬液中浸泡处理之后,桑葚腐烂率均有不同程度的降低。其中,拟粉红锁掷孢酵母菌液和葡萄汁有孢汉逊酵母菌液处理过的桑椹,其腐烂率降低更为明显,在处理12 d 后分别比空白对照降低了18.7%和21.9%。因此,综合体外拮抗实验结果和体内拮抗实验结果,拟粉红锁掷孢酵母菌液和葡萄汁有孢汉逊酵母对桑椹致腐真菌均有较好的拮抗作用,具有良好的应用前景。目前,对于桑椹的微生物保鲜主要集中在枯草芽孢杆菌,鲜有拮抗酵母用于桑椹保鲜的研究。草莓与桑椹都是易腐烂的浆果,有关拮抗酵母用于草莓保鲜的研究较多。研究发现,拟粉红锁掷孢酵母对草莓灰霉病菌具有明显的拮抗作用[21-22]。Qin 等[23]研究发现,葡萄汁有孢汉逊酵母可通过产生挥发性物质延长草莓的货架期。未来还需进一步研究这3 株酵母菌对桑椹致腐真菌的体内外拮抗机理。
3 结论
有效控制采后病害的发生对保持果蔬品质、降低真菌毒素污染风险、延长贮藏和货架时间具有重要意义。本文从腐烂桑椹中分离出3 株致腐真菌,经形态学观察和分子生物学鉴定,菌株MFR-1、MFR-2、MFR-3 分别鉴定为链格孢菌(A.alternata)、黑曲霉(A.niger)和富克尔核盘菌(B.fuckeliana)。然后研究桑椹内生酵母菌对桑椹致腐真菌的体内外拮抗效果。体外拮抗实验显示:拟粉红锁掷孢酵母对菌株MFR-1 和MFR-3 具有很好的抑制作用;葡萄汁有孢汉逊酵母和异常威克汉姆酵母对菌株MFR-1、MFR-2、MFR-3 具有很好的抑制作用,当酵母菌浓度为1×106个/mL 时,对3 株桑葚致腐真菌抑制率为90%以上。体内拮抗实验结果显示,拟粉红锁掷孢酵母和葡萄汁有孢汉逊酵母对3 株桑椹致腐真菌都具有很好的拮抗效果。后续还可进行酵母对桑椹致腐菌的拮抗机理研究,并研究它们的固体制剂,以加速拮抗酵母在桑椹采后病害控制中的实际应用进程。
