不同热加工工艺对巴氏杀菌乳中乳清蛋白的影响
2024-01-03李梦凡陈小红朱立民李红娟邹旸
李梦凡,陈小红,朱立民,李红娟,邹旸*
(1.天津海河乳品有限公司,天津 300457;2.天津科技大学 食品科学与工程学院,天津 300457)
牛乳是一种营养全面的食品,富含蛋白质、脂肪等多种营养物质,是微生物的天然培养基。因此,生牛乳必须经过热处理,以保证产品的安全性并延长货架期[1-2]。但是热处理会使得牛奶的口感和营养成分明显下降,根据不同强度的热处理,牛乳中众多的热不稳定物质会发生物理化学反应,例如乳糖降解为有机酸和乳果糖、乳清蛋白的变性、某些维生素和酶被破坏、蛋白质和脂质的水解以及美拉德反应生成不良物质等[3]。巴氏杀菌乳是一种低温杀菌的乳品,根据NY/T 939—2016《巴氏杀菌乳和UHT 灭菌乳中复原乳的鉴定》对巴氏杀菌的定义是为有效杀灭病原性微生物而采用的加工方法,即经低温长时间(63~65 ℃保持30 min)或经高温短时间(72~76 ℃保持15 s 或80~85 ℃保持10~15 s)的处理方式。目前乳品企业多采用高温短时间的巴氏杀菌方式,且为了延长产品的保质期,多偏好于85 ℃杀菌[4-5]。巴氏杀菌乳的杀菌条件温和,可以最大程度地保留牛乳的营养物质和口感。
乳清蛋白约占牛乳蛋白质总量的20%,包括β-乳球蛋白(β-lactoglobulin,β-Lg)、α-乳白蛋白(α-lactalbumin,α-La)、乳铁蛋白(lactoferrin,LF)、牛血清白蛋白(bovine serum albumin,BSA)等[6]。乳清蛋白在牛乳灭菌过程中极易变性,变性后的乳清蛋白丧失了免疫调节和抑菌等生理功能,并影响人体对牛乳中钙的吸收[7]。β-Lg 是乳清蛋白中最常见的蛋白质,占乳清蛋白总量的58%,含有162 个氨基酸,分子量约为18 300 Da。β-Lg 有两个基因变体A 和B,不同之处在于变体B 中的甘氨酸取代了变体A 中的天冬氨酸[8]。天然的β-Lg呈现三维结构,研究表明:当温度大于65 ℃时,β-Lg会展开并与κ-酪蛋白在胶束表面形成二硫键与酪蛋白胶束聚集。α-La 是乳清蛋白中第二丰富的蛋白质,占乳清蛋白的13%,由123 个氨基酸组成,分子量为14 146 Da。在较高的温度下(70~96 ℃),α-La 发生变性,与β-Lg 聚集体形成络合物,变性的α-La 在高温下也会与αS2-酪蛋白和乳脂肪球膜形成复合物[9-10]。LF是一种单肽链的多功能糖蛋白,分子量约为80 kDa,大约有690 个氨基酸残基,具有抗氧化、抗菌、抗病毒、调节骨髓细胞生成和促进人体对铁吸收的功能。LF 以溶解状态存在于牛乳中,通过氢键、二硫键、配体结合等来稳定结构,在一定的温度条件下,这些结构稳定力会受到影响。研究发现,在65 ℃下以自然的pH 值加热牛奶30 min,LF 不会明显变性,但在85 ℃下加热30 min LF 明显变性,其生物活性大大下降。LF 变性会改变其三维结构,从而改变其功能性质,例如铁结合能力和抗菌活性[11]。
巴氏杀菌的目的是将细菌病原体的数量减少到对公共卫生安全的水平,并使牛乳的感官、物理和化学变化最小化,最大程度保留牛奶中的活性物质。因此为了避免牛乳的过度加工、最大程度保留牛乳中的营养物质以及从安全的角度判断加热是否充足,本试验采用市场上巴氏杀菌乳最普遍的杀菌方法,即高温短时间的杀菌方法(72~85 ℃/15 s),利用高效液相色谱仪对巴氏杀菌乳乳清蛋白中的LF、α-La 和β-Lg 的含量进行测定,分析比较不同杀菌条件对牛乳中乳清蛋白的影响,以期为今后生产保留良好蛋白活性的巴氏杀菌乳产品工艺改进提供理论指导。
1 材料与方法
1.1 材料与试剂
未经任何杀菌处理的生牛乳:天津海河乳品有限公司;乙腈、甲醇(均为色谱级)、α-乳白蛋白标准品(纯度≥85%)、β-乳球蛋白标准品(纯度≥90%)、乳铁蛋白标准品(纯度≥85%):美国Sigma 公司;三氟乙酸、十二水合磷酸氢二钠、二水合磷酸二氢钠(均为色谱纯):天津市科密欧化学试剂有限公司;0.22 μm 微孔滤膜:美国安捷伦科技公司;HiTrap Heparin HP 亲和层析柱(1 mL):思拓凡生物科技公司;平板计数琼脂、嗜冷菌计数琼脂:北京陆桥技术股份有限公司;试验用水均为超纯水。
1.2 仪器与设备
液态乳小试生产线:上海沃迪智能装备股份有限公司;MikoScan FT2 多功能乳品分析仪:丹麦福斯公司;1260 Infinity II 高效液相色谱仪:美国安捷伦科技公司;Synergy 超纯水仪:美国密理博公司;H1750R 离心机:湖南湘仪离心机仪器有限公司;XBridge Protein BEH C4 色谱柱(3.5 μm,4.6 mm×250 mm):沃特世科技(上海)有限公司。
1.3 试剂的配制
结合液:称取30.08 g 十二水合磷酸氢二钠和3.24 g二水合磷酸二氢钠,加适量超纯水溶解,用10 mol/L 氢氧化钠溶液调节pH 值至7.5 后,用超纯水定容至500 mL。
淋洗液:称取7.52 g 十二水合磷酸氢二钠、0.62 g二水合磷酸二氢钠和2.92 g 氯化钠,加适量超纯水溶解,用10 mol/L 氢氧化钠溶液调节pH 值至7.5 后,用超纯水定容至500 mL。
洗脱液:称取7.52 g 十二水合磷酸氢二钠、1.63 g二水合磷酸二氢钠和59.65 g 氯化钠,加适量超纯水溶解,用10 mol/L 氢氧化钠溶液调节pH 值至7.5 后,用超纯水定容至500 mL。
三氟乙酸溶液:取1 mL 三氟乙酸,用超纯水定容至1 L。
三氟乙酸乙腈溶液:取1 mL 三氟乙酸,用乙腈定容至1 L。
1.4 方法
1.4.1 巴氏杀菌乳的制备
样品在牧场(天津市滨海新区)的运奶车上采集。使用液态乳小试生产线对生牛乳(RM)进行巴氏杀菌,热加工的工艺条件分别为72、75、80、85 ℃加热15 s。
热加工工艺步骤:生牛乳→一段加热至60 ℃→均质[(20±1)MPa]→二段加热至所需的杀菌温度→保持管中保持15 s→冷却→洁净罐装→4 ℃冰箱冷藏。
1.4.2 巴氏杀菌乳中微生物的检测
巴氏杀菌乳中菌落总数的测定参照GB 4789.2—2022《食品微生物学检验菌落总数测定》[12];嗜冷菌的测定参照NY/T 1331—2007《乳与乳制品中嗜冷菌、需氧芽孢及嗜热需氧芽孢数的测定》[13]。
1.4.3 巴氏杀菌乳中理化指标的检测
巴氏杀菌乳中蛋白质和脂肪使用MikoScan FT2多功能乳品分析仪进行检测。
1.4.4 巴氏杀菌乳中乳铁蛋白的检测
检测方法参考陈美霞[1]的方法并稍作修改,具体如下。
1.4.4.1 LF 标准系列溶液的配制
将LF 标准品按照纯度换算后称量,用水溶解并定容至10 mL,配制成10 mg/mL 的储备液。吸取储备液200 μL,用水定容至10 mL,配制成200 mg/L 中间液。用洗脱液将中间液稀释成LF 浓度分别为5.0、10.0、20.0、50.0、100.0 mg/L 的标准工作溶液。以LF 的浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
1.4.4.2 LF 样品前处理
称取巴氏杀菌乳6 g(精确到0.01g),加入结合液定容至30 mL,混匀。溶液在4 ℃下12 000 r/min 离心15 min,避开上层脂质和下层沉淀,移取中间层试液,经玻璃纤维滤纸过滤,收集滤液待净化。亲和层析柱使用前先用10 mL 水冲洗,之后用10 mL 的淋洗液活化。处理完毕后移取10 mL 滤液过柱,之后用10 mL 淋洗液淋洗,最后用4.5 mL 洗脱液洗脱,并用洗脱液定容至5.0 mL,涡旋混匀,过0.22 μm 微孔滤膜后待测。
1.4.4.3 LF 色谱条件
色谱柱:Xbridge Protein BEH C4 柱(3.5 μm,4.6 mm×250 mm)。流动相A:三氟乙酸溶液,流动相B:三氟乙酸乙腈溶液;梯度洗脱:0~6.5 min 95% A;6.5~12.0 min 62% A;12.0~15.5 min 40% A;15.5~20 min 95% A。流速1.5 mL/min,柱温60 ℃,进样量30 μL,使用紫外检测器在波长280 nm 下进行检测。
1.4.4.4 LF 结果计算
试样中LF 含量按下式计算。
式中:X 为试样中LF 含量,mg/kg;c 为被测组分曲线计算浓度,mg/L;V3为样液最终定容体积,mL;V1为试样处理液总体积,mL;m 为试样质量,g;V2是样液过柱体积,mL。
1.4.5 巴氏杀菌乳中α-乳白蛋白和β-乳球蛋白的检测
检测方法参考陈美霞[1]的方法并稍作修改。
1.4.5.1 α-La 和β-Lg 标准系列溶液的配制
将α-La 和β-Lg 标准品按照纯度换算后称量,用水溶解并定容至10 mL,配制成10 mg/mL 的储备液。吸取储备液200 μL,用水定容至10 mL,配制成200 mg/L中间液。用水将中间液稀释成α-乳白蛋白和β-乳球蛋白浓度为0.0、5.0、10.0、20.0、50.0 mg/L 的标准工作溶液。以α-La 和β-Lg 的浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
1.4.5.2 α-La 和β-Lg 样品前处理
称取巴氏杀菌乳5 g(精确到0.01 g),加水定容至25.0 mL,混匀,加入乙酸调节pH 值为4.60,混匀静置1 h 后,12 000 r/min 离心15 min。吸取上清液1 mL,用水定容至5 mL,过0.22 μm 微孔滤膜后待测。
1.4.5.3 α-La 和β-Lg 色谱条件
色谱柱:Xbridge Protein BEH C4 柱。流动相A:三氟乙酸溶液,流动相B:三氟乙酸乙腈溶液;梯度洗脱:0~6.5 min 95% A;6.5~12.0 min 62% A;12.0~15.5 min 40%A;15.5~20 min 95% A。流速1.5 mL/min,柱温60 ℃,进样量30 μL,使用紫外检测器在波长210 nm 下进行检测。
1.4.5.4 结果计算
试样中α-La 和β-Lg 含量按下式计算。
式中:Y 为试样中α-La 或β-Lg 含量,mg/kg;c 为被测组分曲线计算浓度,mg/L;V 为样液最终定容体积,mL;m 为试样质量,g。
1.5 数据处理
以上试验分别取样重复测定3 次,采用SPSS 23.0软件进行数据处理,P<0.05 时表示差异显著,数据以平均值±标准差表示,使用Origin 8.0 软件进行作图。
2 结果与分析
2.1 热加工工艺对巴氏杀菌乳微生物的影响
嗜冷菌是一类能够在7 ℃或更低温度下生长的一类细菌的总称。嗜冷菌并不是天然存在于牛乳中的一类微生物,刚取出的乳汁通常不含有可培养的嗜冷菌,因此嗜冷菌污染是挤奶后环境污染所造成的。在原料乳收集和运输的过程中,嗜温菌占据主导地位,但生产前长时间低温冷藏会使得生牛乳中嗜冷菌逐渐成为优势菌群[14]。取生牛乳分别在72、75、80、85 ℃下巴氏杀菌15 s,测定其菌落总数和嗜冷菌,结果如表1 所示。

表1 不同热加工工艺对巴氏杀菌乳中微生物的影响Table 1 Effect of different thermal processes on microorganisms in pasteurized milk
由表1 可知,杀菌前牛乳的菌落总数为25 000 CFU/mL,72 ℃杀菌后牛乳中的菌落总数降至9 200 CFU/mL,当牛乳的杀菌温度在80 ℃以上,牛乳中的菌落总数小于10 CFU/mL。随着杀菌温度的提高,巴氏杀菌乳中菌落总数随之下降。巴氏杀菌前牛乳中的嗜冷菌数为2000CFU/mL,经巴氏杀菌之后嗜冷菌数均小于10 CFU/mL。根据GB 19645—2010《食品安全国家标准巴氏杀菌乳》的规定,巴氏杀菌乳检出菌落总数应小于5×104CFU/mL,而国家标准中并未对牛乳中嗜冷菌进行相关规定[15]。因此正常的巴氏杀菌可以杀灭大多数的细菌,提高杀菌温度可有效损伤细菌。杀菌是牛乳加工过程中最重要的步骤,巴氏杀菌是相对温和的热处理方式,巴氏杀菌可以杀死嗜冷菌,但嗜冷菌所产生的蛋白水解酶和脂肪水解酶具有很强的热稳定性,巴氏杀菌后这些热稳定酶和嗜冷菌的孢子仍然存活。而巴氏杀菌乳的腐败是由于热加工前生牛乳中嗜冷菌大量繁殖或是热加工后耐热酶和孢子存活[16]。因此只有高品质的生牛乳才能生产出营养丰富、货架期长的优质巴氏杀菌乳,生牛乳的品质是决定巴氏杀菌乳质量的重要因素。
2.2 热加工工艺对巴氏杀菌乳理化指标的影响
过度的热加工会使蛋白质变性、降解以及氧化和脂质氧化等,这些反应在贮藏期也会持续进行,严重影响牛乳的品质。研究发现高温会使牛乳脂肪的氧化速度加快,导致脂肪球融化上浮,出现“分层”现象,影响牛乳品质[17]。而温和的巴氏杀菌并不会对牛乳造成明显的不稳定性。热处理后巴氏杀菌乳中蛋白质和脂肪的变化如图1 所示。

图1 热加工工艺对巴氏杀菌乳中蛋白质和脂肪含量的影响Fig.1 Effect of thermal processes on protein and fat in pasteurized milk
由图1 可知,生牛乳的蛋白质含量为3.3%,而巴氏杀菌后蛋白质含量降至3.14%~3.15%。结果显示,巴氏杀菌后牛乳中的蛋白质含量会显著下降(P<0.05)。生牛乳中脂肪含量为3.93%,巴氏杀菌后脂肪含量显著降至3.82%~3.89%(P<0.05)。杀菌后会使牛乳中脂肪含量下降,但与蛋白质一样,并未随着杀菌温度的升高而呈现规律性的变化。GB 19645—2010《食品安全国家标准巴氏杀菌乳》规定牛乳中蛋白质含量应≥2.9 g/100 g,脂肪含量应≥3.1 g/100 g,本试验的巴氏杀菌乳均符合国家标准要求[15]。牛乳热处理后分子内的二硫键会重组形成分子间的二硫键,乳清蛋白变形聚集,酪蛋白、乳清蛋白和乳脂肪球膜表面蛋白会结合,乳清蛋白、乳糖和膜蛋白会发生美拉德反应,而多不饱和脂肪酸会在乳清蛋白的催化下形成共轭异构体[10]。巴氏杀菌后部分含巯基蛋白质发生聚集,还有一部分其他蛋白质发生水解,形成小分子肽和游离氨基酸,从而表现为蛋白质含量下降[18]。
2.3 热加工工艺对巴氏杀菌乳乳铁蛋白的影响
将配制好的不同浓度的LF 标准品溶液进行液相分析,线性回归方程为y=1.153 23x-3.864 65,R2=0.999 3,结果表明LF 的峰面积(mAU)及其浓度(mg/mL)呈现良好的线性关系。
LF 是乳中非常重要的功能性蛋白,对热非常敏感。生牛乳中LF 的含量受动物的种类和健康状况、泌乳季节、胎次等多种因素的影响,鲜牛乳中LF 的含量一般为0.02~0.20 mg/mL[1]。不同热处理对巴氏杀菌乳LF含量的影响如图2 所示。

图2 热加工工艺对巴氏杀菌乳LF 含量的影响Fig.2 Effect of thermal processes on lactoferrin in pasteurized milk
由图2 可知,巴氏杀菌后牛乳中的LF 含量显著下降(P<0.05),并且随着杀菌强度的增强,LF 含量逐渐降低。生牛乳中的LF 含量为(107.40±4.22)mg/kg,经过85 ℃/15s杀菌后牛乳中的LF 含量为(23.37±2.45)mg/kg。研究发现,当杀菌温度为90 ℃以上杀菌15 s 后,牛乳中的LF 含量均小于5 mg/L[1]。在极端温度下,LF 会变性,蛋白质的构象改变,影响其功能特性,如铁结合能力和抗菌活性。LF 最重要的功能特性是抑菌以及对细菌感染有防护作用,过度的热加工会使得LF 结构改变、变性和降解等。研究发现,72 ℃/15 min 对LF 的结构没有影响,也不影响LF 与细菌之间的相互作用;而在超高温瞬时灭菌乳中LF 与细菌之间的相互作用显著下降[17]。LF 分子被折叠成2 个同源的N 末端和C 末端裂片,每个裂片都能结合一个铁原子。根据结合在LF 分子上铁原子的数量,LF 有几种形式:第一种是铁饱和型(holo-LF),N 末端和C 末端裂片都被铁饱和;第二种是缺铁型(apo-LF),不含铁的形式;第三种是中间形式,两个叶片中的任一叶片含铁。holo-LF 结构更紧密,更加耐热且抗蛋白质水解[1,19]。Sánchez 等[20]在不同的温度下(72~85 ℃)将牛LF 在毛细管中加热,通过差示扫描量热仪(differential scanning calorimetry,DSC)来评估LF 的耐热性。研究发现,holo-LF 的吸热峰为双峰,最大的吸热温度为74 ℃和86 ℃;而apo-LF的吸热峰为单峰,最大吸热温度为61 ℃。在另一项研究中发现,牛LF 有两个最大的变性温度,分别为60.4 ℃和89.1 ℃,且LF 的变性不可逆,这是因为LF 在加热过程中会与其他蛋白质形成纳米粒[21]。holo-LF 和apo-LF 两种形式的LF 在超高温处理后都会完全变性[22]。
2.4 热加工工艺对巴氏杀菌乳α-La 的影响
α-La 标准品的线性回归方程为y=23.74x-6.857 4,R2=0.999 5,线性关系良好。不同热加工工艺对巴氏杀菌乳中α-La 的影响如图3 所示。
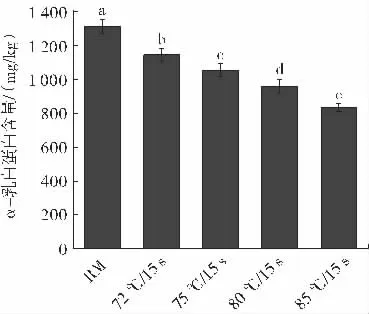
图3 热加工工艺对巴氏杀菌乳中α-La 含量的影响Fig.3 Effect of thermal processes on α-lactalbumin in pasteurized milk
由图3 可知,生牛乳中α-La 含量为(1 308.30±41.26)mg/kg,经过巴氏杀菌后牛乳中依然含有大量的α-La,但与生牛乳相比已显著下降(P<0.05),72 ℃/15 s 杀菌后的巴氏杀菌乳中α-La 含量为(1 142.98±39.89)mg/kg。α-La 在牛乳中的含量为1~1.5 g/L(约占牛乳总蛋白的3.4%),是一种热敏性物质,随着热处理强度的增加,α-La 的含量会逐渐降低[23]。α-La 热变性会使其三级结构遭到破坏,分子内部的二硫键会暴露出来,形成改性单体蛋白[24]。α-La 的变性程度与温度有很大的关系,Jeanson 等[25]研究发现,在65 ℃下处理60 min 后α-La 基本未变性;当加热温度升至75~85 ℃时,α-La的变性速率随着热处理时间的延长而加快;当温度升至90 ℃时热处理30 min 即可使天然的α-La 完全变性。Korhonen 等[26]研究发现,α-La 的解链温度为67 ℃,即在此温度下蛋白部分变性,在72 ℃/15 s 的杀菌工艺下α-La 的活性可以保留69%。但随着杀菌强度的增大,α-La 逐渐被降解,在105 ℃/15 s 的杀菌条件下α-La 的活性仅剩不到10%,与本试验结果一致。因此在巴氏杀菌的工艺下,α-La 的变性率低,能够在牛乳中大量保留。
2.5 热加工工艺对巴氏杀菌乳β-Lg 的影响
β-Lg 标准品的线性回归方程为y =24.611x-26.722,R2=0.998 2,线性关系良好。不同热加工对巴氏杀菌乳中β-Lg 含量的影响如图4 所示。

图4 热加工工艺对巴氏杀菌乳中β-Lg 含量的影响Fig.4 Effect of thermal processes on β-lactoglobulin in pasteurized milk
由图4 可知,β-Lg 的变化规律与α-La 相似,都是随着热加工强度的增加而显著减少(P<0.05)。生牛乳中β-Lg 的含量为(3 315.67±35.33)mg/kg,β-Lg 在80 ℃巴氏杀菌后含量急剧下降,含量仅为(2 052.51±57.65)mg/kg。β-Lg 的解链温度为77 ℃,75 ℃/15 s 可保留其76%的活性,85 ℃/15 s 保留其46%的活性。但通过非变性聚丙烯酰胺凝胶电泳发现经过95 ℃/15 s β-LgB的电泳条带完全消失,β-LgA 电泳条在125 ℃/15 s 杀菌后消失[1,26]。Corredig 等[27]研究发现β-Lg 在蛋白聚集反应中起到了关键性的作用,α-La 只有在β-Lg 存在时才会形成聚集体。α-La 与β-Lg 的聚集反应与热加工的温度和时间有关,有研究发现,随着热处理时间和温度的增加,牦牛乳清中α-La 与β-Lg 的含量显著下降,当热加工温度在80 ℃以上时,达到了β-Lg 的变性温度,会发生蛋白聚集现象,这表明只有热处理的温度大于β-Lg 的变性温度时才会出现蛋白聚合物[28]。因此在80 ℃/15 s 和85 ℃/15 s 的杀菌条件下,蛋白含量显著下降,可能是由于α-La 和β-Lg 变性聚集。
3 结论
巴氏杀菌可杀灭牛乳中的致病微生物并减少热加工对牛乳品质的影响,本试验选择目前市面上常用的巴氏杀菌工艺,使用高效液相色谱法检测牛乳中的α-乳白蛋白、β-乳球蛋白和乳铁蛋白,探究不同的巴氏杀菌工艺对牛乳中微生物和乳清蛋白的影响。随着热加工强度的增加,牛乳中菌落总数和嗜冷菌的数量随之降低,蛋白质和脂肪的含量也显著降低(P<0.05)。72 ℃/15 s 和75 ℃/15 s 的杀菌条件对牛乳中的3 种活性蛋白影响较小;当杀菌温度达到80 ℃以上,3 种活性蛋白的含量会显著下降(P<0.05)。由此可见,不同的热处理方式对巴氏杀菌乳中乳清蛋白有不同的影响。因此,在满足产品安全性的前提下,应尽可能降低杀菌处理的强度。本试验为企业生产出更高质量的巴氏杀菌乳提供一定的理论依据和技术支持。
