酸法脱酰胺改善大米蛋白的溶解性及其功能性质分析
2024-01-03蔡玉红刘欢谢明勇
蔡玉红,刘欢,谢明勇
(南昌大学 食品学院,江西 南昌 330047)
大米蛋白(rice protein,RP)是大米中蛋白质的总称,根据Osborne 提出的基于溶解度的分类方法,大米蛋白组分主要有4 种蛋白:清蛋白(水溶性),占比2%~5%;球蛋白(盐溶性),占比2%~10%;醇溶蛋白(醇溶性),占比1%~5%;谷蛋白(稀酸、稀碱溶性),占比66%~80%[1-2]。低过敏、易消化、氨基酸配比合理是大米蛋白的主要优点,同时也是公认的优质膳食蛋白,其组分主要为谷蛋白,由于谷蛋白亚基通过二硫键聚合形成大分子复合物,从而导致大米蛋白溶解性比较差[3]。此外,大米蛋白往往从大米淀粉、淀粉糖浆的加工副产物中提取而来,这些副产物的加工经历高温液化和糖化作用,容易导致大米蛋白发生变性,部分易溶性清蛋白、球蛋白流失,蛋白质结构也变得更加致密,从而进一步降低了大米蛋白的溶解性[4]。较低的溶解性在很大程度上影响了大米蛋白的功能特性和应用范围,因此亟需对大米蛋白进行改性,以提高其溶解性,改善功能特性,扩大应用范围。
大米蛋白的改性方法主要包括物理、化学和生物酶法,其中酸法脱酰胺(化学法)是一种常用且高效的处理方式[1],并已在其他多种难溶性蛋白(如米糠蛋白)中广泛应用,但是应用在大米蛋白改性的研究较少。酸法脱酰胺反应原理是由酸提供H+将-NH2键打断,脱去NH2,该反应可快速改变蛋白质分子的电子分布状态,伸展大米蛋白分子空间结构,提高蛋白质溶解性,从而进一步使蛋白获得良好的功能特性[5-6]。
本文采用酸法脱酰胺改性,提高大米蛋白溶解性,通过对比大米蛋白(RP)、仅高温处理蛋白(Control)、脱酰胺改性蛋白(Deamidation)在不同pH 值(3、7、9)环境中的溶解性、功能特性以及亚基分子量、二级结构、表面微观形态的变化,分析酸法脱酰胺对大米蛋白的溶解性的改善效果以及对功能特性、一二级结构、表面微观形态的影响,以期提高大米蛋白的应用价值。
1 材料与方法
1.1 材料与试剂
大米蛋白:江西恒顶食品有限公司;大豆油:市售;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)、四甲基乙二胺(4N'-tetramethylethylenediamine,TEMED):阿拉丁试剂(上海)有限公司;可溶性糖检测试剂盒、淀粉检测试剂盒、蛋白Marker、甘氨酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三(羟甲基)氨基甲烷[(tris(hydroxymethyl)aminomethane,Tris)]:北京索莱宝科技有限公司;二喹林甲酸(bicinchonininc acid,BCA)法蛋白浓度测定试剂盒、1×上样缓冲液:上海碧云天生物技术有限公司;浓硫酸、氢氧化钠、磷酸盐(均为分析纯):西陇科学股份有限公司。
1.2 仪器与设备
HH-6B 数显恒温水浴锅:常州国华电器有限公司;TDL-5-A 离心机:上海安亭科学仪器厂;Varioshan Flash 多功能酶标仪:美国热电公司;Milli-Q 超纯水仪:美国Millipore 公司;AL104 电子天平、FE28-Standard pH 计:梅特勒-托利多仪器(上海)有限公司;IKA-RCT 基本型磁力加热搅拌器、T18 高速分散均质机、WORIEXZ 涡旋仪:德国IKA 公司;JSM 6701F 场发射扫描电镜带能谱仪:日本电子株式会社;Chemi XRS凝胶成像系统:美国BIO-RAO 公司;傅立叶红外光谱仪:日本SHIMADZU 岛津公司。
1.3 试验方法
1.3.1 大米蛋白的主要成分测定
蛋白质含量参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》方法测定,脂肪含量参照GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》方法测定,水分含量参照GB 5009.3—2016《食品安全国家标准食品中水分的测定》方法测定,灰分含量参照GB 5009.4—2016《食品安全国家标准食品中灰分的测定》方法测定,可溶性糖含量测定按照可溶性糖检测试剂盒说明书操作,淀粉含量测定按照淀粉检测试剂盒说明书操作。
1.3.2 酸法脱酰胺处理
参考Meenmanee 等[7]的方法并稍作改动,称取一定量大米蛋白样品,按料液比1:25(g/mL)加入0.4 mol/L HCl 溶液,95 ℃水浴加热搅拌4 h,立即冰浴10 min 以停止反应,将处理后蛋白溶液pH 值调为7.0,去离子水透析24 h 除盐,冷冻干燥待用。对照组加入相同料液比的超纯水,其他处理条件保持一致。
1.3.3 溶解性测定
参考Meenmanss 等[7]的方法并稍作改动,准确称取20 mg 蛋白样品,加入5 mL 0.01 mol/L 磷酸缓冲液,用HCl/NaOH 溶液调节pH 值为1~13,室温搅拌60 min,4 800 r/min 离心15 min,取上清液,蛋白质的溶解性(S,%)按公式(1)计算。
式中:c 为溶液中的蛋白浓度,mg/mL;c1为上清液中的蛋白浓度,mg/mL。
1.3.4 持水性、持油性测定
准确称取0.1 g 样品于10 mL 离心管中,加入5 mL的超纯水/植物油,室温搅拌30 min 充分混合均匀,静置30 min 后,离心(3 000 r/min,30 min),除去上层水/油,称取离心管和剩余物的质量。蛋白样品的持水性/持油性按公式(2)、(3)计算。
式中:W 为持水性,g/g;O 为持油性,g/g;m0为蛋白质的质量,g;m1为离心管的质量,g;m2为离心后离心管和剩余物的质量,g。
1.3.5 起泡性及起泡稳定性测定
参考He等[8]的方法并稍作改动,取一定量蛋白样品,溶于0.01 mol/L 磷酸盐缓冲液中,HCl/NaOH 调节溶液pH 值为3、7、9,制备成1%蛋白溶液,取20 mL溶液于50 mL 的离心管中,分散均质机分散2 min(10 000 r/min),立即读取泡沫和液体的总体积,静置30 min 后,再次记录泡沫的体积。蛋白质的起泡性质由起泡性(F1,%)和起泡稳定性(F2,%)表示,按公式(4)、(5)计算。
式中:V0为溶解样品水溶液的体积,mL;V1为分散停止时泡沫和液体的总体积,mL;V2为静置30 min后泡沫和液体的总体积,mL。
1.3.6 乳化性及乳化稳定性测定
参考Liu 等[9]的方法并稍作改动,取一定量蛋白样品,溶于0.01 mol/L 磷酸盐缓冲液中,HCl/NaOH 调节溶液pH 值为3、7、9,制备成1%蛋白溶液,加入5 mL 植物油,分散均质机分散1 min(10 000 r/min),从底部取50 μL 乳状液,用0.1% SDS 溶液稀释100 倍,涡旋3 s,在500 nm 波长下比色,记录吸光度(A0);10 min 后再从底部取50 μL 乳状液,同样稀释,比色,记录吸光度(A1)。蛋白质乳化活性指数[E1,(m2/g)]和乳化稳定性指数(E2,min)按公式(6)、(7)计算。
式中:D 为稀释倍数,100;c 为稀释前蛋白质浓度,g/mL;Ø 为油相体积分数,0.25;θ 为光程,1 cm。
1.3.7 表面疏水性测定
参考Liao 等[10]的方法并稍作改动,取蛋白样品溶于0.01 mol/L 磷酸盐缓冲液中,HCl/NaOH 调节溶液pH 值为3、7、9,测定溶液实际蛋白浓度,稀释浓度为0.01~0.08 mg/mL,取4 mL 各浓度溶液,加入20 μL 8 mmol/L ANS(同一溶剂配制),涡旋5 s,静置5~10 min,激发波长λex=390 nm、发射波长λex=490 nm、狭缝校正5 nm 条件下测定荧光强度,以荧光强度-样品浓度作曲线,曲线初始段斜率即为样品的表面疏水性指数(Ho)。
1.3.8 亚基分子量测定
参考Liao 等[10]的方法并稍作改动,使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)法,具体参数:5%浓缩胶、12%分离胶,样品与上样缓冲液适当比例混合,离心除去未溶解蛋白(10 000 r/min,5 min),金属浴5 min,上样量5 μL,电压、时间条件为80 V 30 min,120 V 120 min,当溴酚蓝指示剂迁移到靠近凝胶板底部时,即可停止电泳。对凝胶进行染色,脱色,脱至条带清晰,凝胶成像系统拍照分析。
1.3.9 傅里叶红外光谱
参考Fang 等[11]的方法并稍作改动,蛋白样品与溴化钾按照质量比1∶1 混合均匀,灯照条件下研磨压片,使用傅里叶红外光谱仪在4 000~400 cm-1扫描32 次,用溴化钾为空白背景,经过基线校正,曲线平滑,得到样品红外光谱。用Ominc 8.0 和Peakfit 4.0 软件分析酰胺Ⅰ区(1 700~1 600 cm-1)的变化。
1.3.10 扫描电镜
参考He 等[8]的方法并稍作改动,取微量样品固定在样品台上(样品需尽可能铺匀),进行喷金后放入扫描电镜仪器中,调节相关参数进行拍照观察。
1.4 统计数据分析
利用Excel 2010 和IBM SPSS Statistics 25 进行数据处理和分析,方差分析采用邓肯多重比较(p<0.05),使用GraphPad Prism 8.0 画图软件绘制统计图表。测定重复3 次,结果以平均值±标准差表示。
2 结果与讨论
2.1 大米蛋白主要成分分析
大米蛋白中的蛋白质含量反映了样品的纯度,也决定了其应用价值。大米蛋白主要成分见表1。
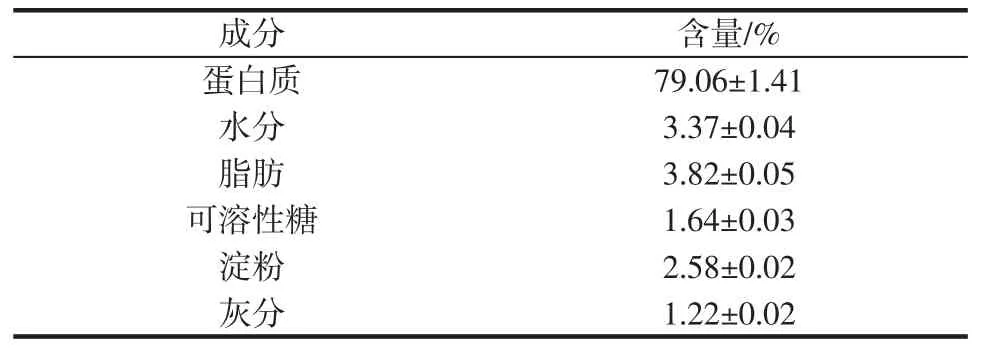
表1 大米蛋白主要成分Table 1 The main components of rice protein
从表1 可以看出,样品中蛋白质含量接近80%,纯度较高,水分含量3.37%、脂肪含量3.82%、灰分含量1.22%。此外,还有少量可溶性糖和淀粉,这是由于在大米蛋白生产过程中历经高温液化工序而使得蛋白质和多糖类物质紧密结合,难以分离。Zhao 等[12]对大米蛋白进行了提取与成分分析,结果发现其中蛋白含量62.62%、水分含量6.05%、脂肪含量10.47%、灰分含量7.71%、碳水化合物含量9.37%,相较之下本文所用蛋白纯度较高、杂质较少。
2.2 大米蛋白溶解性分析
蛋白的溶解性是决定其应用的关键因素之一,同时也在很大程度上决定了蛋白起泡性、乳化性等功能性质。大米蛋白多为碱溶性谷蛋白,在不同pH 值环境中的溶解性差异较大,弱酸弱碱环境有利于其溶解。本文对比研究了改性前后样品在不同pH 值(1~13)环境中的溶解性,结果见图1。

图1 大米蛋白样品在不同pH 值环境中的溶解性变化Fig.1 Changes in solubility of rice protein samples in different pH environments
图1 可以看出,酸法脱酰胺改性后的样品显著提高了大米蛋白的溶解性,中性环境(pH7)中由原来的0.58%提高至56.60%,碱性环境(pH 值为12、13)溶解性达到90.00%以上。彭清辉[6]使用同样的方法对大米蛋白进行改性,结果表明随着脱酰胺程度的增加,大米蛋白溶解性显著提高(溶解度>96.00%);范莹[13]对小米醇溶蛋白进行脱酰胺改性,在pH7.5 时溶解性显著提高,由0.085%提高至10.57%;Meenmanee 等[7]使用酸法脱酰胺处理椰子蛋白,不同pH 值(3、5、7)条件下蛋白溶解性均高于未改性样品,在pH7 时溶解性最好,由10%提高至50%,且溶解性随着处理温度的升高而提高(65 ℃:35%,70 ℃:45%,75 ℃:50%)。大米蛋白改性后溶解性提高的原因可能是脱酰胺反应过程中,酸提供的H+将蛋白侧链的-NH2键打断,以脱去NH2,酰胺基团转变为羧基,该过程改变了蛋白的电子分布状态,主要为净电荷增多、静电斥力增大、蛋白趋于无序结构,聚集的蛋白分子空间结构得到伸展,蛋白分子量减小,从而显著提高了大米蛋白的溶解性[5]。与未处理的样品相比,高温处理的对照组溶解性也稍有提高,这主要是因为在高温条件下,大米蛋白发生部分变性,产生了部分水解效应。
2.3 大米蛋白起泡性及起泡稳定性分析
蛋白质在发泡过程中所形成的界面面积可以用来衡量起泡性的强弱,同时保持气泡不破裂的能力即为起泡稳定性,两种性质与蛋白质的溶解性、pH 值环境等密切相关。经过高温条件下的脱酰胺处理,大米蛋白空间结构的展开和疏水基团的暴露会影响泡沫的形成,蛋白分子量的减小和蛋白分子上净电荷的增加可以增强蛋白质与水的相互作用。不同pH 值条件下改性前后蛋白的起泡性及起泡稳定性的变化见图2。
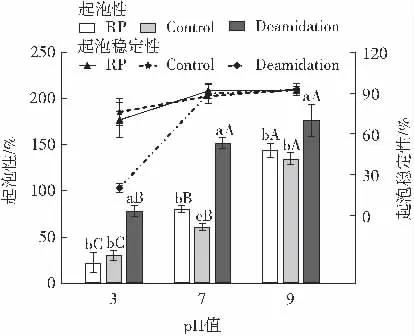
图2 不同pH 值条件下改性前后蛋白的起泡性及起泡稳定性变化Fig.2 Changes in foaming and foaming stability of rice protein samples at different pH
如图2 所示,随着pH 值的增加,起泡性明显提高,pH 值为3、7 时,蛋白起泡性改善效果较好,大米蛋白和脱酰胺改性蛋白起泡性分别由原来的22.50%、80.40%提高至78.50%、151.70%。随着pH 值的增加,起泡稳定性先增加后趋于稳定,pH3 时,改性后蛋白起泡稳定性由原始的70.19%下降至20.34%,可能原因为该pH 值环境非常接近改性蛋白的等电点,蛋白分子间净电荷减少,蛋白质与水的相互作用减弱,导致泡沫稳定性下降。pH 值为7、9 时,改性前后蛋白起泡稳定性无明显差异,可能原因为暴露的疏水性基团相互作用,导致表面疏水性降低,泡沫稳定性变差。郑建冰等[14]的研究结果表明,酸法脱酰胺改性后大米蛋白起泡性显著提高,由13.00%提升至26.00%;Meenmanee 等[7]采用酸法脱酰胺改性后的椰子蛋白起泡性显著提高,由3.68%提高为7.32%(75 ℃),起泡稳定性稍有降低。Suppavorasatit 等[15]使用脱酰胺改性大豆蛋白,发现随着处理时间的延长,起泡性显著增加,由最初的26.00%增加至53.30%,起泡稳定性由11.90%提高至26.10%。
2.4 大米蛋白乳化性及乳化稳定性分析
蛋白质在水/油界面通过阻止结合而快速吸收极性和非极性成分的能力为其乳化性,乳化液在一段时间内保持乳化的能力为乳化稳定性。蛋白质的乳化性和乳化稳定性取决于亲水性和亲脂性的平衡。不同pH 值条件下改性前后蛋白的乳化性及乳化稳定性的变化见图3。
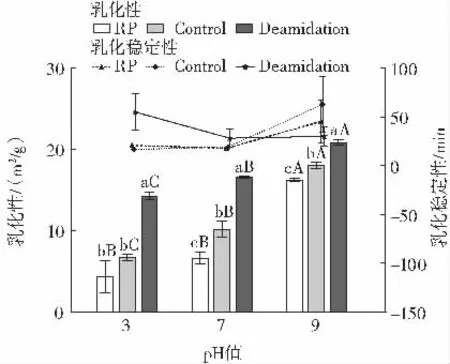
图3 不同pH 值条件下改性前后蛋白的乳化性及乳化稳定性变化Fig.3 Changes in emulsification and emulsification stability of rice protein samples at different pH
如图3 所示,在大米蛋白乳化性方面,随着pH 值的增加,乳化性明显提高,pH 值为3、7 时,蛋白乳化性改善效果较好,分别由原来的4.4、6.6 m2/g 提高至14.3、16.5 m2/g。在大米蛋白乳化性稳定性方面,随着pH 值的增加,与大米蛋白及仅高温处理大米蛋白相比,改性后蛋白乳化稳定性先提高后缓慢降低,pH 值为3、7时,蛋白的乳化稳定性分别由原来的20.8、18.0 min 提高至54.9、28.14 min;pH9 时脱酰胺蛋白乳化稳定性由原来的45.38 min 下降为30.14 min。乳化稳定性降低,分析原因可能为表面疏水性的降低以及净电荷的过度增加会减弱蛋白质分子间相互作用,并且会对油-液界面弹性膜的形成产生阻碍作用,同时过度的水解以及蛋白球状结构的减少,也会导致油滴周围形成的蛋白质层较薄,从而导致乳液不稳定[16-18]。Meenmanee等[7]的研究结果表明,脱酰胺处理后的椰子蛋白乳化性显著提高,由49.94 m2/g 提高到67.43 m2/g,乳化稳定性降低,由65.28 min 降低至24.49 min。郑建冰等[14]对大米蛋白进行脱酰胺改性,随着改性时间的延长,乳化性先增加后降低,乳化稳定性改善效果不明显。综合以上分析,可以发现脱酰胺改性有利于提高蛋白乳化性,对乳化稳定性的改善效果不明显。
2.5 大米蛋白表面疏水性分析
表面疏水性是蛋白质在特定的空间构象下表现出的性质,影响其大小的主要因素有暴露在表面的氨基酸残基类型、数量以及蛋白的空间构象。表面疏水性的变化反映了蛋白质表面的疏水性基团含量,与蛋白质的功能特性密切相关,尤其是蛋白质的界面特性,即起泡、乳化等性质。不同pH 值条件下改性前后大米蛋白的表面疏水性变化见图4。

图4 不同pH 值条件下改性前后大米蛋白的表面疏水性变化Fig.4 Changes in surface hydrophobicity of rice protein samples at different pH
如图4 所示,未进行脱酰胺改性的蛋白在中性(RP=112.1,Control=100.8)、偏碱性环境(RP=97.0,Control=93.7)中的表面疏水性指数高于酸性环境(RP=11.7,Control=31.7),主要原因为随着pH 值的增加,蛋白逐渐溶解,更多的疏水性基团暴露,导致表面疏水性增加。pH3 时,改性蛋白表面疏水性增加至64.5,pH值为7、9 时表面疏水性有所降低,分别为84.5、53.4。改性大米蛋白表面疏水性先增加后降低,分析原因为随着pH 值增加,改性蛋白溶解性增大,暴露了更多的疏水基团,然而随着溶解性的进一步增大,大量亲水性基团会在一定程度上影响荧光探针与疏水性基团的结合,导致表面疏水性的降低[9]。其次,疏水基团间的相互作用也会导致表面疏水性降低。该结果与范莹[13]研究结果一致,即小米醇溶蛋白脱酰胺改性后表面疏水性下降,这主要是因为脱酰胺过程暴露的疏水基团重新聚集,导致水解后亲水性肽增多,从而使得疏水性下降。
2.6 大米蛋白持水性、持油性分析
持水性、持油性是蛋白质与水、油的结合能力。改性前后大米蛋白的持水性、持油性变化见图5。

图5 改性前后大米蛋白的持水性、持油性变化Fig.5 Water and oil holding of rice protein samples before and after modification
从图5 中可以得出,改性前后蛋白持水性、持油性分别为1.93、1.03 g/g 和1.77、1.17 g/g,持水性略有降低,可能原因为溶解性较高的蛋白质会表现出较差的吸水性。改性后,大米蛋白的持油性略有提高,但总体改善效果不明显,这与彭清辉[6]、聂小华等[19]的研究结果一致。此外对比仅高温处理的大米蛋白,其持水性、持油性分别提高至2.24、1.57 g/g,主要原因为在高温处理条件下,部分大米蛋白发生水解,蛋白结构部分展开,从而提高了蛋白质与水、油的结合能力。
2.7 大米蛋白亚基分子量分析
大米蛋白的主要亚基分布在30~37kDa 和10~30kDa之间,50 kDa 分布的亚基含量较少。改性前后大米蛋白亚基分子量变化见图6。

图6 大米蛋白样品的凝胶电泳Fig.6 Gel electrophoresis of rice protein samples
从图6 中可以得出,未处理蛋白(R)主要分子量分布在35 kDa 和20 kDa,少部分亚基分布在66、52、16、10 kDa。改性蛋白(D)条带明显下移,主要分布在6.5~20 kDa 之间,表明大米蛋白分子量大幅度降低,原因为脱酰胺改性过程中,蛋白质发生酸水解,蛋白间肽键断裂,从而使蛋白质分子量变小。该结果与Meenmanee 等[7]的研究一致,即椰子蛋白经脱酰胺处理后,蛋白分子量也降低,但是本研究中的大米蛋白分子量降低幅度更大,可能是由蛋白种类和脱酰胺处理程度不同而引起。与未处理蛋白相比,对照组(C)亚基分子量分布无明显变化,说明高温条件下蛋白的部分水解还不足以改变蛋白的一级结构。
2.8 傅里叶红外光谱分析
傅里叶变换红外光谱是表征蛋白二级结构变化的常用方法,对未处理蛋白(RP)、仅高温处理蛋白(Control)、脱酰胺处理(Deamidation)进行全波段扫描,结果见图7。

图7 大米蛋白样品的FTIR 图谱和酰胺Ⅰ带拟合峰图Fig.7 FTIR spectra of protein samples and fitted peaks in the amide Ⅰbands
如图7 所示,大米蛋白的红外光谱特征吸收峰主要有3 个酰胺带:1 700~1 600 cm-1酰胺Ⅰ带、1 550~1 530 cm-1酰胺Ⅱ带、1 300~1 260 cm-1酰胺Ⅲ带。其中酰胺Ⅰ带可以反映蛋白二级结构的变化。4 种二级结构对应峰所在位置:β-折叠(1 640~1 610 cm-1)、无规则卷曲(1 650~1 640 cm-1)、α-螺旋(1 660~1 650 cm-1)、β-转角(1 700~1 660 cm-1)[20]。使用Peakfit 4.0 软件对红外光谱图去卷积、二阶导数拟合,得到拟合峰图,计算4 种结构对应的峰面积可以得出各结构含量[21],结果如表2 所示。

表2 大米蛋白样品的二级结构组成Table 2 Secondary structure composition of rice protein
从表2 数据得出,未处理蛋白(RP)二级结构含量中β-转角>β-折叠>α-螺旋,不存在无规则卷曲结构;对照组蛋白(Control) 二级结构含量中β-折叠>β-转角>α-螺旋,也不存在无规则卷曲结构;脱酰胺蛋白(Deamidation) 二级结构含量中β-转角> β-折叠>α-螺旋>无规则卷曲。对于仅高温处理的蛋白,二级结构变化不明显,极少部分的α-螺旋、β-转角转化为β-折叠,较致密的α-螺旋结构转化为有序、较为舒展的β-折叠,这说明经高温处理后,蛋白发生一定程度的变性,蛋白结构展开。脱酰胺处理后,蛋白二级结构发生了较大变化,接近1/2 的有序结构β-折叠转化成了无序结构无规则卷曲,α-螺旋、β-转角两种结构则变化不明显,该结果表面脱酰胺反应可以使得蛋白结构大部分展开,由较为致密的有序结构转变成无序结构,Liu 等[22]研究表明β-折叠的紧密程度和稳定性比α-螺旋差,比较容易发生改变,该结构的转变有利于改善蛋白的功能特性;经脱酰胺改性后,大米谷蛋白无序结构无规则卷曲增加,由原始的6.76%增加至15.53%,主要由致密的α-螺旋转化而来。Hadidi 等[20]使用脱酰胺改性处理月见草蛋白,接近1/2 的α-螺旋转化为有序舒展的β-折叠。总体上看,大米蛋白经脱酰胺处理后,有利于形成更多的有序舒展和无序结构,以提高蛋白的溶解性,从而进一步改善蛋白的功能性。
2.9 扫描电镜分析
改性前后大米蛋白的在不同放大倍数下表面微观结构变化见图8。

图8 大米蛋白样品在不同放大倍数下的扫描电镜图Fig.8 Scanning electron microscopy images of rice protein samples at different magnifications
从图8 可以看出,未处理蛋白和对照组在200、800 倍镜下形态多为聚集、致密的不规则球状结构,放大至10 000 倍镜时,可以发现其表面形态较为粗糙,存在多层状和少量孔隙。经酸法脱酰胺改性处理后,在200、800 倍镜下大米蛋白表面变得松散,聚集的球状结构转化为舒展的片状,形成更多的小颗粒,10 000倍镜下大米蛋白表面变得光滑,多层结构消失,孔隙减少。该结果与He 等[8]的结果一致,经酸法脱酰胺改性后,小麦蛋白表面形态在300 倍镜下由粗糙的大颗粒球状结构变成细小颗粒的光滑球状结构,范莹[13]对脱酰胺改性后的小米醇溶蛋白表面形态进行研究,也发现其由致密变成疏松、多孔结构。
3 结论
酸法脱酰胺处理改善大米蛋白溶解性效果显著,中性环境(pH7)中由原来的0.58%提高至56.60%,碱性环境(pH 值为12、13)溶解性达到90.00%以上,pH值为3、7 时起泡性、乳化性改善效果较好。亚基分子量测定结果说明,改性后大米蛋白亚基分子量大幅度降低,主要分布在6.5~20 kDa 之间。红外光谱研究发现,改性后蛋白结构大部分展开,有序的β-折叠结构转变成无序的无规则卷曲结构。通过扫描电镜研究发现,改性后大米蛋白颗粒由聚集变得松散,致密的球状结构变为不规则块状结构,表面由粗糙变得光滑。因此,本文研究结果表明酸法脱酰胺改性可有效提高大米蛋白的溶解性,从而提高难溶性大米蛋白的应用范围,除此之外,该方法操作简单、便于工业化。
