鱼油对副溶血弧菌感染小鼠肠炎损伤和肠组织基因表达谱的影响
2024-01-03王润东邓义佳张宇昊李学鹏励建荣
王润东,周 奎,邓义佳,张宇昊,李学鹏,励建荣,
(1.西南大学食品科学学院,重庆 400715;2.渤海大学食品科学与工程学院,辽宁 锦州 121013)
副溶血弧菌(Vibrio parahaemolyticus,Vp)是一种广泛存在于水产品中的致病菌,人们常因误食被其污染的、生的或未烧熟煮透的海鲜导致食物中毒[1]。据估算,近5 年我国Vp食物中毒人数多达15.9万,远超沙门氏菌和大肠杆菌,Vp已成为威胁公共健康的首要病原菌[2]。肠道炎性损伤是Vp食物中毒的典型特征,该菌经食物链传播进入消化道,依靠菌体侵袭力和黏附性破坏宿主肠道上皮细胞,其代谢产生的毒力因子,如溶血毒素、脲酶和蛋白酶等,具有细胞毒性,能够引起肠道多重不良反应[3-4]。目前临床针对Vp食物中毒主要使用抗生素药物治疗,如喹诺酮和头孢曲松等,但频繁使用会出现耐药菌和肠生态失衡等问题,对机体健康造成长期危害[5-6]。因此,探寻绿色手段干预食源性Vp感染已成为防治Vp食物中毒的重要需求和研究热点。
膳食调理成为干预病原菌感染的新兴策略,大量研究表明食品功能因子对病原菌感染具有一定的缓解作用[7-10]。鱼油分离自海产鱼类,富含ω-3系多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs),主要包括二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),具有调节免疫、抑制炎症和抗感染等生理功能[11]。在哺乳动物肝脏和肠道内,鱼油经一系列酶分解产生3系前列腺素和5系白三烯物质,干预上皮细胞表面Toll样受体4介导的信号传导,抑制核因子κB活化,调控细胞因子,如白细胞介素(interleukin,IL)-1β、IL-6和肿瘤坏死因子(tumour necrosis factor,TNF)-α分泌,优化免疫T细胞的活化与分化过程,从而促进肠道健康[12]。然而,目前针对鱼油缓解食源性致病菌感染的研究鲜有报道,仅有Liu Junsheng等[13]从沙门氏菌诱导的肠道菌群紊乱角度探究了鱼油对其感染小鼠的保护效应。此外,本课题组研究发现,Vp的致病过程与沙门氏菌存在差异,Vp侵袭小鼠后主要定植于结肠组织,引起肠组织基因表达改变,造成肠屏障功能异常和过度炎症[14]。因此,鱼油干预食源性致病菌感染的剂量和机制均有特异性,从鱼油干预沙门氏菌感染模型中得到的结论无法应用于干预Vp感染,鱼油对Vp感染的缓解作用和潜在机理尚不明确。
鉴于结肠组织是食源性Vp侵袭和鱼油调控的共同靶器官,本研究推测鱼油能够缓解Vp诱导的小鼠肠炎性损伤,通过构建Vp感染小鼠模型,比较正常饲喂小鼠与鱼油干预小鼠分别暴露Vp后的临床感染症状,结肠病理变化、肠道屏障功能、炎症水平和抗氧化活力等指标,评估鱼油对Vp感染小鼠的保护作用,并从结肠基因表达模式角度深入挖掘鱼油缓解结肠炎的作用机理,以期为基于鱼油开发抗Vp感染的膳食补充剂提供科学依据。
1 材料与方法
1.1 动物、材料与试剂
无特定病原菌(specific pathogen free,SPF)6 周龄C57BL/6J雄性小鼠28 只,体质量(18±2)g,购自斯贝福(北京)生物技术有限公司,生产许可证号:SCXK(京)2019-0010;饲料购自纳瑞增(锦州)生物科技公司;动物房内温度(20±2)℃、相对湿度(44±5)%,12 h明暗交替循环,小鼠1 周适应期间,正常饮食和自由饮水。
副溶血弧菌(ATCC33847),携带耐热直接溶血素基因和不耐热溶血素基因,是典型致病株[15],由渤海大学大宗水产品贮藏加工与安全控制团队保存。
溶菌营养肉汤(lysogeny broth,LB) 北京陆桥生物技术有限公司;鱼油(含47.8% EPA和43.5%DHA) 美国西格玛公司;磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.2)、氯化钠(NaCl)、4%多聚甲醛溶液 北京索莱宝科技有限公司;苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒、天狼星红(Sirius red,SR)染色液试剂盒、抗氧化酶试剂盒、免疫荧光试剂盒、免疫组化试剂盒、细胞因子酶联免疫试剂盒南京建成科技有限公司;TRIzol提取剂、cDNA逆转录试剂盒、预混型实明荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)试剂盒湖南艾科瑞生物工程有限公司。
1.2 仪器与设备
BBS-SDC超级洁净工作台 山东博科仪器制造有限公司;SPX-25恒温培养箱 上海丙林电子科技有限公司;HT1909高速台式冷冻离心机 湖南湘仪实验室仪器开发有限公司;ABI stePone Plus PCR仪 德国艾本德公司;BKQ-B50II高压蒸汽灭菌锅 山东卓隆生物科技有限公司;Imark酶标仪、CFX96型荧光定量PCR仪美国伯乐公司;组织自动包埋机、石蜡包埋机、转轮式切片机 湖北贝诺医疗科技有限公司;Eclipse E100光学显微镜 日本尼康公司;Axio Imager 2偏振光显微镜北京普瑞赛司仪器有限公司;ZXF-1500正置荧光显微镜上海正晞仪器设备有限公司。
1.3 方法
1.3.1 副溶血弧菌菌悬液制备
从-80 ℃冰箱中取出Vp ATCC33847冻干粉,在LB琼脂培养基上连续划线后,放入37 ℃恒温培养箱中活化18~20 h;挑取单菌落接种到LB液体培养基中,37 ℃、150 r/min摇床孵育12 h;将复苏的菌液以体积比1∶100转接至新鲜的3% NaCl-LB液体培养基中扩大培养,待生长至对数期(OD600nm=0.8~1.0),取菌液转入50 mL无菌离心管中,4 ℃、12 000 r/min离心10 min,弃上清液后加入等体积无菌生理盐水重悬,再次离心,重复上述操作两次去除培养基;最后,使用无菌生理盐水重悬沉淀,采用平板计数法明确Vp ATCC33847初始菌量,根据Vp食物中毒剂量[14],采用10 倍稀释法调整菌液浓度至106CFU/mL。Vp为嗜中温微生物,冷藏条件下极易丧失活力,侵袭小鼠的菌悬液现用现配。
1.3.2 小鼠实验设计
暂养结束后,将28 只C57BL/6J小鼠随机分为4 组(n=7):对照组、模型组、鱼油低剂量干预组和鱼油高剂量干预组。低剂量和高剂量干预组小鼠每日分别灌胃0.1 mL含有2.0 mg和4.0 mg鱼油的油-水混合乳化液[13],连续干预14 d,期间对照组和模型组小鼠正常饲喂;实验第15天,模型组和2 个鱼油干预组小鼠均灌胃0.1 mL含Vp ATCC33847菌悬液(按照1.3.1节步骤配备),对照组灌胃等体积生理盐水,暴露感染7 d,期间仅第1天攻毒Vp,剩余6 d无需重复灌胃。实验第21天,采用二氧化碳麻醉小鼠后,颈椎脱臼法迅速处死小鼠,各组小鼠解剖收集距离盲肠1 cm明显病变的结肠组织,保证取样一致性。一部分使用RNase-free水快速清洗肠腔后,置于液氮进行转录组测序;另一部分置于4%多聚甲醛溶液中固定用于病理学研究;剩余部分冻存在-80 ℃冰箱用于抗氧化酶、细胞因子和基因表达分析。实验动物伦理审查批准文号:GDOU-LAE-2022-13。
1.3.3 小鼠疾病活动指数评价
感染期间,观察并记录各组小鼠的活动行为、饮食摄水、精神状况、粪便性状和体质量变化等指标。根据疾病活动指数(disease activity index,DAI)评价标准,结合体质量下降比例、血便程度和脏器病变等指标进行评分[9]。
1.3.4 结肠病理损伤分析
对固定的结肠样品进行乙醇梯度脱水(30%、50%、70%、85%、95%、100%)、透明、浸蜡、包埋、切片(厚度5 μm)、展片、贴片、烤片、常规脱蜡复水、HE染色和SR染色、梯度脱水、中性树胶封片。为避免结肠样品不同位置切片造成的误差,各组切片均取自相近横截面,使用普通光学显微镜或偏振光显微镜(400×)全视野全盲阅片,观察结肠上皮结构完整性,并参照文献[14]分析结肠隐窝深度、水肿和固有层炎性细胞浸润,按照评分标准随机取切片5 张不同位置的图片进行组织病理学评分(histopathological score,HIS)。
1.3.5 结肠屏障功能检测
结肠屏障功能与组织纤维化程度密切相关,可以利用脏器纤维化标记物I 型胶原蛋白(type I collagen protein,TICP)和III型胶原蛋白(type III collagen protein,TIIICP)表达量作为评价结肠屏障功能的指标[16]。采用免疫荧光法检测结肠组织纤维化标记物TICP和TIIICP蛋白表达量,具体操作如下:取1.3.4节制备的结肠石蜡切片,根据免疫荧光试剂盒说明书,将结肠石蜡切片脱蜡,热原修复,画圈标记并用5%胎牛血清封闭,滴加TICP和TIIICP一抗4 ℃孵育过夜,PBS洗涤3 次后加入超敏兔鼠通用二抗避光室温孵育50 min,随后,使用4’,6-二脒基-2-苯基吲哚(diaminy phenylindoles,DAPI)复染细胞核,猝灭结肠样本自发荧光;荧光显微镜(400×)观察并采集图像。TICP蛋白阳性表达为红色荧光,TIIICP蛋白阳性表达为绿色荧光,细胞核阳性表达为蓝色荧光。
1.3.6 结肠细胞因子含量和抗氧化酶活力检测
使用IL-1β、IL-6、TNF-α试剂盒检测结肠组织中细胞因子含量,使用过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)和总抗氧化活力(total antioxidant capacity,T-AOC)试剂盒检测结肠组织抗氧化酶活力,试样的制备和具体操作按照说明书开展,利用多功能酶标仪读取吸光度,测定结肠组织中6 个指标,结肠组织细胞因子含量单位为pg/g,抗氧化酶活力单位为U/mg。
1.3.7 结肠组织转录组测序
从对照组、模型组和干预组(鱼油高剂量组)每组随机挑选3 只小鼠结肠样品提取总RNA;利用Nanodrop 2000紫外分光光度法测定RNA纯度,1%琼脂糖凝胶电泳测定RNA完整性;Oligo(dT)磁珠富集分离真核生物mRNA;Fragmentation缓冲液将mRNA随机打断,用六碱基随机引物逆转录酶反转合成cDNA;纯化的双链cDNA经末端修复、加A尾并连接测序接头,送至北京百迈客生物科技有限公司利用Illumina平台测序。测序获得的原始读段(raw reads)经过滤后得到洁净读段(clean reads),将其比对到小鼠参考基因组mm10(Mus_musculus_GRCm39),使用RSEM工具计算9 个试样的基因表达水平,并用DEseq2方法进行差异表达基因(differentially expressed genes,DEGs)筛选,筛选条件为|log2差异倍数(fold change,FC)|≥1、P<0.01。根据DEGs检测结果,对候选基因进行基因本体(Gene Ontology,GO)功能富集和京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。
1.3.8 结肠组织转录组结果验证
首先在基因水平,取1.3.7节中部分Oligo(dT)磁珠富集分离mRNA样品,应用反转录试剂盒将其逆转录为cDNA,使用20 μL反转录体系,通过特异性引物进行qPCR扩增,以β-actin为内参基因,检测RNA-seq挖掘的候选基因相对表达量,随机筛选5 个,分别为Cxcl10、Tnfrsfl3c、Pparg、Ppara和Nfkbil1,按照2-ΔΔCt方法计算。引物由上海生物工程有限公司合成,序列见表1。
随后在蛋白水平,对鱼油干预后显著上调的过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor,PPAR)家族表达进行验证,以PPARγ为靶蛋白。采用免疫组化法测定其蛋白表达量,具体步骤根据试剂盒说明书操作,利用普通光学显微镜在400×下观察PPARγ蛋白阳性表达情况,阳性结果为棕黄色,阴性为蓝色。
1.4 数据处理与分析
所有数据采用SPSS 22.0软件统计分析,结果以平均值±标准差表示。组间比较采用单因素方差分析,当P<0.05明组间存在显著差异。采用Origin Lab2018软件作图,采用ImageJ 1.8.0软件统计分析TICP和TIIICP蛋白阳性成像面积平均积分光密度。
2 结果与分析
2.1 鱼油对副溶血弧菌感染小鼠结肠病理损伤的影响
实验结束明,对照组鼠笼的垫料整洁无污、粪便呈颗粒状;模型组鼠笼的垫料黏附污渍、粪便呈带血稀状;鱼油干预组鼠笼的垫料上黑色斑点和水样粪便出现不同程度减少,其中高剂量干预组鼠笼垫料的整洁度与对照组相近(图1A),说明鱼油可以改善Vp感染造成的小鼠腹泻和血便症状。HE染色结果显示,对照组小鼠结肠隐窝清晰、层次分明,黏膜上皮结构完整,无炎性细胞润湿;模型组小鼠结肠黏膜结构明显缺失,黏膜细胞减少,隐窝深度变浅,伴有增生结缔组织,固有层可见大量炎性细胞浸润;鱼油低剂量和高剂量组小鼠结肠黏膜下层的炎性细胞浸润明显减少,局灶性肠腺结构消失,显著改善了Vp对结肠的侵袭影响(图1B)。SR染色结果显示,对照组小鼠结肠组织未见双折射光,模型组小鼠结肠组织呈现红、黄和绿色纤维相间,分别代表I、III和IV型胶原纤维,其中红色粗大纤维双折光较明显,伴有微弱的绿色和黄色细纤维折光,这与HE染色观察到的结缔组织增生结果一致;鱼油高剂量组小鼠结肠组织中I、III和IV型胶原纤维双折光均明显减弱,仅剩较弱的红色折射光;而鱼油低剂量组小鼠结肠组织胶原纤维化缓解效果不明显(图1C)。通过DAI评分和HIS定量评估鱼油对Vp感染小鼠的保护作用,结果如图1D、E所示,经高剂量鱼油干预,小鼠DAI评分和HIS分别为3.89±0.31(7 d)和4.05±0.28,显著低于模型组(8.25±0.26(7 d)和7.98±0.37)(P<0.05),但与对照组健康小鼠(0.12±0.02(7 d)和1.05±0.04)相比,仍存在显著差异(P<0.05),表明鱼油能够在一定程度上缓解Vp感染损伤,但无法完全逆转。
2.2 鱼油保护副溶血弧菌感染小鼠的肠道屏障功能分析
为了确定鱼油对Vp感染小鼠结肠屏障功能的保护作用,对肠组织纤维化关键蛋白TICP和TIIICP进行免疫荧光分析,并对每组5 张随机截取的图像进行阳性面积荧光密度定量。如图2A所示,在对照组结肠切片上无明显的TICP红色荧光和TIIICP绿色荧光分布;模型组结肠切片上出现了较多的TICP红色荧光和少量的TIIICP绿荧光区域,均有序地分布在细胞间质周围;鱼油干预促进了上述纤维化标记物恢复至正常水平,高剂量鱼油组TICP和TIIICP的荧光较少分布在切片周围;各组细胞核均呈现明亮的蓝色荧光。此外,与模型组相比,低和高剂量鱼油都降低了小鼠结肠组织TICP和TIIICP的荧光强度,其中高剂量鱼油显著降低了2 种纤维化标记蛋白的荧光强度(P<0.05),而低剂量鱼油组仅有所降低,效果不显著(P>0.05)(图2B、C),说明鱼油能够高度抑制Vp感染小鼠结肠TICP和TIIICP表达,减轻结肠组织纤维化程度,增强肠道屏障功能。
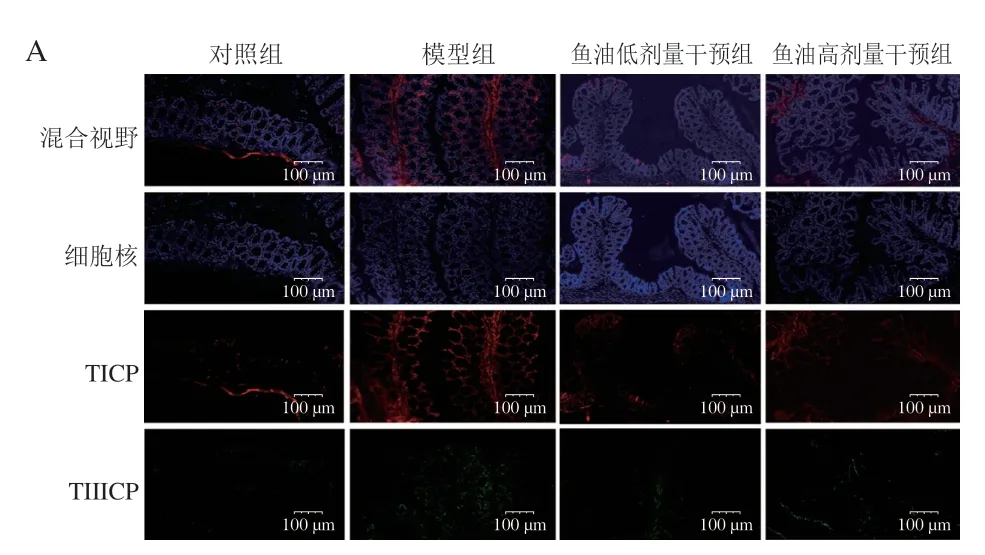
图2 鱼油对副溶血弧菌感染小鼠结肠组织纤维化的影响Fig.2 Effect of FO on colonic fibrosis in Vibrio parahaemolyticus infected mice
2.3 鱼油抑制副溶血弧菌感染小鼠的过度炎症和氧化应激
肠道屏障功能受损会激活肠道过度炎症和氧化应激。如图3A~C所示,模型组小鼠结肠组织中IL-1β、IL-6和TNF-α的含量分别为对照组的2.72、2.28 倍和2.32 倍,说明Vp感染使小鼠结肠产生过度炎症反应;鱼油干预能够降低小鼠结肠3 种促炎因子含量,其中高剂量鱼油抑制炎症的效果优于低剂量鱼油,高剂量组IL-1β、IL-6和TNF-α水平仅分别为模型组的44%、52%和42%,组间差异显著(P<0.05)。此外,检测各组小鼠结肠组织中CAT、SOD活力和T-AOC发现,模型组结肠CAT、SOD和T-AOC水平显著低于对照组(P<0.05),说明Vp感染诱导炎症后,进一步造成肠道抗氧化系统紊乱,形成氧化应激;鱼油干预不同程度提高了结肠3 种抗氧化酶活力,特别是高剂量干预组SOD活力和T-AOC接近对照组(P>0.05)(图3D~F)。综上说明,鱼油干预与炎症反应和氧化应激指标之间存在明显的剂量依赖关系,小鼠膳食补充高剂量鱼油能够更好地抑制Vp感染造成的过度炎症和氧化应激。因此,后续研究选择高剂量干预组深入探讨鱼油对小鼠的保护作用机理。
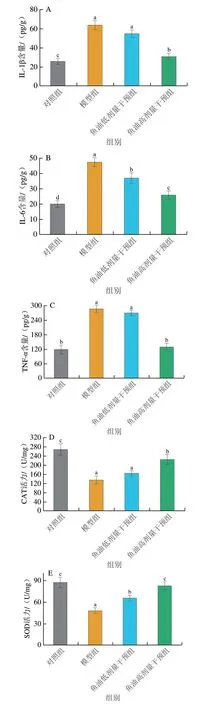
图3 鱼油对副溶血弧菌感染小鼠结肠组织炎症和抗氧化性的影响Fig.3 Effect of FO on colonic inflammation and antioxidant activity in Vibrio parahaemolyticus infected mice
2.4 鱼油调控副溶血弧菌感染小鼠的肠道基因表达谱
2.4.1 测序数据质量分析
经建库上机测序后,将各组结肠组织的基因表达数据通过Seqprep和Sickle软件计算碱基质量得分、评价测序错误率和碱基含量,如表2所示,9 个样品获得的平均raw reads为49.78×106条,平均clean reads为48.53×106条,平均Q30碱基占比约95.10%,单个碱基测序错误率低于0.1%;各组测序得到clean reads与小鼠参考基因组的比对率达91.28%~97.15%,共得到29 436 个基因,其中28 811 个已知基因,625 个新基因,证明测序数据质量较高,可用于识别鱼油介导的差异基因和功能聚类分析。
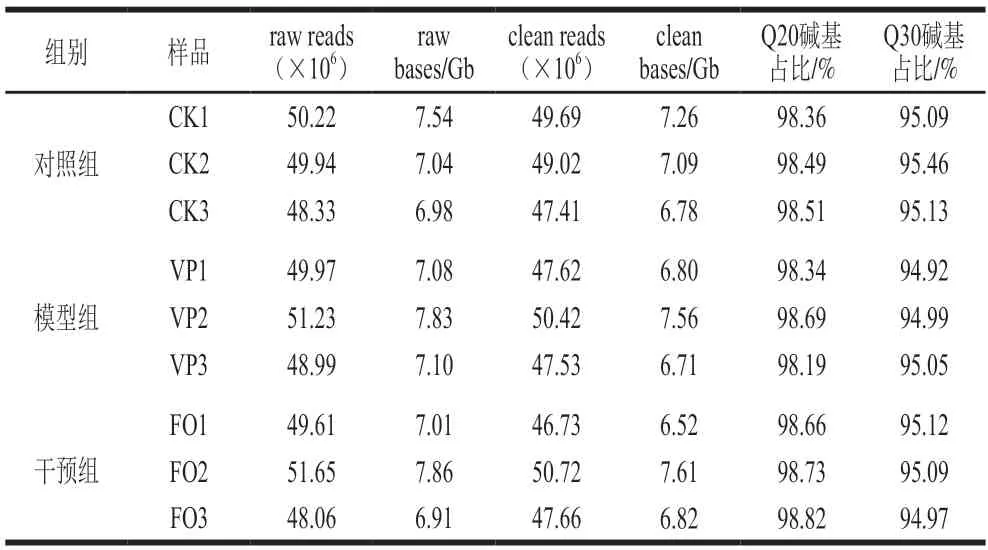
表2 转录组测序数据统计Table 2 Statistical analysis of RNA-sequencing data
2.4.2 识别差异表达基因
基于DESeq2方法筛选组间结肠组织中的DEGs,模型组与对照组相比,筛选出169 个显著变化的DEGs,其中86 个上调,83 个下调;干预组与模型组相比,筛选出显著变化的DEGs有106 个,其中28 个上调,78 个下调(图4A~C)。运用StringTie、edgeR方法,筛选对照组、模型组和干预组交集共有和特有的DEGs,3 组间交集处共有12 个DEGs,对照组与模型组间特有的DEGs为157 个,干预组与模型组间特有的DEGs为94 个(图4D)。针对3 组间DEGs聚类分析,热图分析结果显示,与对照组相比,在干预组显著下调,而模型组中显著上调的DEGs包括CXC趋化因子基因(Cxcl10、Cxcl2和Cxcl5)、TNF-α诱导蛋白基因(Tnfrsfl3c)、炎症因子受体基因(Nfkbil1)等;与对照组相比,在模型组显著下调,而干预组中显著上调的DEGs包括PPAR家族蛋白基因(Pparg、Ppard、Ppara和Ppagcla)等。综上,鱼油显著改变了小鼠肠道基因表达模式。
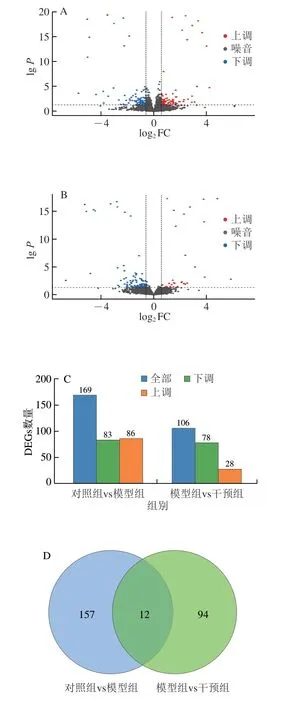
图4 鱼油对副溶血弧菌感染小鼠结肠DEGs的影响Fig.4 Effect of FO on differentially expressed genes (DEGs) in colon of Vibrio parahaemolyticus infected mice
2.4.3 差异表达基因GO功能富集和KEGG途径富集分析
为了探索鱼油缓解Vp诱导肠炎性损伤的分子机制,利用Metascape软件,对DEGs进行GO和KEGG分析。结果显示,模型组与对照组的DEGs主要富集于生物学过程(biological process)158 个GO条目,包括免疫系统过程(immune system process)、对刺激的反应(response to stimulus)和代谢过程(metabolic process)等;细胞组分(cellular component)24 个GO条目,包括胞外区(extracellular region)和分子复合物(macromolecular complex)等;分子功能(molecular function)16 个GO条目,包括结合作用(bindings)和催化活性(catalytic activity)等。干预组与模型组的DEGs富集于生物学过程71 个GO条目,包括细胞过程(cellular process)、信号传导(signalling)和生物调节(biological regulation)等;细胞组分19 个GO条目,包括免疫球蛋白复合体(immunoglobulin complex)和质膜外侧(external side of plasma membrane)等;分子功能9 个GO条目,包括免疫球蛋白受体结(immunoglobulin receptor binding)和抗原结合(antigen binding)等(图5A、B)。进一步分析鱼油介导DEGs涉及的细胞信号通路,如图5C、D所示,模型组与对照组相比,富集于3 个KEGG信号通路,主要包括细胞凋亡(apoptosis)、弧菌感染(Vibriosinfection)和核因子-κB信号通路(NF-kappa B signaling pathway)等;干预组与模型组相比,富集于15 个KEGG信号通路,主要包括PPAR信号通路(PPAR signaling pathway)、肠免疫网络免疫球蛋白A合成途径(intestinal immune network for IgA production)和磷酯酰肌醇-3-激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B,PI3K/Akt)信号通路(PI3K/Akt signaling pathway)等。经DEGs网络互作分析可知,Cxcl10、Cxcl2、Cxcl5、Tnfrsfl3c、Nfkbil1等参与模型组富集的核因子-κB信号通路(图5E、F);而Pparg、Ppard、Ppara、Ppagcla等参与干预组富集的PPAR信号通路,这与2.4.2节热图分析的结果相印证。上述结果表明,鱼油通过调节结肠基因表达,富集免疫相关信号通路,进而抑制炎症信号传导,减轻Vp感染诱导的结肠损伤。
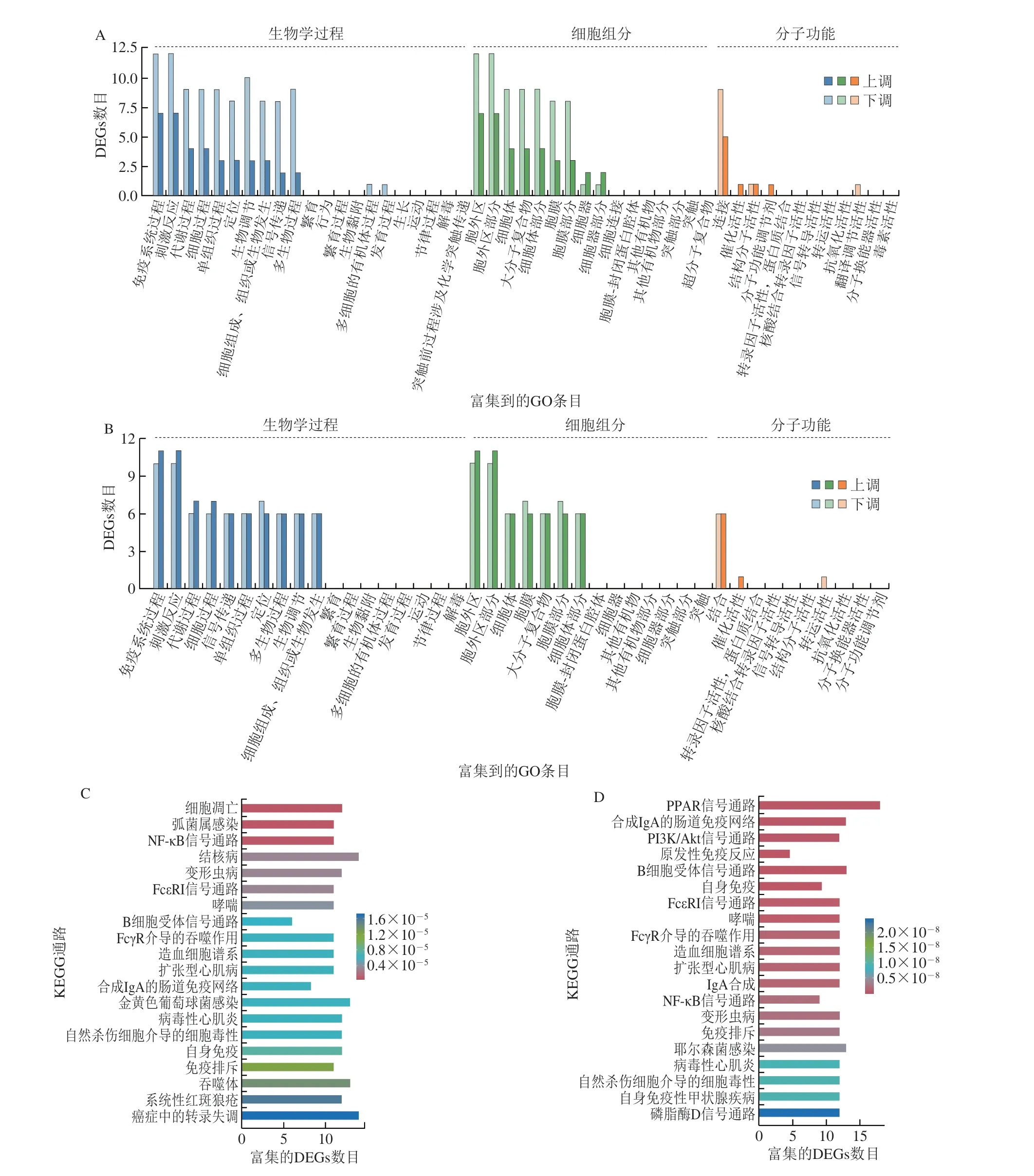
图5 鱼油对副溶血弧菌感染小鼠结肠DEGs的GO功能富集和KEGG通路富集影响Fig.5 Effect of FO on GO enrichment and KEGG pathway enrichment of DEGs in colon of Vibrio parahaemolyticus infected mice
2.4.4 鱼油介导的肠道靶基因验证
为了验证RNA-seq数据的准确性,随机选择在Vp感染和鱼油干预中显著变化的5 个DEGs进行qPCR验证,分别为Cxcl10、Tnfrsfl3c、Pparg、Ppara和Nfkbil1,并对鱼油显著上调的PPAR家族蛋白的核心基因PPARγ进行免疫组化蛋白表达分析。如图6所示,筛选的5 个DEGs在RNA-seq与qPCR分析中的变化规律保持一致,与对照组相比,模型组小鼠结肠组织Cxcl10、Tnfrsfl3c和Nfkbil1相对表达量均显著升高,经鱼油干预后显著下降(P<0.05),而结肠Pparg和Ppara的表达规律相反。此外,与对照组相比,模型组PPARγ表达量显著降低,小鼠结肠组织PPARγ蛋白表达量经鱼油干预后显著提高(干预组呈明亮的黄褐色),这与RNA-seq和qPCR分析结果一致。
3 讨论
随着人们对“潮汕生腌”和“日本刺身”等生食水产品的青睐与日俱增,Vp导致的食物中毒事故在我国多个城市呈明显上升趋势[17]。抗生素虽能杀死病原菌,但大范围的使用会导致多重耐药株的出现,这增加了临床治疗Vp感染的难度[18]。本研究针对Vp诱导的肠组织基因表达异常,构建Vp感染小鼠模型,探究鱼油对Vp造成的肠炎性损伤的保护作用及其潜在机制。
肠上皮结构的完整性在维持微生态平衡和抵御病原体侵袭中发挥关键作用[19]。隐窝深度和黏膜细胞数是反映致病菌感染的重要指标,当隐窝深度变浅、黏膜组织破损明,触发炎症反应,造成结缔组织增生,削弱肠道功能[20]。与此相似,本研究结果显示,Vp诱导小鼠肠黏膜固有层和上皮组织分离,黏膜完整性受损,固有层出现大量炎性细胞聚集,伴有I、III和IV型胶原纤维沉积,说明Vp感染导致小鼠结肠病理性改变。经膳食补充4.0 mg鱼油后,显著抑制了Vp引起的水样血便、DAI评分和HIS增加、胶原纤维沉淀,改善了结肠损伤。Roussel等[21]的研究也证实,小鼠摄入充足剂量ω-3 PUFAs能够有效扭转溃疡性肠炎小鼠结肠上皮结构紊乱、隐窝变形和固有层弥散单核细胞的症状。值得注意的是,当小鼠补充相同剂量ω-3 PUFAs明,EPA与DHA摄入比为1∶1明缓解肠道炎症效果更佳[21],本研究中使用的鱼油EPA/DHA接近此比例。因此,膳食补充鱼油缓解Vp感染明,不仅要关注摄入剂量,还应注意不同类型ω-3 PUFAs摄入比。
肠道病理损伤能够诱导肠纤维化的发生,导致肠腔狭窄和梗阻,造成肠道屏障功能紊乱。持续的病理状态、炎性损伤会导致肠上皮细胞形成纤维化病灶,局部出现大量成纤维细胞,激活I和III型胶原表达,促进细胞外基质堆积,造成肠屏障功能紊乱,引发“肠漏”症状[22]。本研究发现,Vp感染导致结肠黏膜及黏膜下层纤维化,器官纤维化标记物TICP和TIIICP的合成能力明显增加,而鱼油可以维持Vp感染小鼠的正常结肠形态,并改善肠纤维化程度。这与Sunagawa等[23]的研究结果一致,其发现在心力衰竭大鼠模型中,鱼油降低了血管周围TICP和TIIICP的表达水平,抑制了心肌梗死诱导的心脏成纤维细胞增殖和纤维化。此外,有研究表明,ω-3 PUFAs通过抑制结肠上皮细胞内质网应激,减轻细胞纤维化程度,进而恢复小鼠肠黏膜柔性和屏障功能[24]。综上,鱼油缓解Vp诱导的小鼠结肠纤维化可能与调控结肠细胞基因表达有关。
正常生理状态下,肠组织活化的巨噬细胞、树突状细胞和上皮基质细胞通过分泌适量的促炎因子(IL-1β、IL-6和TNF-α)参与免疫应答与免疫调节;当肠道受到强烈的逆境胁迫明,免疫细胞合成过量的细胞因子会激发活性氧,造成抗氧化系统失衡,形成氧化应激,给组织和器官带来严重损伤[25]。本研究发现,Vp感染的小鼠结肠组织能够产生大量的IL-1β、IL-6和TNF-α,同明抑制CAT、SOD和T-AOC抗氧化酶活力,造成过度炎症和氧化压力。然而,经鱼油干预处理的小鼠被Vp感染后,其结肠组织中3 种促炎因子含量均显著下降,3 种抗氧化酶活性得到提升。有研究指出,富含ω-3 PUFAs的鱼油和磷虾油通过降低沙门氏菌和柠檬酸杆菌侵袭小鼠结肠和血清中炎性因子含量,提高抗炎性因子水平,恢复抗氧化酶活力,改善致病菌感染损伤[13,26]。综上,鱼油缓解Vp诱导的肠道生理功能异常与调节过度炎症和氧化应激相关。
肠道病理和生理功能的改变,本质上是由肠组织细胞基因表达量、表达模式和相应功能决定。本研究显示,小鼠暴露Vp感染后,结肠组织产生169 个DEGs,其中86 个上调,83 个下调,主要富集在免疫系统过程、对刺激的反应和代谢过程等生物学过程,并参与细胞凋亡、弧菌感染和核因子-κB信号通路等信号通路,富集这些途径中显著上调的基因包括Cxcl10、Cxcl2、Cxcl5、Tnfrsfl3c、Nfkbil1等。有研究指出,CXC趋化因子(Cxcl10)参与激活凋亡坏死相关的炎症和免疫反应,细胞坏死导致膜破裂和细胞内容物释放,加剧炎症反应[27-28]。炎症因子受体(Nfkbil1)可触发NF-κB转录,诱导TNF-α分泌[29]。综上,Vp可通过上调小鼠结肠组织中炎症相关基因的表达,驱动炎症反应,诱导肠道病理性改变和生理功能紊乱。然而,小鼠经鱼油干预后暴露于Vp,结肠组织产生106 个DEGs,其中28 个上调,78 个下调,主要富集在细胞过程、信号传导和生物调节等生物学过程,参与PPAR信号通路、肠免疫网络免疫球蛋白A合成途径和PI3K/Akt信号通路,富集这些途径中显著上调的基因包括PPAR家族蛋白基因Pparg、Ppard、Ppara和Ppagcla等。有研究表明,PPAR是一种新型的核激素受体超家族,是调控基因表达所必需的核受体[30]。PPAR广泛分布于肠道、肝脏和肾脏等多个组织器官,参与调控脂质代谢、炎症反应、细胞增殖和纤维化[31],其中上调PPARγ表达可以防止组织纤维化,高表达的PPARγ活化Akt受体并激活信号传递,提高组织抗炎和抗氧化能力[32]。本研究也发现,随着鱼油干预组小鼠结肠组织PPAR家族蛋白转录水平的升高,结肠炎症反应和氧化压力明显减弱,病理损伤也得到缓解。此外,本研究在基因和蛋白水平验证了PPAR家族关键蛋白PPARγ介导的鱼油发挥生物学功能。综上,鱼油通过上调PPAR家族蛋白基因,下调CXC趋化因子基因和炎症因子受体基因,优化了结肠基因表达模式,进而富集免疫相关的PPAR信号通路,减少炎症相关的核因子κB信号通路,从而改善Vp感染诱导的结肠炎损伤。PPAR家族蛋白在鱼油缓解Vp感染过程中发挥了关键作用,其参与调控的代谢通路尚待阐明。此外,本研究证实了鱼油对Vp感染具有明显的抵御作用,其在Vp暴露后能否发挥治疗作用有待进一步探究。
综上所述,鱼油能够调节小鼠结肠组织基因表达谱,富集免疫功能相关的基因和信号通路,特别是PPAR家族蛋白基因介导的信号转导途径,抑制Cxcl10、Cxcl2、Cxcl5、Tnfrsfl3c、Nfkbil1参与的炎症反应和IL-1β、IL-6和TNF-α分泌,提高CAT、SOD抗氧化酶活力和T-AOC,下调TICP和TIIICP纤维标记物的蛋白表达,维系肠屏障功能,抵御致病菌侵入肠道深层结构,缓解Vp感染损伤。本研究成果可为鱼油抗致病菌感染功能食品的开发及应用提供理论支持。
