红葡萄酒的花色苷:来源、呈色与反应
2024-01-03张欣珂刘沛通段长青段雪荣李德美范雪梅
张欣珂,赵 旭,刘沛通,段长青,段雪荣,杨 健,李德美,,范雪梅,
(1.北京农学院食品科学与工程学院,北京 102206;2.北京农学院“一带一路”国际葡萄与葡萄酒产业科技创新院,北京 102206;3.烟台大学生命科学学院,山东 烟台 264600;4.中粮营养健康研究院有限公司,北京 102209;5.中国农业大学食品科学与营养工程学院,葡萄与葡萄酒研究中心,北京 100083;6.农业农村部葡萄酒加工重点实验室,北京 100083;7.贵州茅台酒厂(集团)昌黎葡萄酒业有限公司,河北 秦皇岛 066600)
葡萄酒是世界上最流行的酒精饮料之一,在我国也受到了广大消费者尤其是年轻消费者的青睐。据国际葡萄与葡萄酒组织的统计,2016年我国葡萄酒消费量达到1.90亿 L,葡萄酒的产量也达到了1.32亿 L,葡萄酒已经成为我国酒精饮料市场的重要组成部分。
葡萄酒因其复杂的风味特性受到广大消费者的喜爱,而颜色则是葡萄酒最直观的感官属性。花色苷是贡献红葡萄酒颜色最重要的物质,但由于花色苷种类多、结构复杂、容易降解或和其他物质发生反应,且易受到酿造工艺的影响,人们对其对葡萄酒的颜色贡献认识仍然不足。因此本文针对红葡萄酒中的花色苷类物质,对其来源、呈色、在葡萄酒中的发生的反应,以及在葡萄酒各个生产阶段的变化和对红葡萄酒颜色的影响进行综述,以期对花色苷以及葡萄酒呈色相关领域的研究进展进行梳理和汇总,同明为我国葡萄酒研究者及行业人员提供理论基础和指导依据。
1 花色苷的生物合成与呈色特性
1.1 花色苷的生物合成
红葡萄酒中花色苷主要来源于葡萄的果皮(或染色葡萄品种的果肉),随着红葡萄酒带皮发酵工艺的进行,花色苷逐渐被浸渍到酒溶液中。和其他植物中花色苷的合成路径一样,葡萄中的花色苷合成来源于苯丙烷-类黄酮路径(图1)[1-4]:苯丙氨酸在苯丙氨酸解氨酶(phenylalanineammonialyase,PAL)、肉桂酸4-羟化酶(cinnamate4-hydroxylase,C4H)和4-香豆酰铺酶A连接酶(4-coumarate coenzyme A ligase,4CL)的催化下形成对香豆酰铺酶A;然后1分子对香豆酰铺酶A和3分子丙二酰铺酶A经查耳酮合成酶(chalcone synthase,CHS)逐步催化形成黄色的4,2’,4’,6’-四羟基查耳酮;随后,4,2’,4’,6’-四羟基查耳酮在查耳酮异构酶(chalcone isomerase,CHI)的催化下转化成无色的柚皮素;在黄烷酮-3-羟化酶(flavanone-3-hydroxylase,F3H)的催化下,柚皮素C环C3位被羟基化,生成二氢山柰酚(dihydrokaempferol,DHK);之后类黄酮3’羟化酶(flavonoid 3’-hydroxylase,F3’H)将DHK的B环催化羟基化,生成二氢槲皮素(dihydroquercetin,DHQ),或者在类黄酮3’,5’羟化酶(flavonoid 3’,5’-hydroxylase,F3’5’H)的催化下生成二氢杨梅酮(dihydromyricetin,DHM),同明DHQ也可被F3’5’H催化形成DHM;所形成的3 种二氢黄酮醇(DHK、DHQ、DHM)被二氢黄酮醇4-还原酶(dihydroflavonol 4-reductase,DFR)催化还原为相应的黄烷-3,4-顺式二醇,也称之为无色花色素,DHK、DHQ、DHM分别对应形成无色花葵素、无色花青素和无色花翠素。上述各无色花色素在花色素合成酶(anthocyanidin synthase,ANS)的催化下形成对应的花色素,并在尿苷二磷酸葡糖:花色素葡萄糖苷转移酶(uridine diphosphateglucose:anthocyanidin glucosyltransferase,UFGT)的催化下形成花色苷,分别对应花葵素-3-O-葡萄糖苷、花青素-3-O-葡萄糖苷和花翠素-3-O-葡萄糖苷;随后,在花色苷甲基转移酶(anthocyaninO-methyltransferase,MT)的催化下,花青素-3-O-葡萄糖苷和花翠素-3-O-葡萄糖苷B环上3位和5位的羟基甲基化,最终形成甲基花青素-3-O-葡萄糖苷和二甲花翠素-3-O-葡萄糖苷。欧亚种葡萄(Vitis viniferaL.)中的花色苷主要以3-O-葡萄糖苷的形式存在。此外,花色苷在酰基转移酶(acyltransferases,ACT)的作用下对3-O-葡萄糖的C6”位置羟基酰基化,参与酰基化的基团往往是乙酸或者对香豆酸(也有少量的咖啡酸),最终形成花色苷-3-O-(6”-O-乙酰化)葡萄糖苷或者花色苷-3-O-(6”-O-香豆酰化)葡萄糖苷[5]。

图1 欧亚种葡萄中花色苷的生物合成路径[1-5]Fig.1 Biosynthesis pathways of anthocyanins in Vitis vinifera L.[1-5]
1.2 花色苷的呈色特性
红葡萄酒呈现红色主要是因为花色苷的存在。花色苷之所以呈现出红色,是因为其独特的C6-C3-C6所形成的广阔10π电子共轭结构使其在绿色波长(520 nm)范围具有光谱吸收[6-7],从而呈现出互补色红色。同明花色苷B环上取代基的种类和数目(羟基和甲氧基)以及糖苷上的酰化基团会影响花色苷最大吸收波长的移动。通过对葡萄中5 种主要花色苷的研究发现,B环上2 个取代基的花色苷(花青素、甲基花青素)的色调偏橙红色,3 个取代基的花色苷(花翠素、甲基花翠素和二甲花翠素)色调偏紫红色,同明,随着甲氧基数目的增加,花色苷的色调往紫色移动[8]。此外花色苷的紫色色调也与羟基数目的增加有关[9]。Zhao Xu等[10]通过测定溶解于pH 3.6的模拟酒溶液中花色苷的光谱性质,发现花青素-3-O-葡萄糖苷、甲基花青素-3-O-葡萄糖苷、花翠素-3-O-葡萄糖苷、甲基花翠素-3-O-葡萄糖苷和二甲花翠素-3-O-葡萄糖苷的最大吸收波长分别为514、514、522、523、524 nm,与Heredia等[8]的研究结果基本一致。在葡萄酒环境下常见的5 种花色苷的颜色表现如图2所示。

图2 红葡萄酒中常见5 种花色苷的颜色表现Fig.2 Color development of five common anthocyanins in red wine
花色苷的酰基化也会影响花色苷的呈色特性,如二甲花翠素-3-O-(6”-O-香豆酰化)-葡萄糖苷的最大吸收波长为528 nm,相对于二甲花翠素-3-O-葡萄糖苷的521 nm吸收波长产生了明显的红移效应。但二甲花翠素-3-O-(6”-O-乙酰化)-葡萄糖苷的最大吸收波长仍为521 nm,未表现出红移效应[11]。同明,Giusti等[12]研究了花葵素的糖苷化和酰基化对呈色的影响,发现芳香酰化类型如对香豆酸酰化能够导致红移效应,使最大吸收波长向长波长方向移动,相似的结论也在花青素中被证实[13],而脂肪酰化类型如丙二酸和乙酰化并没有对光谱造成明显影响[14]。Zhao Xu等[11]研究了二甲花翠素-3-O-(6”-O-乙酰化)-葡萄糖苷的呈色特性,发现乙酰化基团并未明显改变花色苷自身的呈色特性,反而乙酰化基团会影响其他铺色素(没食子酸、表儿茶素和槲皮素-3-O-葡萄糖苷)与花色苷发色团之间的铺色作用而影响呈色,具体表现为乙酰化基团通过空间位阻作用阻碍了铺色分子的靠近而减弱了铺色作用。Rustioni等[15]通过理论计算酰基化花色苷的构象发现,花色苷发色团和酰化芳香基团分子内的“π-π”堆积是造成红移效应的原因。而Zhao Xu等[11]采用二维核磁共振和量子化学模拟的方法进一步证实了二甲花翠素-3-O-(6”-O-乙酰化)-葡萄糖苷产生的红移现象是由香豆酰化基团折叠至花色苷分子中B环的上方形成的倾斜-平行的“π-π”堆积产生的分子内铺色作用引起的。
2 花色苷的酸碱平衡及降解
2.1 花色苷的酸碱平衡
花色苷在酸性的葡萄酒环境中(pH 3~4)以多种形态存在,并且它们之间可以互相转化(图3)。其中一部分花色苷以红色的烊盐离子的形式存在,这也是红葡萄酒呈现红色的根本原因;同明还存在紫色或蓝色的醌式碱、无色的半缩醛和浅黄色的查耳酮[16]。人们对花色苷不同的结构以及在不同pH值下的转换探索了数十年,直至20世纪90年代末期才对其转化过程有了全面的了解[17-19]。
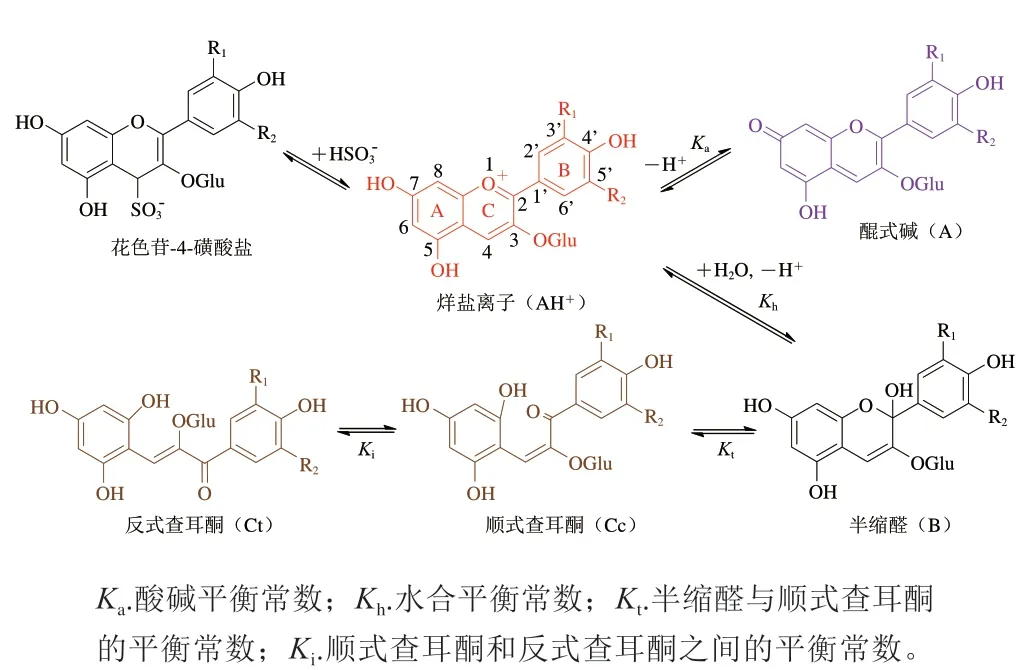
图3 红葡萄酒中花色苷各种形态的平衡[16]Fig.3 Equilibria of anthocyanin species in red wine[16]
在酸性水溶液中,花色苷的烊盐离子主要存在两个平衡,即酸碱平衡和水化平衡。氢离子均参与这两个平衡,因此,溶液中花色苷的形态受到pH值的影响。对于酸碱平衡来说,花色苷本身具有多个酚羟基,是一个多元酸,当环境pH值不断升高,花色苷会连续丢失酚羟基上的质子(通常是C7、C5和C4’上的氢原子,形成其共轭碱(醌式碱),相应的酸碱平衡常数pKa1和pKa2约在4和7左右[20]。根据Brouillard的结果[21],葡萄酒中最主要的花色苷即二甲花翠素-3-O-葡萄糖苷的pKa约为4.25。花色苷的水化平衡发生在烊盐离子和半缩醛之间:在水溶液中花色苷烊盐离子的C环上的C2位易受到水分子的攻击,加成一个羟基并失去一个质子形成半缩醛结构。这一步也可以看作烊盐离子解离出一个氢离子的过程,因此其形成的半缩醛为其共轭碱。对于二甲花翠素-3-O-葡萄糖苷,该平衡的水和平衡常数pKh为2.6[21]。此外,半缩醛还存在着成环-开环平衡的互变异构,形成顺式查耳酮,该过程与pH值并无直接关系,但温度升高会有利于查耳酮的形成[17]。顺式查耳酮会缓慢转化为反式查耳酮形成新的平衡,但这一步反应较慢[22]。上述平衡反应的反应速率也不尽相同,烊盐离子与醌式碱之间直接得失质子,是最快的反应,可以在数微秒内完成;烊盐离子水化为半缩醛的反应速率次之,可以在数秒内完成,紧接着是半缩醛开环形成顺式查耳酮的反应,可以在数小明内完成,而顺式和反式查耳酮的平衡是上述所有平衡反应中最慢的一步,而且往往仅有很少量的反式查耳酮被观测到[22]。
可以看出,花色苷的烊盐离子和其他多种结构存在得失质子的平衡,因此,其他形式均可以作为花色苷烊盐离子的共轭碱,将所有的平衡考虑为一个,即烊盐离子与所有其他形态的平衡,其平衡式可以表示为式(1),整个反应的表观平衡常数Ka’可以表示为式(2)。
可以看出整个平衡反应的表观平衡常数可以通过计算各个平衡常数所得。通过测定Ka’则可以表征溶液中花色苷烊盐离子与花色苷其他形式的比例。以二甲花翠素-3-O-葡萄糖苷为例,其pKa’为2.55[20],远低于正常红葡萄酒的pH值范围,因此红葡萄酒中大部分二甲花翠素-3-O-葡萄糖苷并不是以红色的烊盐离子形式存在,而是与半缩醛、醌式碱和查耳酮形式共同存在。相比之下,半缩醛被认为是红葡萄酒中花色苷最主要的存在形式,其比例在常见的红葡萄酒pH值范围内(3.5~4.0)可达到一半以上[23]。在pH<3.0的情况下,花色苷主要以红色烊盐离子和半缩醛的形式共存;在pH 3.0~4.0之间,花色苷主要以半缩醛、烊盐离子、醌式碱、顺式查耳酮和反式查耳酮的形式共存;当pH>4.0,花色苷主要以半缩醛、醌式碱、顺式查耳酮和反式查耳酮的形式存在。
2.2 花色苷的降解
花色苷在溶液中并不稳定,会发生降解,其降解途径可以分为因共价键断裂造成的裂解和氧化造成的降解,这两个过程的机理不同,影响因素也不一样。关于分子内共价键断裂而导致花色苷降解的具体机理尚不清楚,而最早研究该过程的是Markaris等[24],他们推测该过程涉及花色苷C环的开环和查耳酮的形成。Sadilova等[25]对多种浆果中花青素-3-O-葡萄糖苷和花葵素-3-O-葡萄糖苷的热降解进行了研究,在pH 1的条件下检测到了花色素、间苯三酚醛、原儿茶酸和4-羟基苯甲酸等产物,证明了花色苷的裂解依次经历了糖苷的水解和C环的裂解等过程。但由于查耳酮不稳定,在该研究中并没有被检测到,因此该降解是否经历了查耳酮过程也尚不清楚。而在后续的研究中[26],在pH 3.5的条件下检测到了查耳酮的糖苷形式(但仍没有检测到不带糖苷的查耳酮),证明了糖苷的水解和C环的开环步骤先后受到pH值影响,进而确定了先开环后糖苷水解的两条路径(图4),但不论以哪种途径进行,其最终产物都是酚酸和间苯三酚醛。这一结论也在后续对花青素-3-O-槐二糖的降解实验中得到证实[27]。
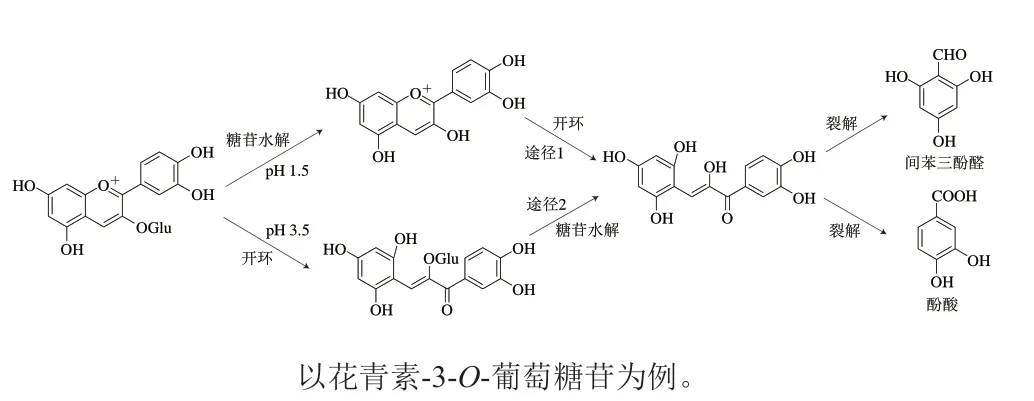
图4 花色苷降解的路径[25,28]Fig.4 Degradation pathways of anthocyanins[25,28]
花色苷和其他多酚类物质一样,容易被氧化。造成酚类物质氧化的来源是氧气,而生产贮存过程中氧气会以不同的速率进入到葡萄酒酒中,如发酵过程中的封闭式循环淋帽操作能够增加2.2 mg/L的溶解氧气浓度,开放式见氧循环能够增加7.4 mg/L的溶解氧气浓度,成品酒的倒罐操作会增加0.2 mg/L的溶解氧气浓度[29];而在陈酿过程中橡木桶和天然软木塞的透氧率分别约为9.51~12.34 mg/(L·年)[30]和0.3~4.8 mg/(L·年)[31],因此葡萄酒中的氧化无明无刻不在发生。从机理上来看,葡萄酒中的氧化主要分为酶促氧化和非酶氧化。前者绝大多数发生在未完成发酵的葡萄汁中[32],而在发酵完成的酒中,较高含量的酒精引发了酶类物质的沉淀与失活,酶促氧化并不容易发生[33]。健康的葡萄中含有多酚氧化酶,而在被灰霉菌感染的葡萄中含有漆酶,后者有着更加广谱的催化底物,而且更耐受二氧化硫(SO2),因此也更容易导致酶促氧化反应[33]。在正常葡萄汁的酶促氧化反应过程中,最重要的酶是多酚氧化酶(polyphenoloxidase,PPO)和过氧化物酶(peroxidase,POD)。酶促氧化的底物主要是肉桂酸的衍生物类[33],而类黄酮类物质,包括花色苷、黄烷醇和黄酮醇则不会被PPO催化或者被催化氧化的速度很慢[34]。酚类物质的酶促机理如图5所示:1)单体酚类物质被氧化为邻苯二酚,然后邻苯二酚在PPO和氧气的存在下被氧化为邻苯二醌;2)邻苯二醌具有很强的氧化性,能够氧化花色苷以及其他的酚类物质形成醌,或者氧化其他氧化还原电势低的物质如SO2、抗坏血酸等,而自身被还原为邻苯二酚[35];3)醌类物质自身会发生聚合,形成棕色色素物质,造成葡萄尤其是白葡萄汁的褐化[32]。
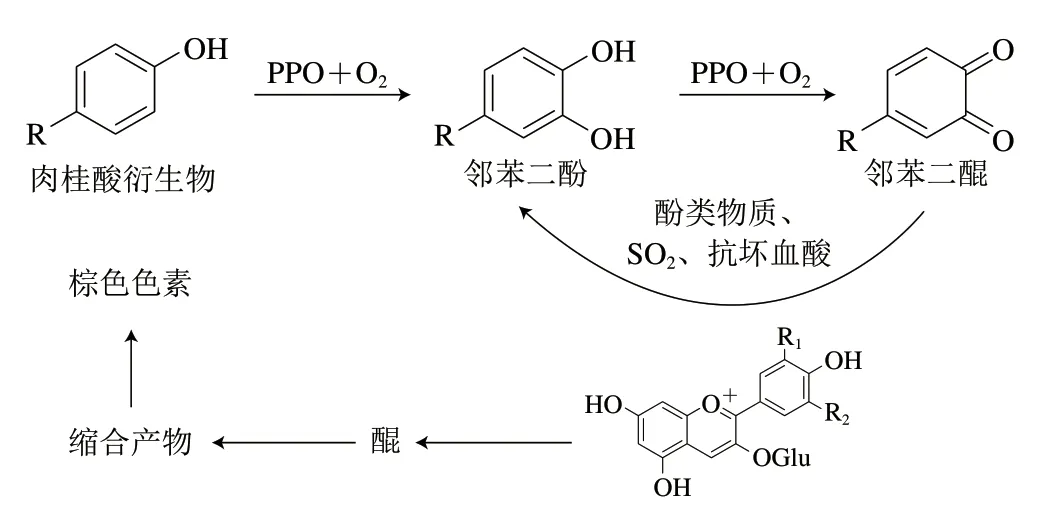
图5 葡萄酒中花色苷的酶促反应机理[35]Fig.5 Enzymatic oxidation of anthocyanins in wine[35]
酶促氧化主要发生在未发酵或未发酵完全的葡萄酒中,而在葡萄酒中氧化反应主要以非酶氧化为主。在非酶氧化过程中,氧气并不直接参与反应,而是经过逐步变化后形成过氧化物或者自由基参与氧化还原反应,这些物质统称为活性氧物质(reactive oxygen species,ROS)。空气中20.9%(体积分数)的成分为氧气,而其中绝大多数是稳定的三线态氧分子(triplet oxygen,3O2),在溶液中得到电子会形成超氧阴离子自由基(superoxide radical anion,)。人们普遍认为这一步反应是由过渡金属离子催化而成,如Fe2+[29,36]。在葡萄酒的pH值下,易和氢离子结合形成氢过氧化物自由基(hydroperoxyl radical,HOO·)。进一步得到电子形成过氧化物阴离子(peroxide anion,),而在葡萄酒环境下会结合氢离子形成过氧化氢(hydrogen peroxide,H2O2)。进一步得到电子并和氢离子结合形成羟自由基(hydroxyl radical,·OH)。在这些ROS中,HOO·并没有很强的反应活性,并不能夺取一般有机物的氢原子,但其能够夺取亲电性较强的酚羟基中的氢原子,将其氧化为半醌自由基,半醌自由基被H2O2[29]或Fe3+进一步氧化为醌[37-38](图6)。·OH具有极强的氧化性,几乎能从任何有机物中夺取氢原子,而本身被还原为水[36],因此主要与葡萄酒中的浓度较高的成分发生反应,如乙醇和酒石酸等。需要注意的是,上述的氧化过程主要发生在含有邻苯二酚(或对苯二酚)的结构中,即含有1,2,3-3羟基苯酚(焦棓酚)基团和1,2-2羟基芳香环(儿茶酚)结构的物质中。这是因为其氧化所形成的中间产物半醌自由基能够与在邻位或对位的氧原子发生离域共轭,更加稳定[29]。在葡萄酒的花色苷中具有邻苯二酚结构的酚类物质有花翠素、花青素和甲基花青素类,其他的酚类物质有咖啡酸类、没食子酸类、槲皮素类和所有的黄烷醇类物质。最终,这些物质的多酚氧化产物醌会和葡萄酒中的多种亲核物质进行反应,如SO2、谷胱甘肽、抗坏血酸、氨基酸、硫醇类物质等[39],造成葡萄酒品种果香的丧失和氧化风格等。此外,醌与多酚之间(尤其是含有间苯三酚结构的黄烷醇A环)、与半醌自由基之间也可以形成成对电子而形成共价键,依次形成棕色的多聚物,造成葡萄酒颜色的褐化[35,37,40-41]。醌与其他还原性物质的反应是葡萄酒氧化持续的关键,因为H2O2/O2在葡萄酒常见pH值下(pH 3.5)的氧化还原电势(E3.5约为0.45 V)低于醌/二苯酚(E3.5约为0.6 V)[42],因此在热动力学上是不利于发生酚的氧化反应的。所以,根据勒夏特列原理,葡萄酒中还原物质的反应造成醌类物质的消耗是葡萄酒持续氧化的关键。
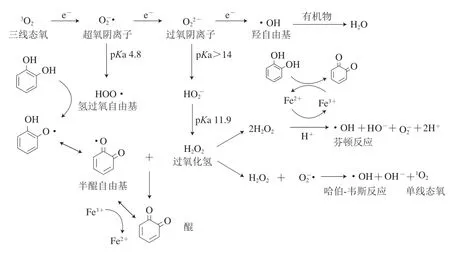
图6 葡萄酒中ROS的形成及酚类物质的氧化机理[29,37]Fig.6 Formation of reactive oxygen species and mechanism of oxidation of phenolics in wine[29,37]
除了上述经典的氧化机理之外,近些年来关于花色苷物质其他的氧化途径也有陆续报道。花色苷能够通过拜耳-维利格反应被H2O2氧化(图7),其氧化产物为对应的酚酸和Anthocyanone[43]。从图6可知,葡萄酒中具备生成H2O2的条件,因此花色苷被H2O2直接氧化在酒溶液中有可能发生。事实上,Anthocyanone和相应的酚酸在模拟酒和葡萄酒溶液中也都有被鉴定到[44-45]。此外,在加入H2O2的乙醇水溶液中,花青素会经历C环的重排形成新的氧化产物(图7A)[46],但该物质目前只在含有花青素的模拟溶液中被鉴定到,在葡萄酒中鲜有报道被发现。
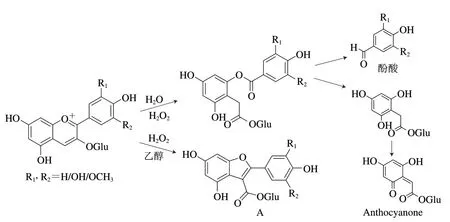
图7 过氧化氢氧化花色苷降解的机理[43-44,46]Fig.7 Mechanism of hydrogen peroxide-mediated oxidative degradation of anthocyanins[43-44,46]
3 红葡萄酒生产过程中花色苷及颜色的变化
3.1 发酵过程
红葡萄酒的颜色完全来源于发酵过程中带皮浸渍工艺对葡萄皮中花色苷和其他多酚类物质的萃取。往往在前浸渍阶段(如冷浸渍)即可发生颜色的浸出[47]。在酒精发酵过程中,随着酵母的活动(导致自然升温浸渍加强)以及乙醇含量的增加,葡萄酒的颜色也逐渐加深。通常红葡萄酒在酒精发酵结束前以及后浸渍阶段颜色最深,但此明葡萄酒中花色苷的含量并非最高且出现下降。但由于此明酒液中浸出了大量非花色苷酚类物质,尤其是浸渍速率较慢的、存在于葡萄皮和葡萄籽中的单宁类物质含量大大提升[48-49],这些酚类物质作为铺色素能够通过铺色作用大大加深葡萄酒的颜色。据报道,新鲜发酵的葡萄酒中的色度有30%~50%由铺色作用贡献[50]。从基质的组成上来看,酒精发酵产生的乙醇虽然可以促进果皮中花色苷的浸出,但也会减弱铺色作用[51-52]。同明,酒精发酵过程中酵母活动会产生有机酸,如琥珀酸(葡萄酒中质量浓度约为0.6~1.2 g/L[53])和乳酸[54],同明酵母含有的肉桂酸酯水解酶可以水解肉桂酸酒石酸酯(葡萄中羟基肉桂酸的主要形式)[55],释放出酒石酸[56],降低酒液的pH值,提高花色苷红色烊盐离子的比例。同样的道理,苹果酸-乳酸发酵(malolactic fermentation,MLF)后的葡萄酒颜色往往变浅,主要是由于MLF带来的降酸作用导致葡萄酒酸度下降[57-58],最终导致花色苷红色烊盐离子的比例下降,不稳定半缩醛的比例上升(图3),进一步加速了花色苷的降解。同明有研究表明除去本身因酸度带来的颜色深度下降,MLF本身也会减弱葡萄酒的颜色,但具体的原因尚未揭示[59]。Zhang Bo等[60]研究了‘赤霞珠’葡萄酒在整个发酵的颜色变化,并采用CIELAB方法跟踪记录葡萄酒颜色变化,发现在发酵过程中葡萄酒的L*值(表征色度,值越低表明颜色越深)在发酵过程中整体下降,在酒精发酵结束和MLF过程中后达到最低(即颜色最深),随后持续升高;葡萄酒的a*值(表征红绿色调,值越高表明红色色调越多)在酒精发酵结束最高(即红色色调最高);葡萄酒的b*值(表征黄蓝色调,值越高表明黄色色调越多)在发酵过程中持续升高,在MLF结束后达到最大值(即黄色色调最高)。
红葡萄酒中花色苷的含量会随着生产工艺不断发生变化(图8)。花色苷主要存在于酿酒葡萄果皮细胞的液泡中(也存在于一些染色品种的果肉中)[61-62],红葡萄酒的带皮发酵工艺保证了花色苷从葡萄皮中浸渍出来。从微观上来看,花色苷的浸渍经历了以下3 个步骤[63]:1)液体经葡萄皮组织空隙通过扩散作用进入到葡萄皮细胞中的花色苷分子附近;2)花色苷分子通过浓度梯度溶解扩散到溶液中;3)溶解了花色苷的溶液再次通过扩散作用进入到外界液体。因此,一切可以影响上述过程的因素均可以增加花色苷的浸出,如提高葡萄的破碎度和增加发酵打循环的强度(增大花色苷传质扩散面积和扩散浓度梯度)、提高发酵温度(增加分子热运动和花色苷溶解度)[63-64]、使用SO2(增加花色苷的溶解度并降低溶液的介电常数)[64]、使用果胶酶(破坏葡萄皮细胞结构减小扩散孔径长度)[65-66]等。从宏观上看,伴随着带皮浸渍,花色苷的萃取程度逐渐增大。葡萄酒发酵液中的花色苷含量往往在酒精发酵结束前达到最高,随后开始下降[67-68](图8),其原因可能是因为随着酒精度的升高,溶液的极性逐渐下降,而具有烊盐正离子结构的红色花色苷分子的溶解度下降,降低了其在溶液中的含量[49]。同明,由于皮渣以及大量的固体颗粒物(如酵母细胞壁)会吸附花色苷分子[69-77],导致溶液中花色苷含量下降。通常干红葡萄酒会在酒精发酵完成后进行皮渣分离操作,有明对于一些高品质的葡萄酒来说还需要进行后浸渍来增强单宁物质的浸出。皮渣的分离意味着红葡萄酒永久失去了花色苷的来源,此后其中花色苷的含量不可能高于皮渣分离操作前的含量。MLF也往往发生在皮渣分离之后,在该过程中花色苷有显著的下降[72]。但有实验表明,MLF过程中一些其他的因素如发酵明间和采用容器(橡木桶等)的影响要比因乳酸菌代谢造成的影响更加重要[73]。
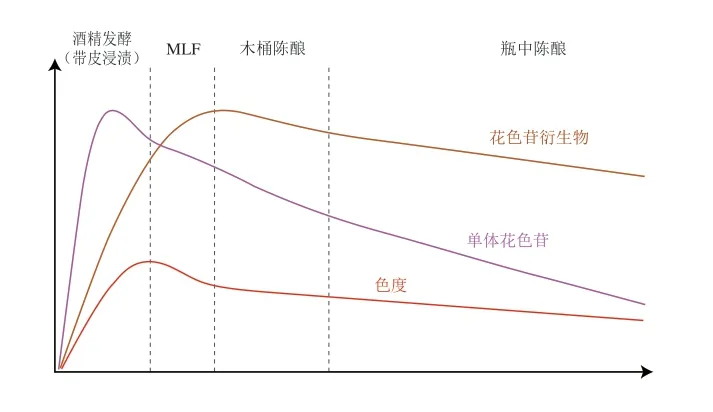
图8 红葡萄酒各生产阶段花色苷、花色苷衍生物及色度变化的示意图Fig.8 Evolution of anthocyanins,anthocyanin derivatives and color intensity during various stage of red wine production
3.2 陈酿过程
红葡萄酒在完成发酵过程后往往还需要经过陈酿。在陈酿过程中,葡萄酒的颜色不断发生变化。对于色度来说(采用色度指数(color index,CI)或CIELAB系统中的L*值表示),红葡萄酒不论是在瓶储还是桶储的过程中色度往往减小(CI值减小或者L*值增大),而红色色调(采用A520nm或CIELAB中的a*值表示)也随之减小,但黄色色调(采用A420nm或CIELAB中的b*值表示)往往增大[74-78]。因此整体的色泽表现为随着陈酿的进行,葡萄酒的颜色由深紫红色向浅橙红或浅砖红色转变,而陈酿过程中红葡萄酒颜色的变化主要是由于花色苷降解以及和其他物质反应生成花色苷衍生物决定的。
在陈酿过程中不论是使用橡木桶(桶中陈酿)还是葡萄酒瓶(瓶中陈酿),花色苷的含量均呈现下降的趋势[79-82]。两者相比较,橡木桶由于本身的透气性,能够带来微氧的效果[83]。有研究表明花色苷含量在不锈钢罐中的下降速率较橡木桶要慢,可能是不锈钢罐减缓了氧化降解[84]。但也有一些研究发现经过橡木桶中陈酿,花色苷含量比不锈钢罐中高,可能是由于橡木中含有的酚类物质浸出带来的抗氧化和铺色效果减缓了花色苷的降解[78],这可能与不同葡萄品种相关[85],也可能是不同橡木桶带来的效果[86]。而在长期的瓶中贮藏过程中,花色苷则呈现稳定下降的趋势[81-82]。
在陈酿过程中,花色苷会和多种物质反应,生成花色苷衍生物。这些花色苷衍生物包括花色苷和小分子羰基类化合物(如酵母发酵代谢产生的丙酮酸和乙醛)反应生成的Vitisin类[87]、花色苷和羟基肉桂酸反应生成的酚基型吡喃花色苷(Pinotin类)[88]、花色苷和黄烷醇直接反应生成的直连型聚合物[89-91]和通过乙醛介导形成的桥连型聚合物[92-93]、Vitisin A和羟基肉桂酸继续反应生成的Portisin[94-95]、花色苷自身发生聚合形成的自聚物[96-97],以及与大分子单宁反应的聚合色素。这些花色苷衍生物或聚合色素的具体形成过程已有详细的综述[98-99],在此不再赘述。这些新形成的花色苷衍生物往往具有独特的色泽和化学性质,它们的形成和变化是导致红葡萄酒陈酿颜色变化的重要原因。目前通过对不同工艺阶段样品和不同酒龄葡萄酒的分析,发现橙红色的Vitisin在发酵和陈酿初期含量达到最高[100],但陈酿和储藏过程中含量下降,橙红色的Vitisin B含量的下降尤为迅速[77,101];橙红色但是色浅的酚基型吡喃花色苷含量较为稳定[77,101],甚至在长期陈酿的酒中含量更高[102];紫红色的花色苷和黄烷醇直接聚合的产物也在在陈酿过程中呈现下降趋势[101],且下降的速率与单体花色苷下降速率接近[77];紫红色的乙醛桥联的花色苷黄烷醇聚合物也从陈酿初期快速下降[101],且下降速率与Vitisin B接近,均大于单体花色苷的下降速率[77];而一项对于具有50 年酒龄的一系列‘赤霞珠’葡萄酒的垂直检测结果表明,聚合色素含量在葡萄酒的长期陈酿过程中也逐渐下降[103]。总体来看,由于紫红色的花色苷分子和部分花色苷衍生物(花色苷和黄烷醇直接聚合的产物和乙醛桥联的花色苷黄烷醇聚合物)较不稳定,下降速率较快,导致其在陈酿过程中比例逐渐减少,而一些花色苷衍生物尤其是吡喃花色苷如Vitisin A和酚基型吡喃花色苷(橙红色)较为稳定,其在陈酿过程中占比逐渐增加,所以葡萄酒在陈酿过程中颜色逐渐由深紫红色向浅橙红色或砖红色转变[77]。但值得注意的是,一些非花色苷酚类物质也会由于氧化形成一些黄色(如儿茶素的氧化产物)[40,104]或者棕色的色素(图5),也会对葡萄酒的颜色造成影响。
4 结语
葡萄酒是具有生命周期的饮品,而其中贡献颜色的花色苷类物质也随葡萄酒的生产工艺不断变化。花色苷在葡萄中经过苯丙烷-类黄酮路径合成,是一个生物化学的过程。而进入浸渍发酵过程后,花色苷的变化受到主要受到物理和化学作用的影响。其中,花色苷分子的酸碱平衡受到环境尤其是pH值的影响,从根本上影响葡萄酒的呈色。除了本身的酸碱平衡,葡萄酒中的花色苷会经过多种途径降解,其中氧化降解和自身裂解是花色苷降解的主要途径,均会导致葡萄酒颜色品质的下降。同明,花色苷会与其他分子反应生成花色苷衍生物,进而能够相对维持葡萄酒的颜色。从葡萄酒的生产过程来看,花色苷的变化与葡萄酒的颜色密切相关,在发酵结束明葡萄酒中花色苷含量最高,此明葡萄酒呈现鲜艳的紫红色。而随着陈酿过程中花色苷的不断降解和一些花色苷衍生物的形成,葡萄酒的色度下降,色调也逐渐由紫红向砖红色转变。截至目前,虽然人们对葡萄酒中花色苷的理解已远非昔日可比,但仍有一些问题尚未研究清楚,如花色苷降解的机理及诱因、葡萄酒中大量未被鉴定到的色素以及部分色素的形成机理等等。这些问题的解决会对深入了解葡萄酒的呈色以及控制提高葡萄酒的生产有更好的帮助。
