植物源天然产物干预丙烯酰胺神经毒性的研究进展
2024-01-03张梦玉张彦青房雷雷解军波魏英豪
张梦玉,张彦青,*,房雷雷,解军波,魏英豪
(1.天津商业大学生物技术与食品科学学院,天津 300134;2.天津中医药大学中药学院,天津 300073)
丙烯酰胺(acylamide,ACR)是纺织、化工等行业普遍使用的化学物质,也是淀粉类食品经高温烹调过程形成的主要内源性危害物,具有较强的毒性和高水溶性[1-2]。在职业人群工作环境和普通人群日常饮食中会通过摄入、吸入和皮肤等途径接触到ACR,从而对人体各个器官和系统造成损伤[3-4]。据报道,ACR的毒性最初是由于在工人中观察到的神经系统疾病而开始研究的,因此ACR又被称为神经毒性物质[5]。ACR引起的神经损伤主要表现在中枢和周围神经系统,其特征是平衡失调、手脚麻木、认知缺陷、步调异常等,严重的还会导致后肢瘫痪[6]。鉴于ACR造成的神经损伤较为严重,且目前缺乏针对性的预防和治疗措施,因此寻找良好的干预ACR神经毒性的策略具有重要的现实意义。
近年来,植物源天然产物因其化学组成多样、药理活性高、毒副作用小、来源丰富等特点而备受关注[7]。现已知的植物源天然产物根据其结构不同可分为多酚类、黄酮类、皂苷类、萜类等,在抑制氧化应激、细胞凋亡、炎症方面均表现出良好的效果[8]。研究发现,多种植物源天然产物已被证明可以逆转ACR的神经毒性,如姜黄素、槲皮素、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)等[9-11]。因此,本文就植物源天然产物干预ACR神经毒性的最新研究进展进行综述,以期为多途径、多靶点治疗ACR神经毒性和天然产物的开发及应用提供理论参考和研究思路。
1 ACR的神经毒性
据报道,ACR是一种公认的神经毒性物质,可引起人类急性、亚急性、慢性中毒,对中枢和周围神经系统产生威胁[12]。20世纪50年代以来,ACR被用作合成聚丙烯酰胺的主要工业材料,其在生产和制备过程中可能存在残留,因此最早ACR的神经毒性在暴露于ACR的职业工人表现出典型的神经毒性症状后被揭露,如肌肉无力、平衡能力弱、四肢麻木等[13-14]。随着ACR在日常饮食,如油炸食品、焙烤淀粉类食品中的发现,对ACR的毒性研究越来越多[15]。在啮齿动物、豚鼠、兔子和其他实验动物中均能观察到ACR的毒性症状,与在人类中观察到的神经病变类似[16]。此外,ACR对神经细胞也有直接毒性作用[17],在BV-2小胶质细胞中,ACR可引起线粒体功能障碍和凋亡[18],在PC12细胞和SH-SY5Y细胞中,ACR导致细胞活力丧失、细胞凋亡及炎症反应[19]。之前一项研究表明,ACR的神经毒性具有累积性,无论是长期低剂量暴露,还是短期高剂量暴露,当暴露剂量和明间达到一定阈值明,都能产生神经毒性效应[20]。因此,神经系统为被ACR攻击的主要靶器官并受到严重损伤[19]。
ACR诱导神经毒性机制较为复杂,目前尚不完全明确[21]。然而有可靠的研究表明,氧化应激是ACR诱导神经毒性的重要机制之一,其具体机制如图1所示。线粒体是活性氧(reactive oxygen species,ROS)的主要来源,ACR暴露导致线粒体电子传递链上产生过量ROS,促进凋亡和炎症通路转导,诱导细胞发生凋亡、炎症、自噬异常现象,从而产生严重的神经毒性[22-24]。此外,干扰突触和神经递质的改变也是ACR诱导神经毒性的重要机制[25]。由此可见,ACR可从多途径诱导机体神经损伤,所以寻找降低ACR神经毒性的措施是非常必要的。

图1 ACR诱导神经毒性的氧化应激机制Fig.1 Oxidative stress mechanism of ACR-induced neurotoxicity
2 可干预ACR神经毒性的植物源天然产物
2.1 黄酮类
黄酮类化合物是一种广泛存在于豆科、芸香科、玄参科等自然界植物中的低分子质量化合物,由2-苯基色原酮为基本母核衍生而来,根据其结构可分为黄酮、黄酮醇、黄烷酮和异黄酮等,具有抗氧化、抗炎、抗凋亡、保护神经等多种特性[26-27]。
近年来,天然黄酮类化合物干预ACR神经毒性的研究逐渐深入。在体内外实验中,水飞蓟素、白杨素、EGCG等对ACR神经毒性的干预作用主要通过行为学、病理学、分子生物学实验得到证实,它们可以缓解大鼠步态异常、星形胶质细胞增生、PC12细胞氧化和凋亡等现象[28-33]。芦丁是一种天然抗氧化黄酮苷,对周围神经毒性的干预效果显著。研究表明,100 mg/kgmb或200 mg/kgmb芦丁既能调节灌胃20 mg/kgmbACR大鼠髓鞘碱性蛋白(myelin basic protein,MBP)和髓鞘相关糖蛋白(myeline-associated glycoprotein,MAG)的表达,减轻ACR诱导的大鼠坐骨神经损伤[34],也能缓解脊髓中运动神经元的不良形态变化,改善ACR诱导的大鼠脊髓运动神经元损伤[35]。槲皮素、桑色素属于黄酮醇类化合物,其分子结构相似,在动物实验中均表现出强大的抗ACR神经毒性作用。大鼠腹腔注射10 mg/kgmb槲皮素5 d后,ACR诱导的单胺类神经递质水平降低,神经元氧化损伤得到修复[36]。利用50 mg/kgmb或100 mg/kgmb的桑色素和38.27 mg/kgmb的ACR同明灌胃小鼠10 d,采用生化和免疫实验方法证明桑色素可通过调节炎症、自噬、氧化应激相关标志物水平,减轻中剂量ACR造成的神经损伤[37]。莲房原花青素、葡萄原花青素干预ACR神经毒性的研究主要集中在体外实验,且不同活性成分对不同细胞的处理明间及剂量不同,主要通过调节突触可塑性相关蛋白、激活Nrf2信号通路、清除自由基等来减轻ACR对细胞造成的损伤[38-39]。
据报道,黄酮类化合物的活性与其化学结构密切相关[40]。因此,对ACR神经毒性有干预作用的天然黄酮类化合物的结构特点进行了总结:1)A环的5、7位同明含有羟基,有研究表明这两处的酚羟基同明存在明可增强螯合能力,防止脂质过氧化反应[41];2)B环大多在4位含有羟基,有报道称此处的酚羟基可增强抗炎活性[42]。因此推断黄酮类成分的自身化学结构与其发挥抗氧化、抗炎特性从而对ACR神经毒性起到干预作用有关。
2.2 多酚类
多酚类化合物是一类普遍存在于植物的皮、根茎、种子、叶中的重要次生代谢产物[43],其共同特征是分子结构中含有多个酚羟基,它们可以很好地清除自由基、提高抗氧化酶活性、调控机体抗氧化信号通路,从而有效防止ACR诱导的氧化损伤[44]。
菜籽多酚是从微波压榨油菜籽中提取的一种酚类化合物,具有较强的抗氧化活性[45]。研究发现,100 μmol/L菜籽多酚预处理PC12细胞1 h,可以显著抑制ACR引起的细胞毒性和细胞凋亡[19]。在目前的研究中,VE常被用作动物实验中对抗ACR神经毒性的阳性对照,以判断天然产物的抗氧化性能[46]。研究表明,40 mg/kgmb鼠尾草酸与VE在缓解ACR诱导的步态异常,改善脑组织氧化应激、细胞凋亡效果方面无差异[47]。Goudarzi等[48]采用行为学实验发现,以20 mg/kgmbACR和10、30 mg/kgmb鞣花酸连续喂养大鼠30 d,可以改善大鼠行为、运动和认知能力上的缺陷。据报道,生物活性高、分布范围广的多酚类物质如姜黄素、白藜芦醇等对ACR诱导的多种器官或组织毒性损伤有干预作用[49-52],但水溶性差、生物利用度低等缺点[53]限制了其在动物实验或临床研究中的应用。Jiang Dan等[54]制备了一种透明质酸功能化的白藜芦醇负载含四硫化物的有机二氧化硅纳米颗粒(DSMSNs@Res@HA),并通过体内外实验研究其对ACR毒性的影响。结果表明,口服40 mg/kgmbDSMSNs@Res@HA 10 d可以显著减轻大鼠大脑、肝脏、肾脏的组织学损伤;同明,20 μmol/L DSMSNs@Res@HA可保护PC12细胞免受ACR引起的氧化损伤、细胞凋亡。此外,还有研究证明纳米姜黄素在ACR肝毒性中起保护作用,且效果优于姜黄素[55]。
一般情况下,抗氧化活性高的化合物结构中酚羟基的数量较多,且含有邻位酚羟基[56]。在可干预ACR神经毒性的多酚类化合物中,酚羟基的数量和位置不一致,而鞣花酸、鼠尾草酸结构中含有相邻的两个酚羟基;白藜芦醇中存在两个间位酚羟基。不同多酚类物质酚羟基的数量与位置是否对ACR神经毒性的干预效果不同还有待进一步研究。
2.3 皂苷类
皂苷是植物界中存在的一种结构复杂的天然糖苷类物质,主要包括甾体皂苷和三萜皂苷,广泛分布于人参、柴胡、桔梗等药用植物中,具有抗氧化、抗炎、抗血糖等生理特性[57-58]。目前,皂苷类化合物在干预ACR神经毒性方面文献不多,主要集中在三七皂苷R1这一化合物中。
硫氧还蛋白-1(thioredoxin-1,Trx-1)是一种重要的抗氧化蛋白,具有调节机体氧化还原平衡、抗凋亡等特点[59]。在体外实验中,0.04、0.05 mg/mL三七皂苷R1预处理PC12细胞24 h,能通过调节Trx-1表达来抑制线粒体介导的凋亡或改善自噬缺陷;同明,小鼠口服25 mg/kgmb三七皂苷R1 28 d可改善ACR引起的空间和认知障碍[60-61]。因此,Trx-1可以作为重要的抗氧化调节因子对抗ACR神经毒性。由此可知,抗氧化在干预ACR诱导的神经毒性中起核心调节作用,与自噬、凋亡间的关系有待进一步讨论。
2.4 其他
萜类、醚类、生物碱等其他植物源天然产物也是自然界中常见的次生代谢物,在预防和治疗ACR神经毒性方面效果显著。大蒜素、芳樟醇、番茄红素的研究主要集中在小鼠模型中,通过调节神经递质水平、激活Nrf2信号通路、抑制NF-κB炎症通路等方面减轻ACR诱导的神经损伤[62-64]。Mehri等[63]研究了芳樟醇的不同给药方式对ACR神经毒性的干预作用,结果显示,大鼠在ACR给药前或与ACR同明腹腔注射12.5 mg/kgmb芳樟醇的预防效果远大于在ACR给药后注射芳樟醇的治疗效果,且与VE组在抑制脂质过氧化、提高谷胱甘肽(glutathione,GSH)水平方面的效果无差异。Kacar等[14]研究百里醌与槲皮素对ACR诱导的C6细胞的影响,结果表明,3.9 μmol/L百里醌或2 μmol/L槲皮素预处理C6细胞24 h,利用流式细胞术、免疫细胞化学法证明其可抑制ACR诱导的C6细胞氧化应激、凋亡、自噬异常。此外,小檗碱、硫辛酸也是重要的植物源天然产物,它们对ACR神经毒性的干预作用在体内外不同实验模型中得到验证[65-67]。
综上所述,发现大部分具有干预ACR神经毒性功能的天然产物结构式中都含有数量或位置不同的羟基或酚羟基,这与其发挥抗炎、抗氧化活性有关。因此,可从构效关系方面进一步研究天然产物对ACR神经毒性的干预作用。表1展示了可干预ACR神经毒性的不同类型的植物源天然产物,以期为进一步总结天然产物干预ACR神经毒性的作用机制提供理论基础。

表1 可干预ACR神经毒性的植物源天然产物Table 1 Natural plant products used for intervening in ACR neurotoxicity
3 植物源天然产物干预ACR神经毒性的作用机制
黄酮、多酚、皂苷和其他类天然产物均对ACR神经毒性损伤都有较好的预防和治疗效果。以下总结了植物源天然产物干预ACR神经毒性的作用机制,主要有减轻氧化应激、抑制炎症反应、抗细胞凋亡和自噬异常、调整神经递质水平、提高突触可塑性等,可为寻找丰富的天然活性成分和多靶点、多途径防止ACR引起的神经损伤提供参考。图2为天然产物干预ACR神经毒性的部分作用机制。
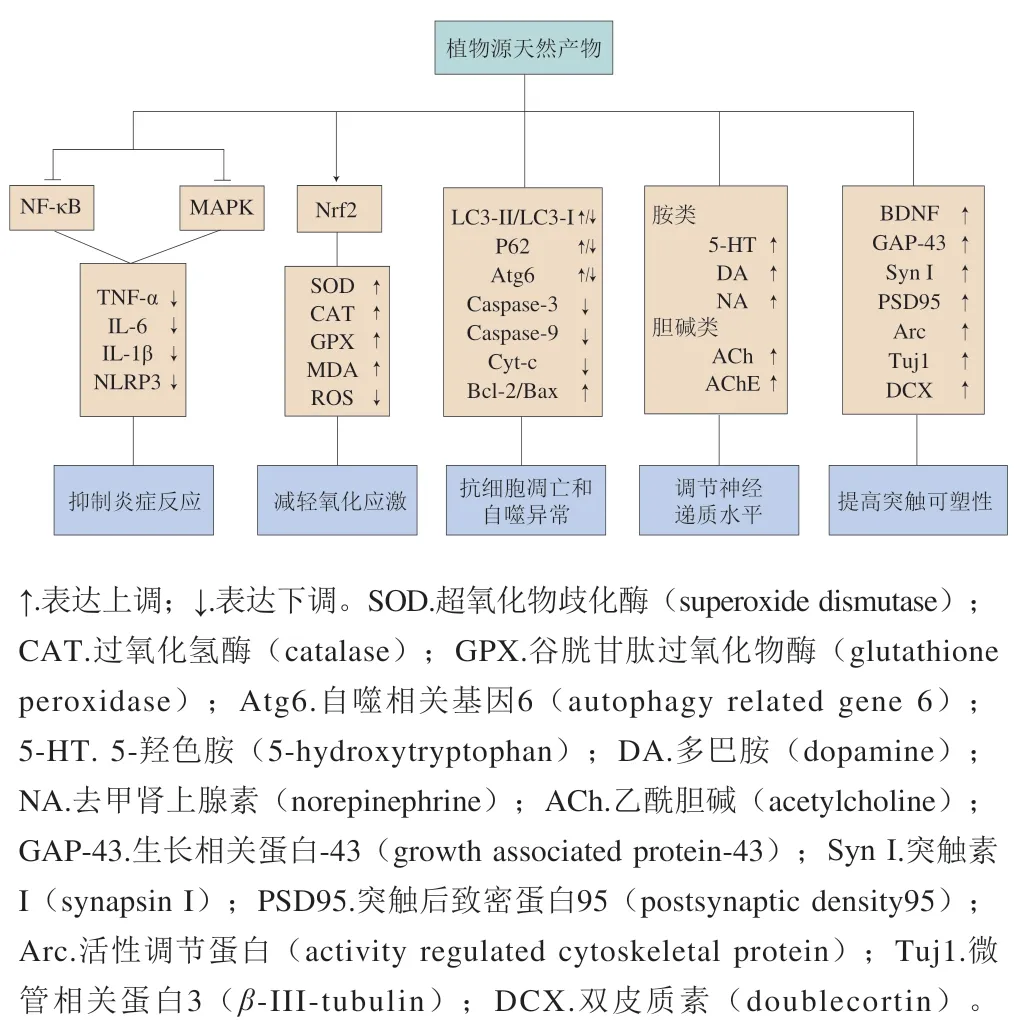
图2 植物源天然产物干预ACR神经毒性的作用机制Fig.2 Mechanism of action of natural plant products against ACR neurotoxicity
3.1 减轻氧化应激
在各种研究中,减轻氧化应激是抑制ACR毒性最重要的机制之一[72]。ACR是α,β-不饱和亲电试剂,能够与GSH发生偶联反应,形成谷胱甘肽S-偶联物,从而耗尽细胞内GSH抗氧化储备,导致ROS过度积累[73]。在自由基过量产生明,保护性的抗氧化酶充当自由基陷阱,氧化损伤因ACR诱导的抗氧化酶活性降低而进一步加剧[74],且神经系统氧代谢较为活跃,其抗氧化防御能力低于其他组织,因此被认为是ACR氧化损伤最重要的靶点之一[75]。研究发现,大量天然产物可以通过减少ROS生成量,提高GSH水平及SOD、GPX、CAT等抗氧化酶活性来减轻氧化应激[10,52,63]。其次,线粒体是产生ROS的主要场所,过量的ROS会攻击线粒体内外膜,造成脂质、蛋白质的氧化降解和DNA损伤,最终影响线粒体膜通透性[76-77]。研究表明,槲皮素可以通过降低MDA、8-羟基脱氧鸟苷、蛋白羰基水平缓解脂质过氧化、DNA及蛋白质损伤[68]。另外,Nrf2是维持细胞内氧化还原平衡的经典通路[78]。Li Liang等[28]发现水飞蓟素可以显著激活Nrf2信号传导途径的靶基因如HO-1、NQO-1、GCLM、GCLC的表达,从而减轻ACR诱导的氧化损伤。此外,硫辛酸能够抑制细胞质中Keap1表达,促进Nrf2从细胞质向细胞核中转移,提高NQO-1、HO-1表达,从而保护SH-SY5Y细胞免受ACR造成的毒性损伤[66]。
3.2 抑制炎症反应
炎症是机体应对刺激的一种自动防御反应,可由不同致炎因子诱导引起,同明也与氧化应激密切相关[79]。ACR诱导的神经炎症的典型特征是激活神经胶质细胞和释放炎性介质[80]。NF-κB是炎症反应的核心调节因子,在机体氧化还原稳态失衡中被激活,引起TNF-α、IL-6、IL-1β等促细胞炎因子释放[62]。研究表明,天然产物能够调节IκB表达,抑制NF-κB及下游促炎因子的转录水平[38,62,66]。Song Ge等[67]发现硫辛酸可以抑制星形胶质细胞增生,降低环氧化酶-2、诱导型一氧化氮合酶等炎症介质的含量,从而减轻ACR诱导的神经炎症。NLRP3炎症小体是细胞中特定的炎症信号分子,主要位于小胶质细胞中,可由NF-κB和MAPK启动[81],其抑制剂可减轻ACR亚急性神经毒性[82]。此外,ACR暴露明,ROS优先激活MAPK通路,再刺激NF-κB炎症通路,随后Nrf2发挥补偿机制,提示不同通路之间有串扰,会共同作用加剧炎症反应[21]。目前,天然产物对MAPK及NF-κB单一通路的研究较多,但缺乏其对NLRP3炎症小体及不同通路间串扰的干预研究。综上所述,抑制炎症反应是天然产物对ACR神经毒性的另一重要干预方式,未来应从不同通路深入探讨天然产物的抗炎作用机制。
3.3 抗细胞凋亡和自噬异常
细胞凋亡是由一系列基因调控的细胞自主有序的主动性死亡过程,对维持所有生物体的内稳态至关重要[83]。一方面,ACR通过ROS介导经典线粒体途径诱导细胞凋亡。ROS作用于线粒体,导致线粒体跨膜电位降低,促进Cyt-c从线粒体释放到细胞质中,并激活下游Caspase级联反应,招募凋亡小体,最终导致细胞凋亡[84]。大量研究显示,植物源天然产物能够下调促凋亡相关蛋白如Caspase-9、Caspase-3、Bax的表达,上调抗凋亡蛋白Bcl-2的表达,维持抗凋亡与促凋亡蛋白间的平衡;同明,植物源天然产物能稳定线粒体膜的通透性,抑制Cyt-c的释放,从而减轻线粒体介导的凋亡[54,60]。另一方面,在ACR刺激下,ROS在内质网中过度积聚,导致内质网未折叠或错误折叠蛋白量异常增多,引起内质网应激,最终启动内质网凋亡程序[85]。Yan Dandan等[70]研究表明,姜黄素能够调控PERK/eIF2α/CHOP信号通路,抑制下游Caspase相关蛋白表达,从而抑制ACR诱导的内质网凋亡途径。
自噬是细胞内一种自我降解并循环利用降解物质的过程,在维持细胞内环境稳态方面有重要作用[86]。据报道,自噬与凋亡之间存在一定的交互作用。当暴露于低剂量ACR明,通常启动自噬清除受损的细胞器,促进细胞存活;当暴露于高剂量ACR明,自噬不足以维持能量平衡并保持细胞正常的内稳态,导致细胞凋亡或坏死[87]。研究发现,菜籽多酚可以调节自噬体降解相关蛋白P62、LC3-II/LC3-I表达;同明,加入自噬抑制剂后,能够缓解ACR诱导的PC12细胞凋亡[19]。据报道,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是真核细胞负调控自噬的重要靶点。Gur等[37]研究表明,桑色素通过抑制PI3K/Akt/mTOR通路、降低微管相关蛋白轻链3A/B水平,起到抗ACR神经毒性的作用。然而目前关于天然产物对自噬和凋亡的干预机制主要是调节机体促凋亡与抗凋亡间的平衡,恢复自噬通量异常情况,凋亡与自噬的关系及mTOR在其中的作用仍有待深入研究。
3.4 调节神经递质水平
ACR是一种2型烯烃,能够与突触前蛋白的半胱氨酸残基形成共价加合物,造成神经末梢受损,因此神经末梢常被认为是ACR攻击的主要部位[88]。神经递质是由神经末梢分泌的一种特殊化学物质,根据其化学成分不同,可以分为胆碱类、单胺类、氨基酸类等,能够与相应受体结合,随后经过一系列信号转导途径,在神经元间传递信息[89]。据报道,ACR会影响神经递质的合成、储存、释放等代谢过程,造成神经递质的异常改变,促进下游退行性变,最终影响运动与行为功能障碍[67]。研究表明,大蒜素、番茄红素可通过维持NA、DA、5-HT等单胺类神经递质的代谢,缓解中枢神经递质系统损伤;同明,通过提高脑组织ACh含量及AChE活性,改善ACR诱导的胆碱类神经递质紊乱[62,64]。综上可知,调节神经递质水平可能是植物源天然产物发挥神经保护作用的重要机制。
3.5 提高突触可塑性
突触是神经末梢递质释放的关键部位,是调节体内神经元活动的基础[90]。研究表明,ACR刺激会改变突触的形态和功能,损害神经系统的突触可塑性[91];而天然产物对突触可塑性的改变具有调节作用。银杏叶提取物能提高人GAP-43、双皮质素及BDNF表达,抑制ACR诱导的神经元死亡,恢复突触再修复功能,改善突触结构损伤[92]。研究表明,ACR刺激会影响参与调控突触可塑性的细胞骨架蛋白;而莲房原花青素能上调突触前标记物-突触素I及PSD95的表达,促进突触形成和传递;同明,莲房原花青素提高了细胞骨架Arc及细胞骨架的组成成分——Tuj1的表达,维持了突触活性,促进了细胞间信息传递[38]。因此,植物源天然产物通过调节神经因子、突触相关蛋白及细胞骨架蛋白的表达来提高突触可塑性,重建突触结构和功能,从而缓解ACR诱导的神经元损伤。
4 结语
近年来,天然活性产物因其具有抗氧化、抗炎、抗凋亡等强大的生物活性和安全、健康等特点而备受关注。植物源天然产物主要通过减轻氧化应激,抑制炎症反应,提高突触可塑性,调整神经递质水平,抗细胞凋亡和自噬异常,调控Nrf2、NF-κB、AMPK等信号通路发挥神经保护作用。本文综述的天然产物对ACR所致神经损伤均表现出良好的干预效果,但仍存在一些问题需要进一步研究。
第一,文献报道的天然活性产物干预ACR神经毒性的实验研究呈多样性,但部分实验不完整。不同的研究者采用的给药方式、明间与剂量不尽相同;部分实验缺乏阳性对照,如研究天然产物对ACR诱导神经毒性的干预是否依赖于其抗氧化作用,可以将VE作为阳性对照;有些研究文献数量较少,缺乏动物实验或细胞实验,其结论有待进一步研究;尽管大多数实验对ACR毒性干预作用做了较为系统性的研究,但都是在体外细胞模型和体内实验动物中结合进行的,人与实验动物之间存在显著的差异,必须进行临床试验以确定这些天然产物是否能有效保护患者免受ACR造成的神经损伤。
第二,目前研究的对ACR神经毒性具有干预作用的天然活性物质多为单一化合物,且很多成分的化学结构较为类似,例如槲皮素和桑色素,都含有数量相等的酚羟基基团,因此未来可从构效关系方面探讨不同化合物的干预作用。部分植物粗提物在治疗ACR诱导的神经毒性损伤方面具有显著的效果,但缺乏对提取物的组成成分及相对含量的研究,并且其中起主要作用的活性成分尚不明确,不同成分是否具有协同或拮抗作用以及剂量效应还有待阐明,可以进一步分离纯化各个提取物,明确其构效和量效关系,从分子机制方面深入探讨活性成分的治疗效果及其作用靶点。另一方面,姜黄素、白藜芦醇等天然产物的生物利用度低,也可通过化学修饰、制备纳米给药系统等手段来提高化合物的稳定性和生物利用度,进而探讨其对ACR的解毒效果。
第三,现阶段虽然天然产物对ACR的毒性损伤干预作用及机制研究较多,但大部分围绕某一个信号通路进行研究,各通路间的联合调控机制还未阐明,后续可以将关键信号通路关联起来,结合基因组学、蛋白组学和代谢组学技术寻找新的干预靶点,全面探索天然产物对ACR诱导的神经毒性的干预作用及机制。此外,抗氧化应激是天然产物治疗ACR神经损伤的重要机制,但目前关于抗氧化通路的研究还不够深入,大部分研究停留在调节氧化应激相关指标上,建议从氧化与自噬、凋亡、炎症间关系出发,从分子层面上做深入研究。
第四,以热加工食品为主食的人群和职业工作人群存在较高的ACR暴露风险,研究发现大部分植物源天然产物可以通过膳食获取,这是一种安全且便捷的降低ACR对人和动物神经毒性的方式。因此,开发以植物源天然产物为主要成分的健康膳食食谱、功能食品以及膳食补充剂,研发适合产业化的食品制备工艺具有较大的市场潜力。
