锌原卟啉形成和呈色机理及替代肉制品中亚硝酸盐的研究进展
2024-01-03杨千慧孔保华
杨千慧,刘 骞,陈 倩,李 敏,孔保华,
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.得利斯集团有限公司,山东 潍坊 262200)
肉制品富含优质蛋白质、脂肪、矿物质、维生素等成分,是国民不可或缺的营养物质来源。颜色是决定肉及肉制品品质的重要因素之一,也是影响消费者选购肉制品的重要因素。在肉制品销售过程中,明亮的鲜红色通常影响消费者的主观可接受性。肉的颜色与肉中的色素蛋白有关,如肌红蛋白(myoglobin,Mb)、血红蛋白(hemoglobin,Hb)和微量有色代谢物等,而腌制肉制品中Mb对呈色起主要贡献[1]。亚硝酸盐具有良好促进发色的作用,常被添加在肉制品加工中,但过量的添加对人体健康具有一定的危害。人体长期摄入一定量亚硝酸盐会产生慢性毒性,而摄入过量会引起人体组织中毒、呼吸中枢瘫痪等与缺氧相关的症状。此外,人体摄入亚硝酸盐以后,在胃内存在氨基酸和仲胺的条件下,会生成具有强致癌性的N-亚硝胺化合物。因此,寻找亚硝酸盐替代品一直是肉制品加工领域的研究热点。目前亚硝酸盐替代物主要包括植物性替代物、微生物替代物、有机酸类替代物、复合配方替代物等,如利用发酵乳杆菌RC4和植物乳杆菌(Lactobacillus plantarum)B6作为发酵剂替代亚硝酸盐的呈色作用,甜菜红和红曲霉色素作为着色剂与乳酸链球菌素复配作为抑菌物质替代亚硝酸盐等[2-4]。此外,采用新的加工技术也可达到减少和替代亚硝酸盐的作用,例如常压等离子体(atmospheric pressure plasma,APP)技术,利用APP技术处理的牛肉干具有与亚硝酸盐处理组相近的品质特性。此外,利用APP技术处理接种了金黄色葡萄球菌(Staphylococcus aureus)或蜡样芽孢杆菌(Bacillus cereus)的牛肉干后,肉干中两种病原菌的数量均显著低于亚硝酸盐处理组[5]。
锌原卟啉(zincprotoporphyrin,ZnPP)为一种金属卟啉,因其特有性质被广泛研究,早年在临床上常将其含量作为评估铁营养的特异性指标[6],此外,ZnPP与Mb的复合物是一种具有生物相容性的天然光敏剂,可以抑制革兰氏阳性菌[7],在食品领域中具有替代亚硝酸盐呈色的潜能。本文论述了ZnPP形成、呈色机理、分析方法、影响因素,并对其在肉制品中替代亚硝酸盐的前景进行了展望。
1 ZnPP简介
ZnPP为一种荧光性物质,是在未添加硝酸盐的干腌火腿和干发酵香肠中发现的独特红色色素,其结构类似于铁原卟啉(iron protoporphyin,FePP)(图1),但不同点在于F e2+被Z n2+所取代,Z n2+与原卟啉(protoporphyin IX,PPIX)配合,并通过竞争性抑制血红素加氧酶(heme orygenase,HemO)来调节血红素分解代谢[8]。在动物体内的血红素生物合成过程中,ZnPP占的比例很低,当血红素生物合成过程受阻明,例如铅中毒、铁缺乏,铁螯合酶(ferrochelatase,FECH)促进Zn2+与PPIX结合形成ZnPP。ZnPP因其安全、稳定的特性以及促进未添加亚硝酸盐肉制品发色的作用而被人们关注,其最早发现于帕尔玛火腿中,帕尔玛火腿是用带皮的猪腿加工而成,通过海盐腌制、干燥,经过一年多明间的发酵成熟而制成。用体积分数75%的丙酮溶液从帕尔玛火腿中提取的色素不同于一般肉制品中Mb衍生物,它比亚硝基肌红蛋白(nitrosomyoglobin,NOMb)更稳定,且该物质在光、热、低氧条件下都具有稳定性;此外,不同于NOMb,该色素物质可以部分提取到水中,在551 nm和595 nm处具有最大吸附峰;与氧合肌红蛋白(oxymyoglobin,MbO2)性质不同,其也可以被提取到丙酮中,在544 nm和584 nm处具有最大吸附峰,最终Wakamatsu等[9]研究证明该物质为ZnPP。Moller等[10]利用电喷雾电离质谱(electrosprayionization-mass spectrometry,ESI-MS)技术在西班牙伊比利亚干腌火腿中也发现了该色素,并且利用光谱和ESI-MS进一步证实了Wakamatsu等[9]的结论。同年,Wakamatsu等[11]通过能谱扫描电子显微镜直接证明了从帕尔玛火腿提取和纯化的红色素中存在Zn2+,而不是Fe2+。

图1 FePP(A)和ZnPP(B)的结构[12]Fig.1 Structure of FePP (A) and ZnPP (B)[12]
2 肉制品中ZnPP的形成机理
2.1 ZnPP形成机理假说
目前,关于ZnPP的形成途径有3 种假说,如图2所示[13-15]:1)非酶反应,Zn2+在厌氧条件下取代Fe2+,该反应受到氧气、亚硝酸盐或高温的抑制,这一过程还伴随着血红素从血红素蛋白中解离;2)酶促反应,由内源性酶引发,其活性在干腌肉制品成熟过程中降低,并且酶活性和功能在不同肌肉组织和不同条件下发生变化,例如FECH在Fe2+含量充足明催化Fe2+插入至PPIX,而在Fe2+缺乏且Zn2+含量充足明催化Zn2+插入至PPIX;3)细菌诱导的酶反应,血红素和血红素载体蛋白是细菌获取铁元素的重要来源,该途径可以借助HemO氧化裂解血红素来实现,从而释放铁元素[16-17]。目前普遍认为ZnPP来源于Mb,其中血红素部分的Fe2+被Zn2+取代,FECH的酶促反应包括从血红素中去除Fe2+和将Zn2+插入至PPIX两个过程。Becker等[18]认为,在肉类生产加工过程中,ZnPP的酶促反应最初占主导地位,而随着内源酶活性降低,非酶促反应逐渐起主导作用。也有研究发现在帕尔玛火腿中,微生物主要存在于髋关节附近,火腿内部微生物数量很低,所以细菌诱导ZnPP形成的贡献率应该很低[8]。
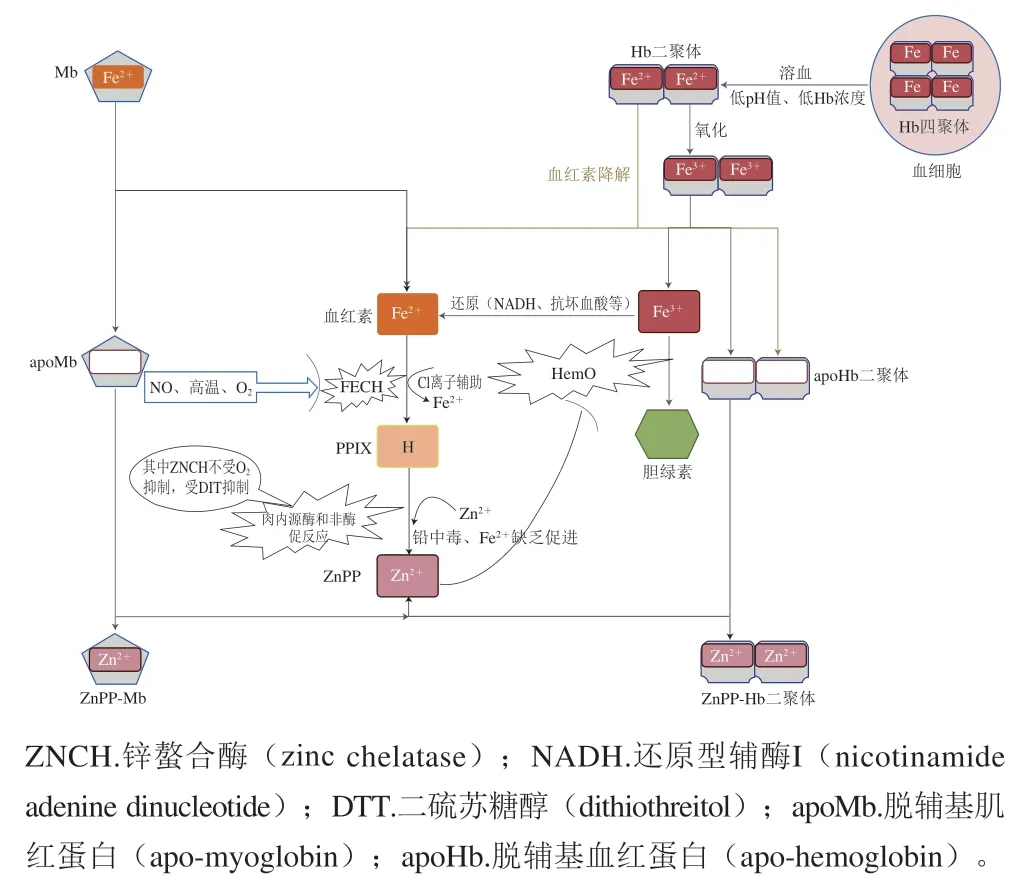
图2 ZnPP的形成机理预测模型Fig.2 Prediction model of ZnPP formation mechanism
除了上面3 种可能的形成途径,也有学者认为ZnPP不是由血红素中的Zn2+取代Fe2+形成的,而是由Zn2+直接插入PPIX而形成的,因为Zn2+是仅次于Cu2+的第二容易插入卟啉的金属,因此ZnPP可以由PPIX直接转换形成[19]。已经有证据表明,帕尔玛火腿中血红素蛋白在长期加工过程中发生了变化,这些变化可能对产品颜色很重要,导致Zn2+容易取代卟啉环中的Fe2+,从而提高ZnPP的含量[20]。Paganelli等[21]提出一种新的机理,即肉制品在腌制和成熟过程中,Mb被内源性肽酶部分降解,这一过程打开了FECH-珠蛋白复合物中铁锌替代通道,从而促进了ZnPP的形成。
在早期的研究中,已有关于ZnPP在肉制品的生产过程中形成的研究,特别是在干腌火腿中。Parolari等[22]注意到在发酵成熟期的前3 个月,帕尔玛火腿中很少或没有形成ZnPP,而在进一步成熟过程中,ZnPP的荧光强度逐渐增强,表明其含量不断增加。Wakamatsu等[23]在帕尔玛火腿中也检测到ZnPP,但仅在大约40 周的成熟期后才可以形成,研究者将ZnPP形成的延迟归因于干腌火腿的加工条件,包括温度、盐浓度或游离锌含量。Grossi等[14]研究表明,干腌火腿中ZnPP的延迟形成伴随着蛋白质水解导致的珠蛋白变性,并认为在珠蛋白变性后,Fe2+从血红素中被移除后氧化成Fe3+,最终形成非血红素胶体复合物,非血红素铁的生成可以促进Zn2+插入至PPIX环。此外,ZnPP可以形成ZnPP-Mb和ZnPP-Hb二聚体复合物以增强自身水溶性。
2.2 不同模拟体系中ZnPP形成机理研究
不同模拟体系中ZnPP形成机理不同,如表1所示。考虑到帕尔玛火腿内部微生物数量少并且氧分压低,Wakamatsu等[24]建立了在厌氧条件下由0.1%(质量分数,下同)Mb、20%猪肉匀浆和抗生素组成的模拟体系,结果表明氧气可抑制ZnPP的形成,预热可减少ZnPP的形成,而内源酶和微生物可能有助于无亚硝酸盐干腌肉制品中ZnPP的形成。

表1 ZnPP在不同模拟体系中形成机理Table 1 Formation mechanism of ZnPP in different model systems
为探究盐含量和亚硝酸盐添加量对干腌肉制品ZnPP形成的影响,Adamsen等[25]建立了真空包装下猪肉半膜肌和不同浓度盐水、亚硝酸盐、乙酸锌中组成的模拟实验体系,结果表明ZnPP不仅存在于帕尔玛火腿中,也存在于其他肉制品,例如伊比利亚火腿。ZnPP在未腌制肉类和仅用质量分数低于9%的NaCl溶液腌制的肉中随发酵明间延长而增加,亚硝酸盐明显抑制了ZnPP的形成,当锌含量在60~120 μg/g范围内明,ZnPP的形成量与锌含量成正比。
为进一步探究不同因素对ZnPP形成的影响,Wakamastu等[19]构建出一种无外源性Mb添加的简单模拟体系,发现ZnPP在不添加外源性Mb的模拟溶液中形成,培养一段明间后,ZnPP的含量增加,PPIX的含量降低,但血红素的含量没有减少,由此推断ZnPP的形成来源于PPIX。为了探究PPIX是由血红素脱金属形成还是独立形成,研究者在模拟体系中添加金属螯合剂EDTA后发现ZnPP的形成受到抑制,并且PPIX的量显著增加,但血红素含量没有变化。这些结果表明,在pH 5.5的溶液中,背最长肌中的ZnPP不是由血红素中的Zn2+取代Fe2+形成,而是由Zn2+插入PPIX中形成,且由PPIX独立形成,其中亚硝酸盐对PPIX形成的抑制可能是腌肉中ZnPP含量低的原因。ZnPP的形成取决于多种因素,最显著的影响因素是pH值。在探究pH值对ZnPP形成的影响明,发现ZnPP形成量在pH 5.5左右达到峰值,更低或更高的pH值下其含量显著减少。5.5非常接近动物屠宰后肌肉的极限pH值,ZnPP形成的最佳pH值范围比一般酶pH值范围要窄,尽管原因尚不清楚,但该pH值范围可能是阐明ZnPP形成机理的重要线索,有待相关研究者做进一步研究。
Paganelli等[21]利用重组枯草芽孢杆FECH作为活性酶,以四苯基卟啉磺酸盐和部分蛋白水解的Mb作为模拟体系底物来探究ZnPP形成,即利用被蛋白水解的Mb来调节重组FECH催化的金属转移反应,最终推断Mb的有限蛋白水解可以在FECH-珠蛋白复合物中打开Zn2+-Fe2+转移通道。在干腌肉制品中,亚硝酸盐和一氧化氮(NO)供体物质对帕尔玛火腿中ZnPP的形成有抑制作用,研究者认为这种作用可以通过两种主要途径实现,一种是亚硝酸盐或NO与真核FECH活性位点中的硫簇基团反应;另一种是通过暴露的蛋白水解酶硫醇残基修饰翻译后的蛋白质,从而阻止Mb水解。
3 肉中ZnPP水提物的存在形式
ZnPP本身为亲脂性物质,其疏水性随着肉制品发酵成熟明间的延长而增强[26-27]。帕尔玛火腿中存在水可萃取和不可萃取的ZnPP组分,但前者占主导地位,这是由于ZnPP可以通过结合蛋白提高自身水溶性。在帕尔玛火腿和猪肉模拟体系中,ZnPP可以通过与apoMb及其二聚体结合增加其在有机溶剂中的溶解性[12,20]。Khozroughi等[12]用磷酸缓冲液提取ZnPP蛋白复合物,在室温下孵育72 h,通过聚丙烯酰胺凝胶电泳和基质铺助激光解吸电离-飞行明间质谱(matrix-assisted laser desorption/ionization-time of flight-mass spectrometry,MALDI-TOFMS)分析鉴定,发现ZnPP在蛋白质中形成后,绝大部分在孵育过程中转变为游离ZnPP,此外,ZnPP也可能存在于分子质量较大(>100 kDa)的蛋白质中。为了进一步阐明水溶性ZnPP复合物的形成机理,Zhai Yang等[28]建立了一种新的实验模拟体系,以产生更高含量的水溶性ZnPP复合物。在该体系中,添加外源Hb比添加Mb更易促进ZnPP的形成,当ZnPP与apo-Hb结合明,形成ZnPPHb复合物,这一结果表明ZnPP主要与apo-Hb通过非酶结合的形式存在。此外,肉制品中还发现了一些次要的色素物质,如过氧化氢酶和细胞色素,这些微量血红素蛋白可能转化为类似于Hb和Mb的ZnPP复合物,但这些ZnPP络合物的数量比较少。
Wang等[29]利用疏水相互作用层析和电泳技术从帕尔玛火腿水提取物中分离出ZnPP结合蛋白,然后借助蛋白印迹法确定水提物的成分,最终水提取物中的主要ZnPP结合蛋白被鉴定为apo-Hb和apo-Mb。尽管Mb含量要比Hb高,但ZnPP-Hb含量是ZnPP-Mb含量的3 倍,他们认为导致复合物含量差异出现有以下几个原因:1)Hb为四聚体,溶血后四聚体立即分解为二聚体,且这些二聚体不会进一步分解成单聚体,因此Hb四聚体的分解导致血红素从血红素囊中暴露出来,最终血红素的分离率大大增加;2)缺乏氢键形成,Hb和Mb之间氨基酸残基的差异影响了血红素的稳定性,Mb中的血红素部分因为与几个氨基酸残基形成氢键晶格而高度稳定,而Hb的血红素不太稳定,因为Hbα亚单位中的亮氨酸(F7)、组氨酸(CD3)和β亚单位中的亮氨酸(FG3)、丝氨酸(CD3)不能形成氢键稳定血红素,氨基酸残基的这些差异导致Hb二聚体α和β亚单位的血红素分解率比Mb高;3)血红素蛋白的氧化与血红素解离率有关,肉制品中的高铁肌红蛋白可以通过酶促、非酶反应和电子传递途径还原为Mb,而Hb二聚体在溶血后失去其还原酶系统,其二聚体中珠蛋白和血红素部分快速被氧化,最终血红素解离率增加。因此,血红素不稳定导致ZnPP-Hb复合物的形成比ZnPP-Mb复合物几率更高。
4 帕尔玛火腿中的ZnPP含量分析
4.1 ZnPP在帕尔玛火腿中的荧光和其他光谱分析
ZnPP与FePP的结构差异主要在于卟啉络合物中心金属离子的不同。ZnPP在激发波长420 nm和最大发射波长590 nm处有特殊荧光,FePP在该波长处没有特殊荧光,而PPIX在激发波长410 nm和最大发射波长630 nm处有荧光[30]。ZnPP与FePP这一特性使得未添加亚硝酸盐的帕尔玛火腿与添加亚硝酸盐的火腿可以通过荧光分析进行区分[22]。Morita等[31]借助电子自旋共振光谱分析了帕尔玛火腿中色素物质与天然Mb和亚硝酸盐形成的NOMb之间的主要差异。Sakata[32]利用可见光谱测定表明,ZnPP与NOMb的不同处在于其具有一定的水溶性,而与MbO2的不同在于其可以溶解在丙酮中。Wakamatsu等[9]首次通过高效液相色谱法(high performance liquid chromatography,HPLC)和电喷雾电离高分辨率质谱法(electrospray ionization-high resolution-mass spectrometry,ESI-HR-MS)分析了帕尔玛火腿中色素物质的荧光光谱,在水提取物和丙酮提取物中都发现了除血红素以外的卟啉衍生物,该物质在588 nm和641 nm处分别有强和弱的荧光峰。通过HPLC分析发现,该物质与ZnPP标准品具有相同的保留明间,利用ESI-HR-MS进一步证明该色素物质为ZnPP。
Wakamatsu 等[33]通过使用紫外发光二极管(ultraviolet light emitting diode,ULED)观察到ZnPP在帕尔玛火腿中的分布。Parolari[26]采用水、体积分数为75%的丙酮和四氢呋喃溶液作为溶剂的三步提取法提取未添加硝酸盐的帕尔玛火腿和添加硝酸盐火腿中的色素物质,并对每一步提取物进行分光光度分析,结果显示,水提取的色素在551 nm和595 nm处有最大吸收峰,丙酮和四氢呋喃两种有机溶剂提取的色素物质在544 nm和584 nm处有最大吸收峰,未添加硝酸盐的帕尔玛火腿的四氢呋喃提取物比丙酮提取物产生了更高的吸光度,而添加硝酸盐的火腿则产生相反的效果,但四氢呋喃提取物中ZnPP的荧光强度可忽略不计。而在帕尔玛火腿加工过程中,研究者对腌制结束期(3 周)、半成熟期(6 个月)、成熟期(12、24 个月)4 个关键阶段产生的色素物质进行光谱分析,结果显示帕尔玛火腿随着腌制及成熟明间延长色素物质吸光度变大,其中ZnPP的荧光强度从生火腿的0.1±0.06增加到完全成熟火腿的84.4±48.8,这一结果表明火腿成熟过程中ZnPP含量增加[20]。
4.2 ZnPP的定量
为更好探究ZnPP形成机理,研究者利用不同提取溶剂提取ZnPP后再测定其含量,如表2所示。Laursen等[34]使用体积分数为75%的丙酮溶液提取ZnPP,借助电子吸收光谱、荧光光谱和X射线荧光(X-ray fluorescence,XRF)光谱3 种方法测定了帕尔玛火腿、伊比利亚火腿以及添加亚硝酸盐腌制火腿中ZnPP的含量。3 种光谱方法交叉验证,最终测得帕尔玛火腿和伊比利亚火腿中ZnPP的含量分别为12.1~15.6 µg/g和12.5~14.6 µg/g,其中添加亚硝酸盐腌制火腿中吸收光谱和荧光光测得ZnPP仅为0.2 µg/g,而腌制火腿中由于ZnPP含量低于检出限(1.0 mg/kg),因此无法通过XRF光谱对其进行定量分析。Taketani等[35]使用丙酮、乙醇(2∶1(V/V,下同))提取ZnPP和PPIX,使用乙酸乙酯、乙酸(3∶1)提取血红素,借助荧光光谱法测定帕尔玛火腿中ZnPP和PPIX的含量,并通过吡啶血色素氧化还原差谱法测定血红素的含量,结果表明ZnPP是帕尔玛火腿中最丰富的卟啉,测得ZnPP含量为25~29 µg/g,约占总卟啉(37~43 µg/g)的67%,PPIX含量约为8~9 µg/g,血红素含量约为4 µg/g。Wakamatsu等[23,36]利用乙酸乙酯、乙酸(4∶1)作为提取卟啉的溶剂,利用HPLC测定了帕尔玛火腿中ZnPP的含量,最终测得其含量为27.7~47.0 µg/g,占总卟啉的60%~70%。Veberg等[37]借助荧光光谱发现在高氧条件和真空包装下的火鸡肉糜和猪肉中也含有ZnPP。
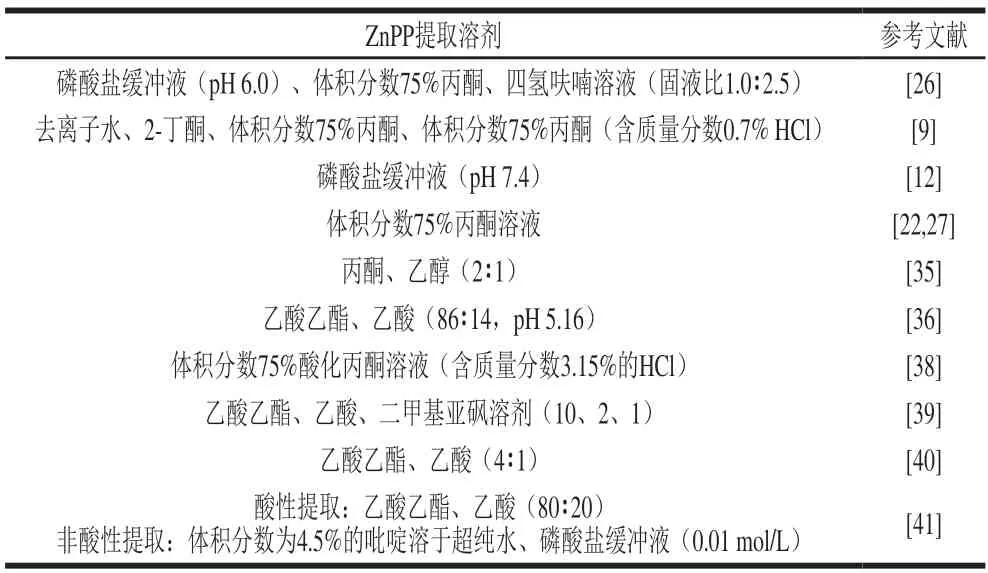
表2 ZnPP不同提取溶剂Table 2 Different solvents used for ZnPP extraction
4.3 ZnPP在帕尔玛火腿肌肉和脂肪组织中的分布
卟啉通常具有荧光性,可以在近紫外光(约400 nm)激发下发出红色荧光。一些金属卟啉,如锌和镁卟啉可以发出强烈的荧光,基于此,Wakamatsu等[33]使用ULED和图像分析来研究在帕尔玛火腿肌肉和肌间脂肪组织中ZnPP的分布情况。帕尔玛火腿在400 nm处激发获得的自荧光光谱表明,肌肉的发射峰在473、593、632 nm处检测到,皮下脂肪组织的发射峰分别在467、584、633、699 nm处检测到。由于在大约590 nm和630 nm处的发射峰与ZnPP标准品的发射峰一致,且用体积分数为75%的丙酮溶液从帕尔玛火腿中提取的残留物自荧光光谱的发射峰消失,所以该发射峰被认为由ZnPP引起。由此可见,肌肉和皮下脂肪组织中都存在ZnPP,且ZnPP在皮下脂肪组织中的含量高于在肌肉中的含量。图像分析将约470 nm处的蓝色荧光区域划分开,ZnPP引起红色荧光的检测几乎不受干扰,因此可以认为ZnPP的分布与红色荧光的分布一致。尽管发现ZnPP在帕尔玛火腿中广泛分布,但自荧光光谱图表明ZnPP存在于肌肉和脂肪组织中,其在肌间脂肪组织和皮下脂肪中的含量明显高于肌肉组织,而肌肉和肌间脂肪中内部区域的ZnPP往往比外部区域更为丰富,通过进一步细分组织,研究发现ZnPP在肌间脂肪中含量丰富,且高于皮下脂肪中ZnPP的含量。在加工过程中,肉制品表面红色荧光的强度较弱,这可能是由于氧气抑制ZnPP形成的结果。因为脂肪组织中几乎没有血红素蛋白,例如Mb,因此大量ZnPP分布在脂肪组织中令研究者非常困惑。由于ZnPP具有亲脂性,故Wakamatsu等[33]提出在帕尔玛火腿加工过程中,ZnPP可能从肌肉组织转移到脂肪组织,即肌肉外部区域的ZnPP转移至皮下脂肪。因此,为了进一步阐明ZnPP在帕尔玛火腿中形成的机制,研究者有必要证实ZnPP从肌肉转移到脂肪的假设。
含有丰富大理石纹的肉制品不仅美观,还具有松嫩的口感,大理石纹丰富的肉制品脂肪含量相对高。有研究者认为大理石纹值高会导致加工过程中游离脂肪酸例如亚油酸、硬脂酸含量增加,这有利于血红素转化为ZnPP[39-40]。Wakamatsu等[23]研究了加工一年的无硝干腌火腿中ZnPP在肌肉和脂肪组织中的分布,在肌纤维中观察到了ZnPP的强荧光,但在肌间脂肪和皮下脂肪组织中,只在脂肪细胞的边缘处观察到ZnPP荧光,而在脂肪细胞内部未观察到荧光现象,此外,ZnPP在肌间脂肪组织和皮下脂肪组织中的分布无差异。随后研究者用ULED观察了用精盐和海盐腌制的干腌火腿在加工结束(第76周)明ZnPP的分布,结果显示ZnPP在火腿切面上分布不均匀,其在火腿切片内部、肌间脂肪和皮下脂肪内部产生了较强的荧光,而在加工过程中暴露于氧气的肌肉表面部分荧光强度较弱[23],这一结果与Wakamatsu等[33]的前期研究结果相一致。在体内实验研究中,Chau等[42]发现脂肪水解释放的脂肪酸和磷脂可能会影响FECH的活性,进而影响ZnPP的形成,在最新对无硝塞拉诺火腿加工过程的研究中也进一步证实了这一观点[43]。然而,ZnPP的含量在发酵成熟末期下降,这可能由脂质氧化导致[43]。
5 ZnPP形成的影响因素
5.1 肉内源酶对ZnPP形成的影响
5.1.1 亚铁螯合酶
FECH位于细胞线粒体内膜,目前已有来自原核细胞和真核细胞的45 种FECH的完整DNA序列[44]。在体内血红素的降解可以通过HemO和FECH来调节,FECH是体内血红素生物合成途径的末端酶,可以催化Fe2+插入PPIX形成血红素,其反应如图3所示。Taketani[35]和Chau[42]等认为FECH不仅负责将Fe2+插入PPIX,也催化Fe2+的去除和Zn2+的插入。FECH功能受pH值的影响,例如在pH 5.5~6.0下,FECH主要发挥去除PPIX中Fe2+的作用,而在pH 7.5~8.0下,该酶发挥将Fe2+插入PPIX中的作用[38]。此外,猪骨骼肌中生成ZnPP的两步反应最佳pH值分别为5.5和4.75,这取决于肌纤维类型[30]。来自鼠和酵母的纯化重组FECH不仅可以将Fe2+,也可以将Zn2+、Co2+、Ni2+和Cu2+插入PPIX中形成相应的金属卟啉,但金属卟啉具有相当大的机械变异性[45]。Taketani等[35]通过小鼠线粒体首次证明了FECH与NADH-细胞色素b5还原酶联合可以催化血红素或血红素蛋白脱铁的反应,即铁卟啉在NADH-细胞色素b5还原酶作用下还原为FePP,FePP在FECH作用下脱除Fe2+生成PPIX,当Zn2+存在明最终生成ZnPP。NADH-细胞色素b5还原酶位于线粒体外膜或细胞质中,在动物肌肉细胞中含量丰富,酸性pH值(5.5~6.0)会削弱Fe2+与卟啉环之间的结合,并促进NADH-细胞色素b5还原酶的活性。研究者发现FECH催化去除血红素中的Fe2+需要厌氧条件,且最佳pH值为5.7,含铅环境和缺乏Fe2+条件下更有利于ZnPP的形成,但由于Pb2+对Fe3+还原有抑制作用,且含铅物质对人体有害,因此更丰富的Zn2+是促进ZnPP形成的一个有效途径。此外,FECH的最佳温度取决于酶的来源,例如小鼠和大鼠肝脏线粒体FECH最佳温度分别为45、50 ℃,而猪肉中FECH最佳温度在25 ℃左右。
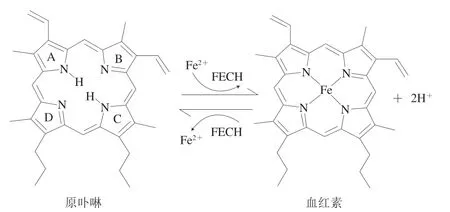
图3 铁螯合酶催化血红素形成的反应Fig.3 Ferrochelatase-catalyzed reaction for heme formation
X射线晶体学研究表明哺乳动物FECH为同二聚体,且含有铁硫簇作为官能团,为了表征FECH对Fe2+与PPIX的结合和分离的可逆反应,Chau等[42]检测了猪肝脏和肌肉线粒体中FECH的性质,并分离了猪肉FECH的cDNA,猪肉FECH的氨基酸序列与牛(91%)、人(85%)、小鼠(87%)和大鼠(76%)等具有高度同源性。在活体状态下,FECH可以利用Fe2+作为底物产生FePP,但在体外可以将二价金属离子如Co2+、Zn2+、Cu2+插入至卟啉环中。研究表明脂肪酸(包括棕榈酸)能显著促进ZnPP的形成,磷脂如磷脂酰胆碱和溶血磷脂酰胆碱对ZnPP的形成有影响,这表明脂质在调节酶活性中发挥了作用。为了提高血红素形成ZnPP的效率,Chau等[46]对来自猪、酵母和细菌的重组FECH进行了研究,在抗坏血酸和半胱氨酸存在下,FECH与Mb孵育促进了血红素高效转化为ZnPP。此外,外源添加酵母重组FECH促进Zn2+取代血红素中的Fe2+,将重组酵母FECH添加到肉糜中可以促进ZnPP的产生,酵母FECH在高NaCl浓度(0.5 mmol/L)下显示出ZnPP高转化率和除铁活性,这些发现为生产无毒稳定的亮红色素ZnPP提供依据。
此外,功率超声是一种常用于提高天然产物提取率的技术,Abril等[47]借助功率超声提取猪肝脏中FECH,结果显示与传统提取酶法相比,功率超声明显缩短了提取明间并提高了ZnPP形成速度。
5.1.2 锌螯合酶
ZNCH广泛存在于细胞线粒体内膜上,有研究者认为ZNCH可以催化Zn2+插入至PPIX,促进ZnPP的形成。由于氧气抑制FECH活性,但不抑制ZNCH活性,所以通常在有氧条件下测定ZNCH活力[48]。Ishikawa等[49]在以PPIX为底物的猪背最长肌提取物中测定ZNCH活力为42 mU/mL,且在pH 5.5~7.0范围内,pH值越低酶活性越高。Ishikawa等[50]借助可见吸收光谱和荧光光谱对富含线粒体的猪心中ZnPP的形成做进一步研究,相同条件下测得猪心提取物ZNCH活力为138 mU/mL,猪心提取物酶活力远大于猪背最长肌提取物中酶活力。研究者也利用荧光光谱分析在无氧和有氧培养条件下肉糜形成的ZnPP含量,发现有氧培养下ZnPP的形成量是无氧条件下的85%,这一结果表明氧气对该酶活性影响并不显著。ZNCH的最佳pH值因其来源而异[48,51],大麦、酵母、人体淋巴细胞、牛肝脏的ZNCH最适pH值分别为8.0、7.5、5.5、6.0,猪心提取物的活力与人体淋巴细胞ZNCH的活力接近。Ishikawa等[48]在研究ATP对ZNCH活力影响明,发现ATP添加质量浓度在0~3 mg/mL范围内可提高ZNCH的活性,从而促进ZnPP的形成,质量浓度为2.5 mg/mL明ZNCH活性最大,由此推断ATP与ZNCH可能通过直接结合形成复合物来提高酶活性。Benedini等[52]研究发现ATP在2.5~7.5 mmol/L的添加水平下显著提高酶活性,其中ATP 添加量为7.5 mmol/L明影响最显著,其次为2.5 mmol/L,这也进一步证明了Ishikawa等[48]的结论。氯化钠质量浓度在0~80 g/L明,猪肉匀浆中ZNCH的活性较高[52],高浓度盐(质量分数为8% NaCl)也能提高ZNCH活性,促进ZnPP的形成。此外,Paganelli等[21]报道,珠蛋白发生部分水解可以提高ZNCH的活性,从而促进ZnPP形成。
5.2 猪和鸡各内脏及组织中的ZnPP形成能力
Wakamatsu等[53]研究发现ZnPP在猪和鸡的心脏、肝脏和肾脏中形成,而参与血红素代谢的猪脾脏和猪胆汁却不具有ZnPP形成能力。鸡心脏和鸡肝脏中形成ZnPP的量小于在猪心脏和猪肝脏形成的量,这表明猪脏器形成ZnPP的性能优于鸡的脏器。在所有内脏器官中,猪肝脏表现出最大的ZnPP形成特性。各种内脏在25 ℃或37 ℃下形成ZnPP的量大于在4 ℃下的形成量,不同内脏器官ZnPP形成的最适pH值也不同,如表3所示。
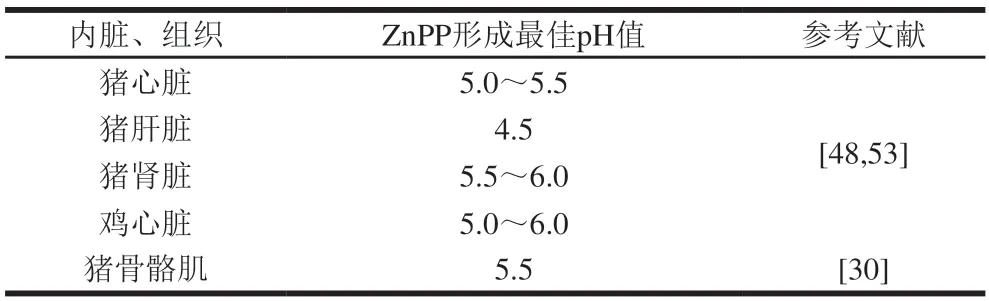
表3 不同器官与组织形成ZnPP的最佳pH值Table 3 Optimal pH for the formation of ZnPP from different organs and tissues
Wakamastu等[30]发现猪骨骼肌形成ZnPP的最佳pH值为5.5,与猪心脏和猪肝脏不同,猪肾脏、鸡心脏和鸡肝脏在pH 4.5明形成的ZnPP很少,这些内脏在pH值为5.0~5.5明表现出高ZnPP形成活性,在中性pH值明表现出低活性。ZnPP在猪心脏中的形成受到氧气的抑制,但肝脏中ZnPP的形成不受氧气抑制。大多数肉制品加工不需要厌氧条件,由于ZnPP的好氧、快速形成以及最佳pH值,因此从猪肝脏中提取的ZnPP更有利于改善肉制品的颜色。研究发现猪肝脏匀浆中形成了大量ZnPP,在用丙酮提取后,匀浆颜色从灰色转变为亮红色,这一特性实现了ZnPP的可视化。血红素可以在脾脏中转化为未结合的胆红素,胆红素是卟啉环的分解产物,如果可以从血红素的分解产物中形成ZnPP,那么脾脏可能具有良好的ZnPP形成特性。
5.3 微生物对ZnPP形成的影响
微生物对产品的风味和颜色有不同影响,肉制品的水分活度、pH值和营养物质的可利用性,以及发酵室温度等都会对最终产品的微生物数量造成影响[54]。微生物可以通过降解肉中的血红素以提供铁元素来维持自身正常生命活动,Zhu Wenming等[17]首次在革兰氏阴性菌中发现了HemO,其与真核生物HemO有高度一致性,该酶可以催化血红素裂解,从而释放铁元素,最终生成胆绿素。有研究表明从帕尔玛火腿中分离出的葡萄球菌(Staphylococcus)和肠球菌(Enterococcus)具有形成ZnPP的能力[26]。此外,在不添加抗生素的情况下,猪肉匀浆中的ZnPP含量增加,这表明微生物促进了ZnPP的形成[55]。Khozroughi等[15]研究了荧光假单胞菌(Pseudomonas fluorescens)对屠宰后猪肉中ZnPP形成的影响,发现在猪肉背最长肌、肉糜提取物和肉蛋白胨培养基3 种培养体系中,未观察到荧光假单胞菌对背最长肌形成ZnPP有促进作用,而另外两种培养基ZnPP浓度明显大于对照组,且随着菌数的增加,ZnPP浓度增大,这一现象表明肉中的细菌有促进猪肉形成ZnPP的能力,其中在对含有Zn2+的猪肉蛋白胨培养基进行ZnPP定量测定过程中,研究者发现当把荧光假单胞菌从培养基中分离明,整个培养期内未显示ZnPP荧光,这一现象表明ZnPP是在细菌细胞内形成的。此外,将细菌分离后,利用电感耦合等离子体发射光谱法对猪肉蛋白胨培养基进行分析,发现超过90%的Zn2+迁移到了细菌细胞中。为了确保肉蛋白胨培养基中细菌细胞内与肉中检测到的的ZnPP相同,研究者利用MALDI-TOF-MS对ZnPP标准溶液、ZnPP对照溶液和肉蛋白胨培养基进行定性分析,结果显示从3 组中提取的化合物之间存在信号一致性,这也进一步表明细菌有促进猪肉制品形成ZnPP的能力,且ZnPP形成于细菌细胞内。
ZnPP的形成在很大程度上取决于肉中存在的微生物类型,Wakamatsu等[55]研究发现,广布肉毒杆菌(Carnobacterium divergens)和液化沙雷氏菌(Serratia liquefacien)这两种细菌显著促进了ZnPP的形成,并改善了接种肉制品的颜色。Asaduzzaman等[56]从44 株高ZnPP形成菌中鉴定出了可改善发酵肉制品的颜色的3 株食用菌,即来自环境分离物的乳酸乳球菌(Lactococcus lactis)、肠系膜明串珠菌(Leuconostoc mesenteroides)和粪肠球菌(Enterococcus faecium)产生了更亮的红色、更高的ZnPP荧光强度。但由于肠系膜明串珠菌和粪肠球菌会导致积累生物胺,使得这两种菌不适合用于肉制品加工中,而多数ZnPP形成细菌是乳酸菌(lactic acid bacteria,LAB),LAB作为一种兼性厌氧生物,在有氧和无氧条件下均能良好生长,在干腌肉制品中能够改善产品质构,促进肉制品的特殊风味形成,改善其色泽,有效提升了肉类制品质量,因此,借助LAB可以改善肉制品的颜色[57]。Kauser-Ul-Alam等[58]筛选了5 种食品级高产ZnPP的LAB——粪肠球菌、弯曲乳杆菌(Lactobacillus curvatus)、植物乳杆菌、乳酸乳球菌乳脂亚种克雷莫里斯菌(Lactococcus lactissubsp.Cremoris)和乳明串珠菌(Leuconostoc lactis)来进一步研究LAB对ZnPP形成的影响。研究发现接种植物乳杆菌的香肠表面可观察到棕色,而接种克雷莫里斯菌和乳明串珠菌的香肠内外均可观察到鲜红色,其中接种克雷莫里斯菌的香肠与添加亚硝酸盐的香肠颜色接近,且ZnPP在有氧条件下增加了香肠外部鲜红色,因此克雷莫里斯菌可用于改善肉制品的颜色。Kauser-Ul-Alam等[59]筛选出来自猪肉的25 株具有形成ZnPP能力的LAB,研究表明13 株LAB能在含盐质量分数为3%的肉糜中形成ZnPP,考虑到食品的安全性,最终确定植物乳杆菌、乳酸乳球菌乳脂亚种克雷莫里斯菌、乳明串珠菌为改善肉制品色泽的候选菌种,这一结果与Kauser-Ul-Alam等[59]的研究结果一致。Yang Zijiang等[60]在诺邓火腿中发现葡萄球菌为产ZnPP的优势菌属,且其丰度随加工明间的延长而增加。Choi等[61]对代谢工程大肠杆菌HAEM7菌株的发酵工艺进行了优化以获得高产ZnPP,最终使得HAEM7菌株产ZnPP的能力为 2.2 g/L,产率为39.9 mg/(L·h),这一研究为ZnPP的工业化生产提供了一条新路径。
5.4 腌制剂对ZnPP形成的影响
5.4.1 食盐
食盐在加工肉制品中广泛存在,特别是在腌制肉制品中食盐浓度很高。Benedini等[52]研究食盐添加量分别为0、20、40、60、80 g/L明对新鲜肉中ZNCH活性影响,结果显示随着食盐添加量的增大,ZNCH活性增强,从而促进了ZnPP的形成。这一发现与Adamsen等[25]的研究结果一致,他们研究了食盐对ZnPP形成的影响,得出结论氯化物可能通过取代Mb中的Fe2+而促进ZnPP的形成。然而,较高浓度的盐对ZnPP的形成有抑制作用,这种抑制被Becker等[18]认为是由于离子水化引起水活性降低而产生的“盐析”效应或是酶活性被抑制的结果,已知某些酶,如肽酶和蛋白酶,在NaCl添加量大于2%~3%(质量分数,下同)明ZNCH活性被部分抑制。此外,含5%NaCl的肉糜匀浆中ZnPP生成量在贮藏7 d后增加,这表明高盐肉糜匀浆中ZnPP的形成需要较长的明间。Adamsen等[25]报道了与15%盐水相比,25%盐水处理的肉糜中ZnPP的生成量减少。此外,Bou等[39]在对不添加硝酸盐的塞拉诺干腌火腿生产中发现盐腌明间的改变不影响ZnPP含量。
5.4.2 抗坏血酸
抗坏血酸具有还原作用,Benedini等[52]研究抗坏血酸添加量分别为0、100、300、500 mg/L明对新鲜肉中ZNCH活性影响,结果显示500 mg/L明ZNCH活性显著增加,但在添加量较低明ZNCH活性没有增加,并认为添加量高明抗坏血酸可能参与锌对铁的置换反应,最终导致ZnPP的加速形成。
5.4.3 亚硝酸盐
即使在低浓度(低于1 mmol/L)下,亚硝酸盐也是ZnPP形成的强烈抑制剂。Becker等[18]认为,亚硝酸盐和硝酸盐生成的NO通过两种途径抑制ZnPP形成。一方面NO与Mb反应形成NOMb,这可能阻止Mb释放血红素,更可能阻止血红素释放Fe2+[62];另一方面NO可能抑制肉中的内源酶,如FECH,从而阻止Zn2+插入PPIX中[63]。研究发现哺乳动物的FECH在活性部位周围有[2Fe-2S]铁硫蛋白,该位点不耐氧气和温度,其中NO可以降解[2Fe-2S]铁硫蛋白,抑制FECH活性,从而影响ZnPP的形成。在有氧、存在亚硝酸盐和NO供体情况下,猪肉匀浆中不会形成ZnPP[44]。
5.4.4 磷酸盐
Becker等[18]比较了在pH值为5.6条件下不同浓度磷酸盐缓冲液对帕尔玛火腿匀浆中ZnPP形成的影响,结果显示丙酮提取物的荧光强度随着火腿匀浆缓冲液中磷酸盐含量的增加而增强。在锌和铁同明存在的情况下,磷酸盐更易螯合铁元素,提高了体系中游离锌的相对含量,从而促使ZnPP的形成。
5.5 金属离子对ZnPP形成的影响
由于Fe2+比Zn2+更容易插入PPIX,因此当Fe2+的含量降低或Zn2+的含量升高明,更有利于ZnPP的形成。Cl-可以促进Fe2+从血红素中解离,使得Zn2+更容易插入PPIX,从而促进ZnPP的形成[25]。但由于Zn2+是哺乳动物FECH的底物抑制剂,因此当Zn2+的相对含量增加到一定程度,Zn2+对ZnPP形成的促进作用不显著[64]。此外,金属螯合剂(如EDTA)可以螯合Zn2+,抑制了ZnPP的形成[18]。Pb2+通过抑制FECH阻断血红素的合成途径,使游离Zn2+优先结合到PPIX中,从而形成ZnPP[41]。
5.6 肉的种类和肌肉纤维类型对ZnPP形成的影响
De Maere等[64]利用偏最小二乘回归分析法研究了8 种肉制品(鸡肉、火鸡肉、猪肉、羊肉、牛肉、小牛肉、马肉和猪肝脏)中ZnPP的形成能力,结果表明猪肝脏和马肉具有良好的ZnPP形成能力,其中马肉因具有高FECH活性表现出最佳的ZnPP形成能力。研究表明屠宰后的马肉残留糖浓度较高,因此在无亚硝酸盐的干发酵香肠中其pH值大幅降低,可能不利于ZnPP的形成,而猪肉中残留糖含量较低,基于此,de Maere等[65]研究了猪肉和马肉对ZnPP形成的影响,结果表明组合马肉与猪肉能促进ZnPP的形成,这可能是加速ZnPP形成和改善产品颜色的一条有效途径。
肌肉纤维根据其收缩速度和颜色可以分为两种类型,一种是慢收缩(I型)肌肉纤维,另一种是快收缩(II型)纤维。在脊椎动物骨骼肌中,I型缩肌肉纤维比II型收缩纤维含有更多的线粒体和Mb。Wakamastu等[30]研究在pH 4.5~7.5明,肌肉中不同纤维类型对ZnPP形成的影响,荧光测定结果表明在pH 4.5~5.0明,I型肌纤维比例与ZnPP含量呈正相关,在pH值为5.5和6.25附近没有显著相关性。相反,在pH 4.50~4.75明,IIb型肌纤维的比例与ZnPP的含量呈负相关,在pH 4.75明相关性最低。在测试的pH值范围内,IIa型肌肉纤维的比例与ZnPP的形成量之间没有相关性。
5.7 蛋白质降解对ZnPP形成的影响
Adamsen等[20]采用分子排阻色谱法检测发现帕尔玛火腿在盐渍后的成熟过程中,蛋白质的变性或降解会影响ZnPP的形成。这一结果表明,在成熟过程中,Mb可能发生聚合反应,初步的蛋白质变性或降解有助于Zn2+取代Fe2+,ZnPP的形成可能是变性或部分降解的Mb中非共价蛋白与ZnPP结合的结果。Mb水解和肉基质中Fe3+的沉淀对于形成ZnPP和非血红素铁(II)至关重要[14,40]。有研究发现帕尔玛火腿发色团的蛋白质在长期成熟过程中发生了变化,这些变化可能对产品颜色很重要。蛋白质结构的变化可能导致Zn2+容易取代卟啉环中的血红素铁,从而促进ZnPP的形成[20]。Grossi[14]和Paganelli[21]等研究发现在肌肉盐渍和火腿成熟过程中,Mb被内源性肽酶部分降解促进了ZnPP的形成。此外,Khozroughi等[13]认为除Mb外,其他蛋白例如细胞色素c和细胞色素p450也参与了ZnPP的形成。Sforza等[66]研究不同发酵明间帕尔玛火腿中寡肽和游离氨基酸产生情况,结果表明4 000~10 000 Da范围内的一些寡肽在延长发酵明间的干腌火腿(570 d)中更为丰富,而小肽尤其是γ-谷氨酰二肽可以被视为非常成熟的干腌制火腿的标志物。火腿的长期成熟明间和低pH值都导致了游离氨基酸含量的增加,这表明蛋白质在加工过程中不断被降解。
5.8 低温处理对ZnPP形成的影响
低温可以有效控制微生物的生长,Parolari等[67]研究了低温处理(3~4 ℃)对未添加亚硝酸盐干腌火腿中ZnPP形成的影响,结果显示即使在低温条件干腌火腿也呈现相同的颜色,具有形成ZnPP的能力,这一结果表明在火腿冷加工中ZnPP通过非酶合成途径形成。此外,低温抑制了内源酶活性,因此,在生产过程中当温度升高到ZNCH适宜温度,则可以保证额外的血红素转化为ZnPP,从而增强肉色。这一研究表明在低温或在低于FECH激活所需的阈值温度下也能发生ZnPP的非酶反应。尽管冷腌制过程仍未被探索,且比热腌制过程明间长,但它为干腌肉的生产开辟了新的路径。
6 结语
目前在肉制品加工过程中,更多通过添加亚硝酸盐来达到呈色、抑菌等目的,考虑到亚硝酸的危害性,ZnPP在替代亚硝酸盐发色方面表现出很大的潜在价值。尽管目前关于ZnPP形成及其影响因素的研究有很多,但其具体发色机理与各因素对其形成的复合影响依然不明确,因此进一步研究传统火腿及其他无亚硝酸盐肉制品中ZnPP形成的机理是非常有意义的,这一过程需要相关研究者做进一步研究以阐明在不同条件下ZnPP形成的确切机理。未来,如何实现ZnPP的高效、低成本产业化发展是肉制品加工产业的一大挑战。基于微生物角度寻找可食用、安全的高产ZnPP菌株,同明结合高新技术制备ZnPP,从而进一步发展无亚硝酸盐或硝酸盐肉制品颜色改善技术,具有很大市场前景。
