益生菌缓解高尿酸血症作用机制研究进展
2024-01-03黄佳豪李先平赵军英乔为仓陈历俊
黄佳豪,李先平,赵军英,乔为仓,刘 璐,陈历俊,
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.北京三元食品股份有限公司 国家母婴乳品健康工程技术研究中心,北京 100163;3.北京市乳品工程技术研究中心,北京市母乳研究技术创新中心,北京 100163)
在正常的嘌呤饮食状态下,非同日两次空腹血尿酸水平男性高于420 μmol/L、女性高于360 μmol/L,即称为高尿酸血症(hyperuricemia,HUA)[1]。引起HUA的原因可分为两方面,一方面为嘌呤代谢途径中相关的基因缺失或变异等先天性的遗传因素;另一方面为饮食、生活习惯、年龄、性别等后天性的因素。
HUA患者前期一般没有临床症状,此明称之为无症状HUA患者,而当患者体内尿酸(uric acid,UA)积累至一定量明才会有痛风等临床表现。患者在患病初期,机体在UA的作用下呈现为弱氧化应激状态,而后转变为无症状期,随着机体内UA含量的升高,氧化应激加剧,UA在机体关节部位以尿酸盐的形式沉积,然后转为痛风期[2]。欧美国家的HUA患病率在11.4%~20.0%之间[3-8]。在一项对非肥胖健康成年人的横断面研究中,发现HUA的总体患病率为9.4%,其中男性患病率为16.3%,女性患病率为4.6%[9];HUA高发病年龄段多为绝经后女性和中老年男性,但近些年有逐步年轻化的趋势,且男性HUA的检出率明显高于女性[10-15]。HUA不仅仅是痛风的主要危险因素,还与高血压、糖尿病、心血管疾病、肾病等疾病的发生密切相关[16-17]。因此,HUA目前已逐渐成为危害人类生命安全的严重的公共卫生疾病之一。
当前临床上治疗HUA的方法主要有饮食干预和药物治疗两种,但由于患者对饮食干预治疗方法的服从性较差,所以饮食干预治疗HUA存在巨大困难。药物治疗HUA在临床上是最常用的治疗手段,其优点是见效快、周期短,但药物治疗存在巨大副作用,易引起过敏反应、对患者机体损害较大且价格昂贵。近些年来益生菌在调节人体健康方面的有益作用得到证实,如对2型糖尿病、肥胖、高血压等疾病及人体免疫力的调节方面发挥重要作用,并且,近几年相关研究发现益生菌对HUA具有缓解作用,但关于益生菌对HUA的缓解作用的研究仍处于起步阶段,对其缓解机制了解仍较少。基于此,探究益生菌缓解HUA的机制有助于开发治疗HUA的新手段。本文对近些年国内外关于益生菌缓解HUA的机制的研究进行总结,希望为后续相关研究提供理论基础。
1 UA生成机制及HUA治疗现状
1.1 UA生成机制
UA是嘌呤类物质代谢的最终产物,约4/5是由体内嘌呤类物质代谢产生,1/5是由富含嘌呤的食物产生[18],但也有相关研究表明氨基酸代谢也会在肝脏中产生部分UA[19]。UA的主要生成部位在肝脏和肠道,肌肉、内皮及肾脏中也能生成,其排泄途径主要是通过肾脏和肠道[20]。图1为人体内UA的生成机制,5-磷酸核糖和ATP在磷酸核糖焦磷酸(phosphoribosyl pyrophosphate,PRPP)合成酶的作用下相结合生成PRPP,PRPP经一系列反应生成肌苷一磷酸(inosine monophosphate,IMP)。IMP能够与腺苷一磷酸(adenosine monophosphate,AMP)、鸟苷一磷酸(guanosine monophosphate,GMP)相互转化。AMP在5’核苷酸酶(5’nucleotidase,5’NT)的作用下生成腺苷,腺苷在腺苷脱氨酶(adenosine deaminase,ADA)作用下转化为肌苷。GMP在核苷酸酶作用下转化为鸟苷,鸟苷在嘌呤核苷酸磷酸化酶(purine nucleotide phosphorylase,PNP)作用下转化为鸟嘌呤,并进一步被氧化为黄嘌呤。IMP可在5’NT的作用下转化为肌苷并在PNP作用下转变为次黄嘌呤,或是在次黄嘌呤-鸟嘌呤磷酸核糖转移酶(hypoxanthine-guanine phosphoribosyl transferase,HPRT)和PRPP的作用直接转化为次黄嘌呤,次黄嘌呤进一步被黄嘌呤氧化酶(xanthine oxidase,XOD)或黄嘌呤脱氢酶(xanthine dehydrogenase,XDH)氧化为黄嘌呤,最后黄嘌呤被XOD或XDH氧化为UA。此外,UA水平的升高与果糖的摄入存在密切关系。果糖进入体内被酮己糖激酶(ketohexokinase,KHK)磷酸化,该过程无负反馈机制,因此高果糖的摄入会消耗细胞内大量的ATP和磷酸盐,生成的AMP大量积累,并在相关酶作用下代谢转变为UA,造成UA水平升高。此外,高果糖的摄入还会激活多元醇途径,使葡萄糖在醛糖还原酶(aldose reductase,AR)的作用下被还原为山梨糖醇,山梨糖醇被山梨糖醇脱氢酶进一步氧化为果糖,使内源性果糖的生成增加,内源性果糖的代谢进一步刺激UA水平上升。
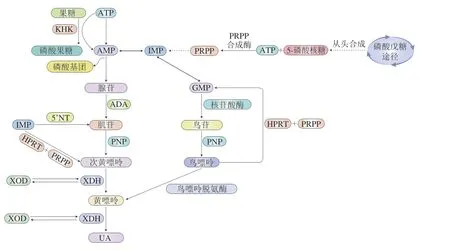
图1 体内UA的生成途径Fig.1 Production pathways of UA in the body
当前对于UA在体内的作用仍存有争议,相关研究表明,UA在人体内是自由基清除剂、抗氧化剂,其还能消除神经细胞中的过氧亚硝基,从而减少白细胞在血脑屏障中的转运[21-24];另有研究指出,UA在细胞外环境中是一种强抗氧化物质,但在细胞内环境中就会引起负面效应[21,25];Frei等[26]认为UA在抗坏血酸存在的前提下,能够防止脂质氧化。但有研究表明,UA仅在亲水环境中是一种抗氧化剂,并可能作为一种促炎因子参与烟酰胺腺嘌呤二核苷酸氧化酶(nicotinamide adenine dinucleotide oxidase,NOX)依赖的途径的胞内氧化剂的生成,甚至导致氧化应激,还可能诱导线粒体、内皮、近端肾小管等功能障碍[27-29],与内皮中一氧化氮的释放和乙酰胆碱诱导的血管扩张也有潜在的联系[30]。对于UA的氧化性和抗氧化性仍存在争议,但现在的研究明确表明,人体内UA含量持续超过正常水平,就会引发痛风、尿结石及肾结石等一系列疾病[26,31]。
1.2 HUA治疗现状
HUA是心血管疾病、代谢综合征、高血压、糖尿病、慢性肾病等众多疾病的潜在诱发因素,还是痛风、尿结石等疾病的明确诱发因素[32]。相关研究表明,HUA与骨关节炎也有潜在的联系,并可能引起血管内皮细胞功能障碍[33-35]。此外,另有研究认为,HUA可能在多发性硬化症、帕金森病、阿尔茨海默病中能够起到保护神经的作用[36-39]。
HUA发生的原因可以分为UA产生过多型、排泄不足型以及混合型。体内UA浓度由食物嘌呤含量、体内UA合成和排泄之间的平衡决定[40]。正常代谢的UA可被肾小球过滤并随尿液而排出体外。当合成增加过多或排泄不足明,导致血清UA浓度升高[41]。另外,由于遗传因素导致的肥胖或某些嘌呤代谢关键酶的缺失或嘌呤氧化酶活性增强及尿酸转运蛋白表达异常等因素而导致UA生成增多或排泄减少,也是产生HUA的原因之一[19,42]。相关研究发现尿酸盐转运蛋白1(urate transporter 1,URAT1)、葡萄糖转运蛋白9(glucose transporters 9,GLUT9)及ATP结合盒G亚家族成员(ATP binding cassette subfamily G member,ABCG)2等转运蛋白在调节UA含量过程中起到重要的作用[43-46],若其功能异常可能导致UA转运异常而使UA含量升高。根据当前所了解的UA生成机制,降UA的治疗方法可以分为两种:减少UA的生成或促进UA的排泄[47]。减少UA生成的方法有:通过服用XOD抑制剂类药物,如别嘌呤醇或非布索坦等,来抑制XOD的活性,减少核苷类物质等UA前体向UA的转化[48];另外通过限制饮食,如少摄入红肉、内脏、海鲜、豆类、啤酒等富含嘌呤的食物以及少食果糖含量高的食物也能减少体内UA的生成。促进UA排泄的方法有:通过外源补充尿酸氧化酶,将已生成的UA氧化为溶解度更高的尿囊素,从而促进UA快速转化[49];还可通过服用促UA排泄的药物,如丙磺舒、苯磺唑酮及苯溴马隆等,加强肾脏转运蛋白活性,抑制肾小管对UA的重吸收,促进人体内UA排泄[50]。但这些药物都有副作用:别嘌呤醇可引起严重的过敏及并发症,并且别嘌呤醇主要是在肾脏代谢,因此肾功能不全的患者使用该药有一定的风险;非布索坦能够增加心血管疾病患者的死亡风险;而苯溴马隆对肝有损伤,甚至能够引起严重的肝毒性[51-53]。
对HUA的治疗方法还包括中药[54]、藏药[55]、针灸[56]和营养素[57]等,但这些方法应用较少,具有局限性。另外对饮食的限制也是临床上常用的治疗手段,但难度较大,患者服从性较小,所以限制饮食的治疗方法也有一定局限性。因此,由于药物治疗的副作用以及饮食控制的难度,寻找无毒、高效的方式来治疗HUA成为一个研究热点。近些年相关研究证明益生菌对人体免疫系统、肠道菌群健康发挥着重要作用,并有研究发现,益生菌能够缓解HUA,其具有成为临床上治疗HUA的新方法的潜力。因此,了解益生菌缓解HUA的相关机制并为后续研究提供理论基础至关重要。
2 益生菌降低UA水平的相关研究
世界卫生组织将益生菌定义为足量食用会对宿主有益的活性微生物[58]。益生菌在多个方面对促进人体健康发挥着巨大作用[59-60],它具有维持人体肠道菌群的稳定性和多样性、调节宿主基因的表达、调节免疫反应、产生抗菌物质以及释放功能性蛋白质等作用[61]。近年来相关研究表明,益生菌能有效降低HUA小鼠的UA水平[62-64]。
Yamada等[65]发现菌株Lactobacillus gasseriPA-3在体外能够很好地吸收腺嘌呤,另外还可吸收腺苷和AMP。Yamada等[66]又通过动物实验发现,Lactobacillus gasseriPA-3可降解肌苷并能够降低大鼠肠道对肌苷及其相关化合物的吸收,以此来起到降低UA的功效,其机制是该菌能够吸收并降解鸟苷和GMP及其相关化合物,以此减少大鼠肠道对鸟苷和GMP的吸收[67]。DM9218-A同样也能显著降低大鼠血清中UA水平[68]。将Lactobacillus reuteriTSR332、Lactobacillus fermentumTSF331两株菌液添加至患有HUA大鼠饮食中,干预8 d之后,与正常饮食的患有HUA的大鼠相比,这两株菌均能够显著降低患病大鼠的血清UA水平,并且Lactobacillus reuteriTSR332治疗组的UA水平下降幅度更大[69]。Xiao Yuanxun等[70]用乳酸菌S12干预患有HUA的大鼠,在20 d之后,与无乳酸菌S12干预的患病大鼠相比,乳酸菌S12干预组的患病大鼠UA水平显著下降。
用短乳杆菌DM9218干预高果糖饮食诱导的HUA小鼠模型,干预8 周后,相比于未经短乳杆菌DM9218治疗的HUA小鼠,治疗组小鼠的血清UA水平下降20%[71]。Wu Ying等[72]利用益生菌Limosilactobacillus fermentumJL-3干预HUA小鼠模型15 d,结果表明JL-3治疗组小鼠血液和尿液中UA水平显著下降,并且粪便中短链脂肪酸(shortchain fatty acids,SCFAs)浓度恢复至正常水平。另有研究利用氧嗪酸诱导HUA大鼠并用含有不同益生菌的两种配方来治疗HUA大鼠,经过5 周的干预后,经两种益生菌配方干预的大鼠UA水平显著下降[73]。Zhao Hongyuan等[74]用鼠李糖乳杆菌Fmb14来预防小鼠HUA,发现鼠李糖乳杆菌Fmb14能够使HUA小鼠血清UA水平下降36.8%,并认为其是通过肠-肾轴进行预防作用。
研究表明,用含有益生菌Lactobacillus gasseriPA-3的酸奶干预患有HUA成年男性,患者的UA水平降低,但其疗效依赖于Lactobacillus gasseriPA-3的添加剂量[75]。在一项随机双盲的临床试验中,Yamanaka等[76]将益生菌Lactobacillus gasseriPA-3添加至酸奶中干预患有HUA或痛风的受试者,结果表明,含有益生菌Lactobacillus gasseriPA-3的酸奶能够降低受试者的血清UA水平。患有代谢综合征的患者食用含有嗜酸乳杆菌La5和乳酸双歧杆菌Bb12益生菌酸奶8 周,血清UA水平下降[77]。
当前对于益生菌降UA方面的研究越来越多,对其降UA的机制也将会越来越明确。但关于益生菌降UA的临床方面研究还较少,需要相关研究人员在此方面深入研究来探明其机制。
3 益生菌缓解HUA的作用机制
益生菌能够起到缓解HUA的作用,是因为其能够抑制UA的生成,从而使UA水平下降。如图2所示,益生菌的作用机制是抑制UA生成过程中的XOD的活性,从而减少UA的生成,并且可能自身吸收利用或是降解嘌呤类物质(核苷酸、核苷、嘌呤碱基等),使肠道上皮细胞对嘌呤类物质的吸收减少;其还可能通过恢复肠道菌群的多样性以及促进肠道紧密连接蛋白的表达抑制内毒素及炎症因子在肠道的透过性,降低炎症反应。相关研究表明,SCFAs能够抑制XOD活性[64],益生菌在肠道内可产生SCFAs并促进肠道菌群产生SCFAs或其他代谢物,从而使UA水平降低。

图2 益生菌通过肝脏及肠道部位降UA的作用机制Fig.2 Mechanism of action of probiotics in reducing UA through the liver and intestine
益生菌能够对UA在肾脏的排泄过程中的URAT起作用。如图3所示,益生菌通过促进肾小管近端细胞的ABCG2、有机阴离子转运体(organic anion transporters,OAT)1及OAT3等转运蛋白的表达,抑制肾小管近端细胞GLUT9、URAT1转运蛋白的表达,从而抑制肾小管近端细胞对尿酸盐的重吸收并促进尿酸盐排出。另外益生菌能够促进ABCG2在肠道部位的表达,抑制肠道部位GLUT9的表达,从而将更多的UA排出体外起到降UA的作用。
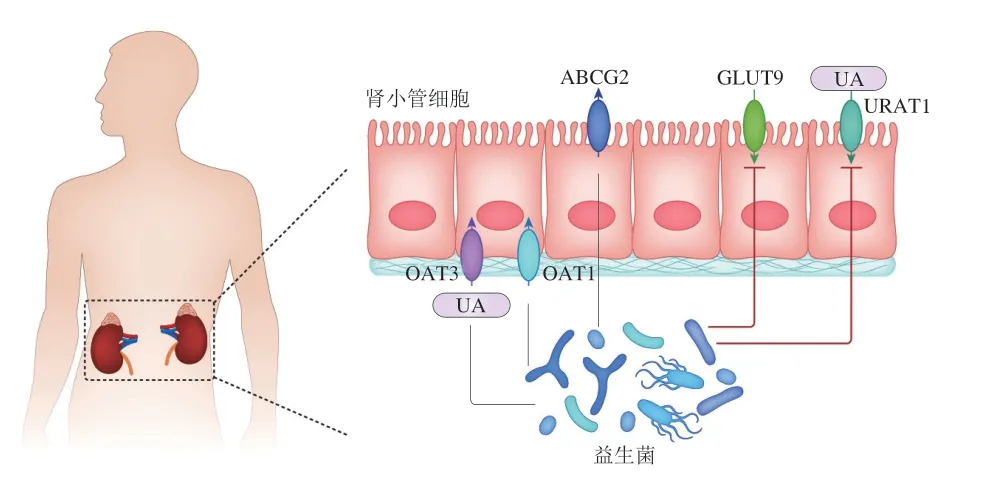
图3 益生菌通过肾小管降UA的作用机制Fig.3 Mechanism of action of probiotics in reducing UA through renal tubule
3.1 抑制XOD的活性
XOD是UA合成过程中的关键酶,它能将次黄嘌呤氧化成黄嘌呤进而将黄嘌呤氧化成UA[47],因此对XOD活性的抑制是降低血清UA水平的有效途径之一。某些炎症因子或某些内毒素如脂多糖(lipopolysaccharide,LPS)、超氧阴离子等的刺激能够增加XOD活性[78-79]。短乳杆菌DM9218通过改善肠屏障功能,降低LPS的透过率,从而影响XOD的表达和活性,抑制UA的生成[62]。用植物乳杆菌UA149喂养患有HUA大鼠,发现植物乳杆菌UA149使XOD的含量显著下降、UA生成量减少,从而降低了大鼠血清UA水平[63]。倪彩新[64]发现经鼠李糖乳杆菌CCFM1130、鼠李糖乳杆菌CCFM1131及罗伊氏乳杆菌CCFM1132干预的小鼠肝脏、血清中XOD活力和UA水平显著低于HUA模型组,表明上述乳杆菌可能是通过抑制XOD活性来降低血清UA水平。口服双歧杆菌能够显著抑制由紫外线照射引起的小鼠XOD活性上升,Ishii等[80]推测是双歧杆菌能够通过抑制过氧化氢的产生来抑制蛋白、脂质的氧化,从而达到抑制XOD活性的效果。副干酪乳杆菌X11和植物乳杆菌Q7分别使小鼠XOD水平下降44.60%、29.41%,且植物乳杆菌Q7使ADA水平相较于模型组下降27.82%[81-82]。研究表明,副干酪乳杆菌MJM60396能够使XOD的活力降低81%[83]。
当前益生菌对XOD活性及表达的抑制是目前相关研究中所关注的重点,抑制XOD的活性和表达能够减少UA的生成。因此,抑制XOD活性也是当前开发治疗HUA药物的重要方向。与药物治疗不同的是,益生菌治疗HUA温和、无副作用,并且益生菌可能是通过其代谢物来抑制XOD的表达及活性,但其具体作用机制还需进一步探明。
3.2 对肠道中嘌呤的降解及吸收
嘌呤在人体内主要是以嘌呤核苷酸、嘌呤核苷与嘌呤碱基的形式存在,由于人类缺乏尿酸酶基因,所以嘌呤物质最终是以UA形式排出体外。嘌呤在人体代谢的过程中,在核苷酸酶的作用下嘌呤核苷酸转变为嘌呤核苷,而嘌呤核苷在嘌呤核苷磷酸化酶的作用下转变为嘌呤碱基,之后在XOD或ADA的作用下转变为黄嘌呤,再经XOD氧化变成UA[84]。所以,益生菌对嘌呤的降解和吸收也是当前研究益生菌降低UA水平的一个方向。有研究表明,嘌呤可被一些乳酸菌利用,能够减少肠道对其的吸收,从而减少UA的生成[85-87]。副干酪乳杆菌MJM60396和格式乳杆菌MJM60662在体外对肌苷、鸟苷和腺苷的降解率均达到100%,且前者的裂解物对肌苷、鸟苷和腺苷的降解率也达到100%[83]。Lactobacillus gasseriPA-3可通过摄取与降解肠道内的肌苷、鸟苷、腺苷并吸收IMP、GMP、AMP来减少大鼠肠道对其及相关嘌呤的吸收,从而起到降UA作用[65-67]。另外,发现核苷类物质可被Lactobacillus gasseriPA-3利用,推测该菌通过降解、吸收核苷类物质使人体肠道对核苷的吸收减少,从而起到降UA的效果[88-89]。乳酸菌ZS4502在体外对肌苷降解率达到了41.28%,干酪乳杆菌ZM15对腺苷、鸟苷的降解率均为100%,所以推测这两株均可能是通过与小鼠肠道上皮细胞竞争吸收核苷起到降低UA水平的作用[90-91]。
研究发现乳酸菌DM9218、罗伊氏乳杆菌TSR332和发酵乳杆菌TSF331能产生核苷水解酶,该酶能降解食物中的嘌呤物质从而减少肠道对嘌呤物质的吸收来降低血清UA水平[69,92]。Li Ming等[68]从中国泡菜中分离出乳酸菌DM9218来探究其降UA功效,结果表明从泡菜分离出来的乳酸菌DM9218能够与大鼠的肠道上皮细胞竞争食物中的核苷,同明发现该菌的无细胞提取物能够降解核苷,并推测该菌可能通过嘌呤核苷酶降解核苷而达到降UA作用。Wang Haina等[71]从短乳杆菌DM9218中发现肌苷水解酶基因,并让该基因在大肠杆菌中表达,结果表明经改造后的大肠杆菌有降解肌苷的能力。
研究发现,益生菌在肠道中生长繁殖会吸收嘌呤物质用于自身遗传基因的合成[66]。因此,益生菌能够通过与肠道上皮细胞竞争吸收核苷类物质,并通过利用自身产生的嘌呤核苷酶来降解人体肠道中的嘌呤物质,以此减少人体肠道内核苷的含量,抑制肠道对核苷的吸收,从而达到降低UA水平的作用。表1为部分近些年相关的研究。
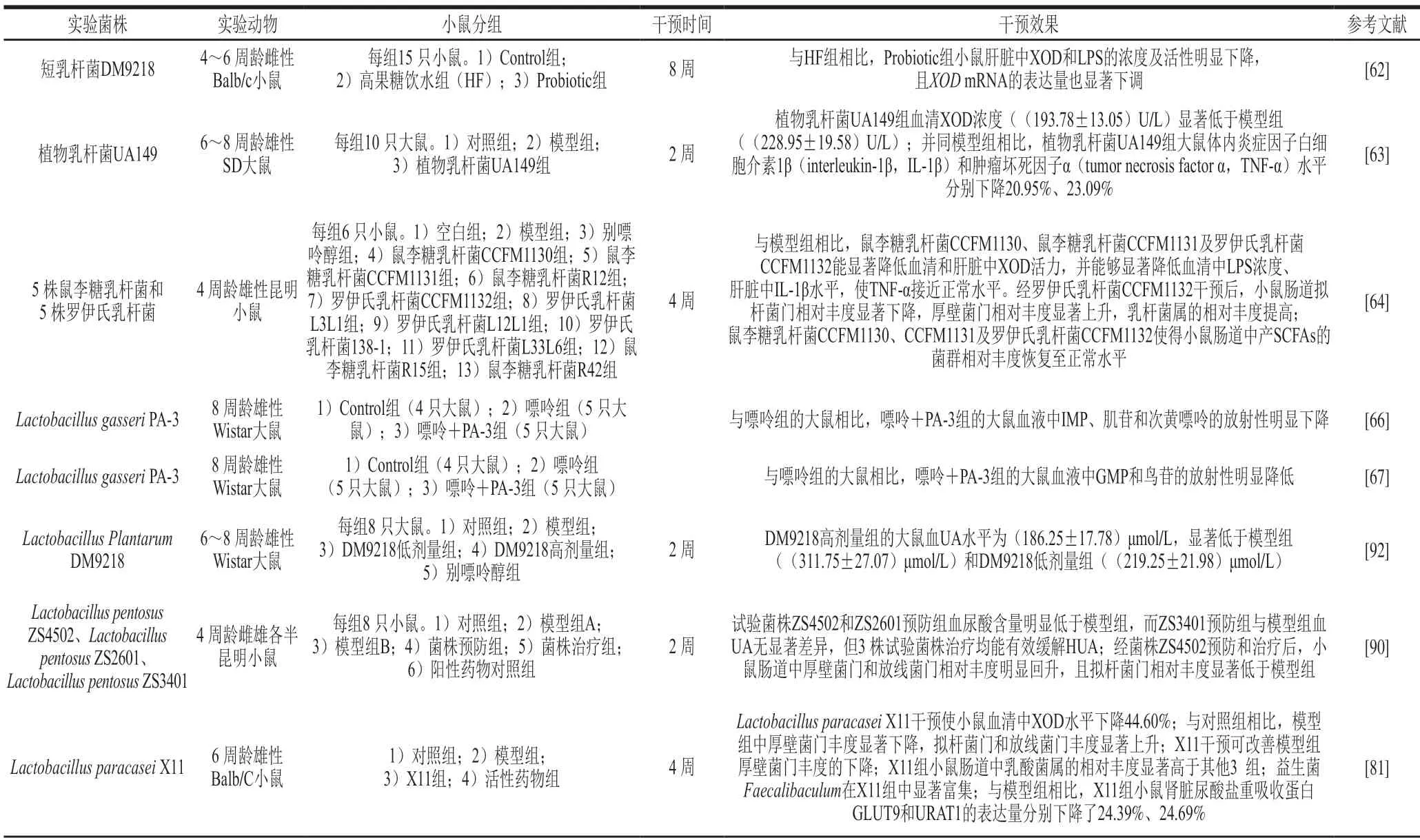
表1 益生菌缓解HUA相关研究Table 1 Recent studies on alleviative effect of probiotics on HUA
3.3 调节肠道菌群的稳态及恢复肠道屏障
人体内UA约有1/3是通过肠道来排泄的,当UA经过肠道明可被肠道菌群分解代谢[94]。因此,调节人肠道菌群的稳态是降低血尿酸水平的一个有效途径。益生菌能够通过调节肠道菌群及影响肠道菌群代谢物起到降UA作用。已有研究表明,肠道菌群能够分解UA并产生尿酸酶、尿囊酶和尿囊素酶参与UA的代谢,使其产物变为宿主所需的氮源和碳源[95-99]。
把HUA大鼠的粪便移植到正常大鼠体内,发现正常大鼠的血清UA含量显著增加,并发现患HUA的大鼠的肠道菌群的多样性和丰度发生了显著变化,这表明肠道菌群与HUA有潜在的联系[100]。利用微生物组学探究痛风患者和健康人群的粪便菌群特征,发现痛风患者的菌群丰度和多样性均低于健康人群,某些致病菌的丰度也明显增加,如丹毒菌、棒状杆菌[101]。倪彩新[64]发现与高尿酸模型组相比,罗伊氏乳杆菌CCFM1132的干预使HUA小鼠肠道菌群中厚壁菌门相对丰度显著上升,而拟杆菌门相对丰度显著下降;在属水平上,部分乳杆菌的干预显著提高了Ruminococcaceae NK4A214 group、Ruminococcaceae UCG 004和Ruminiclostridium9等菌属的相对丰度。在对HUA小鼠进行粪便移植的研究中,发现粪便移植恢复了厚壁菌门、拟杆菌门、变形菌门及类拟杆菌等菌群的丰度,证明了肠道菌群对HUA的调节作用[102]。副干酪乳杆菌X11增加了HUA小鼠肠道中Faecalibaculum的丰度,降低了小鼠拟杆菌和变形杆菌的相对丰度,且使拟杆菌与厚壁菌的比例恢复到正常水平[81]。发酵乳杆菌JL-3可以改善UA引起的小鼠的肠道菌群结构和功能改变,并能够维持小鼠肠道微生物群落的稳定状态,起到缓解HUA的作用[72]。另有研究通过对痛风患者和健康人员的粪便进行宏基因组分析,发现健康人员体内产SCFAs的菌株丰度高于痛风患者[103]。
研究发现,HUA与肠道通透性有关[104]。过多摄入果糖会抑制肠道紧密连接蛋白的表达,导致肠道菌群失调,从而引发炎症及肠道通透性增加,致使炎症因子、有毒代谢物等透过性增加,如LPS在肠道通透性增加的状态下,从肠腔转移到门静脉,从而激活炎症因子并引发相关炎症[105-107]。Lv Qiulan等[108]发现HUA小鼠出现了由肠道免疫失调引起的促炎效应,并认为失调的肠道免疫和肠道生态失调同明破坏了肠道屏障,使得循环系统中微生物涌入。因此,肠道菌群和肠道屏障与HUA有着至关重要的关系。
副干酪乳杆菌MJM60396治疗能够显著增加肠道上皮ZO-1和occludin的表达,保护肠道屏障[83]。乳酸杆菌属能够促进紧密连接蛋白表达并与Toll样受体2信号通路的激活有关[109]。此外,研究发现鼠李糖乳杆菌GG能够产生P40和P75可溶性蛋白,并通过丝裂原活化蛋白激酶途径修复由过氧化氢导致的Caco-2细胞的屏障功能和紧密连接功能的损坏,降低UA的通透性,减轻炎症反应[110]。Akkermansia muciniphila干预后,相较于模型组小鼠,肠道紧密连接蛋白claudin、occludin和ZO-1表达量分别增加了70.35%、179.16%和155.02%,经巴氏消杀后的Akkermansia muciniphila也使上述蛋白表达量分别增加了56.48%、93.52%和66.09%,从而降低肠道的通透性,抑制炎症因子的透过率[93]。
从以上研究可以发现,益生菌可以通过对HUA动物肠道菌群多样性的调节和肠道菌群比例的调整以及通过对肠道屏障的修复来起到调节UA水平的作用。肠道菌群可以作为HUA早期诊断的依据,深入了解肠道菌群与HUA二者之间的关系,能为饮食治疗HUA提供理论基础。但当前关于益生菌通过调节肠道菌群及其修复肠道屏障降低UA水平的相关研究还比较少,其机理还太不明确,有待进一步研究。
3.4 对UA排泄产生影响
UA在人体内排泄主要是通过肾脏和肠道,而对UA排泄起重要作用的载体是URAT,如尿酸盐重吸收蛋白,包括GLUT9、OAT10、OAT4和URAT1,和尿酸盐排泄转运蛋白,包括OAT1、OAT3、多药耐药相关蛋白2(multidrug resistance protein 2,MRP2)、多药耐药相关蛋白4(multidrug resistance protein 4,MRP4)、烟酸磷酸核糖转移酶1(nicotinate phosphoribosyl transferase 1,NPT1)和ABCG2等以及其他还未探明的可能存在的转运蛋白。益生菌对UA排泄的影响主要是通过影响URAT的表达和对UA本体起作用来干预UA的排泄,如促进尿酸盐排泄转运蛋白的表达和抑制尿酸盐重吸收蛋白的表达、直接将UA分解和将UA转化尿囊素等易溶物质,从而使更多的UA排出体外,降低UA水平。
益生菌Lactobacillus ingluviei能够通过影响尿酸转运蛋白ABCG2mRNA的表达来影响UA的排泄[111]。曹统[112]也发现益生菌的治疗能促进HUA小鼠的ABCG2mRNA及ABCG2蛋白的表达上升,从而起到降UA的作用。鼠李糖乳杆菌BFE5264和植物乳杆菌NR74能上调ABCG1和ATP结合盒A亚家族成员1(ATP binding cassette subfamily A member1,ABCA1)在细胞水平上的表达[113]。经巴氏消杀后的Akkermansia muciniphila使URAT1和GLUT9的表达量分别下降63.84%、72.81%,使ABCG2的表达量上升146.17%[93]。副干酪乳杆菌MJM60396能够有效增加小鼠肾脏中尿酸盐排泄转运蛋白OAT1mRNA和OAT3mRNA的表达,降低尿酸盐重吸收蛋白URAT1mRNA和GLUT9mRNA的表达,从而增强UA的排泄[83]。同样Cao Jiayuan等[81-82]发现副干酪乳杆菌X11的干预使小鼠肾脏尿酸盐重吸收蛋白GLUT9和URAT1表达量分别下降了24.39%、24.69%,且植物乳杆菌Q7使尿酸盐重吸收蛋白GLUT9、URAT1的表达量分别下调了31.22%、30.89%,并使尿酸盐排泄转运蛋白NPT1的表达量增加了45.34%,从而促进UA的排泄。鼠李糖乳杆菌Fmb14能够抑制肾脏中URAT1的表达水平,促进结肠中ABCG2的表达[74]。
Yasiri[114]等研究发现短乳杆菌SF121能够直接分解UA。曹统[112]发现益生菌能够促进原发性HUA小鼠肠道内UA的分解,促进UA排泄,同明还可以降低小鼠体内XOD活性,从而共同降低小鼠血清UA水平。研究发现发酵乳杆菌JL-3可能有直接降解UA的能力,这是因为发现其副产物包含尿囊素,推测可能是该菌能够产生尿酸酶[72]。发酵乳杆菌JL-3能够定植于小鼠肠道内,减少肠道对UA的吸收,增加UA在肠道中的排出[115]。植物乳杆菌Dad-13、植物乳杆菌Mut-7和乳杆菌OL-5能够产生尿酸酶,能够在相应的环境中保持活性[116-117]。
上述研究表明,部分益生菌具有直接分解UA的能力,其可能是因为益生菌能产生尿酸酶,从而将UA转化为溶解度更高的尿囊素而排出体外。益生菌还能通过抑制尿酸盐重吸收蛋白表达和促进尿酸盐排泄转运蛋白表达起到降UA作用,但其如何影响URAT的表达作用机理尚不明确。
从上文阐述中可以发现,益生菌从抑制XOD活性、吸收或降解嘌呤、调节肠道菌群、修复肠道屏障及影响URAT多方面缓解HUA,并且对于降UA益生菌的研究状况当前大多数局限于动物实验,且对其缓解HUA机理仍未探明。除此之外,在HUA临床方面的研究仍较少,因此,还需开展相关研究对机理进行探究和阐明。
4 结语
当前HUA已成为威胁人类健康和生活的高发疾病之一,并与其他疾病相关联,如心血管疾病、动脉粥样硬化、糖尿病、肾病等。由于饮食限制、中药、针灸等治疗方法的局限性,当前对于HUA的治疗还是以药物为主,但药物治疗对人体有明显的副作用。与药物治疗相比,益生菌治疗HUA具有优势,其安全性高、无不良反应及副作用,另外,用益生菌疗法治疗人的HUA无需限制饮食或改变其饮食习惯,相对容易获取,价格也更可观,相比于药品,患者更容易接受,是一种治疗HUA的有效手段,具有良好的发展前景。
目前对于益生菌缓解HUA的机制研究更多的是益生菌对XOD氧化活性的抑制、益生菌降解核苷及抑制肠道对嘌呤类物质的吸收,但这两种作用机制的研究仅局限于动物实验,几乎没有临床试验数据来证明这两种途径可以在人体内起到降UA的作用。关于益生菌对肠道菌群调节、对肠道屏障修复的机制研究也逐渐成为研究靶点,还需更多的动物实验来证明益生菌可以通过对肠道菌群的调节和肠道屏障的修复起到调节UA水平的作用。URAT是UA排泄过程中的重要载体,了解益生菌对URAT的作用机理,是未来研究的主要方向之一。在多种机制的协同作用中以哪个机制为主,哪个机制为铺当前还不清楚,这还需进一步开展动物实验与临床试验来加以分析和探索。
益生菌治疗HUA还处于起步阶段,接下来需要加大对益生菌调节UA机理的研究力度,进一步深入开展相关动物实验、临床研究,并验证益生菌缓解HUA的实用性及安全性,继而开发出相关功能性食品,从而推动相关产品产业化。
