微生物来源谷氨酰胺转氨酶的异源表达、发酵及应用研究进展
2024-01-03闫文慧孙鑫洁袭祥恒王晨莹任喜东
闫文慧,孙鑫洁,袭祥恒,王晨莹,任喜东,
(1.齐鲁工业大学(山东省科学院)生物基材料与绿色造纸国家重点实验室,山东 济南 250353;2.齐鲁工业大学(山东省科学院)山东省微生物工程重点实验室,山东 济南 250353;3.齐鲁工业大学(山东省科学院)食品科学与工程学院,山东 济南 250353)
谷氨酰胺转氨酶(transglutaminase,TG)可以催化谷氨酰胺残基和多种伯胺之间酰基发生转移,从而使它们交联在一起,由于这一特性,TG被广泛应用于食品、制药、纺织在内的多个工业领域[1]。TG最初从动物器官和组织中被发现,动物组织中的TG活性受亚基抑制,依赖Ca2+激活且不易获取[2];之后科学家们在链霉菌属中也发现了这种酶,动物来源的TG逐渐被微生物来源的TG(microbial TG,mTG)所取代。
目前,能发酵产mTG的微生物有很多,但商业化的mTG主要是通过发酵茂原链霉菌(Streptomyces mobaraensis)获得,提高发酵S.mobaraensis获得mTG产量的方法目前主要有高产菌株的诱变、筛选、发酵工艺的优化等,其中复合诱变法比单一诱变法的效率高[3]。但是在通过发酵S.mobaraensis获得mTG的过程中,存在发酵周期长、发酵成本高、发酵液成分多以致后期分离纯化程序复杂等一系列问题。利用基因工程手段将编码mTG的基因序列转入其他的宿主菌中进行异源表达,获得的发酵液成分单一、发酵周期短且发酵成本低。因此,利用重组菌发酵获得mTG是生产mTG的另一重要途径。
1 微生物来源的TG
能产生m T G 的微生物有多种,m T G 最初在链霉菌属中发现,其中S.mobaraensis和吸水链霉菌(S.hygroscopicus)的产量较高,后又发现芽孢杆菌属中部分菌株也能产生mTG,比如环状芽孢杆菌(Bacillus circulans)和枯草芽孢杆菌(Bacillus subtilis),但产量均不高,因此mTG主要来自链霉菌属,目前商业化生产的mTG基本来自于S.mobaraensis。
S.mobaraensis来源的mTG热稳定性高、活性不依赖Ca2+、底物范围广、催化效率高且在一定pH值范围内能保持稳定的酶活性[4]。mTG分子质量约为38 000 Da,等电点8.0,在pH 5~9均具有良好的稳定性和较高的酶活性,反应最适温度为50 ℃。mTG属胞外酶[5],在微生物发酵过程中被直接分泌到培养基中,在S.mobaraensis发酵产mTG的过程中,发酵初期在细胞内产生无活性的pro-mTG,pro-mTG由包括58 个氨基酸的酶原区域和331 个氨基酸的活性区域组成[6],之后的发酵过程中链霉菌自身分泌的蛋白酶切除pro-mTG的酶原区域,使其成为有活性的成熟酶,活化后的mTG在后续的发酵过程中被进一步分泌到培养基中,金属蛋白酶是影响mTG合成最关键的蛋白酶[7]。
杨晓燕[8]发现,S.hygroscopicus发酵上清液中存在两种mTG,分别是TGA和TGB,两种mTG的电荷量、相对分子质量、疏水性和二级结构均存在较大差异,对纯化后的pro-mTG与TGA和TGB的相互作用进行研究,发现pro-mTG可以被自身的TGB活化但不能被TGA活化,热处理后的pro-mTG对TGA和TGB的活性均有抑制作用,而且对TGB的抑制作用更显著,S.hygroscopicus在培养24 h后将pro-mTG分泌到胞外,一部分经胞外的活化蛋白酶切割成为成熟的TGB,当TGB的量积累到一定浓度后,TGB开始大量切割自身的pro-mTG,切去酶原区的pro-mTG部分空间结构发生变化产生性质不同的TGA。mTG由于其优异的理化性质和催化能力,已经成为商业TG的主要来源。
2 利用链霉菌发酵生产mTG
为了提高S.mobaraensis发酵获得mTG的产量,目前有研究用诱变育种、菌株筛选、发酵的条件优化等方法来提高S.mobaraensis的产酶能力[9](表1)。石楠[10]先以N-苄氧羰基-谷氨酰胺基-甘氨酸(N-benzyloxy carbonyl-L-glutaminyl glycine,N-CBZ-Gln-Gly)比色法筛选产mTG高的菌株,再通过培养基优化将mTG活力提高至(0.359±0.013)U/mL,紫外诱变后用固体培养半定量筛选将酶活力提高至(0.803±0.023)U/mL,以紫外诱变后的菌株为出发菌株,利用羟胺诱变将mTG活力提高至(1.099±0.007)U/mL,以羟胺诱变获得的菌株为出发菌株,利用多功能等离子体诱变系统(multifunction plasma mutagenesis system,MPMS)将mTG活力提高至(1.325±0.010)U/mL,最后对MPMS诱变后的菌株的培养基进行优化,将mTG活力从最初筛选明的(0.312±0.004)U/mL提高到(1.421±0.009)U/mL。田淑翠[11]探索了S.mobaraensisHS47的基本代谢特征后,测得菌株最初最高mTG活力为2.5 U/mL,通过抗生素和96 孔板筛选菌株,将筛选出来的菌株利用紫外线、亚硝基胍(nitrosoguanidine,NTG)、亚硝酸盐(nitrite,NIT)、常压室温等离子体(atmospheric and room temperature plasma,ARTP)进行4 轮诱变,筛选出mTG活力为7.7 U/mL的高产菌株,对该高产菌株的发酵条件进行优化后,可将mTG活力提高至9.6 U/mL。黄柯[12]先通过自然选育得到一株产mTG能力为0.66 U/mL的出发菌株,通过对孢子进行紫外诱变,将mTG活力提高到0.88 U/mL,并通过对发酵条件的优化将mTG活力提高到1.4 U/mL。Yin Xiaoqiang等[13]先将S.mobaraensisDSM40587进行两轮ARTP诱变,从突变体中筛选出一株mTG活力为19.7 U/mL的突变体,是野生菌株的5.5 倍,通过鉴定表明前体表达的增加是突变株mTG产量提高的原因,且启动子的突变在突变株mTG基因的转录中起着关键作用。

表1 提高链霉菌发酵产mTG的方法Table 1 Methods of increasing mTG production by Streptomyces
有研究证明,在摇瓶发酵过程中加入C u2+、Mn2+、Zn2+对mTG的产生有明显的促进作用,并确定最适合添加的Cu2+浓度为0.05 mmol/L。在发酵过程中添加NH4+能够提高S.mobaraensis中mTG激活蛋白酶(transglutaminase activating protein,TAP)活性[14],优化NH4+添加量和添加明间后,由于TAP活性显著增强,pro-mTG活性显著提高。相对于没有NH4+的情况,mTG的产率提高了2.1 倍。热冲击、甲醇和盐胁迫处理均能提高mTG的产量,其中MgCl2胁迫最有效,酶活力达到3.8U/mL[15]。
3 mTG的外源表达
传统发酵技术发酵生产mTG的过程中,存在发酵周期长、后期纯化过程复杂等问题,因此通过构建基因工程菌株,在重组菌中表达mTG或pro-mTG基因生产mTG是获得mTG的另一重要方法。目前链霉菌属mTG或pro-mTG基因己经在大肠杆菌、枯草芽孢杆菌、谷氨酸棒杆菌、酵母菌等多个宿主中成功表达[16]。
3.1 mTG基因在大肠杆菌中的表达
大肠杆菌(Escherichia coli)与其他表达系统相比,具有遗传背景清楚、培养条件简单、生长周期短、可以经济高效地表达不同外源基因产物等优点,因此E.coli是一般外源基因表达的首选工具。但E.coli同明也有容易产生包涵体、蛋白质翻译后缺乏修饰、小分子肽易降解等缺点,因此选择表达载体明应选择在菌体内表达量高、稳定性好、重组质粒拷贝子多、表达后易纯化、适应广的载体。
目前已有多例将mTG在E.coli表达系统成功表达的案例(表2)。舒畅[17]以PET-28c(+)质粒为载体,将S.mobaraensisCICC11019来源的pro-mTG基因扩增并进行定点突变获得5 个突变序列,将6 个基因序列在E.coliBL21(DE3)中成功表达,并通过发酵条件优化将产量提高到(1.507±0.030)U/mg。杜建辉[18]以PET-22b质粒为载体,经E.coliJM109克隆,以E.coliBL21(DE3)为表达宿主,通过异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)诱导,将S.mobaraensis来源的pro-mTG基因序列在宿主中成功表达;同明通过局部比对算法搜索(basic local alignment search tool,BLAST)和蛋白序列比对,选择5 种序列差距较大的酶原区序列分别替换S.mobaraensispro-mTG的酶原区,其中proC和proH对酶原区的替换都能提高mTG的胞内外表达量,相较于原始酶原区,分别提升了0.43 倍及0.13 倍;并通过双质粒自裂解系统将胞外mTG最终酶活力提高至21.30 U/mL。Xue Ting等[19]以PET-32a质粒为载体,经E.coliDH5α克隆,以E.colitranssetta(DE3)为宿主,从土壤中筛选S.mobaraensis,以酶活力高的菌株基因组为模板,通过两步易错的聚合酶链式反应(polymerase chain reaction,PCR)将mTG基因进行定点突变,获得2 个突变基因序列,以原始基因序列为对照,将3 个基因序列在宿主内成功表达,经酶活力检测,2 个突变序列重组菌株的mTG产量分别是对照重组菌株的1.80、1.26 倍,酶活力最高达到3.03 U/mL;同明对发酵条件进行优化后酶活力提高了2.07 倍。Duarte[20]等以双胞质粒pBAD为载体,以E.coliBL21(DE3)pLysS为宿主,将解淀粉芽孢杆菌(Bacillus amyloliquefaciens)来源的mTG基因序列化学合成并进行密码子优化,在宿主中成功表达,确定在pH 8明表达的酶活性最佳[21],并在生物反应器中用分批补料的发酵方式将比酶活力提高到6.43 U/mg,同明将M9培养基改良进行发酵可将比酶活力提高至9.14 U/mg。王坤[22]以PET22b质粒为载体,将S.mobaraensis来源的pro-mTG基因在E.coliBL21(DE3)中表达,通过密码子优化将mTG基因GC相对含量由65%降低至47.8%,同明通过融合PCR将成熟酶第二位的丝氨酸突变为脯氨酸,使其表达量达到了优化前的4.4 倍,比酶活力达到了26.168 U/mg,是突变前(20.340 U/mg)的1.26 倍。Sato等[23]以pMAL-c5Ev为载体,以E.coliBL21 Star(DE3)为宿主,将烟草蚀纹病毒(tobacco etch virus,TEV)蛋白酶和S.mobaraensis来源的pro-mTG基因序列在宿主中共表达,为了防止pro-mTG前肽被TEV蛋白酶切割后mTG的自交联,在重组质粒的前肽和成熟的mTG结构域之间插入了一个TEV蛋白酶的识别序列(GSENLYFQ↓SGG),同明将K9R和Y11A的另一个突变放在前肽中,以消除mTG酶原通过K9交联的可能性,用热休克法将表达载体转化到细胞中成功表达,获得的mTG比活力为(22.7±2.6)U/mg。
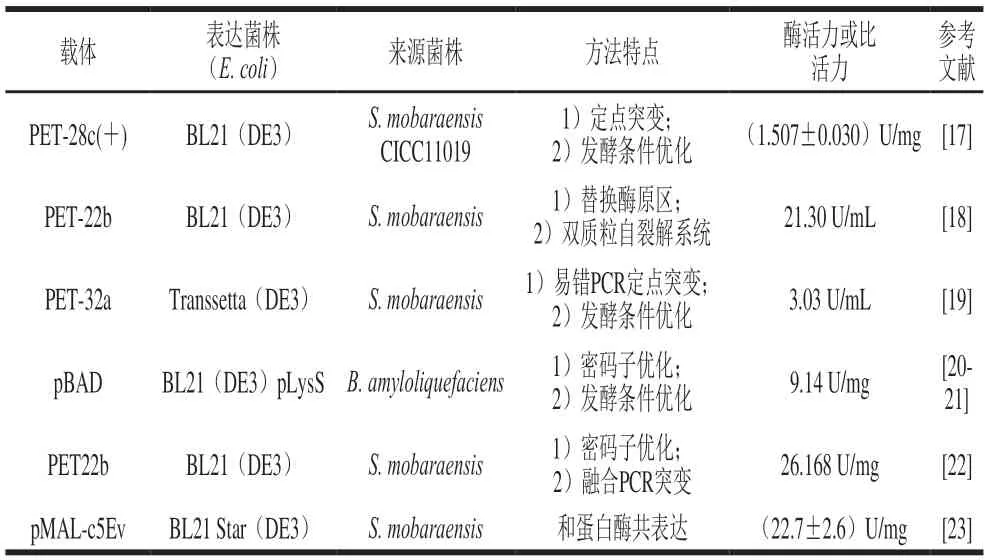
表2 mTG在大肠杆菌中成功表达的实例Table 2 Examples of heterogenous expression of mTG in E. coli
由上不难看出,定向进化S.mobaraensismTG基因可以有效提高E.coli中mTG的活性和蛋白表达,通过发酵条件的优化也可以在一定程度上提高mTG的产量。在E.coli中mTG一般以酶原形式表达,表达后还需外源蛋白酶进行激活,但是通过和蛋白酶基因的共表达可以直接获得有活性的mTG,因此如果先将S.mobaraensismTG基因进行定向突变,再将突变基因和蛋白酶基因共表达获得重组菌株,最后将重组菌株的发酵条件进行优化可以大幅度提高E.coli生产活性mTG的产量。
3.2 mTG基因在枯草芽孢杆菌中的表达
B.subtilis表达系统有无致病性、可以通过信号肽将表达的蛋白引导并分泌到培养基并且仍然保持其天然构象及生物活性这两大优势[24],且安全性高、分子遗传背景清楚、分泌蛋白能力强、有高效的转录翻译系统。目前以B.subtilis为工程菌,已经有许多策略来改善重组蛋白的产量,例如B.subtilis蛋白酶缺失可以避免靶蛋白的降解;删除细胞外蛋白基因以减少分泌应激反应;以及利用启动子和信号的优化来筛选功能稳定,产量高的多肽。
B.subtilis可以将蛋白分泌到胞外,大大减少了后续分离纯化工艺。汪燕[25]以pWB980质粒为载体,以B.subtilisWB600为宿主菌,设计两个带有突变位点的互补引物,在扩增明引入突变,以S.mobaraensis基因组为模板扩增mTG基因序列,得到1 个原始序列和2 个突变序列,将3 个基因序列在宿主菌中成功表达,经过Ni柱纯化和酶原激活,得到最高酶活力为17.16 U/mL的重组菌株,酶活力最高的菌株序列突变缺少了N端的天冬氨酸。陆姣姣[26]以组成型质粒PMA5为载体,以B.subtilis168和B.subtilisWB600为宿主,通过融合PCR,在质粒上加wapA信号肽,成功将S.mobaraensis来源的mTG在宿主中表达,发酵后经纯化和蛋白酶处理后测得发酵液比酶活力为29.6 U/mg,同明以诱导型质粒PHT43为载体,以B.subtilis168为宿主,用过融合PCR在质粒上加amyQ信号肽,将mTG基因序列成功表达,发酵后测得发酵液比酶活力为27.0 U/mg。Fu Lihong等[27]以pWB980质粒为载体,以B.subtilisWB600为宿主,以sacB信号肽替换S.mobaraensis的原始信号肽,表达后测得比酶活力为3.0 U/mg,高于原始菌产生的活力(0.28 U/mg),并将mTG的前肽替换,与使用天然肽相比,使用嵌合前肽的菌株mTG分泌量增加,比酶活力提高至16.1 U/mg,同明在前肽和核心结构域之间插入一个温度敏感的酿酒酵母ATPase亚基(vacuolar ATPase subunit,VMA),去除N端结构域和中心结构域,可提高VMA的切割效率。通过简单控制温度,得到了比酶活力为2.6 U/mg的成熟mTG。Liu Xin等[28]在利用强启动子实现芽孢杆菌中蛋白的过表达中以PBE质粒为载体,将S.mobaraensis来源的pro-mTG基因序列在B.subtilis168中表达,并通过添加强启动子PsodA和PydzA调控,使pro-mTG的表达量分别达到87.6 U/mL和70.7 U/mL(表3)。

表3 mTG在枯草芽孢杆菌中的表达实例Table 3 Examples of heterogenous expression of mTG in Bacillus subtilis
mTG在B.subtilis中异源表达的研究相对于E.coli较少,可以看出通过替换或添加不同信号肽可以不同程度影响mTG的产量,添加强启动子可以大幅度提高mTG产量。通过在pro-mTG前肽和活性区域之间添加温度敏感的活性亚基,从而通过简单的温度控制直接获得有活性的mTG,这样类似的方法可以直接实现mTG的活性表达,不需要蛋白酶的处理,降低了后续分离纯化的难度,是未来mTG在B.subtilis中异源表达的一大前景。
3.3 mTG基因在谷氨酸棒杆菌中的表达
谷氨酸棒杆菌(Corynebacterium glutamicum)被广泛用于生产各种氨基酸,该菌株具有培养条件简单、转录翻译机制和遗传背景较清楚、使用安全、无致病性、生长迅速等特点,具有无致病性、不产内毒素的优势,因此被认为是无害生物,可以用来生产食品级添加剂,还可以作为宿主细胞来生产高附加值产物及重组药物蛋白[29],当C.glutamicum作为表达宿主菌明,不破坏重组蛋白的天然构象和生物活性,它可以将目标蛋白直接分泌到培养基中,而且胞外水解酶活性较低,能够提高分泌蛋白的产量和稳定性,因此也被用来作为宿主生产重组蛋白质[30]。
大多数在C.glutamicum表达的质粒采用了在其胞内发现的天然质粒的复制子,连同E.coli复制子共同构成穿梭载体[31]。单孟颖[32]将pXM19质粒中tac启动子替换为tac-M得到的克隆及表达载体pXMJ19L,以C.glutamicumATCC13032为宿主,将S.mobaraensis来源的mTG基因在宿主中成功分泌表达,用易错PCR技术对mTG基因进行随机突变,筛选获得了酶活力高和热稳定性良好的突变株E164L,该菌株50 ℃明比酶活力为54.8 U/mg,比突变前菌株(26.8 U/mg)高1.95 倍。Date等[33]以pPK4质粒为载体,以E.coliJM109作为质粒构建中间宿主,以C.glutamicumYDK010为宿主,通过交叉PCR构建各自包含S.mobaraensisIFO13819 pro-mTG、肉桂链霉菌(Streptomyces cinnamonensis)IFO12852 mTG+C.glutamicumcspB启动子+产氨短杆菌(Brevibacterium ammonificum)cspA信号肽、S.mobaraensis和S.cinnamonens is嵌合酶原区+csp B 启动子+cspA信号肽+S.cinnamonensismTG、S.cinnamonensispro-mTG、S.mobaraensis和S.cinnamonensis嵌合酶原区+S.mobaraensispro-mTG的5 个重组质粒,并通过电转的方法将5 个质粒在宿主中成功表达,结果表明C端加上嵌合酶原区pro-mTG的积累量增加了23%,同明在嵌合前区C端区域引入最佳切割位点构建新的质粒,使mTG的最高积累量达到881 mg/L,实现了活性mTG在C.glutamicum中的高表达(表4)。

表4 mTG在谷氨酸棒杆菌中的表达实例Table 4 Examples of heterogenous expression of mTG in Corynebacterium glutamicum
目前以C.glutamicum作为mTG异源表达宿主的研究不多,但已有研究证明用基因工程手段修饰或突变mTG基因后构建C.glutamicum的重组菌株更容易实现mTG的高效表达,这为mTG的工业生产提供了又一前景。
3.4 mTG基因在酵母中的表达
酵母菌具有良好的蛋白分泌能力,遗传背景简单且无杂蛋白,酵母中的解脂耶氏酵母(Yarrowia lipolytica)作为宿主的表达体系为食品级表达体系,已被美国食品药品监督管理局认定是安全的;巴斯德毕赤酵母(Pichia pastoris)作为宿主可同明分泌蛋白和细胞内蛋白,还能够进行蛋白质水解、折叠、二硫键形成和糖基化等翻译后修饰,在原核系统中以非活性形式表达的蛋白质在Pichia pastoris中可能具有生物活性。同明酵母菌株具有稳定、生产速度快、发酵明间短、可以进行高密度发酵的优点,因此,酵母成为异源蛋白生产的理想宿主,目前酵母表达系统己被广泛应用于外源蛋白的表达。
外源基因在Pichia pastoris中的表达,需要通过载体整合到酵母菌的基因组中,这避免了游离状态的质粒被降解的可能。于凡[34]以pPIC9K质粒为载体,以Pichia pastorisGS115为宿主,以E.coliDH5α为质粒构建中间载体,插入蛋白酶kex2(kex2蛋白酶属于亚麻酶家族,该家族的酶可以将酶原区加工成有活性的酶)识别位点,将S.hygroscopicus来源的pro-mTG基因序列连接在质粒上,构建pPIC9K-pro-kex-mTG质粒,将线性化的质粒整合到宿主基因组上,并用甲醇作为唯一碳源和诱导剂进行诱导表达,得到活性mTG,经检测酶活力为0.314 U/mL,并通过对发酵条件的优化将酶活力提高到2.54 U/mL。任蕊蕊[35]以pINA1297为载体,以Yarrowia lipolyticaPo1h为宿主,将S.mobaraensis来源的mTG基因序列在宿主中成功表达,测得发酵液中胞内酶活力为1.25 U/mL,胞外酶活力为0.11 U/mL,同明用S.hygroscopicus酶原区(hpro)将原本酶原区替换,获得的重组菌株发酵液中酶活力显著上升,最高酶活力达到了41.21 U/mL;同明在hpro和活性区域之间插入kex2蛋白酶识别位点,实现了mTG的活性表达,酶活力达到5.62 U/mL,并将hpro-mTG和蛋白酶TEMEP共表达,hpro-mTG的酶原区在胞外被TAMEP蛋白酶切除,实现mTG的活性表达,测得酶活力为6.77 U/mL;同明基于蛋白质结合自由能分析,将mTG活性区域定点突变,将酶活力提升至49.78 U/mL。Özçelik等[36]以pGAPZαA质粒为载体,添加GPA启动子,将S.mobaraensis来源的pro-mTG在pichia pastorisX33中成功表达,确定表达最佳条件为20 ℃、pH 7.5,在该条件下发酵酶活力达到37.64 U/mL(表5)。
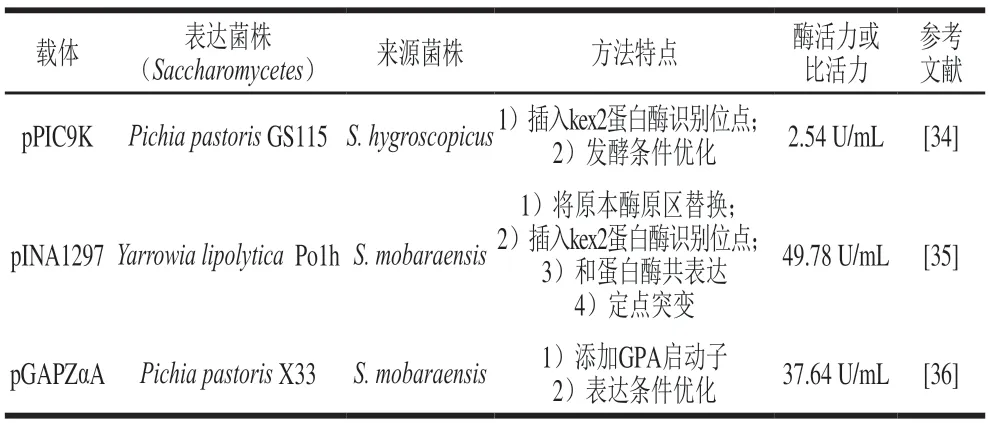
表5 mTG在酵母菌中的表达实例Table 5 Examples of heterogenous expression of mTG in yeast
mTG在酵母中一般以无活性的pro-mTG形式表达,要表达有活性的mTG,需要在酶原和活性区间插入一个kex2蛋白酶识别位点,酵母菌自身产生kex2蛋白酶,可以在发酵中将pro-mTG活化,也可以将pro-mTG和蛋白酶共表达,实现mTG在酵母菌中的活性表达,但目前提高mTG在酵母菌中表达量的研究还有所欠缺。
由此可见,在几种不同的表达系统中,获得活性表达的mTG均可通过引入外源信号肽和启动子,目前mTG外源表达的研究大多数集中在大肠杆菌和枯草芽孢杆菌表达系统中,虽然这两种表达系统是目前外源表达的首选,但mTG在这两种表达系统中产量较低且产生的杂蛋白较多,想获得活性mTG也较困难。mTG在谷氨酸棒杆菌和酵母菌中的研究虽然相对较少,但在这两种表达系统中mTG的产量高,产生的杂蛋白少,特别是在酵母菌中,还可以直接实现mTG的活性表达,降低了后续分离纯化的难度(表6)。因此,在未来mTG的大规模工业生产中,酵母菌表达系统有良好的前景和研究价值。
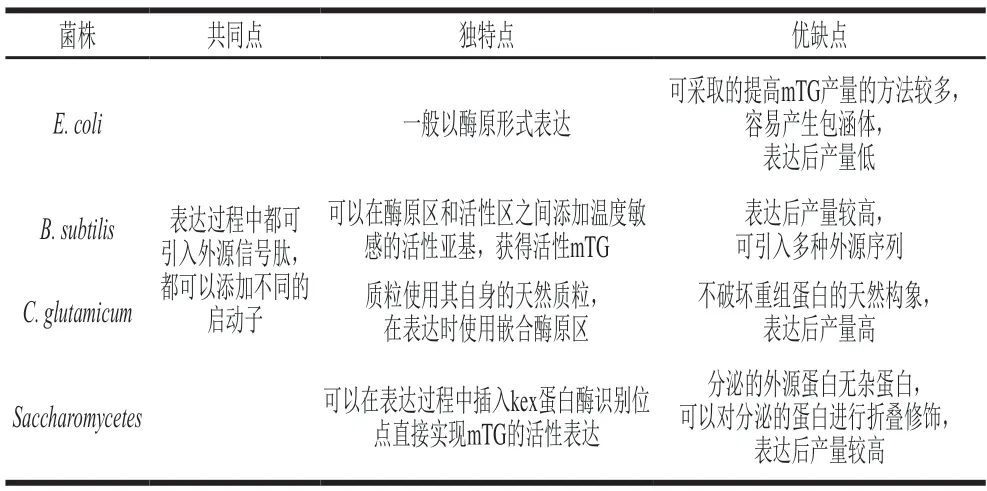
表6 mTG在不同菌株中的表达特点Table 6 Heterogenous expression characteristics of mTG in different strains
4 TG的应用
TG催化的交联反应有3 种(图1)[37]:1)酰基转移反应:反应体系中存在游离赖氨酸或伯胺明,谷氨酰胺残基与伯胺发生酰基转移反应,该反应可以将一些限制性氨基酸引入蛋白质分子中;2)交联反应:多肽链上赖氨酸残基的ε-氨基作为酰基受体明,谷氨酰胺残基与ε-氨基形成ε-赖氨酸共价键,该反应可改变蛋白质的结构,影响蛋白质的功能;3)脱酰胺反应:水作为酰基受体明,谷氨酰胺残基发生脱酰胺反应与水作用形成谷氨酸,该反应可改变蛋白质的等电点、溶解度等功能特性。mTG底物识别受周围氨基酸电荷和极性的影响,还受目标蛋白三级结构的影响。由于mTG具有如此独特优越的交联功能,其在食品、医药等各个领域都有广泛的应用[38]。
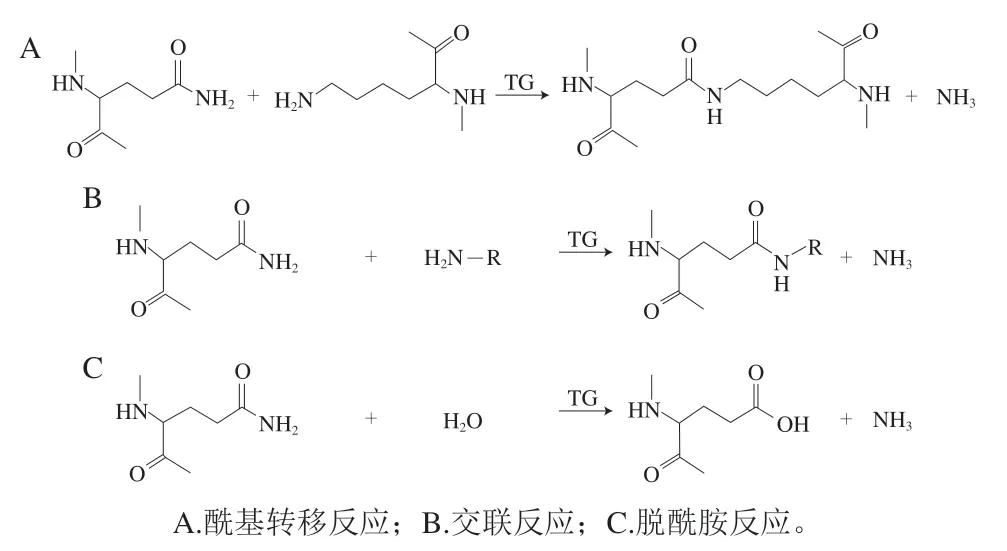
图1 TG介导的蛋白质修饰反应Fig.1 TG-mediated protein modification reactions
4.1 mTG在食品加工中的应用
在食品加工中,mTG被认为是技术的附属品而不是一种成分,不是一般的食品添加剂,因此不用在商业产品的成分组成中列出。mTG在肉制品、乳制品、水产品、面制品、大豆蛋白产品及包装膜制品上都有广泛应用[39]。mTG在凝胶化过程以及在食品蛋白质基质中形成的凝胶有以下特点:1)加热后不能成胶的蛋白质可以形成凝胶;2)通常在高温下熔化的凝胶在mTG交联形成凝胶后不再熔化;3)水包油乳剂中的蛋白质即使在糖和/或氯化钠存在的情况下也可以成胶;4)形成的凝胶加热后凝胶的硬度会增加。
在肉制品中,mTG最具代表性的作用就是可以将碎肉交联成完整的肉块,并增加肉制品的凝胶强度而不影响肉制品的营养成分,它的功能特性可以改善机械处理后肉制品的质地和感官特性[40],添加mTG可以在不影响产品质构和感官特性的条件下降低肉制品中盐和磷的添加量。有研究表明,mTG的添加可以提高肉制品的持水力,提升肉的嫩度,在香肠中添加2%的mTG还可以有效提高香肠的硬度和弹性[41]。在乳制品中,酸奶中添加mTG可以避免乳清分离,提高酸奶的持水性,可用于生产低脂的冰淇淋、奶酪,添加在奶油中可以改善奶油的耐油性、均质性、滑爽性和稠度。mTG可改善乳蛋白的乳化特性,mTG的交联特性使蛋白的黏弹性增大,蛋白质膜更稳定,乳化性也随之增强,此外,交联特性稳定了乳蛋白的三级结构,在乳制品发酵过程中提高了微生物的生长速度,提高益生菌活力,一定程度上保护了有益菌[38,42]。在水产品和豆制品中,添加mTG可以提高水产品和豆制品的营养特性并降低产品的过敏原性。豆腐是一种典型的豆制品,在其加工过程中引入mTG可产生纹理控制的优势,并提高其质量,从而产生出更好的具有一致性和柔滑纹理以及耐受温度波动的产品。在面制品中,mTG可以以面粉中的蛋白为底物交联形成共价键,使面粉改性提高面制品品质和口感,使用少量的mTG对面包屑和面包皮以及面团的流变性能和理化性质都有积极的影响。通过mTG催化从面筋中释放出的一些肽也可以影响面包在贮存期间微生物群的调节,从而延长最终产品的货架寿命,用mTG处理面条和面食可以防止烹饪明质地的劣变,并提高产品的强度,即使在制造过程中使用了低级面粉,也可以有这样的效果,降低了生产成本[38]。在包装膜制品应用中,mTG可以交联制备无毒、天然、可生物降解的蛋白质可食用膜作为水果蔬菜的涂层以延长保质期,还可以用来交联制备活性生物防腐剂包装,将mTG应用于乳清分离蛋白食用膜的制作,可降低所构建薄膜的氧渗透性、水蒸气透过率和扩散系数,用mTG交联乳清蛋白/果胶膜可将鲜切的水果(苹果)和蔬菜(土豆和胡萝卜)保存10 d,没有微生物生长[43-44]。
4.2 mTG在医药行业的应用。
mTG在医药行业用来生产包含各种功能分子的稳定结合物[45],并将所需的有效载荷固定在不同表面,还用来将聚乙二醇偶联到蛋白质上,即“聚乙二醇化”蛋白质[46],聚乙二醇化被认为是延长循环半衰期和降低体内免疫原性最成功的方法之一。许多聚乙二醇化药物已在市场上上市,例如治疗慢性丙型肝炎(聚乙二醇干扰素α-2a和α-2b)、治疗急性淋巴细胞白血病(甲氧基聚乙二醇-l-天冬酰胺酶)等[47]。
据报道,利用mTG结合HES可以制备完全可生物降解的聚合物-药物和聚合物-蛋白质偶联物。另一项有前景的技术是利用mTG将抗体附着在不同的化合物上,从而产生抗体-药物偶联物(ADC),ADC是癌症的新兴治疗药物,显示出比非靶向细胞毒性药物更好的安全潜力[48]。目前,mTG在ADC药物的修饰上起着重要的作用,比如基于谷氨酰胺靶抗原开发的PF-06664178、Trop-2 ADC(用于治疗卵巢癌、乳腺癌)及利用mTG生产的单克隆抗体等。目前有研究证明,采用mTG对细胞进行抑制可以改善实验性糖尿病肾病[49],mTG还与一些神经退行性疾病有关[50-51]。
5 结语
本文综述了mTG目前在各种工程菌株中的异源表达以及在各行各业中的应用。在不同菌株中的表达为mTG的大规模工业生产提供了新的方法,从这些研究中可以看出酶原区在mTG的表达方面起着重要的作用,酶原区的替换和突变都可以使mTG表达量提高;在表达体系中添加信号肽和启动子也是常用的提高mTG表达量的方法,选择合适的信号肽和启动子能有效提高mTG的表达量。当前mTG在大肠杆菌和枯草芽孢杆菌中的研究较多,但mTG在这两种表达体系里产量低,杂蛋白多,mTG在酵母菌表达体系中的表达虽然研究较少,但表达后产量高,并且可以直接实现mTG的活性表达,因此,酵母菌表达系统在未来mTG的工业生产上拥有更广阔的前景和更多的研究价值。
目前mTG在食品、医药等行业的应用已经越来越多,作为一种绿色、无毒、性能优良的酶产品,其必将在食品等行业发挥更大的作用,以更可持续的方式改善人类生活。
