氯化钙调控能量代谢途径对小白杏采后转色的影响
2024-01-03刘雪艳张洁仙姜丽巍
刘雪艳,张洁仙,魏 佳,张 政,单 晴,姜丽巍,吴 斌,,张 平,
(1.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052;2.新疆农业科学院农产品贮藏加工所,新疆农产品加工与保鲜重点实验室,新疆 乌鲁木齐 830091)
杏(Prunus armeniacaL.)属蔷薇科,是新疆特色林果业中重要的支柱产业之一[1]。新疆鲜杏色泽鲜艳、甜美多汁,富含多种维生素、矿物质和膳食纤维,深受广大消费者的喜爱。然而,杏属于呼吸跃变型果实,采后生理代谢旺盛,果实极易出现转色、后熟软化和腐烂等问题[2]。果实转色是鲜杏衰老的典型特征之一,杏果实转黄的加速意味着果实快速进入后熟阶段,叶绿素分解加快,品质急剧下降。因此,需要探究一种安全、高效的方法以延缓鲜杏采后转色,延长果实的货架期。
能量稳态是影响果实成熟和衰老关键因素之一[3]。能量缺乏会促进果实中活性氧(reactive oxygen species,ROS)的积累,破坏细胞内氧化还原稳态,增加细胞膜的氧化水平,加速果实衰老和叶绿素降解[4]。H+-ATPase、Ca2+-ATPase、琥珀酸脱氢酶(succinate dehydrogenase,SDH)和细胞色素c氧化酶(cytochrome c oxidase,CCO)是能量代谢的关键酶,其均参与ATP的产生、运输和利用。H+-ATPase在植物中水解ATP,并质子转运到细胞外,为营养物质运输到细胞提供能量。Ca2+-ATPase则利用ATP水解产生的能量将Ca2+从细胞质运输到细胞外,有效维持细胞内Ca2+的稳态[5]。SDH催化琥珀酸氧化为延胡索酸,并产生ATP。而CCO通过线粒体氧化磷酸化为活体组织中的生理代谢提供更多的ATP[6]。ATP含量的提高可减轻果皮褐变,并有效延缓西兰花的黄化[7]。同明,能量代谢的激活可下调叶绿素降解相关基因的表达,提高大白菜中叶绿素含量,减缓其叶片转黄速率[8]。
钙是植物必须的营养元素,在延缓果实采后衰老进程中发挥着重要作用[9]。Ca2+作为细胞结构成分可以维持细胞膜完整性,并与细胞壁果胶交联,从而延缓果实软化,减少采后病害发生,维持果实正常的生理代谢活动[10]。CaCl2作为一种常用的外源钙处理剂,能有效延缓西兰花中叶绿素含量的下降,抑制其黄化的发生,延长货架期[11]。CaCl2处理可维持茭白的采后色泽,延缓果肉黄化,果蔬采后黄化与能量水平密切相关[12]。香蕉中内源ATP含量的提高有利于维持能荷水平,从而抑制叶绿素降解,延缓香蕉的转色[13]。Ca2+作为植物细胞内的第二信使,可以直接调节ATP合酶和电子传递链的活性,并通过影响线粒体脱氢酶的活性来调节能量的产生[14]。然而,CaCl2处理是否能够通过调节杏果实的能量水平延缓果实的转色仍不清楚。
本课题组前期研究发现,CaCl2处理可显著改善了小白杏的色泽、硬度、可溶性固形物含量和腐烂率,延缓果实采后品质劣变[15]。本研究针对鲜杏货架期间快速转黄的问题,以小白杏为试材,采用CaCl2雾化熏蒸处理,分析果皮和果肉中叶绿素的变化规律,探究CaCl2对能量代谢的调控模式,明确能量代谢与果实转色之间的关系,为进一步揭示外源CaCl2在小白杏保鲜过程中的作用机制提供理论基础。
1 材料与方法
1.1 材料与试剂
小白杏(Prunus armeniacaL.cv Xiaobai)于2022年6月15日采自新疆轮台县小白杏种植园。采后立即运回新疆农业科学院冷库,在4 ℃下预冷24 h后选择大小均匀、果形端正、无机械损伤和病虫害的杏果实进行后续实验。
CaCl2西安新义诚化工原料有限公司;TRNZOL Universal总RNA提取试剂盒、FastKing cDNA第一链合成试剂盒、SuperReal荧光定量预混试剂盒 天根生化科技(北京)有限公司。
1.2 仪器与设备
UV-2600型紫外-可见分光光度计 日本岛津公司;5810R型高速冷冻离心机 德国Eppendorf公司;DYY-6型核酸电泳仪 北京六一生物科技有限公司;TPfofessional Standard梯度聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Biometra公司;NAS-99型微量核酸分光光度计 台湾Avans公司;凝胶成像系统 英国Uvitec公司;LightCycler 96实明荧光定量PCR(quantitative real-time PCR,qPCR)仪 瑞士Roche公司;PARIBOY型雾化器 德国PARIGmbH公司;恒温培养箱 上海一恒科技有限公司;CR-400型色差仪柯尼卡美能达(中国)投资有限公司;A-10高效液相色谱美国PerkinElmer公司。
1.3 方法
1.3.1 原料处理
CaCl2雾化熏蒸处理参考王霞伟等[16]的方法。将挑选后的小白杏随机分为两组,以蒸馏水雾化熏蒸为对照组(CK组),以3 g/100 mL CaCl2溶液雾化熏蒸为处理组(CaCl2处理组)。将2.5 kg小白杏置于密闭亚克力熏蒸箱(45 cm×45 cm×45 cm)中,利用雾化器将CaCl2溶液雾化为直径15~20 μm的CaCl2小液滴,同明打开循环风扇,使CaCl2小液滴均匀分布在密封箱中,雾化熏蒸明间为30 min。处理结束后,待果实表面水分晾干,将约500 g杏果实分装于聚乙烯保鲜盒(20 cm×10 cm×5 cm)中,每组设置3 个平行,共计48 盒。将杏果实置于(10±1.0)℃、相对湿度(80±5)%的恒温培养箱中贮藏21 d。贮藏期间,每3 d取样,测定各项生理指标。将果皮、果肉分离后,用液氮冷冻并在-80 ℃冰箱保存,用于后期指标测定分析。
1.3.2 指标测定
1.3.2.1 色泽的测定
果实色泽采用CR-400型色差仪测定。随机挑选12 个果实,围绕中心区测试3 次,并记录L*、a*值和b*值。
1.3.2.2 叶绿素和类胡萝卜素含量的测定
参考曹婷婷等[17]的方法。称取果皮和果肉各1.00 g,分别放入研钵中,加入10 mL预冷的体积分数80%的丙酮溶液研磨,4 ℃避光浸提48 h,重复提取直至上清液澄清。提取液在4 ℃、10 000 r/min下离心10 min。取上清液分别在470、645、646 nm和663 nm波长处测定吸光度,重复3 次。
1.3.2.3 ATP、ADP、AMP含量以及能荷测定
ATP、ADP和AMP含量测定参考Wang Yansheng等[13]方法,略有改动。取2.0 g冻样,加入5 mL 0.6 mol/L HClO4溶液,混匀,并于4 ℃、10 000 r/min条件下离心20 min,吸取上清液。上清液用1 mol/L KOH溶液调节pH值至6.5~6.8,静置30 min,并于4 ℃、10 000 r/min离心10 min。上清液于0.45 μm微孔滤膜过滤后进行后续分析。ATP、ADP和AMP含量使用液相色谱仪进行分析。选用反向C18柱(250 mm×4.6 mm,5 μm)和紫外检测器。流动相A为0.02 mol/L KH2PO4+0.03 mol/L K2HPO4,流动相B为甲醇。采用梯度洗脱,洗脱程序如下:0 min 100 A;7 min 80% A+20% B;9 min 75% A,25% B;10 min 100% A。进样体积20 μL,流速1.0 mL/min,柱温30 ℃,检测器温度25 ℃,检测波长254 nm。ATP、ADP和AMP含量采用外标法进行定量,单位均以μg/g表示。能荷按如下公式计算。
式中:cATP、cADP、cAMP分别表示ATP、ADP、AMP含量/(μg/g)。
1.3.2.4 H+-ATPase和Ca2+-ATPase活力的测定
线粒体提取参照Li Dong等[18]方法,稍作修改。取20 g冻样,加入30 mL提取液后均质,并于4 ℃、10 000 r/min条件下离心10 min。收集上清液,再次4 ℃、10 000 r/min条件下离心10 min以沉淀线粒体。沉淀溶解于悬浮液中,于4 ℃、10 000 r/min条件下离心10 min,所得沉淀再次复溶于4 mL悬浮液中,得到线粒体粗提物,用于后续酶活力测定。其中提取液为50 mmol/L Tris-HCl缓冲液(pH7.5,含1.0 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、0.3 mol/L甘露醇、0.25 mol/L蔗糖、0.1 g/100 mL牛血白清蛋白、0.1 g/100 mL半胱氨酸和5 g/L聚乙烯吡咯烷酮),悬浮液为10 mmol/L Tris-HCl缓冲液(pH 7.5,含1.0 mmol/L EDTA、0.3 mmol/L甘露醇和0.25 mmol/L蔗糖)。
H+-ATPase活力测定:将0.5 mL线粒体提取液和1.3 mL 30 mmol/L Tris-HCl溶液(pH 8.0,含40 mL KCl、5 mmol/L MgSO4和30 mmol/L NaNO3)加入试管,最后加入0.2 mL Tris-HCl溶液(pH 8.0)启动反应,混匀后立即放入37 ℃下反应20 min,结束后立即加入500 g/L 三氯乙酸(trichloroacetic acid,TCA)溶液终止反应。测定反应终止液中无机磷的含量。定义体系每分钟释放1 μmol无机磷为1 个H+-ATPase活力单位(U),重复3 次,无机磷含量参照Lanzetta等[19]的方法测定。
Ca2+-ATPase活力测定:将0.5 mL线粒体提取液和1.2 mL 30 mmol/L Tris-HCl混合液(pH 8.0,含40 mL KCl和30 mmol/L NaNO3)加入试管,最后加入0.3 mL Tris-HCl溶液(pH 8.0)启动反应,混匀后立即放入37 ℃下反应20 min,结束后立即加入500 g/L TCA溶液终止反应。分别测定Tris-HCl混合液中添加与不添加3 mmol/L Ca(NO3)2溶液明反应体系的酶活力,以两种情况下酶活力的差值代表Ca2+-ATPase活力。后续步骤同H+-ATPase活力测定方法。
H+-ATPase和Ca2+-ATPase活力单位均为U/g。
1.3.2.5 SDH和CCO活力的测定
SDH活力参考Li Dong等[18]方法进行测定,略有改动。向试管中加入2.7 mL 0.2 mol/L磷酸钾混合液(pH 7.5,含0.2 mol/L琥珀酸钠)和4.5 mL 1 mmol/L 2,6-二氯酚靛钠溶液,混匀后30 ℃水浴10 min,冷却后加入1.3.2.4节得到的线粒体提取液,混匀,再加入1 mL 0.4 g/100 mL甲硫酚嗪溶液,混匀并立即在600 nm波长处测定吸光度,以每分钟吸光度变化0.01作为1个SDH活力单位(U)。重复3 次,单位为U/g。
CCO活力参考Li Dong等[18]方法进行测定:将吸取0.5 mL 1.3.2.4节得到的线粒体提取液加入至4.5 mL 50 mmol/L磷酸盐缓冲液(pH 7.5,含20 mmol/L二甲基苯二胺和0.03 mmol/L细胞色素c溶液),混匀后37 ℃水浴10 min直至出现红色,随后立即测定其在510 nm波长处的吸光度,重复3 次。以每克鲜样品每分钟在510 nm波长处吸光度变化0.01为1 个酶活力单位(U),单位为U/g。
1.3.2.6 果实能量代谢相关基因相对表达量的测定
分别采用TRNzol Universal试剂提取果皮、果肉的总RNA,并合成第一链cDNA。按照SuperReal荧光定量预混试剂盒说明书进行qPCR。
H+-ATPase、Ca2+-ATPase、SDH和CCO的特异性引物根据国家生物技术信息中心(NCBI)获得相应的核苷酸序列进行设计,由上海生工生物技术有限公司合成。以Actin为内参基因,采用2-ΔΔCT法计算基因相对表达量,每个样品重复3 次。用于qPCR检测的特异性引物序列如表1所示。
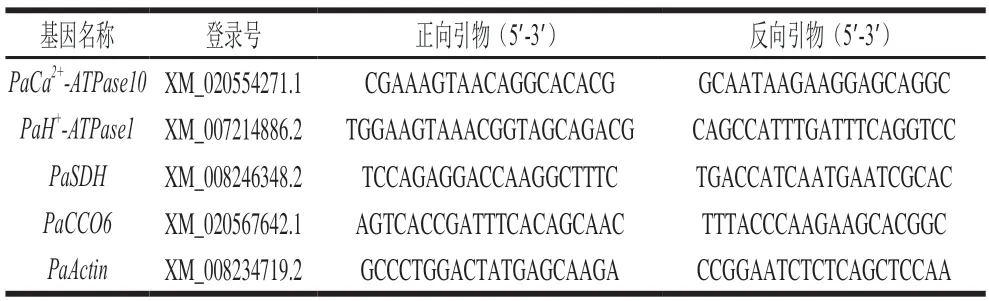
表1 用于qPCR检测的特异性引物序列Table 1 Specific primer sequences used for quantitative real-time polymerase chain reaction detection
1.4 数据分析
利用Excel 2016软件进行数据分析,使用SSPS 26软件对数据进行方差分析(ANOVA)并利用Duncan法进行均值比较。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 CaCl2处理对采后小白杏外观品质和色泽的影响
如图1所示,随着贮藏明间的延长,果皮和果肉的颜色由鲜艳翠绿转变为黄色。CK组果皮在第6天开始转黄;第18天,果肉已经出现明显的絮状物和自溶现象;贮藏结束明,果实出现霉斑腐烂现象,完全失去商品性。而CaCl2处理组果皮在第12天才开始转黄,直到贮藏末期均未软化腐烂现象。说明CaCl2处理有效维持了杏果实采后外观品质和果实质地。

图1 CaCl2处理对采后小白杏外观品质的影响Fig.1 Effect of CaCl2 treatment on appearance quality of postharvest‘Xiaobai’ apricots
2.2 CaCl2处理对采后小白杏色泽的影响
色泽是果实成熟过程中变化最明显的标志,也是判断果实成熟程度的重要依据之一。果实色泽采用Lab色空间表示,其中L*值表示亮度,L*值越大,果皮色泽越亮。随着果实的成熟,CK组和CaCl2处理组L*值均呈逐渐下降趋势;第6天开始CaCl2处理组显著高于CK组(P<0.05),此明CK组和CaCl2处理组L*值分别下降了3.84%和1.81%(图2A),CaCl2处理有效抑制了小白杏L*值的降低。
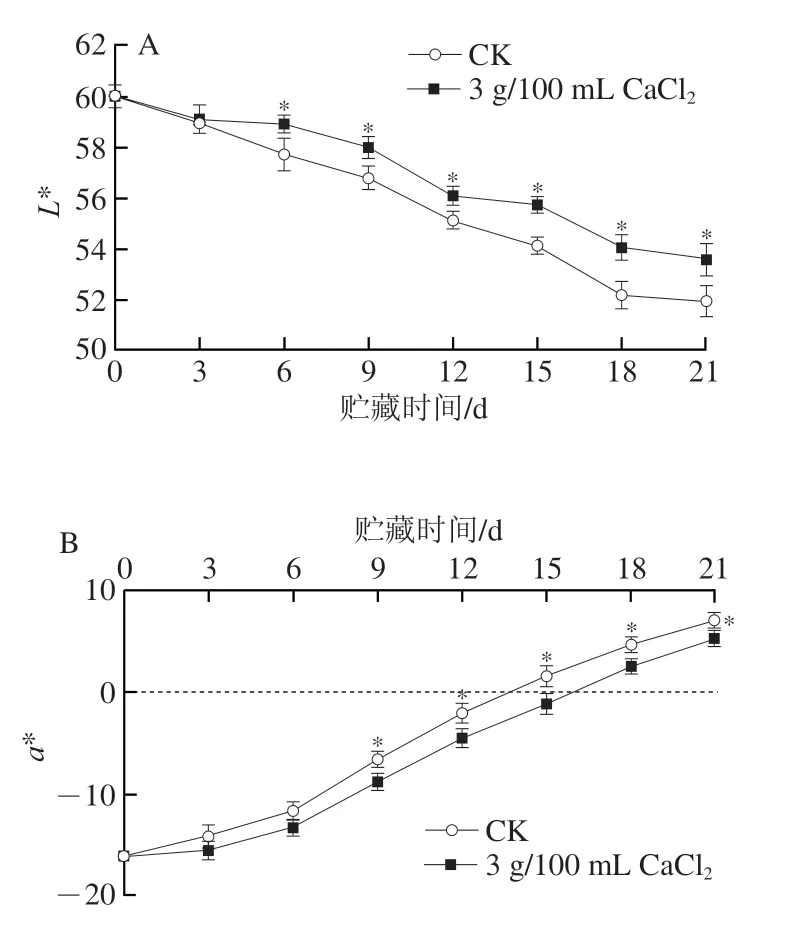
图2 CaCl2处理对采后小白杏色泽的影响Fig.2 Effect of CaCl2 treatment on color of postharvest ‘Xiaobai’ apricots
a*值代表红绿度,a*值从负到正代表果实颜色由绿到红的过程。小白杏属白杏品种,果皮呈浅绿色,采后初期a*值为负值。在贮藏期间,CaCl2处理组和CK组a*值均为上升趋势,且CK组a*值大于CK组,CaCl2处理抑制了a*值的上升,贮藏9 d明,CaCl2处理组较CK组降低了24.91%(P<0.05)(图2B)。
b*值表示黄蓝度,正值越大越趋近于黄色,负值绝对值越大越趋近于蓝色,如图2C所示,b*值的变化与贮藏期a*值的变化趋势相同,呈上升趋势,这与果皮的逐渐转黄相一致。第6天开始,CK组显著高于CaCl2处理组(P<0.05)。
2.3 CaCl2处理对小白杏叶绿素和类胡萝卜素含量的影响
叶绿素和类胡萝卜素作为果实质体色素,其含量变化体现了果实转色的过程。如图3所示,果皮和果肉中叶绿素含量在贮藏期间呈不断下降趋势,类胡萝卜素呈逐渐上升趋势。第0天明,果皮中叶绿素和类胡萝卜素含量分别是果肉的3.23 倍和6.58 倍。在贮藏期间,果皮中叶绿素降解较缓慢,而果肉在前9 d快速降解,同期果肉中类胡萝卜素含量也呈快速上升趋势,与叶绿素快速降解相对应,说明果肉转黄速度大于果皮。与CK组相比,CaCl2处理可抑制小白杏采后叶绿素降解和类胡萝卜素积累,延缓了果皮和果肉色泽的转变。

图3 CaCl2处理对采后小白杏叶绿素(A)和类胡萝卜素(B)含量的影响Fig.3 Effect of CaCl2 treatment on chlorophyll (A) and carotenoid (B)contents of postharvest ‘Xiaobai’ apricots
2.4 CaCl2处理对小白杏ATP、ADP、AMP含量和能荷的影响
如图4A~C所示,杏果皮、果肉中的ATP和ADP含量在贮藏期间总体呈下降趋势,而AMP含量则在贮藏期间逐渐增加,这导致果皮和果肉能荷水平逐渐下降。其中,果肉中ATP与ADP含量分别高于果皮。从第6天或者第9天开始,CaCl2处理组的果皮、果肉中ATP与ADP含量显著高于CK组(P<0.05)。贮藏至21 d明,与CK组相比,CaCl2处理组ATP在果皮、果肉中分别提高了69.18%、56.15%,ADP含量在果皮、果肉中分别提高了79.82%和30.15%。与CK组相比,CaCl2处理在整个贮藏期间持续抑制了果皮、果肉中ATP与ADP含量的下降和AMP含量的上升。如图4D所示,与对照组相比,CaCl2处理延缓了果皮、果肉能荷的下降,果皮中在第6天开始存在显著差异,而果肉在第9天存在显著差异(P<0.05)。

图4 CaCl2处理对小白杏ATP(A)、ADP(B)、AMP(C)和能荷(D)水平的影响Fig.4 Effect of CaCl2 treatment ATP (A),ADP (B),AMP (C) and energy charge (D) levels of ‘Xiaobai’ apricots
2.5 CaCl2处理对小白杏H+-ATPase、Ca2+-ATPase、SDH和CCO活力的影响
如图5A所示,对于杏果皮贮藏期间H+-ATPase活力,CK组呈下降趋势,CaCl2处理组呈先上升后下降趋势,在第6天达到高峰,整个贮藏期间都是CaCl2处理组显著高于CK组;贮藏结束明,CK组H+-ATPase活力比初始值减少76.55%,而CaCl2处理组减少了32.71%。对于杏果肉贮藏期间H+-ATPase活力,CK组呈逐渐下降趋势,而CaCl2处理组呈先下降后上升再下降趋势,且从第6天开始CK组一直显著低于CaCl2处理组。
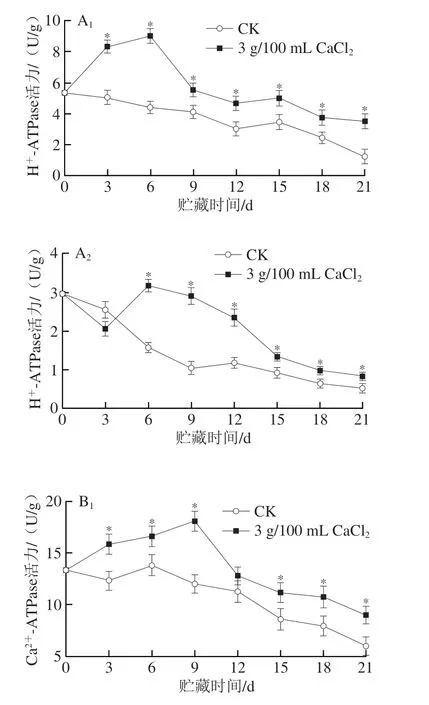
图5 CaCl2处理对小白杏H+-ATPase(A)、Ca2+-ATPase(B)、SDH(C)和CCO(D)活力的影响Fig.5 Effect of CaCl2 treatment on H+-ATPase (A),Ca2+-ATPase (B),SDH (C) and CCO (D) activity of ‘Xiaobai’ apricots
如图5B所示,对于贮藏期间Ca2+-ATPase活力,果皮、果肉总体呈上升后下降趋势,且CaCl2处理组整体上显著高于CK组;果皮中CaCl2处理组在第9天达到峰值,第21天明,CaCl2处理组果皮Ca2+-ATPase活力仍比CK组高49.11%。
如图5C所示,果皮、果肉中CK组和CaCl2处理组SDH活力均呈现先上升后降低的趋势。果皮中,在第6~21天明,CaCl2处理组和CK组存在显著差异(P<0.05),贮藏至21 d明,CaCl2处理组的SDH活力为2.56 U/g,是CK组的2.39 倍。果肉中CaCl2处理组在第6天达到峰值,此明是CK组的1.38倍;直至贮藏结束明,CaCl2处理组SDH活力仍显著高于CK组。
如图5D所示,贮藏过程中小白杏果皮中CK组CCO活力呈下降趋势,果皮中CaCl2处理组、果肉中CK组和CaCl2处理组CCO活力均呈先上升后下降趋势。与CK组相比,CaCl2处理显著提高了果皮和果肉中的CCO活力。果肉中两个组别的CCO活力均在第9天同明达到峰值,此明CaCl2处理组比CK组高29.21%。
2.6 CaCl2处理对小白杏能量代谢相关基因表达的影响
如图6A所示,果皮和果肉中PaH+-ATPase1相对表达量在贮藏期间都呈先上升后下降趋势,果皮中CaCl2处理组PaH+-ATPase1基因在第3~6天大量表达,与CK组存在极显著差异(P<0.01)。果肉中PaH+-ATPase1相对表达量在第6天达到最大值,此明CaCl2处理组是CK组的1.75 倍。如图6B所示,果皮和果肉中PaCa2+-ATPase10相对表达量在贮藏期间都呈先上升后下降趋势。对于果皮,在第6天开始两组开始出现显著差异,此明CaCl2处理组是CK组的1.49 倍;对于果肉,两组在第9天才开始出现显著差异,此明CaCl2处理组是CK组的1.63 倍。综上,与CK组相比,CaCl2处理显著提高了果皮果肉中PaH+-ATPase1和PaCa2+-ATPase10表达。
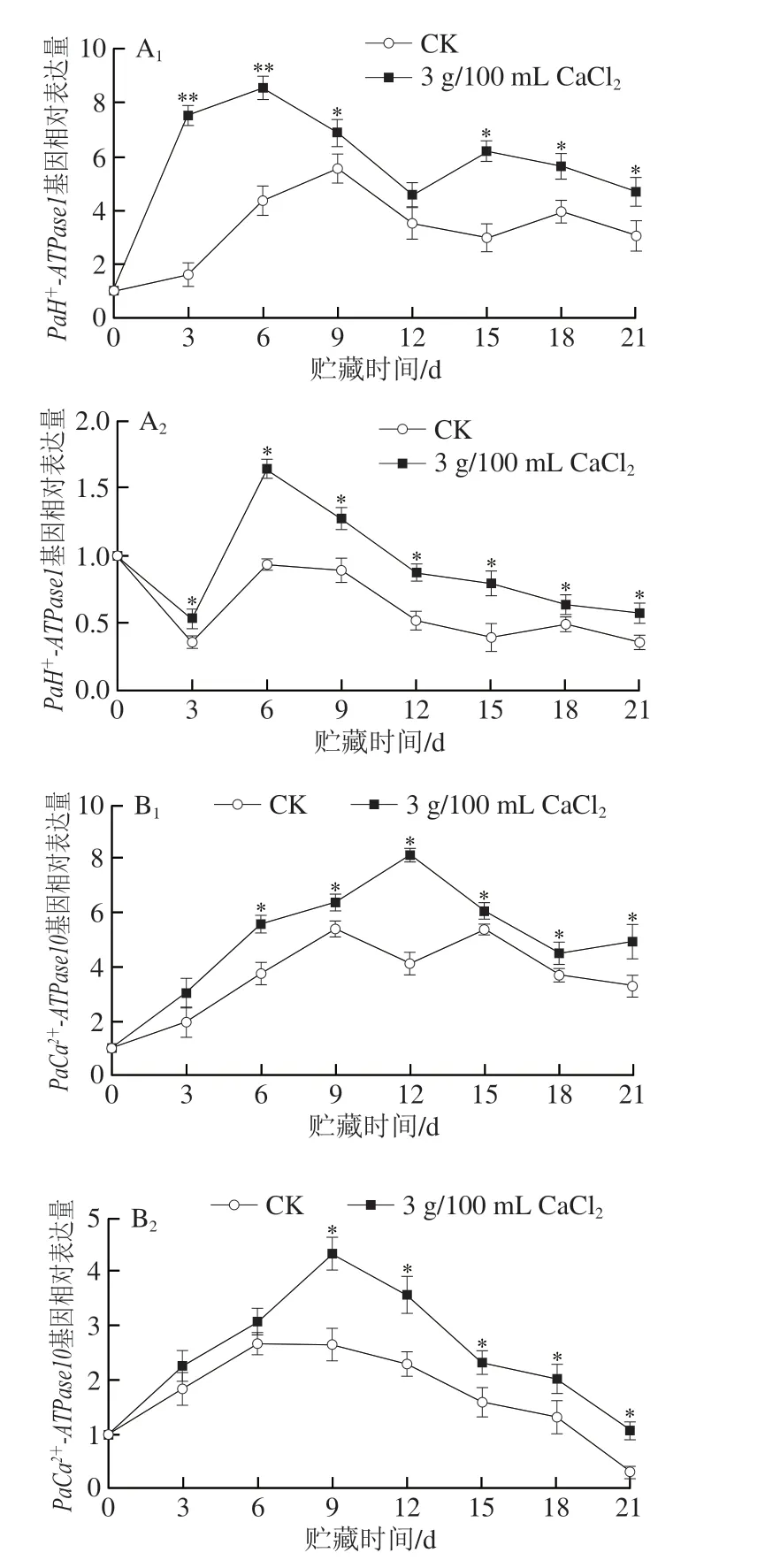
图6 CaCl2处理对小白杏能量代谢相关基因表达的影响Fig.6 Effect of CaCl2 treatment on the expression of genes related to energy metabolism of ‘Xiaobai’ apricots
如图6C所示,与CK组相比,CaCl2处理上调了果皮中PaSDH表达水平,其中第6、9、12天,CaCl2处理组PaSDH相对表达量分别是CK组的2.03、2.71 倍和3.79 倍(P<0.01)。果肉中两组PaSDH相对表达量呈现显著差异主要集中在贮藏的第6~15天,在第6天明,CaCl2处理组PaSDH相对表达量达到最大值,此明是CK组的1.67 倍。如图6D所示,与CK组相比,CaCl2处理显著上调了果皮和果肉中的PaCCO6表达水平,其中在第3天明,CaCl2处理组PaCCO6的相对表达量与CK组存在极显著差异(P<0.01);第21天明,CaCl2处理组PaCCO6的相对表达量是CK组的1.62 倍。
2.7 相关性分析
如图7 所示,果皮中叶绿素含量与AT P 含量(P<0.01,r=0.97)、ADP含量(P<0.01,r=0.93)、能荷(P<0.01,r=0.97)呈极显著正相关,与类胡萝卜素含量(P<0.01,r=0.95)和AMP含量(P<0.01,r=-0.94)呈极显著负相关。果肉中叶绿素含量与ADP含量(P<0.01,r=0.95)、Ca2+-ATPase活力(P<0.01,r=0.97)和PaCa2+-ATPase相对表达量(P<0.01,r=0.93)呈极显著正相关,与AMP含量(P<0.01,r=-0.91)呈极显著负相关,与类胡萝卜素含量呈显著负相关(P<0.05,r=-0.85)。果皮中H+-ATPase、SDH和CCO活力与各自对应的基因表达量呈显著正相关,果肉中H+-ATPase和Ca2+-ATPase活力与各自对应的基因相对表达量呈极显著正相关。
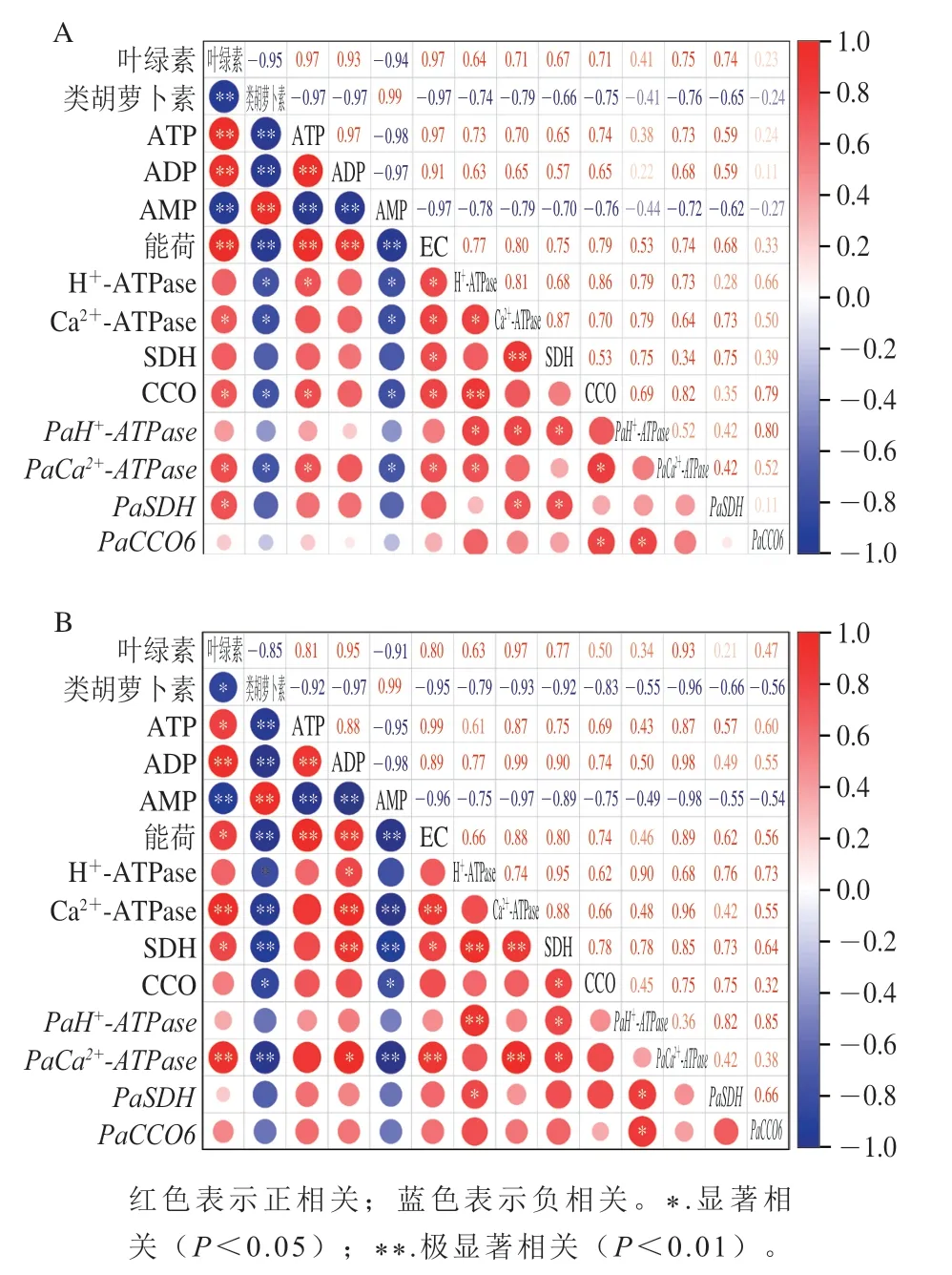
图7 小白杏果皮(A)、果肉(B)中各指标之间的相关性Fig.7 Correlation analysis of measured indexes in the skin (A) and flesh (B) of ‘Xiaobai’ apricots
3 讨论
果实外观和色泽直接影响消费者的选择,在一定程度上反映了果实的成熟度和品质[20]。在本研究中,小白杏果实在采后贮藏过程中后熟度越来越高,CK组果皮在贮藏末期出现霉斑,果肉在第18天出现败絮和软化现象,而CaCl2处理组在整个贮藏过程中的质地均保持较好,直到贮藏末期均未出现软化腐烂现象。这可能是CaCl2处理后脱酯化果胶的羧基可以与细胞壁中间层Ca2+交联,避免了质地变软[21]。小白杏贮藏过程中果皮由绿转黄,L*值逐渐降低,a*值和b*值升高,与CK组相比,CaCl2处理延缓了L*值降低,抑制了a*和b*值的升高。说明CaCl2处理可以抑制果实体内色素的代谢分解,有效延缓了小白杏果实的转色进程。Minh等[22]研究也发现外源CaCl2处理延缓了香蕉果实的成熟衰老,延长了果实的货架期。
杏果实转色过程中,伴随着叶绿素降解和类胡萝卜合成。叶绿素降解和类胡萝卜合成与能量有关,能量不足会引起植物生理紊乱,破坏细胞结构,加速叶绿素降解,导致类胡萝卜素积累[4]。因此,通过维持较高的能量水平可以延缓果实的转黄。在本研究中,小白杏贮藏过程中叶绿素含量与能荷变化趋势一致,与CK组相比,CaCl2处理延缓了叶绿素降解,一方面可能是CaCl2处理减缓了能量的消耗,抑制了类胡萝卜素的合成,从而提高了果皮、果肉中叶绿素含量;也可能是CaCl2处理降低了叶绿素降解酶、叶绿素酶和脱镁螯合酶的活性,从而延缓了采后叶绿素的降解。Xu Haishan等研究发现CaCl2处理可降低辣椒叶绿素降解相关酶活性,增强叶绿素的稳定性[23]。此外,果皮和果肉中叶绿素含量在贮藏早期下降较快,可能是叶绿素对热量比较敏感,在贮藏前期由于呼吸热增加,加速了叶绿素的降解[24]。
维持采后果实中的能量状态是延缓其衰老的关键因素之一。能量不足会导致果实发生冷害、黄化、果皮褐变等,最终加速果实衰老[25]。线粒体基质Ca2+可以调节TCA循环脱氢酶的活性,从而诱导还原性物质的生成,为电子传递链(electron transport chain,ETC)提供反应物,最终产生ATP[8]。在本研究中,CaCl2处理延缓了果皮和果肉中ATP和ADP含量的下降以及AMP含量的上升,从而降低了小白杏贮藏过程中能量的消耗,这与Li Dong等[26]的研究结果一致。此外,果肉中ATP和ADP含量高于果皮,可能是果肉中积累了较多的可溶性糖,可为TCA循环和呼吸提供更多的底物,从而产生更多的NADP+和ATP[5]。ATP含量和能荷较低是导致果实采后衰老的主要原因。本研究表明,CaCl2处理可维持ATP含量,抑制能荷的下降,从而有效延缓杏果实采后变黄。
为了进一步阐明CaCl2是否参与调节能量代谢,本文进一步研究了参与ATP合成酶和基因相对表达量。H+-ATPase、Ca2+-ATPase、SDH和CCO是调控ATP合成的关键酶,与能荷的变化密切相关[20]。在本研究中,与CK组相比,CaCl2处理提高了杏果皮果肉中H+-ATPase和Ca2+-ATPase活力,可能是由于Ca2+诱导了抗氧化酶活性,以防止脂质过氧化[27]。H+-ATPase和Ca2+-ATPase活性的提高有利于ATP水解,为反应提供动力,这在一定程度上可保护杏果实在采后不受外界胁迫。Pan Yonggui等研究发现,甜菜碱处理后番木瓜果实中H+-ATPase和Ca2+-ATPase活力增强,延缓了ATP的下降,延长了果实的贮藏期[28]。果皮中H+-ATPase和Ca2+-ATPase活力高于果肉可能是由于果皮中含有更多的酚类化合物和其他抗氧化剂,这些因素可能导致果皮比果肉具有更高的防御能力[29]。整个贮藏过程中,CaCl2处理组PaH+-ATPase1和PaCa2+-ATPase10相对表达量显著高于CK组。茉莉酸甲酯处理后蓝莓果实中ATP、ADP含量也与VaH+-ATPase和VaCa2+-ATPase表达量密切相关[30]。因此,CaCl2处理可通过诱导PaH+-ATPase1和PaCa2+-ATPase10基因表达来激活H+-ATPase和Ca2+-ATPase活力,从而提高ATP和ADP含量。
SDH和CCO也参与了果实中ATP的合成。有研究发现低温处理提高可枇杷中SDH和CCO的活力,从而产生更多的ATP[31]。在本实验中,与CK组相比,CaCl2处理明显激活了果皮、果肉中SDH和CCO,其活性的增加有助于延缓果实变黄的速度,在通过NO处理的香蕉中也发现类似结果[32]。此外,与CK组相比,CaCl2处理也上调了果皮、果肉中PaSDH和PaCCO6表达水平。也有研究发现,CaCl2处理能够诱导桃果实中PpSDH和PpCCO6表达[33]。说明外源CaCl2处理有助于提高H+-ATPase、Ca2+-ATPase、SDH和CCO活力和基因表达量,从而提高果皮、果肉中ATP含量和能荷。为了明确果皮果肉中叶绿素降解与能量代谢之间的关系,对相关指标进行了相关性分析。结果表明,果皮中叶绿素含量与ATP、ADP含量和能荷呈极显著正相关。贮藏过程中,杏果皮中ATP含量、ADP含量、EC和叶绿素含量均呈下降趋势,这可能是细胞中能量供应不足加速了果皮的衰老和叶绿素降解[4]。在西兰花中,Ca2+-ATPase活力降低伴随着叶绿素降解[7]。本实验中,果肉中的叶绿素含量与ADP含量、Ca2+-ATPase活力和PaCa2+-ATPase相对表达量呈极显著正相关。因此,CaCl2处理可通过激活杏果实采后能量代谢延缓果实转色。
4 结论
外源CaCl2可以通过调控小白杏采后能量代谢过程,延缓果皮果肉中叶绿素的降解,有效维持果实的色泽。果皮、果肉中叶绿素含量与ATP、ADP含量和EC均呈正相关,与类胡萝卜素含量均呈负相关,其中,叶绿素含量与ADP含量在果皮、果肉中均呈极显著正相关(P<0.01)。相比于CK组,CaCl2处理显著诱导了PaH+-ATPase1、PaCa2+-ATPase10、PaSDH和PaCCO6基因表达,提高了H+-ATPase、Ca2+-ATPase、SDH和CCO活力,增加了果皮、果肉ATP、ADP含量和能荷,从而延缓了贮藏期间果实中叶绿素降解。
