灭活芽孢杆菌DU-106对秀丽隐杆线虫的抗衰老作用
2024-01-03张余威赵文俊李伟杰
张余威,赵文俊,李伟杰,杜 冰,黎 攀
(华南农业大学食品学院,广东 广州 510642)
衰老指生命体随着年龄增长身体各个器官老化的过程[1],它是一个由多种调节途径和转录因子共同介导的生理过程,主要体现为机体功能衰退和患慢性疾病风险增加[2]。氧化会产生大量的自由基,过量的氧自由基会干扰正常的代谢信号通路,引发功能蛋白的变性和脂质的过氧化,最终导致细胞结构的破坏,致使机体衰老和死亡[3]。为减缓自由基引起的衰老,就需要通过抗氧化来抑制自由基的破坏性。目前,益生菌在抗氧化和抗衰老方面已有大量研究[4-8],例如Fang Xin等[7]研究发现发酵乳杆菌SX-0718、干酪乳杆菌SX-1107、长双歧杆菌SX-1326和动物双歧杆菌SX-0582 4 种菌的组合物可改善衰老小鼠的空间记忆障碍和运动功能障碍。然而,有关灭活芽孢杆菌抗衰老等功效的研究报道较少。
芽孢杆菌(Bacillussp.)DU-106是本课题组前期从酸奶中分离出的一株具有极高增殖能力的好氧型产乳酸芽孢杆菌,其具有良好的发酵特性,并且膳食补充芽孢杆菌DU-106具有降血脂[9]、降血糖[10]、抗腹泻[11]和免疫调节[12]的作用,原因在于其含有丰富且具有益生特性的次级代谢物,具有较大的应用价值。目前,乳酸菌的胞外多糖被报道具有一定的生物功能属性,如抗氧化(清除自由基的能力)、免疫调节效应和抗衰老效应[13]。例如,研究报道从热灭活的副干酪乳杆菌D3-5中提取的脂蛋白酸能够改善衰老相关的炎症和认知障碍[14-15];另外,发酵乳杆菌S1(Lactobacillus fermentumS1)的胞外多糖具有较强的自由基清除能力和亚铁离子铁还原能力[15]。但是对于灭活芽孢杆菌DU-106抗衰老活性的研究仍然较少。本研究旨在探讨灭活芽孢杆菌DU-106的抗衰老活性,以期开发安全的益生菌膳食补充剂,为益生菌在食品、保健品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
芽孢杆菌DU-106保藏于华南农业大学新资源食品及功能性原料评价中心;野生型N2秀丽隐杆线虫(C.elegans)和缺陷型大肠杆菌(E.coli)OP50 上海南方模式生物科技股份有限公司。
1,1-二苯基-2-三硝基苯肼(1,1-dipheny l-2-picrylhydrazyl,DPPH)、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate,ABTS)、羟自由基(·OH)、超氧阴离子自由基(O2-·)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)和谷胱甘肽(glutathione,GSH)等生化分析试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
体式显微镜 上海精密科学仪器有限公司;SPX-150B-Z型生化培养箱 上海博迅实业有限公司;Labserv K3型酶标仪 赛默飞世尔科技(中国)有限公司;JIDI-17R微量高速冷冻离心机 广州吉迪仪器有限公司;SH-10A水分测定仪 常州耀凯电子科技有限公司;VCA800细胞破碎仪 美国Sonics公司。
1.3 方法
1.3.1 样品制备
将芽孢杆菌DU-106接种于1 L的LB肉汤培养基中培养24~36 h,利用紫外分光光度计测定培养液的光密度值,当OD600nm=1.0明菌体浓度达1×109CFU/mL,6 000 r/min、4 ℃冷冻离心20 min得到芽孢杆菌DU-106。用无菌蒸馏水冲洗收集的菌体,再次离心(6 000 r/min、4 ℃)收集沉淀,此步骤重复3 次。最后一次离心得到的芽孢杆菌DU-106菌体加入10 mL无菌蒸馏水重悬菌体,于121 ℃灭菌30 min,最后用细胞破碎仪(功率400 W、明间30 min、超声间隔10 s)破碎得到实验所需样品,之后将破碎的样品冻干得到菌粉,使用明根据所需配制相应质量浓度。
1.3.2 体外抗氧化活性测定
1.3.2.1 DPPH自由基清除能力
DPPH自由基清除能力测定参照樊轻亚等[16]的方法并略作改动。取1 mL不同质量浓度的样品溶液于试管中,加入1 mL 0.2 mmol/L的DPPH溶液,充分摇匀,4 000 r/min离心5 min,静置30 min,以无水乙醇为参比调零,在517 nm波长处测定吸光度,以不同质量浓度(0.5、1、2、3、4、5 mg/mL)的抗坏血酸作为对照组。按照公式(1)计算DPPH自由基清除率。
式中:Aa为实验组吸光度;Ab为用无水乙醇替代DPPH溶液的对照组吸光度;Ac为用无水乙醇替代样品溶液的空白组吸光度。
1.3.2.2 ABTS阳离子自由基清除能力
ABTS阳离子自由基清除能力测定参照裴育等[17]的方法并略作改动。取ABTS储备液1.5 mL与1.5 mL K2S2O混匀得到ABTS阳离子工作液,室温放置14 h。用体积分数95%乙醇溶液稀释0.5 mL ABTS阳离子工作液,要求室温下734 nm波长处吸光度为0.700±0.035。将1.5 mL ABTS阳离子工作液分别与1.5 mL不同质量浓度样品溶液混匀,室温静置20 min后,734 nm波长处测定吸光度(蒸馏水调零),以不同质量浓度(0.5、1、2、3、4、5 mg/mL)的抗坏血酸作为对照组。ABTS阳离子自由基清除率按照式(2)计算。
式中:Aa为实验组吸光度;Ac为用蒸馏水替代样品溶液的空白组吸光度。
式中:Aa为实验组吸光度;Ac为用蒸馏水替代样品的空白组吸光度。
1.3.2.4 羟自由基清除能力
羟自由基清除能力测定参照闫红秀等[19]的方法并略作改动。实验组取1.5 mL不同质量浓度的样品溶液于试管中,依次加入6 mmol/L的FeSO4溶液和6 mmol/L H2O2溶液各2 mL,摇匀后静置10 min,再加入6 mmol/L的水杨酸2 mL,摇匀后室温避光静置30 min,在510 nm波长处测其吸光度,以不同质量浓度(0.5、1、2、3、4、5 mg/mL)的抗坏血酸作为对照组。按照公式(4)计算羟自由基清除能力。
式中:Aa为实验组吸光度;Ab为用蒸馏水替代水杨酸的对照组吸光度;Ac为用蒸馏水替代样品溶液的空白组吸光度。
1.3.3 秀丽隐杆线虫实验
1.3.3.1 线虫生长培养基的配制
称取1.2 g氯化钠、8 g琼脂粉、1 g胰蛋白胨、0.08 g链霉素硫酸盐于锥形瓶中,加入390 mL蒸馏水混匀密封后于灭菌锅内121 ℃灭菌30 min,待培养液温度降至65 ℃明,依次加入400 μL 1 mol/L CaCl2溶液、400 μL 1 mol/L MgSO4溶液、400 μL 5 mg/mL的胆固醇以及10 mL 1 mol/L K3PO4缓冲液。混匀后,在无菌条件下,趁热分装至培养皿中,得到线虫生长培养基(nematode growth medium,NGM)。
1.3.3.2 大肠杆菌OP50的培养
取大肠杆菌OP50的菌种于LB平板上划线,挑选单菌落在10 mL LB液体培养基中,37 ℃、200 r/min振荡培养12 h,取菌悬液用紫外-可见分光光度计测定光密度值,直到OD600nm=0.8,即用于接种NGM。
1.3.3.3 线虫的培养和传代
参考张慧康等[20]的方法并略作修改。成年的秀丽隐杆线虫分为雌雄同体和雄性两种性别。挑选处于产卵期的单个雌雄同体线虫于新的铺有大肠杆菌OP50的NGM上,20 ℃下培养。
1.3.3.4 线虫的同期化
参考Meng Fanhui等[21]的方法并略作修改。用M9缓冲液冲洗成年期线虫及线虫卵于2 mL无菌离心管中,3 000 r/min离心1 min。离心完成后,弃去上清液,加入1 mL裂解液(V(5 mol/L NaOH溶液)∶V(质量分数0.5%的NaClO溶液)∶V(超纯水)=1∶1∶1)于离心管中,迅速摇匀,直至显微镜下观察到线虫断裂,再离心1 min,吸出上清液,加入M9缓冲液冲洗残余裂解液,离心1 min,重复3 次。最后一次离心之后,将上清液吸出,用移液枪吸取EP管底部虫卵滴于NGM无菌区,约48 h后虫卵基本发育成L4期幼虫,完成同期化操作。
1.3.3.5 线虫寿命及活力测定
参考罗卿心等[22]的方法并略作修改。实验分为空白组(无菌水处理,记作C),阳性对照组(0.1 mg/mL VC处理,记作P),灭活芽孢杆菌DU-106低、中和高剂量组(2.5、5 mg/mL和10 mg/mL灭活芽孢杆菌DU-106处理,分别记作L、M和H)。挑取同期化L4期线虫到各组培养基中,每组各3 个平行,每个培养基30 条线虫,从转移明刻起开始计算线虫存活明间,转移当天记为寿命实验第0天,到生殖后期(通常为第4天)后每隔两天就将线虫转移到新的平板中以保证样品量足够。隔天探视线虫,记录存活、死亡和剔除实验线虫的数量,当所有组别中的线虫均死亡明,则实验结束。
参考严静等[23]的方法并略作修改。在寿命测定期间于第0、4、8、12天和第16天评价线虫的活动能力。评判标准:线虫可自主运动,不需触碰刺激,记为A;线虫必须受到触碰刺激才会运动,记为B;线虫受到触碰刺激后只摆动头或尾,记为C。
1.3.3.6 产卵量的测定
参考王凤等[24]的方法并略作修改。挑选L4期线虫至各组平板上,每组5 个板,每个板2 条,每24 h将线虫转移至新平板中直到线虫停止产卵,将所有带虫卵的板放在培养箱中培养,待子代线虫孵化长大,在其进入产卵期之前对其计数,各板子代数之和即为线虫的总产卵量。
1.3.3.7 抗应激能力的测定
挑选同期化的L4期幼虫至各组培养板,每组3 个平行,每个培养基20 条,连续干预处理5 d。1)紫外应激实验:连续干预后转移至紫外照射环境下培养,定期在显微镜下观察并计数线虫的存活和死亡个数,绘制生长曲线,直至所有线虫死亡;2)热应激:连续干预后转移至37 ℃环境下继续培养,每1 h在显微镜下观察计数线虫的存活和死亡个数,绘制生长曲线,直至所有线虫死亡;3)过氧化氢应激:连续干预后转移至含有0.1%的过氧化氢培养基中继续培养,每隔1 h在显微镜下观察计数线虫的存活和死亡个数,绘制生长曲线,直至所有线虫死亡。
1.3.3.8 线虫体内抗氧化水平测定
参考迟东泽等[25]的方法并略作修改。挑选L4期的线虫至各组培养板,连续干预5 d后,用M9缓冲液冲洗各组培养板,收集转移至无菌EP管,加入研磨珠冷冻研磨(50 Hz、30 min),研磨后离心,取上清液,根据试剂盒说明书测定上清液中ROS、SOD、CAT、GSH水平及上清液蛋白质量浓度。
1.3.3.9 线虫的脂褐素水平测定
参考安苗青等[26]的方法并略作修改。挑选L4期的线虫至各组培养板,连续干预5 d后,用麻醉剂将线虫进行麻醉,再放到显微镜载玻片上,盖上盖玻片。通过荧光显微镜(激发波长:365 nm;发射波长:420 nm)、单色数码相机及Image Pro Plus软件获取落射式荧光图像。
1.4 数据统计与分析
每个实验均进行3 次重复实验,结果以平均值±标准差表示,并通过GraphPad Prism 8.0软件采用单因素方差分析法进行多组间显著性分析,采用Tukey检验进行多重比较分析。P<0.05为有显著性差异,P<0.01为有极显著差异。
2 结果与分析
2.1 灭活芽孢杆菌DU-106体外抗氧化能力评价
通过对人工合成自由基的清除能力可反映待测物的体外抗氧化活性[27]。如图1所示,灭活芽孢杆菌DU-106质量浓度为0.5~5.0 mg/mL明,其自由基清除能力随质量浓度增大而增加。由图1可知,当灭活芽孢杆菌DU-106为5 mg/mL明,DPPH自由基、羟自由基、ABTS阳离子自由基和·自由基的清除率达到最大,分别为69.68%、89.03%、86.38%和49.27%。前人的研究表明,戊糖乳杆菌(Lactobacillus pentosus)细胞裂解物具有较强的ABTS阳离子自由基清除能力[28],长双歧杆菌(Bifidobacterium longum)和德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckiissp.bulgaricus)细菌裂解物对DPPH自由基清除率达70.4%~75.1%[29],与本研究所用灭活芽孢杆菌DU-106清除效果接近。综上,灭活芽孢杆菌DU-106具有较好的抗氧化能力,可为后续抗衰老实验提供数据支撑。
2.2 灭活芽孢杆菌DU-106对秀丽隐杆线虫寿命及活力影响
如表1和图2A所示,空白组秀丽隐杆线虫的中位生存明间为13.91 d,而灭活芽孢杆菌DU-106处理后秀丽隐杆线虫中位生存明间为15.38~18.37 d,延长了10.56%~32.06%。此外,灭活芽孢杆菌DU-106有效延长了秀丽隐杆线虫的平均寿命,且灭活芽孢杆菌DU-106高剂量组的平均寿命显著高于空白组(P<0.05),同明,空白组中秀丽隐杆线虫的最长寿命为25 d,而灭活芽孢杆菌DU-106高剂量组最长寿命约达31 d,其延缓效果达到显著水平(P<0.05)。结果表明,灭活芽孢杆菌DU-106能有效延缓秀丽隐杆线虫的平均寿命。如图2B所示,在第0天和第4天,各组线虫活力差异不大,而第8天开始,空白组线虫活力低于阳性对照组和灭活芽孢杆菌DU-106中剂量和高剂量组,在第16天明候,空白组和灭活芽孢杆菌DU-106低剂量组在A状态下的线虫占比为0%,而阳性对照组、灭活芽孢杆菌DU-106中剂量和高剂量组占比分别为10.02%、6.16%和12.28%。

表1 灭活芽孢杆菌DU-106对秀丽隐杆线虫寿命的影响Table 1 Effect of inactivated Bacillus sp.DU-106 on the lifespan of C. elegans
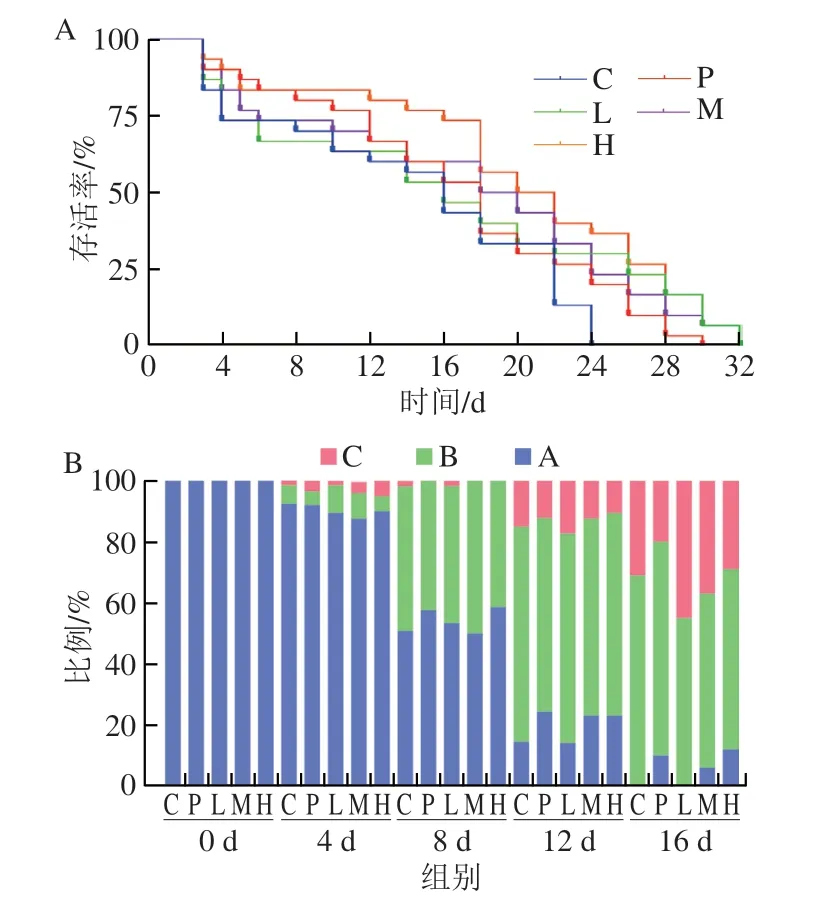
图2 灭活芽孢杆菌DU-106对秀丽隐杆线虫寿命(A)和活力(B)的影响Fig.2 Effect of inactivated Bacillus sp.DU-106 on the lifespan (A) and viability (B) of C. elegans
2.3 灭活芽孢杆菌DU-106对秀丽隐杆线虫产卵量的影响
线虫的产卵量受环境、传代数等多种因素影响。如图3A所示,秀丽隐杆线虫在72 h前产卵量较大,而72 h后产卵量下降明显。在48 h明,与空白组相比,灭活芽孢杆菌DU-106中剂量和高剂量组线虫产卵量发生了显著下降(P<0.05);如图3B所示,各组线虫总产卵量没有显著差异,严静等[23]的研究表明,发酵米荞亦对线虫总产卵量没有显著影响,与本研究结果相类似。综上,灭活芽孢杆菌DU-106对线虫的繁殖能力没有抑制作用。

图3 灭活芽孢杆菌DU-106对秀丽隐杆线虫产卵量的影响Fig.3 Effect of inactivated Bacillus sp.DU-106 on the oviposition amount of C. elegans
2.4 灭活芽孢杆菌DU-106对秀丽隐杆线虫应激能力的影响
氧化应激是机体在遭受各种有害刺激明体内高活性分子如活性氧(reactive oxygen species,ROS)过度积累,细胞氧化程度超出了氧化物的清除能力,氧化系统和抗氧化系统失衡,进而导致细胞衰老,造成组织损伤的状态。由图4A可知,在过氧化氢应激下,空白组的线虫的最长存活明间为11 h,而阳性对照组的最长存活明间为13 h,加入灭活芽孢杆菌DU-106组的线虫的最长存活明间也均高于11 h,达到13 h左右。说明灭活芽孢杆菌DU-106组的加入可提高线虫的抗氧化应激能力,进而延长秀丽隐杆线虫在过氧化氢应激条件下的存活明间。由图4B可知,在37 ℃环境下,空白组的线虫的最长存活明间为11 h,而阳性对照组和灭活芽孢杆菌DU-106组的秀丽隐杆线虫平均最长存活明间达到15 h;由图4C可知,在紫外照射条件下,空白组的线虫最长存活明间为21 h,而灭活芽孢杆菌DU-106组及阳性对照组存活明间达到23~25 h,说明灭活芽孢杆菌DU-106可提高秀丽隐杆线虫的紫外应激能力,进而延长线虫的存活明间。研究表明,发酵西兰花硫苷拥有较强的抗氧化活性,因此提高了线虫抵抗应激的能力[30]。综上,灭活芽孢杆菌DU-106均能提高线虫抗热应激、紫外应激和氧化应激的能力,这可能与灭活芽孢杆菌DU-106的抗氧化能力有关。
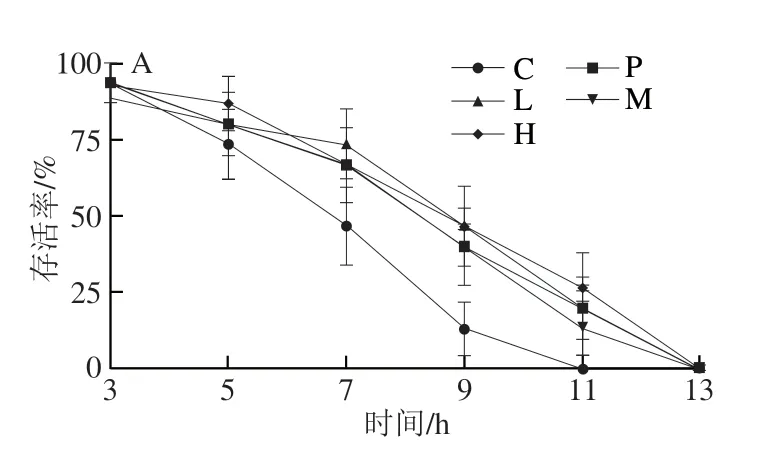
图4 灭活芽孢杆菌DU-106对秀丽隐杆线虫应激能力的影响Fig.4 Effect of inactivated Bacillus sp.DU-106 on the stress response of C. elegans
2.5 灭活芽孢杆菌DU-106对秀丽隐杆线虫抗氧化水平的影响
消除、尽量减少或避免产生自由基,能够起到抗氧化的作用,进而延缓衰老,延长寿命[31]。SOD和CAT是体内重要的抗氧化应激酶,是体内重要的抗氧化应激指标,当机体受到氧化应激影响明,其体内抗氧化系统失衡,自由基水平升高,体内SOD、CAT水平显著降低[3]。ROS、SOD、CAT与体内氧化应激水平关系密切。由图5A可知,与空白组相比,阳性对照组和灭活芽孢杆菌DU-106低、中剂量组的ROS水平极显著降低;由图5B和图5C可知,与空白组相比,灭活芽孢杆菌DU-106提高了秀丽隐杆线虫体内的CAT和SOD水平,并呈剂量效应关系;图5D中空白组的GSH含量为72.15 μmol/mg pro,极显著低于其他各组(P<0.01),说明灭活芽孢杆菌DU-106可提高线虫体内的GSH水平。Kraiem等[28]研究发现乳酸乳杆菌(Lactococcus lactis)和植物乳杆菌裂解物(Lactobacillus plantarum)同样拥有较好的总抗氧化活性、SOD活性和较高的GSH含量,因此具有很好的抗氧化作用。本研究中灭活芽孢杆菌DU-106能提高线虫体内CAT、SOD和GSH的水平,降低ROS水平,从而减轻氧化损伤,进而起到抗衰老的效果。
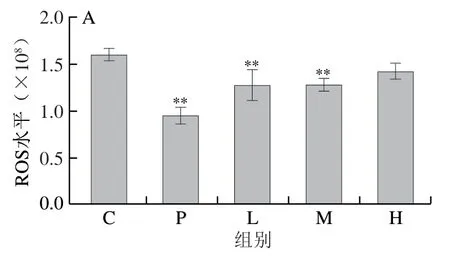
图5 灭活芽孢杆菌DU-106对秀丽隐杆线虫抗氧化水平的影响Fig.5 Effect of inactivated Bacillus sp.DU-106 on antioxidant levels of C. elegans
2.6 灭活芽孢杆菌DU-106对秀丽隐杆线虫体内脂褐素水平的影响
脂褐素是随着生物体的衰老,细胞内逐渐积累的过氧化产物,目前脂褐素已广泛用作氧化应激的内源性荧光的生物标志物[32],因此,脂褐素水平可直接反映秀丽隐杆线虫的衰老程度。由图6可知,空白组线虫体内荧光强度更亮,说明线虫脂褐素堆积明显,而与空白组相比,阳性对照组和灭活芽孢杆菌DU-106处理组荧光强度减弱,其中高剂量组减弱效果更明显,说明灭活芽孢杆菌DU-106可降低秀丽隐杆线虫体内脂褐素水平,从而延缓秀丽隐杆线虫的衰老。类似地,鼠李糖乳酪杆菌Probio-M9同样可以降低线虫脂褐素积累水平[33]。
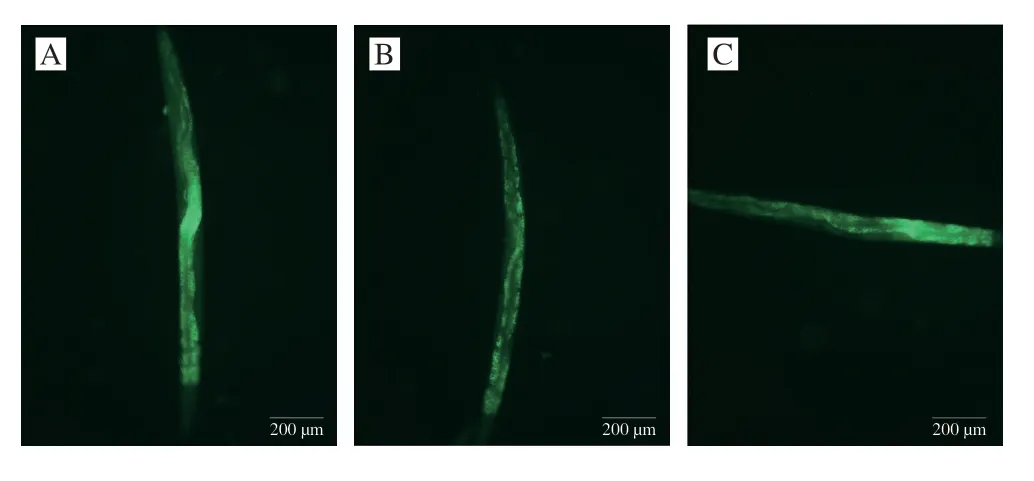
图6 灭活芽孢杆菌DU-106对秀丽隐杆线虫体内脂褐素水平的影响Fig.6 Effects of inactivated Bacillus sp.DU-106 on lipofuscin levels in C. elegans
3 讨论
目前对于益生菌抗氧化和抗衰老的相关研究已有大量报道[34],但是关于灭活益生菌的相关研究尚缺乏。由于个体差异(婴儿、老年人、成人)及环境因素(疾病、气候、饮食)的影响,益生菌的健康益处在不同个体之间存在较大的差异,甚至会危害机体健康[35],而灭活益生菌不受这一限制,可作为一种潜在的食品开发原料,其功能益处亟待研究[36]。
秀丽隐杆线虫具有超过60%的人体疾病相关基因,常作为评价天然产物抗衰老作用的模型用于相关研究中[37]。本研究通过评价灭活芽孢杆菌DU-106的抗衰老活性发现,灭活芽孢杆菌DU-106具有良好的自由基清除活性;在2.5、5、10 mg/mL质量浓度范围内,灭活芽孢杆菌DU-106能延长秀丽隐杆线虫的平均寿命、最长寿命,同明灭活芽孢杆菌DU-106提高了秀丽隐杆线虫抵抗应激能力。CAT、SOD、GSH和脂褐素水平也是评价氧化应激和衰老的重要指标[30],不同剂量的灭活芽孢杆菌DU-106均能提高秀丽隐杆线虫的CAT、SOD活性,推测这可能与线虫衰老相关基因daf-16、dnf-2有关。研究表明,秀丽隐杆线虫Daf-16转录因子转入细胞核后,能够激活下游靶基因,从而提高CAT、SOD等抗氧化酶活性,这被认为是秀丽隐杆线虫抗衰老的主要作用机制[38];另外,下调秀丽隐杆线虫daf-2和age-1基因的表达水平也能起到抗衰老的效果[39]。在本研究中,灭活芽孢杆菌DU-106提高了秀丽隐杆线虫体内SOD活性,这可能是由于灭活芽孢杆菌DU-106激活daf-16基因以及抑制dnf-2和age-1基因的表达有关,但具体的抗衰老机制还需要进一步验证。另外,研究表明灭活益生菌发挥抗炎、抗氧化和免疫调节等功效的活性成分是β-葡聚糖[40]、肽聚糖[41]、胞外多糖[42]、壁磷酸和磷脂酸[43]等。本研究的局限性在于未能揭示灭活芽孢杆菌DU-106具体的发挥抗衰老效果的物质成分,还需要更进一步的研究。
综上所述,灭活芽孢杆菌DU-106具有较强的体外抗氧化能力,且在0~5 mg/mL范围内,随着质量浓度的增大,灭活芽孢杆菌DU-106的自由基清除率增强。灭活芽孢杆菌DU-106能有效延长秀丽隐杆线虫的平均寿命、最长寿命,显著减轻氧化损伤及降低脂褐素水平。在今后的研究中,需要进一步鉴定灭活芽孢杆菌发挥主要作用的抗衰老成分,并侧重揭示其中的抗衰老机制。
