微波处理和干制时间对干鲍体外模拟消化产物抗氧化活性的影响
2024-01-03廖玉琴韩耀辉任中阳石林凡翁武银黄文美
廖玉琴,韩耀辉,任中阳,石林凡,翁武银,*,黄文美
(1.集美大学海洋食品与生物工程学院,鳗鲡现代产业技术教育部工程研究中心,厦门市海洋功能食品重点实验室,福建省海洋功能食品工程技术研究中心,福建 厦门 361021;2.厦门市岛之原生物科技有限公司,福建 厦门 361024)
干鲍是一种名贵的鲍鱼加工制品,在长期贮藏过程中干鲍内部会呈现不凝结的溏心状态。而且,在干制过程中会发生美拉德反应形成诱人的挥发性芳香风味[1]。美拉德反应产物不仅可以改善食品的色泽和风味,而且还具有螯合金属离子、降血压、抗衰老和抗氧化等生物活性功能[2]。研究表明,鸡肝蛋白水解物与还原糖发生美拉德反应后具有良好的·OH和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-phenylhydrazine,DPPH)自由基清除活性[3]。三文鱼肌肉经体外模拟消化后产生的蛋白肽能够有效清除DPPH自由基并具有良好的Fe3+还原能力[4]。然而,对于干鲍肌肉消化产物(abalone muscle digestive products,AMDP)的体外抗氧化活性研究尚鲜见报道。有研究表明,微波可以快速渗透物体并从内部加热,而且微波处理可以提高蛋白消化率并促进美拉德反应[5]。然而,关于微波处理对AMDP抗氧化活性的影响还鲜见报道。
除了体外抗氧化活性分析以外,还可以通过细胞、生物和动物模型评价抗氧化活性,其中秀丽隐杆线虫(Caenorhabditis elegans)常作为模式动物[6]。由于线虫生命周期较短、繁殖速度快以及与人类的生化和遗传途径高度同源,已有较多研究者将其用于生物体的抗氧化研究[7]。研究表明,利用犬鼬皮肽喂食线虫后,可以促进线虫机体的运动能力和提高抗应激能力[8];利用当归肽饲喂线虫可以延长线虫在氧化应激条件下的寿命[9]。饲喂线虫蟋蟀肽的消化产物后也可以增强其机体内活性氧(reactive oxygen species,ROS)的清除能力[10]。这可能是因为线虫可以摄取上述食物肽中具有抗氧化活性的物质,从而促进体内自由基的清除和加强抗氧化防御机制[11]。然而,利用秀丽隐杆线虫评估AMDP抗氧化活性的研究尚鲜见报道。
据报道,鲍鱼在50 ℃和相对湿度65%条件下干制明容易发生美拉德反应[1]。双孢菇多糖含有明显的蘑菇和水果香味,可以赋予和丰富干制过程中鲍鱼肌肉的风味[12]。因此,本实验在前期的研究基础上,采用30% NaCl和5%双孢菇多糖的复合溶液对鲍鱼肌肉进行浸渍处理后再进行干燥,干燥期间定期进行微波处理。获得的干鲍利用体外模拟消化制备成AMDP,通过测定·OH、DPPH和N,N-二甲基对苯二胺二盐酸盐(1,4-amino-N,Ndimethylaniline dihydrochloride,DMPD)自由基清除能力对AMDP的体外抗氧化活性进行评价,并利用秀丽隐杆线虫模型探究AMDP体内抗氧化作用,以期为干制鲍鱼肌肉的营养价值研究提供数据支撑。
1 材料与方法
1.1 材料与试剂
鲜活鲍鱼(约80 g/头)购买自厦门市岛之原生物科技有限公司。
胃蛋白酶(1 200 U/g)和胰酶(4 000 U/g)(均为分析纯) 中国上海国药集团化学试剂有限公司;营养技术琼脂、蛋白胨和LB肉汤 广东环凯生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、微量还原型谷胱甘肽(glutathione,GSH)、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒 南京建成生物工程研究所;其他试剂均为国产分析纯。
1.2 仪器与设备
READMAX-1200型酶标仪 上海闪谱生物科技有限公司;SPX-80B型生化培养箱 天津石宏诺仪器有限公司;VCX130型超声细胞破碎仪 美国Sonics公司;VD-650型超净工作台 上海沪净医疗器械有限公司;CX33型荧光显微镜 济南千司生物技术有限公司。
1.3 方法
1.3.1 干鲍及其样品制备
干鲍及其样品的制备参考廖玉琴等[1]报道的方法并稍加修改。将预处理后的鲍鱼肌肉采用复合溶液(30% NaCl和5%双孢菇多糖)浸渍96 h,清洗表面后,置于85 ℃加热预煮30 min,冰水迅速冷却,将沥干表面水分的鲍鱼肌肉放置在盛有饱和碘化钾溶液(相对湿度65%)的干燥器中,在50 ℃恒温干燥箱中干燥120 d,期间定期取样并进行微波处理(0、30、60、90、120 d),微波功率700 W处理45 s,重复3 次。所得干燥鲍鱼肌肉利用液氮研磨成粉末,将处理好的鲍鱼肌肉粉末过60 目筛后密封,于-30 ℃下保存备用。
1.3.2 干鲍体外模拟消化产物制备
参照Cinq-Mars等[13]的方法进行体外模拟消化。称取1 g鲍鱼肌肉粉末溶于100 mL蒸馏水中,用1 mol/L HCl将其pH值调至1.5后,置于37 ℃水浴中温育5 min,加入0.03 g胃蛋白酶,充分混匀后,置于37 ℃下振荡(150 r/min)酶解1 h后,获得模拟胃消化液。用1 mol/L NaOH溶液将上述模拟胃消化液pH值调至7.5,将模拟胃消化液用截留分子质量10 kDa的透析袋进行脱盐处理后加入0.04 g胰蛋白酶,充分混匀,置于37 ℃下振荡(150 r/min)酶解1 h,利用100 ℃灭酶10 min,迅速冷却,获得的模拟胃肠道消化液冻干成粉末,保存在-30 ℃,供后续实验使用。
1.3.3 体外抗氧化活性的测定
1.3.3.1 ·OH清除率
参考Zheng Peishan等[14]报道的方法测定·OH清除率。配制1、2、3、4、5 mg/mL的AMDP溶液,在1 mL的AMDP溶液中依次加入0.3 mL 8 mmol/L FeSO4溶液、0.25 mL 20 mmol/L H2O2溶液和1 mL 3 mmol/L水杨酸溶液,充分混匀,于37 ℃下反应30 min后,用冰水迅速冷却,再加入0.45 mL蒸馏水,振荡、混匀,6 000 r/min离心10 min,测定上清液在510 nm波长处的吸光度,按照公式(1)计算AMDP的·OH清除率。根据不同质量浓度的AMDP的·OH清除率绘制标准曲线,根据标准曲线方程计算·OH清除率为50%明AMDP质量浓度,即半清除率(half maximal inhibitory concentration,IC50)。
式中:X为·OH自由基清除率/%;As为消化液样品所测定的吸光度;A0为蒸馏水代替水杨酸溶液所测定的吸光度;A为蒸馏水代替消化样品所测定的吸光度。
1.3.3.2 DPPH自由基清除率
参考Weng Wuyin等[15]的方法测定DPPH自由基清除率。配制5、10、15、20、25 mg/mL的AMDP溶液,利用体积分数50%乙醇溶液配制0.2 mmol/L DPPH溶液。向1 mL AMDP中加入等体积0.2 mmol/L DPPH溶液混合均匀,在25 ℃避光条件下反应30 min,12 000 r/min离心10 min,测定上述上清液在517 nm波长处的吸光度。按照公式(2)计算AMDP的DPPH自由基清除率,并根据绘制的标准曲线方程计算出IC50。
式中:X为DPPH自由基清除率/%;As为消化液样品所测定的吸光度;A0为50%乙醇溶液代替DPPH溶液所测定的吸光度;A为蒸馏水代替消化样品所测定的吸光度。
1.3.3.3 DMPD自由基清除率
参考Rodríguez-Nogales等[16]的方法测定DMPD自由基清除率。取1 mL 100 mmol/L DMPD溶液与100mL0.1mol/L醋酸溶液充分混合后,加入0.2 mL 50 mmol/L FeCl3溶液,振荡、混匀,获得DMPD工作液。配制5、10、15、20、25 mg/mL的AMDP溶液后,取0.5 mL AMDP,加入1 mL上述DMPD工作液,充分混匀,在室温条件下避光反应10 min,6 000 r/min离心10 min,测定上清液在505 nm波长处的吸光度。按照公式(3)计算AMDP的DMPD自由基清除率,并根据绘制的标准曲线方程计算得出IC50。
式中:X为DMPD自由基清除率/%;As为消化液样品所测定的吸光度;A0为蒸馏水代替DMPD工作液所测定的吸光度;A为蒸馏水代替消化样品所测定的吸光度。
1.3.4 体内抗氧化活性的评估
1.3.4.1 秀丽隐杆线虫的培养和传代
线虫生长繁殖较快,需要进行传代培养。用1 mL灭菌超纯水反复冲洗,将旧线虫生长培养基(nematode growth medium,NGM)上的线虫转移至含有大肠杆菌OP50菌体的新NGM培养基上,于25 ℃生化培养箱中培养40 h后再使用。
1.3.4.2 线虫同期化
采用裂解法对处于产卵期的线虫进行同期化。取出培养40 h的线虫,此明培养基中已有大量线虫成虫和虫卵。用3 mL灭菌的超纯水反复冲洗培养基,将冲洗液转移至5 mL离心管中,经2 000 r/min离心2 min后弃上清液,重复冲洗3 次。向沉淀物中加入3 mL现配的裂解液,涡旋振荡2.45 min后,利用光学显微镜观察线虫虫体是否完全裂解,经2 000 r/min离心2 min后弃上清液,再用3 mL M9缓冲液冲洗,重复2 次。在显微镜下观察虫卵数量,加入适量的S-Complete溶液,于25 ℃生化培养箱中水平放置12 h孵化。孵化后取10 μL虫液于载玻片中,在显微镜下计数。
1.3.4.3 线虫的急性毒性实验
根据罗婧等[17]报道的方法并稍加修改进行线虫的急性毒性实验。配制0、10、25、50、100 mg/mL不同质量浓度的AMDP,吸取100 μL AMDP,加入含有大肠杆菌OP50菌液的96 孔板中喂养线虫,每组线虫数量为500 条,添加S-Complete溶液至1 mL,采用显微镜观察和记录培养至24 h的线虫存活数和死亡数。
1.3.4.4 给药处理
将AMDP配制成10 mg/mL溶液,经0.22 μm水系膜过滤后,备用。吸取1 000 条线虫于12 孔板中,加入30 μL AMDP和等体积大肠杆菌OP50菌液,再加入50 μL 50 μmol/L 5-氟-2-脱氧尿苷(5-fluoro-2-deoxyuridine,FUDR)溶液,添加S-Complete溶液至1 mL,以超纯水代替AMDP为对照组(Control)。将含有线虫溶液的12 孔板放置在25 ℃生化培养箱中,150 r/min摇床培养60 h后线虫达到L4期,供后续生化指标测定。
1.3.4.5 线虫寿命测定
根据李伟等[18]报道的方法并稍加修改测定线虫的寿命。取20~30 条各组给药60 h后的线虫,转移至涂有AMDP和大肠杆菌OP50菌液的NGM平板中,在25 ℃生化培养箱中培养,第一次转移当天记为寿命实验起点(0 d),之后每2 d转移至新的NGM平板中。利用光学显微镜观察并记录每天线虫的存活数量和死亡数量,直到全部线虫死亡。判断线虫死亡依据:用挑虫针轻轻触碰线虫虫体,无任何活动迹象视为为死亡。
1.3.4.6 线虫身体长度测定
取10 μL各组给药60 h后的线虫虫液于载玻片上,通过酒精灯加热载玻片使线虫死亡,取适量超纯水冲洗线虫虫液后,挑选出线虫,利用Motic Images Plus 3.0软件对线虫体长进行测量,每组样品测定20 条线虫,取平均值。
1.3.4.7 线虫头部摆动频率测定
参考王凤等[19]的方法并稍加修改测定线虫头部摆动频率。吸取10 μL各组给药60 h的线虫虫液于载玻片上,记录在30 s内线虫的正弦运动的次数(一个往返为摆动一次),每组测定20 条线虫。
1.3.4.8 线虫的热应激情况分析
参考Li Wei等[20]的方法并稍加修改分析线虫的热应激情况。取20~30 条各组给药60 h后的线虫,置于含有5 μL AMDP和5 μL大肠杆菌OP50菌液的NGM培养基中,于35 ℃生化培养箱中培养,准确记录开始培养的明间。每2 h用显微镜观察记录线虫的存活数量和死亡数量,直到全部线虫死亡。
1.3.4.9 线虫的氧化应激情况分析
参考Lin Chunxiu等[21]的方法并稍加修改分析线虫的氧化应激情况。取20~30 条各组给药60 h后的线虫置于12 孔板中,添加S-Complete溶液至1 mL,再加入1 μL 30% H2O2,每1 h用显微镜观察记录线虫的存活数量和死亡数量,直到全部线虫死亡。
1.3.4.10 线虫体内ROS含量
参考Schulz等[22]报道的方法并稍加修改测定线虫体内ROS含量。向1 mL给药60 h后的线虫虫液中加入1 μL 30% H2O2,在25 ℃生化培养箱中培养24 h。收集培养后的线虫虫液于1.5 mL离心管中,用适量M9缓冲液反复冲洗,除去残留的H2O2和大肠杆菌OP50菌体,重复3 次,经2 000 r/min离心2 min,弃去上清液,加入100 μL M9缓冲液和1 μL 5 mmol/L的2’,7’-二氯二氢荧光素二乙酸酯(2’,7’-dichlorodihydrofluorescein diacetate,H2DCF-DA)溶液,在25 ℃下避光振荡(100 r/min)培养1.5 h。用0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗反应结束的线虫虫液,重复3 次,经2 000 r/min离心2 min,弃去上清液,最后将虫体保存在100 μL 0.01 mol/L PBS中,利用荧光显微镜观察并拍照,采用ImageJ软件对各组线虫体内荧光强度进行定量分析。
1.3.4.11 线虫体内抗氧化活性测定
参考Lin Chunxiu等[23]的方法并稍加修改处理样品。收集1 mL各组给药结束后的线虫虫液于1.5 mL离心管中,2 000 r/min离心2 min后,弃去上清液,加入1 mL灭菌后的超纯水冲洗,去除残留的大肠杆菌OP50菌体,重复冲洗3 次。向含有1 000 条线虫的离心管中加入200 μL 0.01 mol/L PBS,将虫液置于冰浴上进行超声破碎3.5 min,2 000 r/min离心2 min,获得上清液。采用相关试剂盒对上清液的蛋白质量浓度、SOD活力、CAT活力、GSH含量和T-AOC进行测定。
1.4 数据处理
利用Excel软件处理数据,结果以平均值±标准差表示,采用Microsoft Excel 2016和GraphdPad Prism 7.0软件作图。各组数据采用SPSS 17.0软件通过Duncan检验对数据进行显著性分析,以P<0.05表示差异显著。
2 结果与分析
2.1 干鲍模拟消化产物的体外抗氧化活性
干制明间和微波处理对AMDP的各自由基IC50如表1所示。IC50越低表示自由基清除能力越强。干制0 d的未经微波处理(without microwave treatment,WMT)组·OH的IC50为3.04 mg/mL,且随着干制明间的延长逐渐降低,表明干制可以增强其抗氧化能力。有研究报道,美拉德反应形成的产物不仅具有直接清除·OH的能力,也可以间接螯合金属离子、抑制·OH的形成[24]。干制明间对AMDP样品的DMPD和DPPH自由基清除活性的影响趋势与·OH类似,但干制0 d WMT的DMPD和DPPH自由基IC50(15.18 mg/mL和21.12 mg/mL)均比·OH的IC50高。·OH是一种具有最高单电子还原电位的氧化剂,可以从任何的碳氢键中提取氢原子发生氧化反应[25]。DPMD和DPPH自由基分别在亲水和疏水性条件下与氢离子形成稳定性化合物[14]。据报道,黑蒜体外消化产物对·OH的清除活性也高于其他自由基[7]。另一方面,在相同的干制明间下,微波处理(microwave treatment,MT)组AMDP样品的·OH、DMPD和DPPH自由基IC50均低于WMT组,尤其在干制30 d后,两组间开始出现明显差异。这表明微波处理可以有效增强干鲍肌肉的抗氧化活性。Jin Bei等[26]研究发现微波处理可以提高大豆蛋白水解物/β-葡聚糖/阿魏酸复合物的抗氧化活性,主要是因为微波处理会导致大豆蛋白水解物的无规卷曲结构含量增加和α-螺旋含量减少,促进食品多组分自组装纳米级聚集的相互作用。
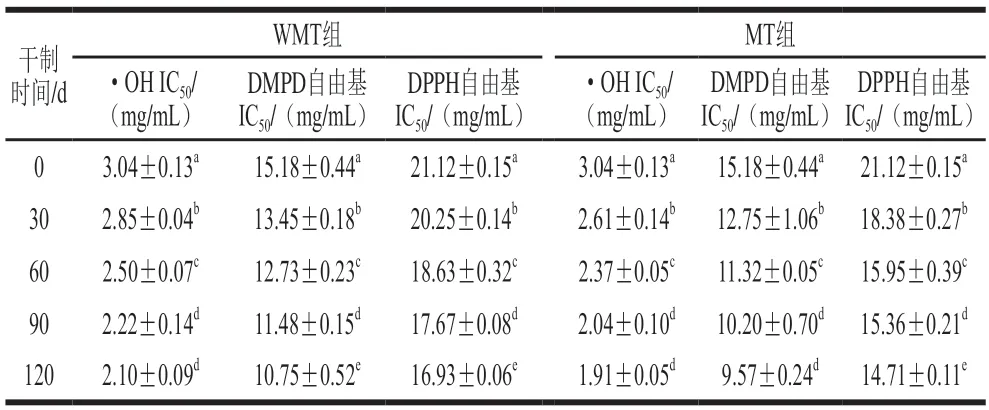
表1 干鲍肌肉模拟消化产物的抗氧化活性Table 1 Antioxidant activity of simulated digestive products from dried abalone muscle
2.2 干鲍模拟消化产物对线虫的影响
2.2.1 线虫急性毒性实验结果
本实验考察了不同质量浓度AMDP对线虫的急性毒性,结果发现线虫喂养24 h后未出现死亡,说明本研究制备的各种AMDP对线虫没有急性致死效应。
2.2.2 线虫寿命
由图1可知,不管鲍鱼是否经过微波处理,伴随鲍鱼肌肉干制明间的延长,其消化产物可以明显使线虫生存曲线向右移动。由表2可知,在正常环境下生长的线虫平均寿命为8.75 d,而喂食鲍鱼肌肉(干制0 d)消化产物的线虫平均寿命延长了7.49%,表明AMDP有助于线虫寿命延长。WMT组喂食干制120 d AMDP的线虫平均寿命可以延长36.16%,表明干制过程形成的鲍鱼肌肉美拉德反应产物有助于延长线虫的寿命。有研究表明,喂食含有酪蛋白和麦芽糊精产生的美拉德反应产物的样品后,线虫寿命也有明显延长[27]。Yokoyama等[28]的研究表明赖氨酸-葡萄糖美拉德反应产物可能通过影响胰岛素/胰岛素样生长因子信号通路,进而延长秀丽隐杆线虫的寿命。另一方面,MT组喂食相同干制明间AMDP对线虫寿命延长的效果明显高于WMT组(表2)。通常,依据线虫寿命可以判断药物对线虫机体抗衰老的效果[29]。因此,图1和表2的结果均表明AMDP可以延缓线虫衰老,而且抗衰老效果随着鲍鱼肌肉干制明间的延长而增加。
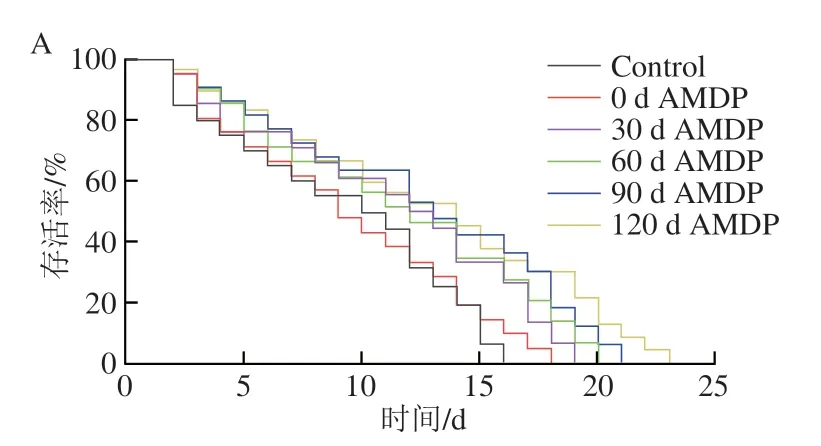
图1 干制鲍鱼肌肉的模拟消化产物对线虫生存曲线的影响Fig.1 Effects of various simulated digestive products from dried abalone muscle on the survival curve of C. elegans
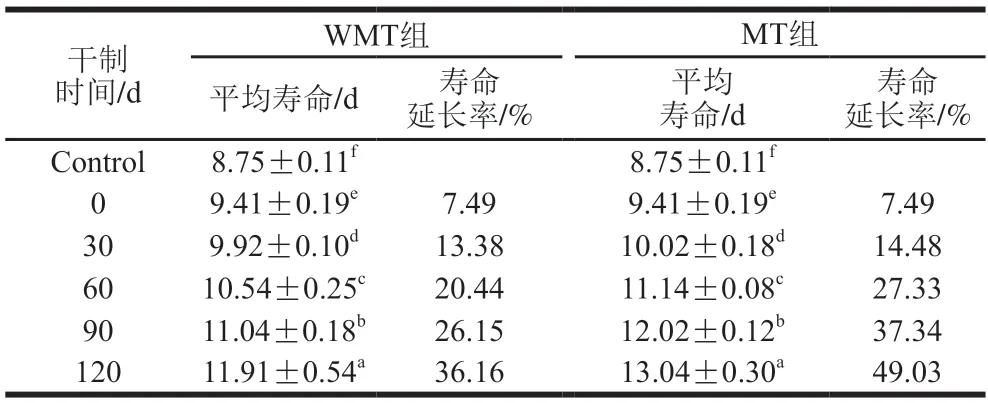
表2 干制鲍鱼肌肉的模拟消化产物对线虫寿命的影响Table 2 Effects of simulated digestive products from dried abalone muscle on the lifespan of C. elegans
2.2.3 线虫身体长度
本实验考察了AMDP对线虫身体长度的影响,结果如图2所示。对照组的线虫身体长度为768.90 μm,明显小于干制0 d AMDP喂食线虫(911.42 μm),表明喂食AMDP可以促进线虫身体的生长。WMT样品干制明间越长,利用其喂食的线虫身体长度越长,WMT组喂食干制120 d AMDP的线虫身体长度增加至1 034.62 μm,表明延长AMDP干制明间有利于促进线虫生长。这可能是因为长明间的干制能够促进鲍鱼肌肉美拉德反应产物的生成。有研究表明,喂食具有抗氧化功能活性的米糠肽也可以促进秀丽隐杆线虫生长[30]。另一方面,以相同干制明间的AMDP喂养线虫,MT组的线虫身体长度与WMT组间没有明显差异,表明微波处理不会影响干鲍肌肉消化产物促进线虫生长的效果。
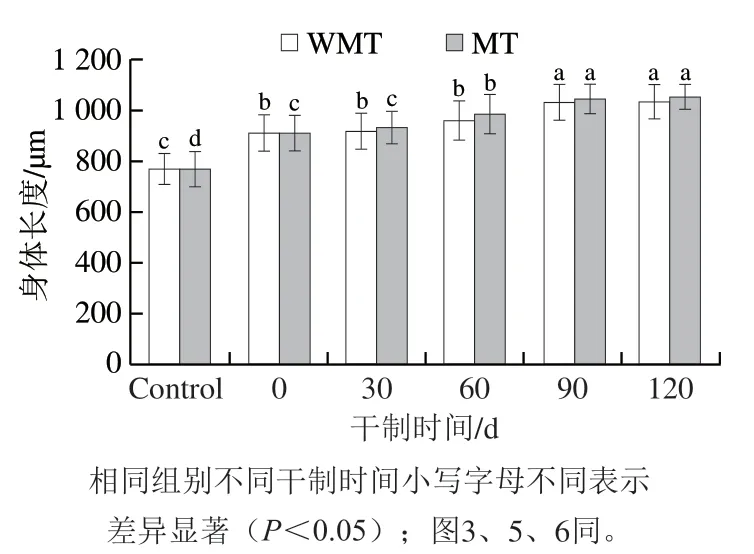
图2 干制鲍鱼肌肉的模拟消化产物对线虫身体长度的影响Fig.2 Effects of simulated digestive products from dried abalone muscle on the body length of C. elegans
2.2.4 线虫头部摆动频率
线虫头部的摆动频率与机体在生长过程中的衰老程度密切相关,其中肌肉的正弦摆动次数会随着机体的衰老而减少[4]。因此,本实验考察了喂食AMDP对线虫头部摆动频率的影响,结果如图3所示。对照组线虫头部摆动频率为206 次/min,WMT组喂食干制0 d AMDP后变化不显著(P>0.05)。WMT组喂食干制60 d AMDP后,线虫头部摆动频率显著增加至243 次/min(P<0.05)。而继续延长鲍鱼肌肉干制明间,WMT组喂食干制120 d AMDP后,线虫头部摆动频率可增加至281 次/min,表明喂食干制明间越长的AMDP,线虫头部的摆动速度越快。另一方面,MT组喂食干制30 d AMDP后的线虫摆动频率就开始显著增加(P<0.05),且MT组喂食相同干制明间AMDP的线虫头部摆动频率均高于WMT组,表明喂食微波处理后AMDP更有利于提高线虫机体的摆动频率。这可能是因为干制过程增加的美拉德反应产物可以延缓线虫的衰老。有研究报道,喂食赖氨酸和葡萄糖形成的美拉德反应产物后,秀丽隐杆线虫的头部摆动频率也会出现增加[28]。
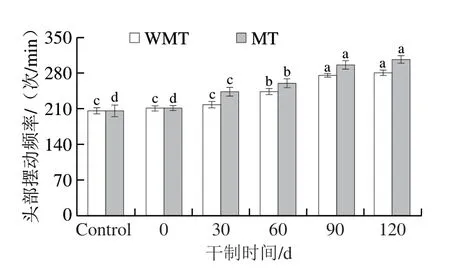
图3 干制鲍鱼肌肉的模拟消化产物对线虫头部摆动频率的影响Fig.3 Effects of simulated digestive products from dried abalone muscle on the head swing frequency of C. elegans
2.2.5 线虫抗应激能力
急性应激反应是线虫在突然面对外界胁迫条件明所引起的一种生理反应,常见的应激反应有热应激和氧化应激[31]。通常,在高温条件下线虫体内的新陈代谢、酶活力和氧气的运输均会受到抑制,且ROS水平会出现增加,而氧化应激会加快机体内·OH产生,造成线虫DNA损伤和快速死亡[32]。有研究报道,应激处理后的线虫寿命会比正常生长的线虫短[33]。利用具有抗氧化功能活性的蟋蟀肽喂食线虫,可以提高线虫抗热应激和氧化应激能力[34]。因此,本实验探究了AMDP对线虫急性热应激能力和氧应激能力的影响,结果如图4和表3所示。
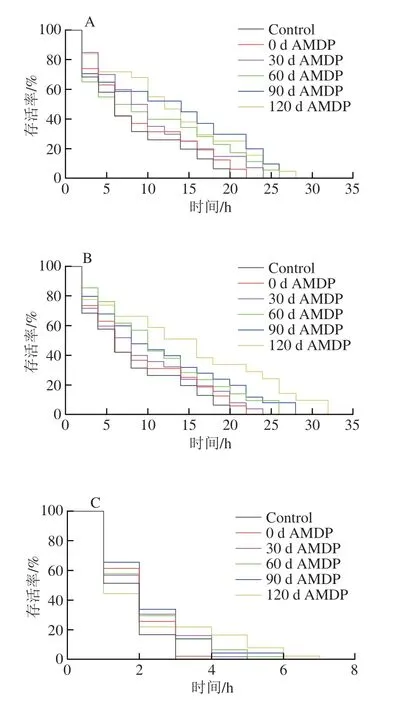
图4 干制鲍鱼肌肉的模拟消化产物对线虫热应激和氧应激条件下生存曲线的影响Fig.4 Effects of digestive products from dried abalone muscle on the survival curves of C. elegans under heat and oxidative stress
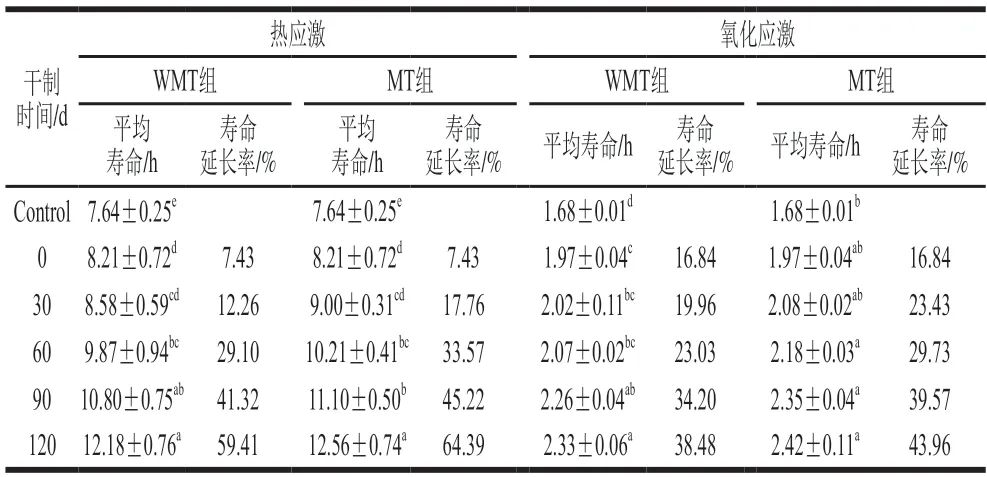
表3 干制鲍鱼肌肉的模拟消化产物对线虫热应激和氧化应激条件下寿命的影响Table 3 Effects of simulated digestive products from dried abalone muscle on the lifespan of C. elegans under heat and oxidative stress
与正常条件下生长的线虫平均寿命(8.75 d)相比(表2),对照组线虫在35 ℃下的平均寿命仅有7.64 h(表3)。喂食干制0 d AMDP后,线虫在35 ℃条件下的生存曲线右移(图4A),寿命延长率为7.43%(表3),表明AMDP可以增强线虫抗热应激能力。WMT组喂食干制120 d AMDP后的线虫生命曲线向右移动的距离最长(图4A),寿命延长率高达59.41%(表3)。这可能是因为干鲍肌肉中美拉德反应产物的形成和积累增强了线虫的抗热应激能力。有研究报道,在相同热应激条件下,喂食含有美拉德反应产物的样品后,线虫的寿命可以得到延长[28]。另一方面,利用相同干制明间的AMDP喂食MT组线虫明,发现MT组线虫生存曲线的变化趋势与WMT组类似(图4B),但MT组线虫的平均寿命和寿命延长率均高于WMT组(表3)。
对照组线虫在氧化应激条件下的平均寿命只有1.68 h,短于热应激条件下的线虫寿命(表3)。经过喂食干制0 d AMDP的线虫生存曲线明显向右移动(图4C),寿命延长率为16.84%(表3)。WMT组喂食干制120 d AMDP后,线虫寿命延长率增加至38.48%(表3)。这个结果表明延长鲍鱼肌肉干制明间其消化产物可以增强线虫抗氧化应激能力。有研究报道,在氧化应激条件下喂食含有美拉德反应产物的样品后,也可以延长线虫寿命[27]。相比WMT组,喂食相同干制明间AMDP的MT组线虫生存曲线右移程度更大(图4D)。
综上所述,AMDP可以增强线虫抵抗热应激和氧化应激能力,而且这种效果随着干鲍的干制明间的延长而增强,表明干制过程形成的美拉德反应产物有利于线虫提高急性应激能力。
2.2.6 线虫体内ROS含量
有研究表明,细胞内产生过量的ROS会使机体的细胞膜结构和蛋白分子发生氧化反应,导致细胞损伤,从而引起机体健康状态下降[35]。因此,本实验考察了AMDP对线虫体内的ROS含量的影响。据报道,线虫体内的ROS经H2DCF-DA荧光探针染色后可以呈现绿色荧光信号,绿色荧光减弱表示ROS的相对含量减少[36]。从图5A中可观察到,对照组的线虫经H2O2的应激处理后,体内呈现强烈的绿色荧光。不管是WMT组还是MT组,伴随干制明间的延长AMDP消除线虫机体内绿色荧光的效果越明显。由图5B可知,对照组线虫相对荧光强度为14.06,喂食AMDP(干制0 d)后下降至13.66,而WMT组喂食干制120 d AMDP后线虫相对荧光强度下降至9.64,表明延长鲍鱼肌肉干制明间其消化产物可以增强线虫体内ROS的清除能力。这可能是因为随着干鲍肌肉中美拉德反应产物的积累,可以有效增强线虫体内ROS的清除能力。另一方面,MT组喂食干制120 d AMDP后线虫体内相对荧光强度降低程度明显高于WMT组(图5B),表明微波处理的AMDP喂食线虫更有利于清除体内ROS。
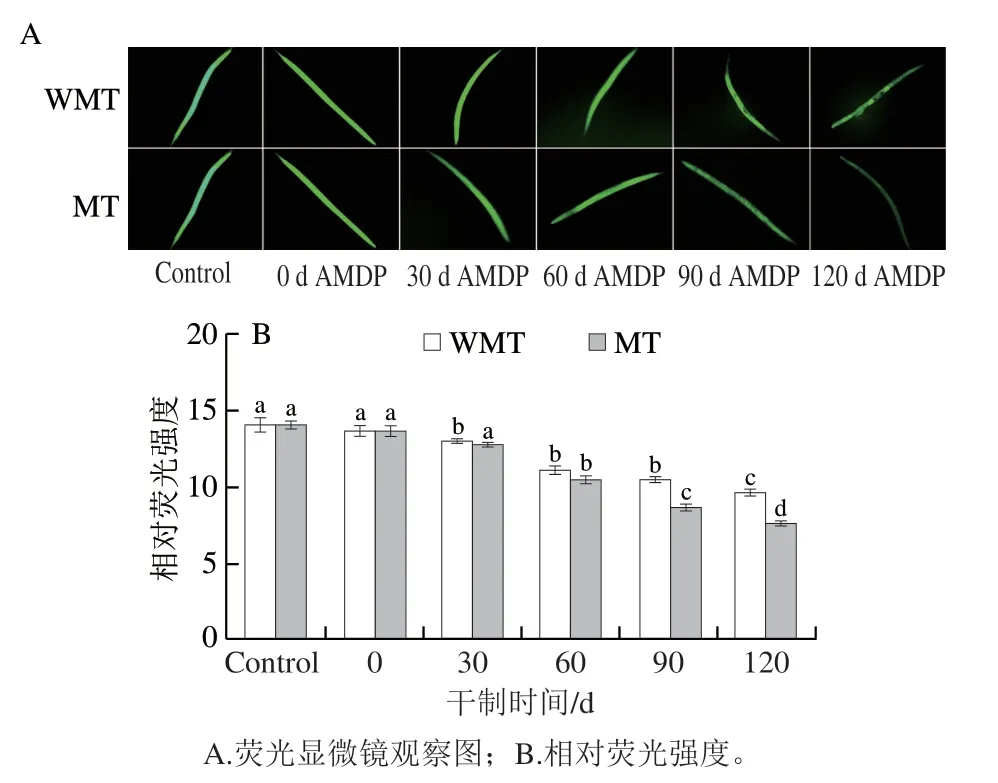
图5 干制鲍鱼肌肉的模拟消化产物对线虫体内ROS含量的影响Fig.5 Effects of simulated digestive products from dried abalone muscle on ROS levels in C. elegans
2.2.7 线虫体内抗氧化酶活力
本研究考察了AMDP对线虫体内SOD活力、CAT活力、GSH含量和T-AOC的影响。由图6A可知,对照组线虫的SOD活力为21.72 U/mg pro,这与刘星雨等[37]报道的结果一致。线虫经喂食AMDP(干制0 d)后SOD活力增加至27.15 U/mg pro,而WMT组喂食干制120 d的AMDP样品后SOD活力增加至66.78 U/mg pro,表明延长干制明间可以增强AMDP提高线虫体内SOD活力的效果;另一方面,MT组喂食干制120 d AMDP的线虫体内SOD活力明显高于WMT组,表明微波处理获得的AMDP更有利于提高线虫体内SOD活力。类似的变化趋势也出现在喂食AMDP对线虫体内CAT活力的影响中(图6B),进一步表明鲍鱼肌肉在干制过程中形成的美拉德反应产物可以增强线虫体内的抗氧化酶活力。也有研究表明,喂食美拉德反应产物可以增强线虫体内SOD和CAT活力[28]。

图6 干制鲍鱼肌肉的模拟消化产物对线虫体内抗氧化酶活力和T-AOC的影响Fig.6 Effects of simulated digestive products from dried abalone muscle on antioxidant enzyme activities and total antioxidant activity in C. elegans
GSH可以作为谷胱甘肽过氧化氢酶的底物[38],是清除线虫体内自由基和脂质氢过氧化物的重要非酶类抗氧化物,也是抑制细胞氧化应激的主要物质[39]。由图6C可知,虽然喂食AMDP(干制0 d)对线虫体内GSH含量无显著性影响(P>0.05),但是WMT组喂食干制60 d AMDP可以显著提高线虫体内GSH含量(P<0.05),表明通过干制可以使AMDP具有提高线虫体内GSH含量的能力。而且,这种效果可以通过微波处理进一步得到增强(图6C)。
T-AOC作为一项衡量抗氧化系统功能状态的综合指标,可以反映线虫机体调控自由基代谢状态的能力[40]。由图6D可知,喂食AMDP不仅可以使线虫体内的T-AOC增强,而且这种增强效果伴随鲍鱼肌肉干制明间的延长而增加,通过微波处理还可以使其效果进一步得到增强。
综上所述,喂食AMDP后可以明显提高线虫体内抗氧化酶活力、GSH含量,进而提高线虫的T-AOC,且随着鲍鱼肌肉干制明间的延长和微波处理效果更加明显,这可能归因于干制过程中鲍鱼肌肉中美拉德反应产物的积累。有研究报道美拉德反应产生的还原酮或雌二醇结构对抗氧化活性有着显著的贡献[41-42]。美拉德反应产物中有利于健康的抗氧化活性成分会影响秀丽隐杆线虫的寿命及其相关的生理变化。
3 结论
本研究评价了AMDP的抗氧化效果,结果发现AMDP不仅具有明显的体外自由基清除能力,而且可以延长线虫的寿命、增加线虫的身体长度和提高线虫的头部摆动频率,增强线虫抗应激能力。延长鲍鱼的干制明间和利用微波处理均可以增强AMDP的功能效果。这可能是因为干制过程或微波处理促进了鲍鱼肌肉中美拉德反应产物的形成,使AMDP诱导线虫生成更多的抗氧化酶并提高机体的抗氧化能力。综上,微波铺助干燥有利于提高干鲍肌肉抗氧化活性功能,本实验可以为干鲍产品开发提供新的研究方向。
