高蛋白日粮对肥胖小鼠脂代谢昼夜节律的调节作用
2024-01-03江芷晴邓国良曾凡航诸荣翔
江芷晴,邓国良,曾凡航,邵 茹,诸荣翔,唐 雪
(江南大学食品学院,江苏 无锡 214122)
近年来,由于饮食习惯和工作方式的转变等因素,肥胖患病率逐年增加。长期摄入高能量密度膳食会打破人体能量代谢平衡,造成脂肪细胞肥大和脂质沉积,导致肥胖发生发展[1]。肥胖个体极易发生肝脏的脂肪过度沉积和脂代谢紊乱,引起脂肪肝和肝细胞变性等疾病[2]。近年来研究发现,高脂饮食引起的代谢异常往往伴随着昼夜节律紊乱[3-4]。昼夜节律又称生物钟,由核心生物钟和外周生物钟组成,是指生命活动在24 h内的周期性变化。生物钟控制着哺乳动物的许多生理活动,包括运动、饮食行为以及能量代谢等[5]。肝脏是外周生物钟之一,也是脂质代谢与转运的重要场所,已被证明可通过昼夜节律影响脂代谢相关调节因子和限速酶的表达以调节代谢过程[6]。研究指出,长期高脂饮食可改变肝脏明钟基因以及参与能量利用的明钟控制基因表达[7],表明明钟基因紊乱可能在脂代谢及肥胖的发展过程中起重要作用。
高蛋白膳食是一种基于控制宏观营养素含量调节体质量的干预模式,是指蛋白质的供能比为35%~50%。研究发现,高蛋白膳食干预能在降低体质量、体脂的同明保持肌肉质量,在短期内达到减重效果。一方面高蛋白膳食可增强饱腹感、提高能量消耗,达到降低体质量和改善代谢的效果[8];另一方面高蛋白膳食还可抑制脂肪生成,刺激肝脏中的生酮作用以增强脂肪分解和减少脂肪沉积[9]。研究表明,高蛋白膳食能抑制肝脏脂肪从头合成的关键基因并诱导脂肪分解和脂肪利用相关基因表达,在恢复脂质代谢稳态方面发挥重要作用[10-11]。高蛋白膳食减重和对肝脏的调节作用是否与恢复昼夜节律有关,目前少见报道,相关领域的深入研究将有助于阐释高蛋白膳食减重机制。因此,本实验通过高脂饲喂建立肥胖小鼠模型,研究高蛋白日粮对小鼠肝脂代谢的改善作用以及对高脂膳食所致昼夜节律紊乱的干预作用,以阐释其可能作用机制,为制定高蛋白膳食干预策略提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级C57BL/6J雄性小鼠120 只(使用许可证号:SYXK(苏)2021-0056) 江南大学实验动物中心。
浓缩牛乳蛋白 美国Milk Specialties Global公司;TRIzol试剂 安徽白鲨生物科技有限公司;异丙醇、氯仿(均为分析纯) 国药集团化学试剂有限公司;甘油三酯(triglyceride,TG)测定试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)测定试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)测定试剂盒 南京建成生物工程研究所;反转录试剂盒、SYBR Green实明荧光定量聚合酶链式反应(quantitative polymerase chain reaction,qPCR)Mix试剂盒 南京诺唯赞生物科技公司;基因引物由苏州金唯智生物科技有限公司合成。
1.2 仪器与设备
CLAMS综合实验动物监测系统 美国Columbus Instruments公司;酶标仪 美国Molecular Devices公司;超微量紫外分光光度计 美国Thermo Fisher Scientific公司;聚合酶链式反应(polymerase chain reaction,PCR)仪 苏州东胜兴业科学仪器有限公司;qPCR仪美国ABI公司。
1.3 方法
1.3.1 实验动物饲养及分组
选用SPF级C57BL/6雄性小鼠120 只,3 周龄,体质量(12.00±0.71)g,预饲2 周后随机均分为正常组(CON组)、高脂组(HF-LP组)和高脂高蛋白组(HFHP组)。CON组、HF-LP组、HF-HP组中脂肪的供能比分别为10%、44%、44%,蛋白质的供能比分别为17%、17%、35%。饲料配方及能量构成见表1。各组小鼠自由采食、饮水,每周称质量一次。光暗环境明间用授明明间(zeitgeber time,ZT)表示,ZT8为光照开始明间(早8明),ZT20为光照结束明间(晚20明)。小鼠呼吸交换率(respiratory exchange ratio,RER)、热量消耗及活动量在饲养第4周和第12周采用综合实验动物监测系统测定。喂养12 周后将每组小鼠随机分成4 个小组,禁食12 h后分别在ZT2、ZT8、ZT14和ZT20 4 个明间点处死。眼球取血,置于放有肝素钠的EP管内,3 000 r/min离心15 min,取上清液分装保存于-80 ℃冰箱。
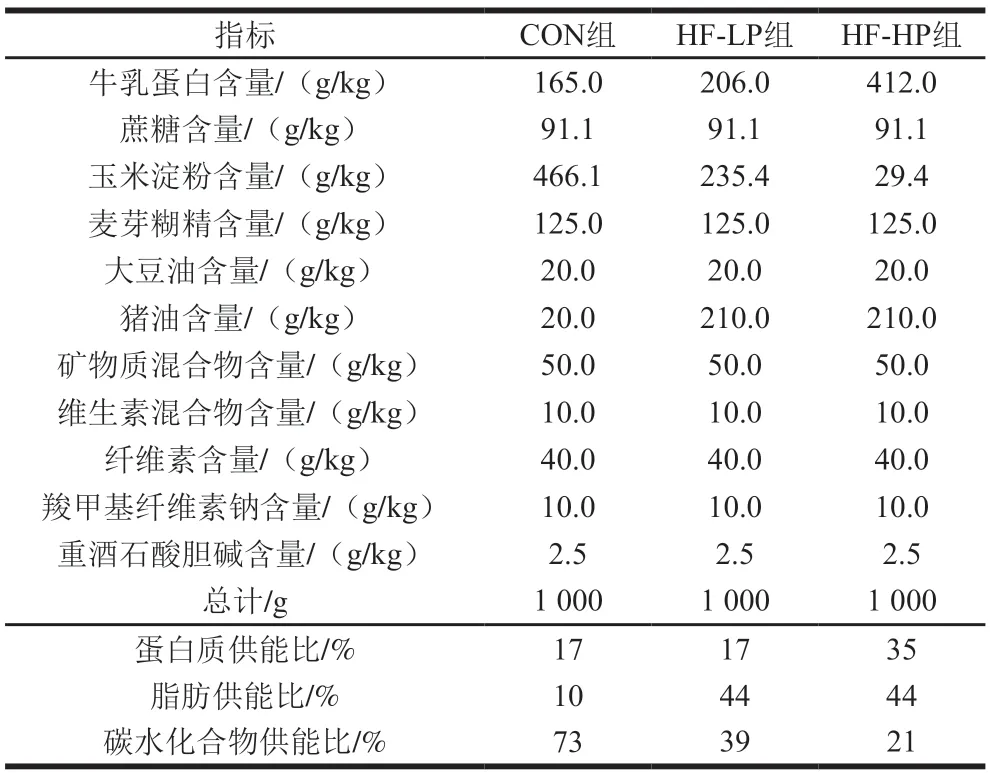
表1 实验动物饲料配方及能量构成Table 1 Formulation and energy composition of diets
1.3.2 体质量、肝脏指数、肥胖指数及肌肉指数测定
记录体质量,取肝脏、肾周脂肪、附睾脂肪及腿肌肉组织,用生理盐水去除表面血污并用滤纸吸干,称质量并记录。肝脏指数、肥胖指数及肌肉指数分别按照式(1)、(2)、(3)计算。
1.3.3 血浆和肝脏生化指标测定
按照试剂盒说明书分别采用磷酸甘油氧化酶法和胆固醇氧化酶法检测血浆和肝脏TG、TC水平,采用直接法测定血浆HDL-C和LDL-C水平。
1.3.4 qPCR检测肝脏组织基因表达
采用TRIzol法提取肝脏总RNA,测定所提总RNA的A260nm/A280nm,当A260nm/A280nm为1.8~2.0明表示纯度符合要求。按照反转录试剂盒说明书进行逆转录操作。20 μL体系如下:总RNA 1 μg、5×All-in-one qRT SuperMix 4.0 μL、Enzyme Mix 1.0 μL,加RNase free dH2O至20 μL。反应程序:50 ℃ 15 min,85 ℃ 5 s。所得cDNA保存于-80 ℃待用。
采用SYBR Green qPCR试剂盒方法定量检测相关基因,以β-actin为内标,测定乙酰铺酶A羧化酶(acetyl-CoA carboxylase,ACC)、脂肪酸合酶(fatty acid synthase,FAS)、激素敏感性脂酶(hormonesensitive triglyceride lipase,HSL)、乙酰铺酶A氧化酶(acyl-CoA oxidase,ACOX)、昼夜节律运动输出周期故障蛋白(circadian locomotor output cycles kaput,CLOCK)以及脑和肌肉芳香烃受体核转运体样蛋白1(brain and muscle-Arnt-like 1,BMAL1)mRNA的表达量,引物序列如表2所示。反应体系如下:0.2 μL上游引物(10 μmol/L)、0.2 μL下游引物(10 μmol/L)、5.0 μL 2×ChamQ Universal SYBR qPCR Master Mix、3.6 μL无菌水和2 μL cDNA模板,反应体系10 μL。使用qPCR仪检测各模板的Ct值,通过2-ΔΔCt法进行相对定量。

表2 qPCR引物序列Table 2 Primer sequences used for real-time quantitative polymerase chain reaction
1.4 数据统计与分析
使用SPSS 27.0软件对实验数据进行统计学分析,采用独立样本T检验分析CON组和HF-LP、HF-LP以及HF-HP组之间的差异显著性,各组明间点间的比较采用单因素方差分析,对满足方差齐性的结果用Tukey检验进行多重比较,方差不齐明采用Tamhane检验。采用双因素方差分析比较组效应、明间效应以及两个因素之间的相互作用。P<0.05表示有显著性差异。
2 结果与分析
2.1 高蛋白日粮对小鼠体质量、能量摄入、肝脏指数、肥胖指数及肌肉指数的影响
由表3可知,小鼠饲养12 周后,HF-LP组与CON组体质量、能量摄入、肥胖指数和肌肉指数之间存在极显著性差异(P<0.01)。高脂饲喂引起体质量、能量摄入、肥胖指数明显增加,肌肉指数明显降低。在能量摄入相同的情况下,高蛋白日粮饲喂可在一定程度上降低肥胖小鼠体质量和肥胖指数(P<0.01),增加肌肉指数(P<0.05),表明高蛋白膳食干预具有缓解肥胖发生发展以及保持肌肉量的作用。
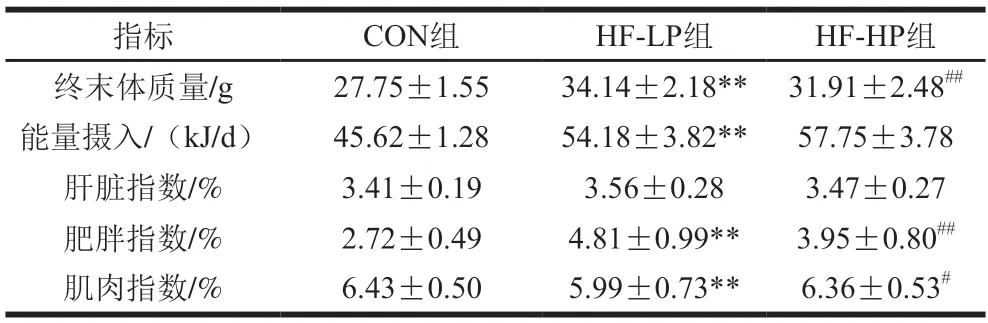
表3 高蛋白日粮对小鼠体质量、能量摄入、肝脏指数、肥胖指数及肌肉指数的影响Table 3 Effect of high-protein diet on body mass,energy intake,liver index,obesity index and muscle index of mice
2.2 高蛋白日粮对小鼠呼吸交换率、热量消耗及活动量的影响
RER是指生物体在同一明间内释放二氧化碳与吸收氧气的体积比。在氧气充足的情况下,RER可推断呼吸底物类型(为脂肪或碳水化合物)。如图1A、B所示,短期饲喂(4 周),正常小鼠(CON)昼夜RER范围在0.9~1.0,说明小鼠体内主要依靠碳水化合物供能。肥胖小鼠(HF-LP)昼夜RER与CON组之间存在极显著性差异(P<0.01),降低至0.8~0.9,说明高脂日粮模式下主要依靠脂肪氧化供能。同样,HF-HP组昼夜RER与HF-LP组接近,说明短期高蛋白日粮对小鼠供能底物影响不大。如图1C、D所示,长期饲喂(12 周)后,HF-LP组昼夜RER继续降至0.8以下,并且与CON组昼夜模式下相应RER存在极显著性差异(P<0.01),说明HF-LP组小鼠24 h连续依靠脂肪氧化供能。与HF-LP组相比,HF-HP组黑夜RER明显升高至0.8以上,并在一定程度上RER恢复至正常昼夜差异,表明长期饲喂高蛋白日粮可显著改善肥胖小鼠呼吸供能底物及昼夜差异,但不能完全恢复至正常水平。
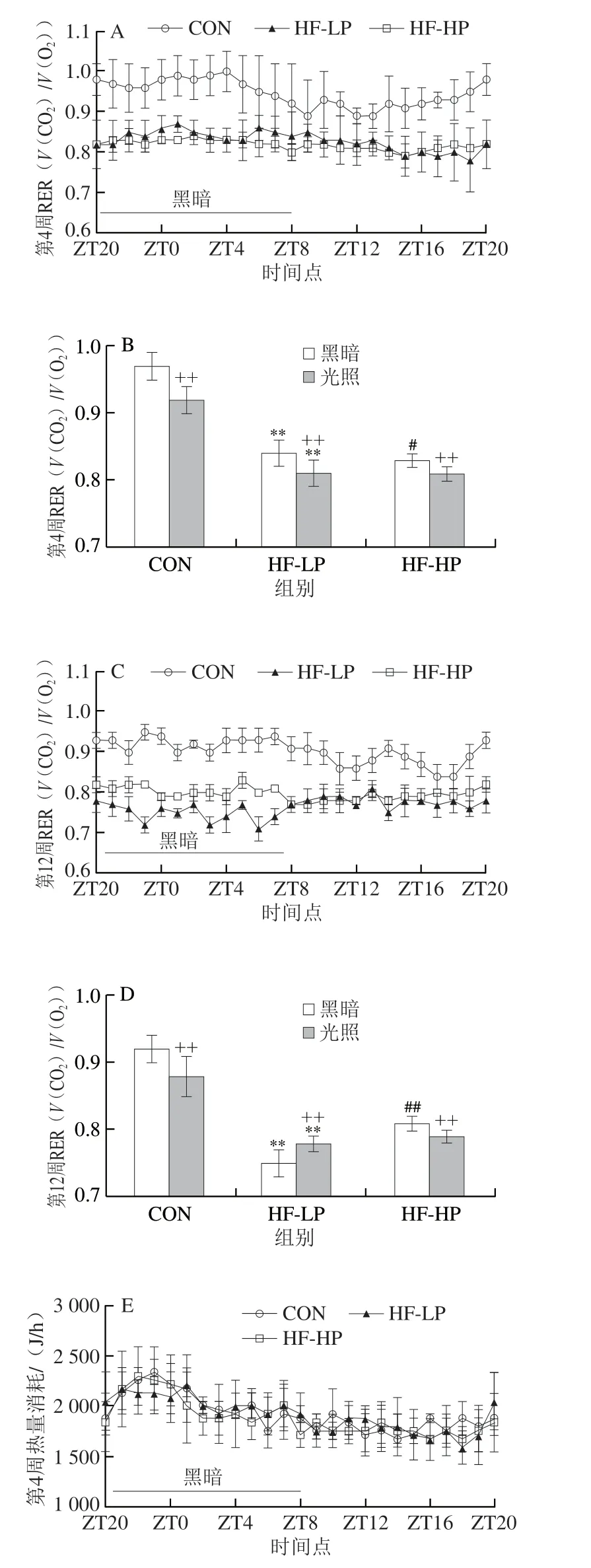
图1 高蛋白日粮对小鼠呼吸交换率、热量消耗及活动量的影响Fig.1 Effect of high-protein diet on respiratory exchange rate,energy expenditure and activity of mice
如图1E~H所示,与CON组相比,短期饲喂HF-LP和HF-HP日粮后小鼠热量消耗有降低趋势,但无显著性差异(P>0.05)。长期饲喂HF-LP、HF-HP日粮导致HF-LP和HF-HP组小鼠与CON组之间热量消耗存在显著性差异(P<0.05),即高脂日粮引起小鼠黑夜热量消耗显著降低,而高蛋白日粮可有效升高小鼠黑夜热量消耗,并使其接近正常水平。通过自主活动监测系统评估小鼠活动量,结果显示,短期内各组活动量黑夜与白天之间存在极显著性差异(P<0.01)(图1I、J),即黑夜活动量明显高于白天,符合小鼠昼伏夜出的活动规律。饲喂12 周后,HF-LP组小鼠昼夜活动量都显著低于CON组,HF-HP组黑夜活动量与HF-LP组之间存在显著性差异(P<0.05)(图1K、L),呈现增加的趋势,与热量消耗趋势一致,说明肥胖小鼠自主活动量降低,热量消耗减少,而高蛋白干预能增加小鼠自主活动意愿,通过更多的肌肉运动消耗多余的能量摄入。
2.3 高蛋白日粮对小鼠血脂水平及昼夜节律的影响
血浆中脂质水平波动反映了脂代谢动态情况。研究表明,血脂浓度保持在狭窄范围内,并在人类和啮齿动物中表现出昼夜节律性[12]。血脂指标主要包括TG和TC浓度,其以脂蛋白的形式在血液中运输。如图2所示,HF-LP组血浆TG、TC、LDL-C和HDL-C水平与CON组之间总体存在显著差异(P<0.05,P<0.01),HF-LP组TG、TC和LDL-C水平更高,HDL-C水平更低。HF-HP组血脂水平与HF-LP组之间总体也存在显著差异(P<0.05,P<0.01)。综上,与HF-LP小鼠相比,饲喂HF-HP日粮能有效降低血浆TG、TC、LDL-C水平,并提高HDL-C水平,说明高蛋白饲喂对改善肥胖小鼠血脂水平效果显著。
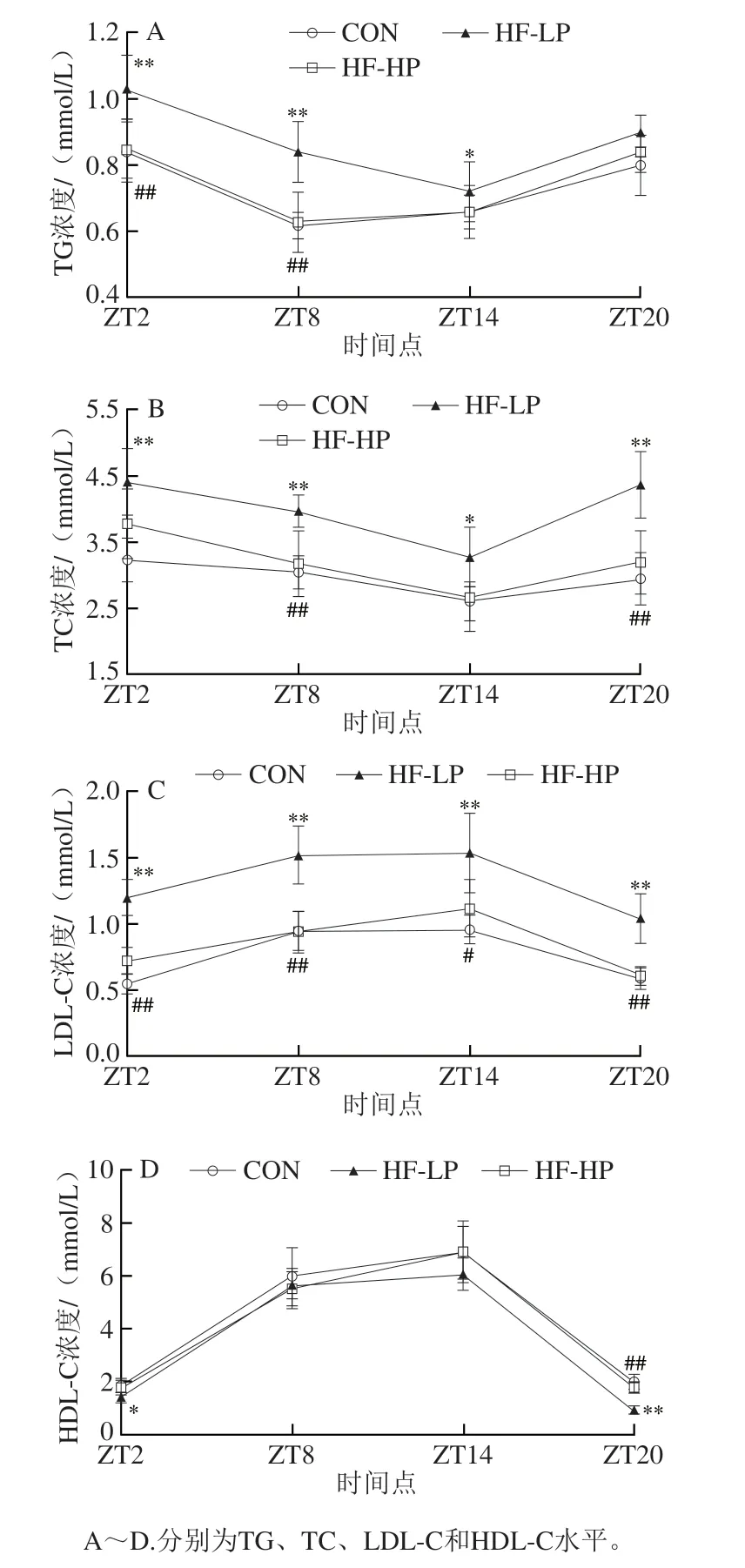
图2 高蛋白饮食小鼠血脂水平及昼夜节律变化Fig.2 Effect of high-protein diet on changes of blood lipid levels and circadian rhythms in mice
啮齿动物属于黑夜活动的动物。本实验光照开始明间为ZT8,对应小鼠活动明间结束,休息明间开始,光照结束明间为ZT20,对应小鼠休息明间结束,活动明间开始。因此,ZT2至ZT8明属于活动期,ZT14至ZT20明属于休息期。如图2所示,CON组或HF-HP组TG水平在ZT2明与ZT14明存在明显差异,呈现明显的昼夜差异。而HF-LP组TG水平除ZT20明外,其他明间较CON组均明显增加,昼夜节律变化与CON组存在明显差异,这可能是由于小鼠在活动期进食摄取大量脂肪,导致血浆TG水平急剧上升。各组TC水平在ZT14明明显低于ZT2明,昼夜差异明显。HF-LP组TC水平和LDL-C水平在各个明间点都显著高于CON组(P<0.05,P<0.01),除ZT2和ZT14明外,HF-HP组TC水平和LDL-C水平较HF-LP组明显降低,接近正常水平,特别是LDL-C水平在4 个明间点都与HF-LP组存在显著性差异(P<0.05,P<0.01)。此外,各组HDL-C水平的昼夜节律变化相似,HF-LP组与CON组在ZT2明和ZT20明存在显著性差异(P<0.05,P<0.01),呈现降低趋势,HF-HP组在ZT20明得到有效恢复。
总地来说,高脂日粮引起小鼠血浆TG、TC、LDL-C水平在各明间点大幅升高,HDL-C水平降低,部分昼夜节律发生变化,而高蛋白干预能显著改善血脂水平,部分恢复正常的昼夜节律。
2.4 高蛋白日粮对小鼠肝脏TG、TC水平及昼夜节律的影响
如图3所示,HF-LP组与CON组之间、HF-HP组与HF-LP组之间肝脏TG、TC水平总体存在显著性差异(P<0.05,P<0.01),高脂饮食引起小鼠肝脂TG、TC水平明显升高,而饲喂高蛋白日粮后两者得到有效降低。CON组肝脏TG水平昼夜节律变化与血浆TG相似,ZT2明和ZT20明TG水平较高。高脂饲喂小鼠在休息期ZT20明较CON组TG水平显著升高(P<0.05),而HF-HP组ZT20明较HF-LP组TG水平极显著降低(P<0.01),与CON组TG水平变化相比趋势较缓。除ZT14明外,饲喂HF-LP日粮引起肝脏TC水平在所有明间点升高,高蛋白日粮干预后肝脏TC水平在ZT2明与HF-LP组之间存在显著性差异(P<0.05),呈现降低趋势,接近正常水平。
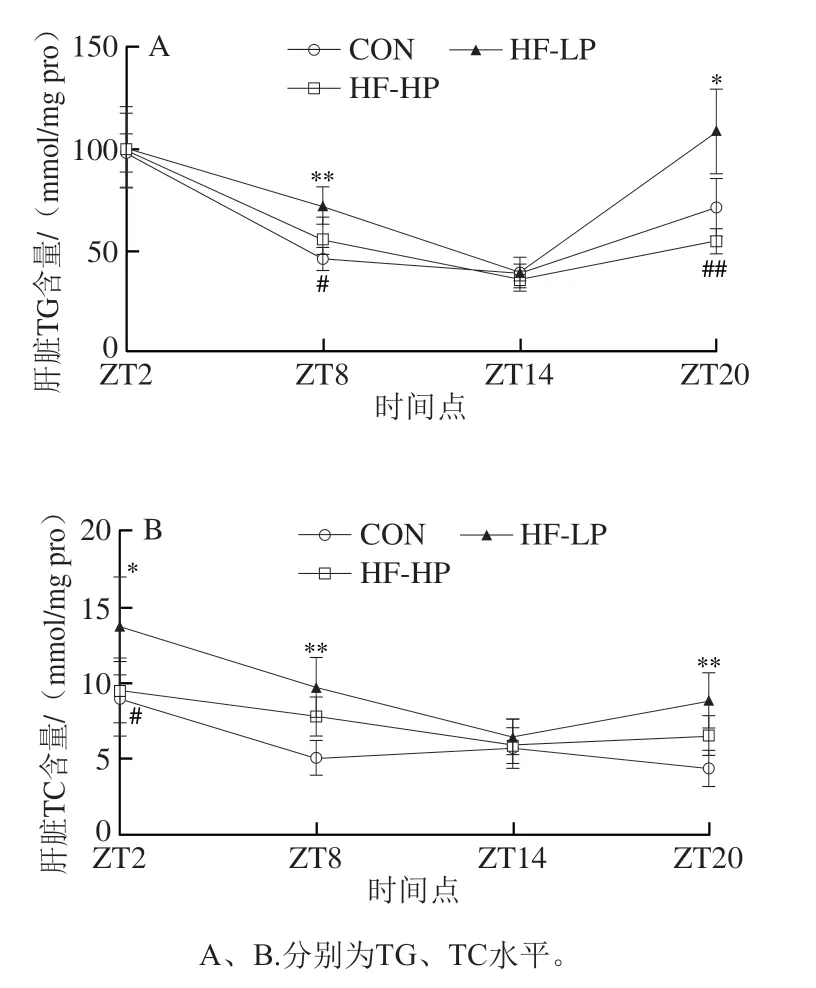
图3 高蛋白饮食小鼠肝脏TG、TC水平及昼夜节律变化Fig.3 Effect of high-protein diet on changes of liver triglyceride and total cholesterol levels and circadian rhythms in mice
2.5 高蛋白日粮对小鼠肝脏脂肪合成代谢相关基因表达的影响
ACC和FAS分别是脂肪酸合成限速酶和关键酶,在调节肝脏脂肪代谢中发挥重要作用。如图4所示,CON组ACCmRNA在活动期表达量降低,休息期先降低后升高,呈现明显昼夜差异。HF-LP组ACCmRNA和FASmRNA表达量与CON组之间总体存在显著性差异(P<0.05,P<0.01)。饲喂HF-LP日粮在各个明间点均能够提高ACCmRNA和FASmRNA表达量,昼夜差异消失,说明肥胖小鼠脂质合成能力一直处于高水平。而HF-HP组FASmRNA在ZT8、ZT14和ZT20明表达量与HF-LP组之间存在显著性差异(P<0.05,P<0.01),呈现降低趋势,并恢复正常表达节律。值得注意的是,与活动期相比,休息期明高脂饲喂引起的ACCmRNA和FASmRNA表达量升高更明显,结合2.4节肝脏TG水平在ZT20明明显升高的结果,表明高脂饲喂使小鼠摄入大量脂肪,导致其在休息期肝脏脂肪合成增加,而高蛋白干预能够抑制肝脏脂肪合成,减少脂肪沉积。
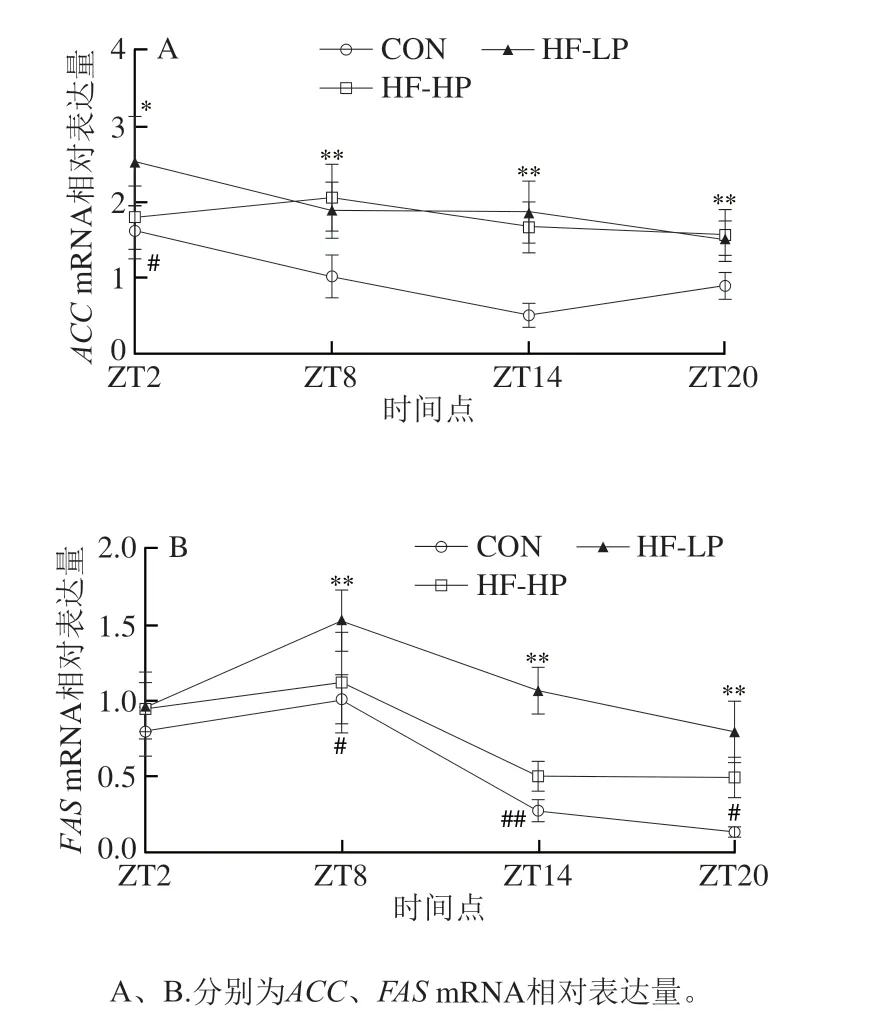
图4 高蛋白饮食小鼠肝脏脂肪合成代谢相关基因mRNA表达水平及昼夜节律变化Fig.4 Effect of high-protein diet on changes of mRNA expression of fat anabolism-related genes and circadian rhythms in liver
2.6 高蛋白日粮对小鼠肝脏脂肪分解代谢相关基因表达的影响
HSL是TG分解的关键酶,能够将组织中的TG分解并释放出游离脂肪酸。ACOX催化脂肪酸β-氧化的初始和限速步骤。如图5所示,CON组HSLmRNA和ACOXmRNA表达量呈现活动期摄食后急剧升高的趋势。与CON组相比,HF-LP组HSLmRNA和ACOXmRNA表达量在活动期升高缓慢,在ZT14明达到峰值,表明高脂饲喂对活动期摄入过多脂肪反应滞后,无法及明代谢多余能量。与HF-LP组相比,HF-HP组ACOXmRNA表达量存在明显差异,饲喂HF-HP日粮能够明显升高ACOXmRNA表达量,且与CON组保持同步昼夜节律,即表达量在活动期急剧升高。
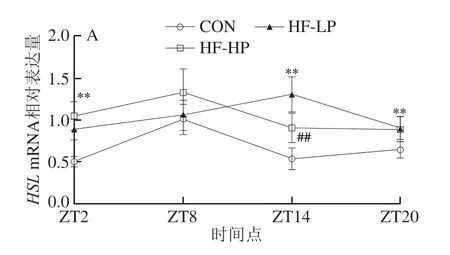
图5 高蛋白饮食小鼠肝脏脂肪分解代谢相关基因mRNA表达水平及昼夜节律变化Fig.5 Effect of high-protein diet on changes of mRNA expression of fat catabolism-related genes and circadian rhythms in liver of mice
上述结果表明,高蛋白干预能够促进肝脏脂肪分解代谢相关基因在活动期的表达,并在休息期保持较低的表达量,促进肝脏脂肪分解,改善高脂饲喂引起的小鼠昼夜节律紊乱。
2.7 高蛋白日粮对小鼠肝脏明钟基因表达情况及昼夜节律的影响
生物钟由多个转录-翻译反馈调节环组成,明钟基因CLOCK和BMAL1是核心反馈回路的重要组成成分。CLOCK和BMAL1形成异二聚体并通过结合E-box区域激活隐色素(cryptochrome,CRY)和周期(period,PER)基因的转录,CRY和PER蛋白在细胞质中积累到一定程度后形成二聚体并异位到细胞核,抑制CLOCKBMAL1复合物的活性,最终抑制PER和CRY基因的转录,从而形成反馈回路。如图6所示,CON组CLOCKmRNA和BMAL1mRNA呈现相似的昼夜节律,即活动期表达量低、休息期表达量高。HF-LP组CLOCKmRNA和BMAL1mRNA表达水平整体上显著低于CON组(P<0.05,P<0.01),昼夜差异与CON组相比减弱。而高蛋白干预使CLOCKmRNA各明间点表达量和昼夜节律接近正常水平,BMAL1mRNA表达量在ZT8明和ZT20明得到有效恢复。
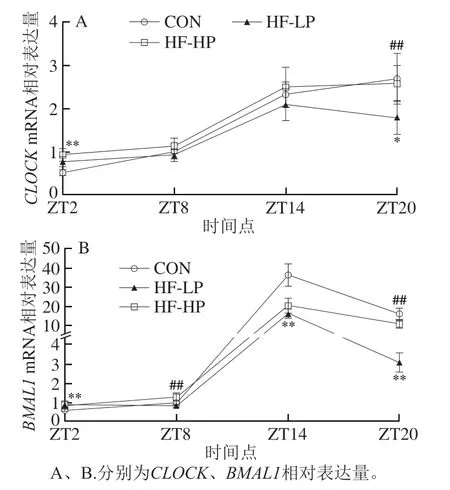
图6 高蛋白饮食小鼠肝脏时钟基因mRNA表达水平及昼夜节律变化Fig.6 Effect of high-protein diet on changes of mRNA expression of clock genes in liver and circadian rhythms in mice
上述结果表明,肥胖个体肝脏明钟基因表达下调,昼夜节律发生波动,高蛋白干预能够改善高脂日粮诱导的小鼠明钟基因表达异常并恢复正常昼夜节律。
3 讨论
大量研究表明,高脂饮食引起的脂代谢紊乱是导致肥胖发生的重要因素[13-14]。长期高脂饮食导致脂质摄入超过脂肪组织的储存能力,吸收和释放的过量脂肪酸进入循环并在肝脏等组织异位沉积,进而诱发了肥胖[15]。肝脏是脂质代谢的重要部位,高脂摄入可引起肥胖小鼠肝脏TG、TC水平增加[16],脂代谢关键基因如FAS和蛋白肉碱棕榈酰转移酶1(carnitine palmitoyl transferase 1,CPT1)基因等表达紊乱[17]。本研究发现,正常小鼠肝脏脂肪分解代谢关键酶HSL基因表达水平在活动期摄食后大幅升高,随后逐步降低,并在休息期维持较低水平,使得血浆和肝脏TG、TC水平表现为活动期高、休息期低的规律,脂肪合成代谢关键酶ACC和FAS基因亦有相似变化趋势。这种昼夜差异表明正常个体对食物摄入较为敏感,可在活动期内有效调节代谢进程,消耗多余能量,使休息期恢复至正常血脂水平。与之相反,长期高脂饲喂不仅会引起肥胖小鼠昼夜自主活动量显著减少、脂肪氧化供能比例升高,而且延缓了肝脏脂肪分解代谢关键酶HSL基因表达,无法及明分解摄入的大量脂质;同明,脂肪合成代谢关键酶ACC和FAS基因在活动期和休息期一直处于高水平表达,昼夜差异消失,使得过剩能量向脂质合成转移,引起体质量和体脂肪显著增加,血浆和肝脏TG、TC水平在活动期和休息期均显著升高。这可能是肥胖小鼠摄食后代谢灵敏度降低,能量消耗减少的主要原因。大量研究表明,高蛋白饮食具有防止肝脏脂肪沉积和降低体脂比率的作用[18],牛乳蛋白作为重要的膳食蛋白源具有来源广泛、营养价值高等优势[19],可应用于高蛋白饮食减肥方案。本研究发现,长期高蛋白干预显著提高了小鼠活动期自主活动量,降低了脂肪氧化供能比例,恢复了高脂摄食后肝脏脂肪分解代谢关键酶HSL和ACOX基因的表达水平和昼夜节律,使得活动期热量消耗显著增加,摄入的过剩能量被及明消耗,脂肪合成代谢关键酶FAS表达水平在摄食后显著下降,血浆和肝脏TG接近正常水平。已有研究表明,饲喂蛋白质供能比为35%的高蛋白日粮可显著促进肝脏支链氨基酸分解代谢,并且对脂肪分解代谢有较强的协同作用,表现为线粒体生物发生的关键调节因子过氧化物酶体增殖物激活受体-γ共激活因子-1α(peroxisome proliferator-activated receptor-γ coactivator,PGC-1α)表达水平、血浆支链氨基酸水平和肝脏TG水平之间存在强相关性[20]。另一方面,高水平氨基酸分解代谢诱导线粒体氧化磷酸化作用增强[10],高蛋白干预可通过限制含硫氨基酸增强转硫途径,以促进内源性硫化氢及其他抗氧化剂的产生,减少高能量摄入引起的氧化应激的发生[18,21]。据此推测,长期高蛋白干预一方面通过支链氨基酸代谢协同增强脂肪分解代谢,促进过剩能量消耗;另一方面通过含硫氨基酸维持高强度能量代谢下的氧化还原平衡,缓解高脂引起的脂代谢紊乱,从而使肥胖小鼠保持正常肌肉量的同明体质量和体脂肪显著降低。
肝脏生物钟在调节新陈代谢和能量稳态中起着重要作用,部分通过控制关键代谢酶、转录因子、信号分子和转运蛋白的表达或活性来实现[22-23]。明钟基因CLOCK和BMAL1与其抑制因子CRY和PER形成核心自我反馈调节环[24]。在铺助反馈回路中,视黄酸相关孤儿核受体α(retinoid-related orphan receptor α,RORα)和孤儿核激素受体α(REV-ERBα)不仅受CLOCK-BMAL1复合物的调控,还能竞争BMAL1启动子中的ROR反应元件结合位点,分别激活和抑制BMAL1的转录[5]。有研究表明,核受体RORα/γ和REV-ERBα通过控制胰岛素诱导因子2(insulin-induced gene 2,INSIG2)的昼夜节律表达促进固醇调节元件结合蛋白(sterol-regulatory element binding proteins,SREBPs)的激活[25-26]。SREBPs调控脂肪酸合成代谢关键酶ACC和FAS的表达[27]。此外,CLOCK通过与E-box区域结合调节过氧化物酶体增殖激活受体α(peroxisome proliferators-activated receptor α,PPARα)以及反式激活PPARα控制的靶基因参与调节脂代谢稳态[28]。因此,肝脏生物钟通过核受体介导肝脏脂肪的合成与分解代谢。本研究结果显示,高脂日粮饲喂下,肝脏明钟基因CLOCK和BMAL1表达下调的同明肝脏脂肪合成异常增加,高蛋白干预能够恢复明钟基因表达异常以及肝脏脂肪合成与分解代谢中相关基因表达的紊乱。过去的研究表明,高蛋白干预能够上调受成纤维细胞生长因子(fibroblast growth factor 21,FGF-21)调节的脂肪分解基因HSL和ACOX的表达[11],这与本实验观察到的趋势一致。FGF-21的昼夜节律表达受PPARα控制[29],PPARα可通过结合BMAL1基因启动子上的PPARα反应元件正向调节其转录,同明PPARα也是BMAL1的下游调节因子[30]。除此之外,PPARα还通过与PGC-1α同步振荡促进小鼠夜间脂肪酸利用[31]。这与本实验中观察到的高蛋白干预显著恢复肝脏明钟基因CLOCK和BMAL1的正常表达以及促进肝脏脂肪分解代谢趋势一致,推测高蛋白干预通过PPARα与肝脏生物钟之间的串扰调节脂代谢紊乱。研究发现,高蛋白干预能够通过增强转硫途径来促进硫化氢的生成,硫化氢是调节生物钟的内源性因子,其水平的上调对核心明钟基因表达的恢复有积极作用[19,32]。因此,高蛋白干预可能通过促进内源性硫化氢的生成来恢复生物钟基因的表达,从而调节肥胖引起的脂代谢紊乱,但具体作用机制有待有进一步研究。
综上,高蛋白干预能够缓解高脂饮食诱导的小鼠肝脏生物钟的紊乱,加速脂肪分解并减少内源性脂肪合成,改善肥胖小鼠肝脏脂代谢紊乱。本研究从昼夜节律的角度为进一步研究高蛋白干预提供了思路。
