泊沙康唑口服混悬液在HSCT 患者中的剂量校正浓度及其影响因素分析Δ
2024-01-03束一朔董中华衣巧艳李洪娟丁国玉赵羽琦张潇月林子云杨依磊时海燕王红美山东第一医科大学第一附属医院山东省千佛山医院血液病学科济南50014山东第一医科大学第一附属医院山东省千佛山医院临床药学科山东省儿童药物临床评价与研发工程技术研究中心山东省医药卫生临床药学重点实验室济南50014山东第一医科大学第一附属医院山东省千佛山医院小儿内科山东省儿童药物临床评价与研发工程技术研究中心济南50014
董 琳 ,束一朔 ,董中华 ,衣巧艳 ,李洪娟 ,顾 艳 ,韩 燕 ,丁国玉 ,赵羽琦 ,张潇月 ,李 雪 ,林子云 ,穆 锴 ,杨依磊 ,时海燕 ,王红美 #[1.山东第一医科大学第一附属医院(山东省千佛山医院)血液病学科,济南 50014;.山东第一医科大学第一附属医院(山东省千佛山医院)临床药学科/山东省儿童药物临床评价与研发工程技术研究中心/山东省医药卫生临床药学重点实验室,济南 50014;.山东第一医科大学第一附属医院(山东省千佛山医院)小儿内科/山东省儿童药物临床评价与研发工程技术研究中心,济南 50014]
侵袭性真菌病(invasive fungal disease,IFD)是造血干细胞移植(hematopoietic stem cell transplantation,HSCT)后常见的感染性并发症,是导致HSCT患者死亡的重要原因[1-2],因此有必要对其进行抗真菌治疗。泊沙康唑是一种全身性的三唑类广谱抗真菌药物,以伊曲康唑结构为基础衍生而来,与其他三唑类药物的抗真菌作用机制类似[3]。泊沙康唑的临床效果和耐受性良好,是临床预防真菌感染的一类推荐药物,目前已被广泛应用于急性白血病和再生障碍性贫血等免疫力低下患者的抗真菌治疗[4-5]。有研究认为,泊沙康唑的疗效与其血药浓度相关,预防IFD时泊沙康唑的目标血药谷浓度(minimum concentration,C0)应不低于0.7 μg/mL[6-7]。临床实践显示,部分患者由于泊沙康唑暴露不足,而未能达到预期的治疗效果[8]。通过治疗药物监测(therapeutic drug monitoring,TDM)可及时发现患者泊沙康唑暴露不足的问题,因此TDM 被推荐应用于泊沙康唑的抗真菌治疗中[9]。
据报道,泊沙康唑的吸收速率常数(absorption rate constant,Ka)在不同患者中有所差异,且其生物利用度(bioavailability,F)的个体间变异性很高[3,10]。已有研究表明,质子泵抑制剂(proton pump inhibitors,PPI)和甲氧氯普胺的使用以及腹泻、呕吐、黏膜炎的发生均会降低泊沙康唑血药浓度(posaconazole plasma concentration,PPC)[6];此外,泊沙康唑几乎不经过细胞色素P450(cytochrome P450,CYP450)代谢,约17%经过尿苷二磷酸(uridine diphosphate,UDP)-葡糖苷酸转移酶代谢,故苯妥英钠、利福布汀等UDP-葡糖苷酸转移酶诱导剂也会降低PPC[11]。进一步研究发现,影响PPC 的因素很多,且患者性别、年龄和体重指数(body mass index,BMI)等指标是否与PPC有关尚无定论[6,11]。因此,分析PPC的影响因素,寻找泊沙康唑个体差异的原因和机制,将有助于该药的临床合理使用。基于此,本研究拟评价HSCT患者使用泊沙康唑预防IFD 的临床失败率,考察TDM后剂量调整对患者临床失败率的影响,并分析该药谷浓度与日剂量比值(即剂量校正浓度,C0/D)的影响因素,旨在为泊沙康唑的临床合理用药提供参考。
1 资料与方法
1.1 资料来源
收集2021年1月至2023年4月山东第一医科大学第一附属医院(山东省千佛山医院)收治的服用泊沙康唑口服混悬液预防IFD并行PPC监测的住院HSCT患者的临床资料。本研究方案经医院医学伦理委员会审核通过,批件号为【2023】伦审字(S359)号。
1.2 纳入与排除标准
本研究的纳入标准为:(1)住院的HSCT 患者;(2)长期服用泊沙康唑预防IFD;(3)治疗期间监测过PPC。
本研究的排除标准为:(1)资料或用药信息不全者;(2)未按医嘱服药者;(3)血液采集与检测不符合要求者;(4)住院期间曾参与过其他抗真菌药物介入临床试验者。
1.3 用药及血药浓度监测方法
所有患者均服用泊沙康唑口服混悬液(加拿大Patheon Inc.,Whitby Operations,国药准字HJ20181110,规格40 mg/mL)40~200 mg,每天2 次或每天3 次。7 d后,于下次服药前采集患者静脉血3~5 mL,血浆样本经高速离心后,吸取上清液100 μL,加入替硝唑内标工作液(质量浓度为250 μg/mL)10 μL,加入乙腈200 μL 沉淀蛋白,涡旋后离心10 min,取上清液,采用高效液相色法测定浓度。色谱条件如下:以Shimadzu InertSustain C18(4.5 mm×250 mm,5 μm)为色谱柱,水(A)-乙腈(B)为流动相进行梯度洗脱(0~8 min,30%B;8~10 min,30%B→50%B;10~30 min,50%B;30~32 min,50%B→90%B;32~40 min,90%B;40~42 min,90%B→30%B;42~50 min,30%B);柱温为35 ℃;流速为0.8 mL/min;检测波长为261 nm;进样量为10 μL;进样器温度为4 ℃;运行时间为50 min。 以血浆中泊沙康唑质量浓度为横坐标(X)、泊沙康唑与内标的峰面积比值为纵坐标(Y)进行线性回归,得回归方程为:Y=0.225 329X-0.004 007 99(R2=0.999 1),检测质量浓度线性范围为0.1~10 μg/mL。相关方法学考察均符合2020年版《中国药典》(四部)的要求[12]。同一患者仅纳入一个血药浓度检测结果进行分析。
1.4 观察指标
本研究的观察指标包括泊沙康唑预防IFD 的浓度达标率、临床失败率及C0/D的影响因素。参考相关文献[6-7],以C0≥0.7 μg/mL 作为泊沙康唑预防IFD 的血药浓度达标标准,泊沙康唑预防IFD 的浓度达标率=PPC达标患者数/总例数×100%。临床失败率指患者服用泊沙康唑100 d后的临床失败率,临床失败评价标准如下:(1)治疗阶段确诊或拟诊断为IFD(具体标准参考欧洲癌症研究与治疗组织和真菌病研究组的相关共识标准定义[13-14]);(2)接受其他全身性抗真菌药物治疗连续4 d或非连续治疗总时间超过10 d;(3)因与研究药物相关的不良反应而停用泊沙康唑[15-16]。以上标准满足≥1项即为临床失败,临床失败率=临床失败患者数/总例数×100%。
1.5 统计学方法
应用SPSS 26.0软件对数据进行统计分析。正态性检验显示,C0/D数据不符合正态分布,对其进行对数转换后,所得对数值符合正态分布,遂进行单因素分析(多组间比较采用单因素方差分析,两组间比较采用独立样本t检验,多重比较采用LSD-t检验),以±s表示;以单因素分析结果中P<0.05 的指标为自变量,C0/D的对数值为因变量,采用多元线性回归分析C0/D的影响因素。计数资料以率表示,采用χ2检验。检验水准α=0.05。
2 结果
2.1 患者基本资料
2021年1月至2023年4月该院共有89 例住院的HSCT 患者监测了PPC,根据纳入与排除标准最终纳入患者44例。其中,男性26例,女性18例;平均年龄22.98(3~63)岁;平均体重43.26(14.20~80.00)kg。
2.2 泊沙康唑预防IFD的浓度达标率
44例患者的泊沙康唑平均C0为(0.99±0.94)μg/mL,最低为0.10 μg/mL,最高为4.03 μg/mL,中位值为0.64 μg/mL,其中20 例患者的C0为(1.78±0.85)μg/mL(≥0.7 μg/mL),该药预防IFD的浓度达标率为45.45%。
2.3 临床失败率及泊沙康唑预防IFD 的浓度未达标患者的剂量调整
44 例患者中,13 例为临床失败,临床失败率为29.55%,包括1例C0达标患者、12例C0未达标患者;达标患者的临床失败率为5.00%(1/20),未达标患者的临床失败率为50.00%(12/24),达标患者的临床失败率显著低于未达标患者(χ2=10.61,P=0.001)。
24例C0未达标患者中,有7例患者按照临床医师指导及时调整了泊沙康唑剂量,但调整后仍有1例临床失败;13例未进行剂量调整的患者中,有7例为临床失败;其余4例患者在临床医师建议下更换为其他抗真菌药物治疗。
2.4 泊沙康唑C0/D影响因素的单因素分析结果
单因素分析结果显示,女性患者的C0/D显著高于男性患者;BMI、肾功能对C0/D有显著影响(P<0.05),进一步LSD-t检验结果显示,体重过低患者的C0/D显著高于体重正常患者(P=0.004),肾功能正常患者的C0/D显著低于重度肾功能不全患者(P=0.014),联用奥美拉唑、苯妥英钠和甲氧氯普胺患者的C0/D均显著低于不联合用药患者(P<0.05)。结果见表1。
2.5 泊沙康唑C0/D影响因素的多元线性回归分析
将表1中单因素分析P<0.05的指标纳入多元线性回归分析,结果显示,所得回归方程显著(F=7.846,P<0.001,R2=0.56),且患者性别、BMI 和联用苯妥英钠对泊沙康唑C0/D有显著影响(P<0.05)。这提示女性患者的泊沙康唑平均C0/D高于男性;BMI 与泊沙康唑C0/D呈负相关,即泊沙康唑C0/D可随患者BMI 的增加而降低;而联用苯妥英钠会降低泊沙康唑C0/D。结果见表2。
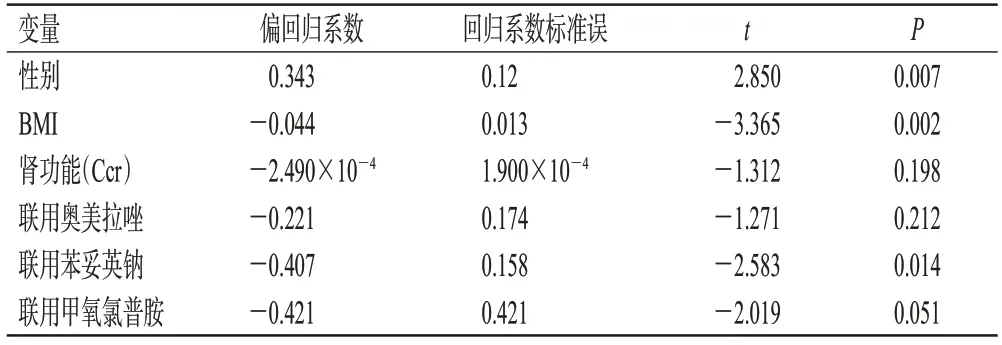
表2 泊沙康唑C0/D影响因素的多元线性回归分析结果
3 讨论
本研究结果显示,44 例患者的泊沙康唑中位C0为0.64 μg/mL,该结果高于其他类似研究的平均血药浓度水平(0.38 μg/mL)[17]。当患者随餐或高脂餐同时服用泊沙康唑口服混悬液,其体内PPC将会增加[6],本研究纳入的44例患者均按照医嘱清淡饮食并随餐服用泊沙康唑,这可能是PPC 高于现有文献数据的原因之一。20 例C0达标患者中,有1例为临床失败,临床失败率为5.0%,明显低于C0未达标患者的50.00%。7例患者经TDM发现C0未达标后,在临床医师指导下及时调整了泊沙康唑的剂量,但仍有1 例为临床失败(临床失败率为14.29%);13例患者经TDM发现C0未达标后,并未进行剂量调整,其中7 例为临床失败(临床失败率为53.84%)。据此笔者建议患者通过TDM 监测到泊沙康唑C0未达标后,临床应及时调整泊沙康唑的剂量,以保证治疗有效。
本研究考虑到患者的泊沙康唑个体差异较大,故选择对泊沙康唑C0进行剂量校正,并分析了影响该药C0/D的可能因素,这可在不考虑日剂量变化的情况下,对患者的PPC 进行对比[18]。本研究结果显示,患者年龄、中性粒细胞计数和肝功能均不是C0/D的影响因素,这与Märtson 等[19]和Vehreschild 等[20]等的研究结果一致。泊沙康唑的血浆蛋白结合率约为98%,且主要与白蛋白结合,低白蛋白水平可能会导致PPC 降低[6]。但本研究结果显示,白蛋白异常患者的C0/D与白蛋白正常患者比较差异无统计学意义,这可能与纳入的白蛋白异常患者例数较少有关。肾脏不是泊沙康唑排泄的主要途径,约77%的泊沙康唑由粪便排出,而13%由尿液排出[3]。本研究单因素分析结果显示,肾功能正常患者的泊沙康唑C0/D显著低于重度肾功能不全患者;但多元线性回归分析结果表明,肾功能不是影响泊沙康唑C0/D的独立因素。这与泊沙康唑药品说明书提及的轻度至中度肾功能不全患者不需要进行剂量调整,但有必要密切监测重度肾功能不全患者的真菌感染情况一致。泊沙康唑为亲脂性药物,组织亲和力强,广泛分布于脂肪组织中,肥胖人群有更高的表观分布容积[3,6]。Miceli等[21]的回顾性研究结果显示,BMI≥30 kg/m2患者的泊沙康唑C0明显低于BMI 较低患者。本研究的结果也表明,泊沙康唑C0/D可随患者BMI 的增加而呈降低趋势。泊沙康唑药品说明书提及,该药在男性和女性患者体内的药代动力学特征相似,不需要根据性别调整剂量,但Jia 等[18]的一项在中国血液病患者中的研究结果表明,女性患者的PPC比男性更高,并解释这可能是由男女性激素水平和脂肪比例的差异所致。本研究结果显示,女性患者的泊沙康唑C0/D高于男性患者,这与上述研究结论一致。已有研究表明,奥美拉唑、苯妥英钠和甲氧氯普胺均能降低PPC[6]。本研究中,联用奥美拉唑、苯妥英钠和甲氧氯普胺均能降低患者的泊沙康唑C0/D,但多元线性回归分析结果表明,只有联用苯妥英钠是影响泊沙康唑C0/D的独立因素,这可能与本研究纳入联用奥美拉唑和甲氧氯普胺患者例数较少有关。
综上所述,泊沙康唑口服混悬液血药浓度个体差异较大;性别、BMI 和联用苯妥英钠是影响泊沙康唑C0/D的独立因素。建议临床借助TDM 完善HSCT 患者的泊沙康唑个体化治疗。
