达原饮对RSV寒湿郁肺证小鼠肺部损伤和肠道菌群的影响Δ
2024-01-03杜海涛王晓雪刘善新山东中医药大学药学院济南50355山东省中医药研究院济南5004
张 茹 ,杜海涛 ,王晓雪 ,王 仪 ,周 倩 ,刘善新 ,王 平 #(.山东中医药大学药学院,济南 50355;.山东省中医药研究院,济南 5004)
呼吸道合胞病毒(respiratory syncytial virus,RSV)属副黏病毒科,是引起婴幼儿下呼吸道感染的常见病原体之一[1]。对于RSV 的防治,目前世界范围内尚无特异性药物和疫苗。中医药治疗病毒感染具有多成分、多途径、多靶点的独特优势,其不仅针对某一特定病毒,而且可就病因病机进行辨证论治。RSV 感染属中医“疫病”范畴,有证据表明在寒湿环境下,机体对RSV 的易感性有所增加[2]。达原饮源自《温疫论》,由槟榔、厚朴、草果、知母、芍药、黄芩、甘草7味药组成,可开达膜原、辟秽化浊,治疗疟疾、瘟疫邪伏膜原等病证。现代药理学研究表明,达原饮具有抗病毒、解热、抗炎等多种药理作用,可用于治疗呼吸道病毒感染导致的肺部损伤[3-5]。
“肺与大肠相表里”是中医藏象学的经典理论之一。临床调查发现,呼吸道病毒在引发肺部损伤的同时,还会导致患者肠道菌群失衡,出现恶心、呕吐、腹痛、腹泻等胃肠道症状[6]。益生菌混合物能通过调节肠道菌群的组成来调控肺泡巨噬细胞分泌干扰素β,从而有效防治RSV 引起的肺部病变[7]。可见,肠道菌群的改变对呼吸道病毒感染的发生、发展和治疗起重要作用。
为了更好地贴合RSV 流行时的气候条件,符合“寒湿疫”的中医证候表现,本研究拟采用“寒湿造模+RSV感染”的方式建立RSV 寒湿郁肺证小鼠模型,同时在前期药效学实验的基础上,通过16S rDNA 技术探索达原饮对模型小鼠肠道菌群的影响,从而阐明其潜在作用机制,为中医药治疗RSV感染提供实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括TC20TM型细胞计数仪、XJ-023型酶标仪(美国Bio-Rad公司),FACSAria Ⅲ型流式细胞仪(美国BD 公司),X-30R 型全能高速冷冻离心机(美国Allegra公司),A200型基因扩增仪(杭州朗基科学仪器有限公司),EPS300型电泳仪、Tanon-2500型凝胶成像仪(上海天能生命科学有限公司),NovaSeq 6000系统测序仪(美国Illumina公司),2100型生物分析仪(美国Agilent公司)等。
1.2 主要药品与试剂
槟榔、厚朴、草果、知母、白芍、黄芩、甘草饮片均购自山东建联盛嘉中药有限公司,经山东省中医药研究院周倩研究员鉴定,分别为棕榈科植物槟榔ArecacatechuL.的干燥成熟种子,木兰科植物厚朴MagnoliaofficinalisRehd.et Eils.的干燥干皮、根皮及枝皮,姜科植物草果AmomumtsaokoCrevost et Lemaire 的干燥成熟果实,百合科植物知母AnemarrhenaasphodeloidesBge.的干燥根茎,毛茛科植物芍药PaeonialactifloraPall.的干燥根,唇形科植物黄芩ScutellariabaicalensisGeorgi 的干燥根,豆科植物甘草GlycyrrhizauralensisFisch.的干燥根和根茎。
利巴韦林原料药(批号J1202A,纯度≥99%)购自大连美仑生物技术有限公司;异氟烷(批号20092202)购自深圳市瑞沃德生命科技有限公司;小鼠白细胞介素6(interleukin-6,IL-6)、IL-1β 酶联免疫吸附测定(enzymelinked immunosorbent assay,ELISA)试剂盒(批号分别为A21020726、A201B20634)均购自杭州联科生物技术股份有限公司;小鼠胃动素(motilin,MTL)、胃泌素(gastrin,GAS)ELISA 试剂盒(批号分别为20220620、20220612)均购自上海酶联生物技术有限公司;苏木精-伊红(hematoxylin-eosin,HE)染色套装(批号G1003)购自武汉赛维尔生物科技有限公司;4%多聚甲醛通用性组织固定液、红细胞裂解液(批号分别为22105339、22118166)均购自北京兰杰柯科技有限公司;藻红蛋白标记的抗小鼠CD45R/B220 抗体、别藻青蛋白标记的抗小鼠CD8a 抗体、Alexa Fluor®700 标记的抗小鼠CD3 抗体、异硫氰酸荧光素标记的抗小鼠CD4 抗体、7-氨基放线菌素D 活性检测染料(批号分别为B357370、B348049、B357069、B356714、B321733)均购自美国Bio-Legend公司。
1.3 病毒毒株与细胞
RSV病毒液由山东省医学科学院基础医学研究所提供,于山东中医药大学BSL-2实验室传代,置于-80 ℃冰箱保存,备用。人喉癌细胞HEP-2由山东省医学科学院基础医学研究所提供。
1.4 实验动物
SPF级雌性BALB/c小鼠36只,体重13~15 g,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号为SCXK(京)2021-0006。所有小鼠均饲养于山东中医药大学动物实验中心ABSL-2实验室。本实验遵循3R 原则动物福利,实验方案按山东中医药大学实验动物福利伦理审查委员会相关规定执行并获批准(批件号SDUTCM20230510001)。
2 方法
2.1 达原饮制备
取达原饮经方组成中槟榔、厚朴、草果、知母、白芍、黄芩、甘草7味中药饮片,加10倍量水浸泡30 min后,煎煮1 h,过滤;再加8倍量水煎煮45 min,过滤;合并2次滤液,浓缩至1 g/mL(按生药总量计),于4 ℃保存,备用。
2.2 RSV扩增
待HEP-2 细胞长成单层后,加入RSV 病毒液200 μL,吸附1 h后,加入2% DMEM维持液培养。当90%以上细胞出现致细胞病变效应后,于-20 ℃与室温之间反复冻融3 次,以4 000 r/min 离心5 min,取上清液于离心管中,于-80 ℃冻存,备用。
2.3 RSV半数细胞培养物感染量的测定
将HEP-2细胞按1×108个/L接种至96孔板中,培养24 h;加入以10倍比稀释12个滴度梯度的RSV病毒液,每孔100 μL,纵向重复3 孔;同时,设置正常细胞(加入等体积10% DMEM 维持液)作为对照。培养48 h,采用MTT 法以酶标仪于490 nm 波长处测定各孔的光密度(optical density,OD)值,重复测定4 次。根据Reed-Muench 公式[8]计算RSV 半数细胞培养物感染量(median tissue culture infective dose,TCID50)。
2.4 小鼠分组、给药与造模
小鼠适应性饲养3 d后,按体重分为正常组(NC组,生理盐水)、模型组(MC 组,生理盐水)、阳性对照组(LBM组,57.59 mg/kg利巴韦林,相当于临床等效剂量)和达原饮低、中、高剂量组(LDYY、MDYY、HDYY 组,剂量按生药量计分别为1.67、3.34、6.68 g/kg,相当于临床等效剂量的0.5、1、2倍),每组6只。根据课题组前期研究方法[9]复制RSV寒湿郁肺证小鼠模型:除NC组外,其余各组小鼠均置于温度(4±1)℃、相对湿度(90±5)%的人工气候箱中,每天4 h,连续5 d,寒湿造模期间禁食、不禁水,刺激4 h后取出。第2次寒湿刺激结束后,除NC 组外的其余各组小鼠均吸入异氟烷麻醉,并鼻腔滴注50倍TCID50的RSV病毒液60 μL,每天1次,连续3 d;NC组小鼠同法滴鼻等体积生理盐水。各药物组小鼠每次滴鼻4 h后灌胃相应药液,NC组和MC组小鼠同法灌胃等体积的生理盐水,每天1次,持续5 d。
2.5 标本采集与处理
末次给药后,所有小鼠禁食、不禁水12 h,摘眼球取血并置于乙二胺四乙酸抗凝采血管和普通采血管中。抗凝采血管中的血样用于流式检测;普通采血管中的血样于室温下静置2 h后,以3 000 r/min离心15 min,收集上层血清,于-80 ℃保存,备用。取血后,收集小鼠结肠内容物于无菌冻存管中,于-80 ℃保存,备用。然后,处死小鼠,开胸剖取肺组织,将其左小叶用4%多聚甲醛浸润、固定;取其右肺最大叶称重后加入适量磷酸盐缓冲液,匀浆后以3 000 r/min离心10 min,收集上清液,于-80 ℃保存,备用;其余肺组织于-80 ℃下保存,备用。
2.6 血清中胃肠激素水平和肺组织上清液中炎症因子水平测定
取“2.5”项下各组小鼠血清和肺组织上清液,严格按照ELISA试剂盒说明书操作,使用酶标仪检测其血清胃肠激素(MTL、GAS)水平和肺组织上清液中炎症因子(IL-6、IL-1β)水平。
2.7 外周血淋巴细胞百分比检测
取“2.5”项下各组小鼠外周血100 μL,加入CD8a、CD3、CD4抗体各1.25 μL,涡旋混匀,于4 ℃下避光染色20 min;加入7-氨基放线菌素D活性检测染料适量,孵育10 min;加入红细胞裂解液1 mL,涡旋混匀,于室温下静置15 min,以2 000 r/min离心5 min,弃去上清液;细胞加入磷酸盐缓冲液2 mL,以2 000 r/min离心5 min,弃取上清液;细胞以磷酸盐缓冲液200 μL重悬后转移至流式管中,使用流式细胞仪进行检测其外周血淋巴细胞百分比。
2.8 肺组织病理形态观察
取“2.5”项下各组小鼠经固定的肺组织,进行脱水、透明、浸蜡、包埋、切片,经HE染色后,以中性树胶封片。使用显微镜观察其肺组织病理形态变化并拍照。
2.9 小鼠肠道菌群基因测序
以NC 组、MC 组、MDYY 组(前述药效学实验结果显示中剂量达原饮药效最佳)小鼠的结肠内容物为检测样本,采用十六烷基三甲基溴化铵法提取样本的DNA,通过琼脂糖凝胶电泳和紫外分光光度计分别确定所提取DNA的质量和数量。以该DNA为模板,对16S rDNA V3~V4 区进行扩增,引物序列为806R:GACTACHVGGGTATCTAATCC;341F:CCTACGGGNGGCWGCAG;序列方向长度为806R-341F,产物长度为465 bp[10]。PCR扩增产物通过2%琼脂糖凝胶电泳进行检测,并回收目标片段;对纯化后的PCR 产物进行评估,将合格的测序文库梯度稀释,根据所需测序量按相应比例混合,并经NaOH 变性为单链后上机测序。得到原始下机数据后,利用Overlap软件将双端数据进行拼接,并进行质控、嵌合体过滤。测序数据经过DADA2 去噪后,利用扩增序列变体(amplicon sequence variants,ASVs)概念构建操作分类单元(operational taxonomic units,OTU)表,获得最终的ASVs特征表及特征序列并进行菌群α多样性分析(Shannon、Simpson、Chao1、Goods_coverage 指数)、肠道结构分析和线性判别分析(linear discriminant analysis effect size,LEfSe)。
2.10 统计学方法
采用GraphPad Prism 8.0.2 软件进行统计分析和作图。数据以±s表示,对于符合正态分布且方差齐的数据,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;对于非正态分布或者方差不齐的数据,组间比较采用非参数秩和检验。检验水准α=0.05。
3 结果
3.1 达原饮对小鼠血清胃肠激素水平和肺组织上清液中炎症因子水平的影响
与NC 组比较,MC 组小鼠血清中MTL 水平和肺组织上清液中IL-6、IL-1β水平均显著升高,血清中GAS水平显著降低(P<0.01)。与MC组比较,各药物组小鼠血清中MTL水平(HDYY组除外)和肺组织上清液中IL-6、IL-1β 水平均显著降低,血清中GAS 水平(HDYY 组除外)均显著升高(P<0.05或P<0.01)。结果见表1。
表1 各组小鼠血清中胃肠激素水平和肺组织上清液中炎症因子水平测定结果(±s,n=6,pg/mL)
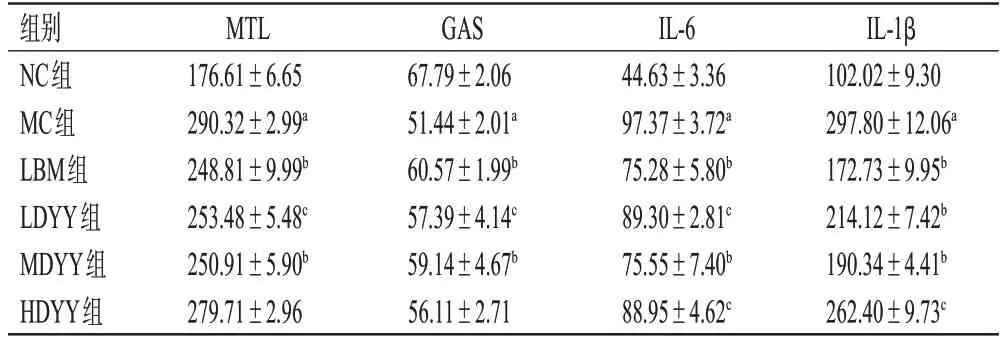
表1 各组小鼠血清中胃肠激素水平和肺组织上清液中炎症因子水平测定结果(±s,n=6,pg/mL)
a:与NC组比较,P<0.01;b:与MC组比较P<0.01;c:与MC组比较,P<0.05。
IL-1β 102.02±9.30 297.80±12.06a 172.73±9.95b 214.12±7.42b 190.34±4.41b 262.40±9.73c组别NC组MC组LBM组LDYY组MDYY组HDYY组MTL 176.61±6.65 290.32±2.99a 248.81±9.99b 253.48±5.48c 250.91±5.90b 279.71±2.96 GAS 67.79±2.06 51.44±2.01a 60.57±1.99b 57.39±4.14c 59.14±4.67b 56.11±2.71 IL-6 44.63±3.36 97.37±3.72a 75.28±5.80b 89.30±2.81c 75.55±7.40b 88.95±4.62c
3.2 达原饮对小鼠外周血淋巴细胞百分比的影响
与NC 组比较,MC 组小鼠外周血中T、B 淋巴细胞百分比均显著降低(P<0.01);与MC组比较,LBM组小鼠外周血中T、B 淋巴细胞百分比均显著升高(P<0.05或P<0.01),LDYY 组小鼠外周血中T 淋巴细胞百分比和MDYY组小鼠外周血中T、B淋巴细胞百分比均显著升高(P<0.05或P<0.01)。结果见表2。
表2 各组小鼠外周血淋巴细胞百分比测定结果(±s,n=6,%)
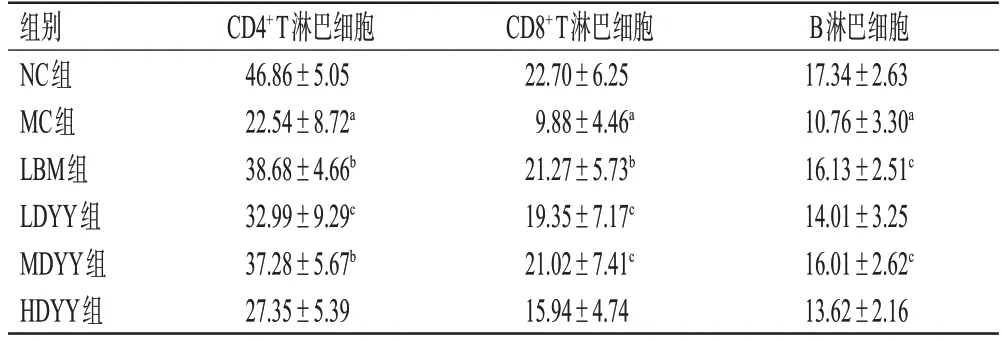
表2 各组小鼠外周血淋巴细胞百分比测定结果(±s,n=6,%)
a:与NC组比较,P<0.01;b:与MC组比较P<0.01;c:与MC组比较,P<0.05。
组别NC组MC组LBM组LDYY组MDYY组HDYY组CD4+ T淋巴细胞46.86±5.05 22.54±8.72a 38.68±4.66b 32.99±9.29c 37.28±5.67b 27.35±5.39 CD8+ T淋巴细胞22.70±6.25 9.88±4.46a 21.27±5.73b 19.35±7.17c 21.02±7.41c 15.94±4.74 B淋巴细胞17.34±2.63 10.76±3.30a 16.13±2.51c 14.01±3.25 16.01±2.62c 13.62±2.16
3.3 达原饮对小鼠肺组织病理形态的影响
NC 组小鼠肺部组织结构完整,间质未见明显的炎症细胞渗出和淤血等病理变化;MC 组小鼠肺组织有大面积出血片状红染,支气管周围有炎症细胞浸润,肺泡壁明显增厚。与MC组比较,各给药组小鼠肺组织病理状态均改善,尤以LBM 组和MDYY 组的改善效果更明显。结果见图1(LDYY组和HDYY组的图片略)。
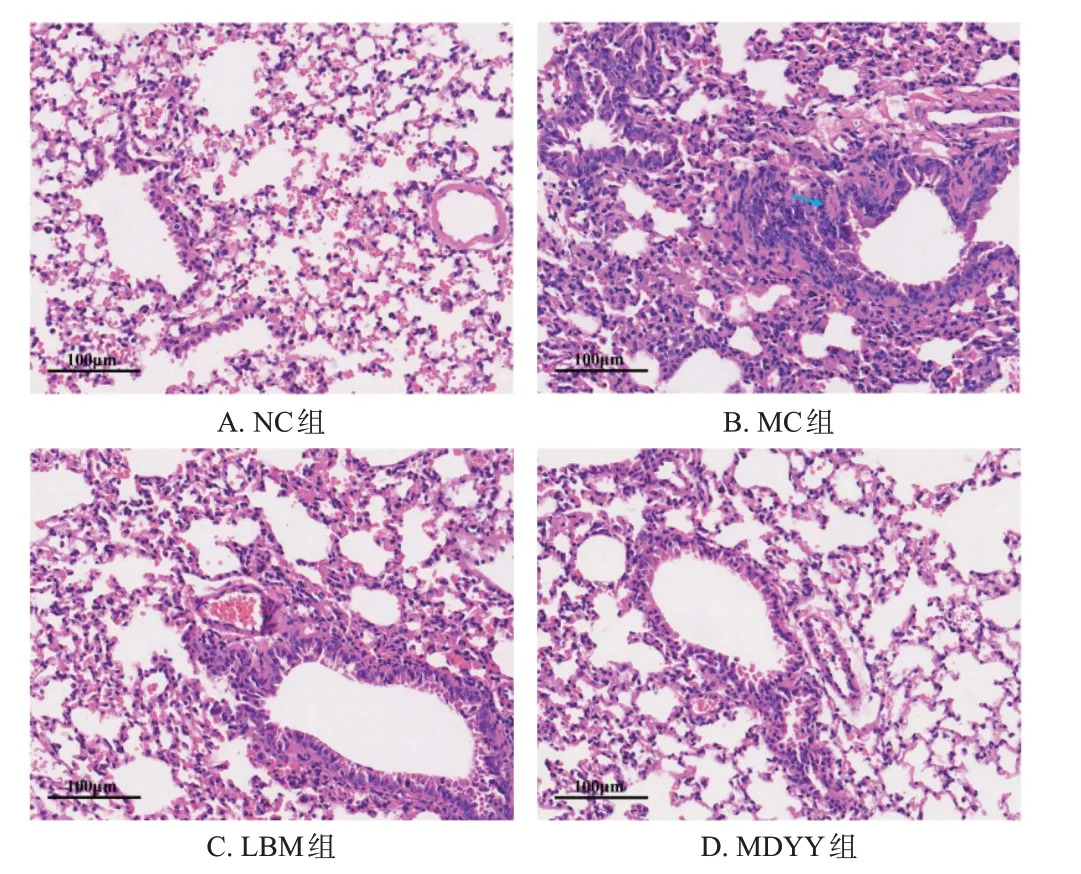
图1 小鼠肺组织病理形态观察的显微图(HE染色)
3.4 达原饮对小鼠肠道菌群结构和组成的影响
3.4.1 α多样性
3组样本的Goods_coverage指数均接近1,表明检测深度已经基本涵盖了样品中的所有物种,能够反映各样本的微生物群落情况[10]。与NC 组比较,MC 组的Simpson、Shannon、Chao1 指数均有所增加;与MC 组比较,MDYY组上述指数均有所降低,提示达原饮干预后肠道菌群多样性有回调趋势。结果见表3。
表3 各组小鼠肠道菌群α多样性分析结果(±s,n=6)
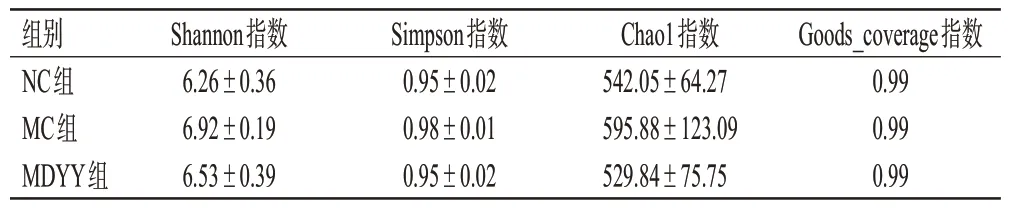
表3 各组小鼠肠道菌群α多样性分析结果(±s,n=6)
组别NC组MC组MDYY组6.26±0.36 6.92±0.19 6.53±0.39 0.95±0.02 0.98±0.01 0.95±0.02 542.05±64.27 595.88±123.09 529.84±75.75 0.99 0.99 0.99 Shannon指数Simpson指数Chao1指数Goods_coverage指数
3.4.2 门水平下肠道菌群差异及相对丰度
在门水平上,BALB/c 小鼠的优势菌群主要有厚壁菌门Firmicutes、拟杆菌门Bacteroidetes、变形菌门Proteobacteria、放线菌门Actinobacteria等,其中厚壁菌门和拟杆菌门占比较大。与NC 组比较,MC 组厚壁菌门(P<0.01)和变形菌门(P>0.05)的相对丰度均有所减少,拟杆菌门(P<0.01)和放线菌门(P>0.05)的相对丰度均有所增加,MC 组小鼠拟杆菌门/厚壁菌门比值增大。与MC组比较,MDYY组拟杆菌门的相对丰度有所降低,厚壁菌门的相对丰度显著增加(P<0.01);此外,放线菌门和变形菌门水平也有回调趋势,但差异均无统计学意义(P>0.05),提示达原饮可以改善模型小鼠的肠道菌群失调。结果见图2。
3.4.3 属水平下肠道菌群差异及相对丰度
在属水平上,各组小鼠肠道菌群主要以毛螺菌属NK4A136 组Lachnospiraceae_NK4A136_group、未分类的Muribaculaceae、另枝菌属Alistipes、未分类的Clostridiales、未分类梭菌属UCG-014、拟普雷沃氏菌属Alloprevotella、丝状菌属Kineothrix和拟杆菌属Bacteroides等为主。与NC 组比较,MC 组小鼠毛螺菌属NK4A136组、丝状菌属和未分类Clostridiales的相对丰度均显著减少(P<0.01),拟杆菌属、另枝菌属、未分类Muribaculaceae、拟普雷沃氏菌属的相对丰度虽有所增加,但差异均无统计学意义(P>0.05)。与MC 组比较,MDYY 组小鼠毛螺菌属NK4A136组和丝状菌属相对丰度均显著增加(P<0.05 或P<0.01),未分类Muribaculaceae的相对丰度显著降低(P<0.01),此外未分类的Clostridiales、拟杆菌属、另枝菌属、拟普雷沃氏菌属水平也呈现回调趋势,但差异均无统计学意义(P>0.05)。结果见图3。

图3 各组小鼠属水平下肠道菌群结构分析
3.4.4 LEfSe多级物种差异
LEfSe结果显示,NC组对群落结构影响较大的差异物种有厚壁菌门、梭菌目、毛螺菌科等[线性判别分析(linear discriminant analysis,LDA)值>4[11],下同]。MC组中对群落结构影响较大的差异物种有拟杆菌纲、Muribaculaceae、Muribaculum、产酸拟杆菌等。MDYY组中对群落结构影响较大的差异物种有Lachnospiraceae_UCG-006、瘤胃球菌属Ruminococcus等。结果见图4。

图4 LEfSe的LDA柱状图
4 讨论
为了更加贴合RSV 流行时的气候条件,符合“寒湿疫”的中医证候表现,本研究采用了“寒湿造模+RSV 感染”的方式建立RSV 寒湿郁肺证小鼠模型。结果显示,与NC 组比较,MC 组小鼠肺组织有明显病变,血清中MTL 水平和肺组织上清液中IL-1β、IL-6 水平均显著升高,血清中GAS 水平显著降低。此外,模型小鼠外周血中CD4+、CD8+T淋巴细胞百分比和B淋巴细胞百分比均显著降低,这些特征与文献报道的“寒湿疫”动物模型相吻合[12]。
本研究使用不同剂量的达原饮对模型小鼠进行干预,发现小鼠肺部病理、肺组织炎症因子水平、血清中胃肠激素水平和T、B淋巴细胞百分比均得到显著改善,有效缓解了RSV 感染引起的肺部损伤。但达原饮并没有呈现明显的量效关系,这可能是由于高剂量达原饮苦味较大,灌胃时小鼠比较抗拒,导致给药量不达标所致。
肠道菌群可调节宿主的免疫反应,参与人体各系统重要的生理功能,影响多种疾病的发生发展,被称为“人类第二基因组”。在正常情况下,宿主与肠道微生物维持着相对动态平衡;当肠道菌群失衡,会引发宿主屏障、免疫等功能丧失,从而加重甚至诱发疾病[13]。本研究运用16S rDNA 技术发现,与NC 组比较,MC 组小鼠的肠道菌群丰度与多样性均有所增加。经中剂量达原饮干预后,小鼠肠道菌群的多样性及丰度均明显回调,表明该方能改善RSV 寒湿郁肺证小鼠的肠道菌群紊乱。BALB/c 小鼠的肠道菌群主要由四大菌门组成,其中以拟杆菌门和厚壁菌门为主,还包括变形菌门和放线菌门[14]。本研究发现,MC 组小鼠肠道菌群的结构及丰度发生了显著变化。首先在门水平上,MC 组小鼠拟杆菌门/厚壁菌门比值增大,这与Groves 等[15]报道的RSV 感染小鼠体内拟杆菌门相对丰度增加、厚壁菌门丰度相对减少的结果一致。厚壁门菌属以抗性淀粉和膳食纤维为底物,产生短链脂肪酸(short-chain fatty acids,SCFAs),SCFAs不仅是维持肠道黏膜细胞功能的主要能量来源,对机体免疫系统也具有重要意义[16]。厚壁菌门产生的SCFAs以具有抗炎活性的丁酸盐为主,从而影响免疫细胞的迁移和黏附、细胞因子表达等信号通路的激活[17]。因此,厚壁菌门丰度降低会造成肠道菌群失衡,影响机体免疫力,造成病原清除障碍,使炎症持续存在,从而加重呼吸道病毒疾病的发展。
在属水平上,中剂量达原饮能显著回调有益菌毛螺菌属NK4A136 组的相对丰度水平。既往研究发现,毛螺菌属NK4A136组能够保护颗粒物或病原微生物引起的肺损伤,其机制可能与调节免疫、减轻炎症及氧化反应有关[18]。毛螺菌科是丁酸盐的主要生成者,丁酸可抑制炎症反应,保护肠黏膜。毛螺菌属NK4A136 组的增加与亚精胺介导的肠道屏障功能增强相关[18],其在MC组小鼠体内呈低丰度表达,可能与模型小鼠的炎症状态有关。本研究认为,毛螺菌属NK4A136 组可能在减轻RSV引起的肺损伤中发挥了关键作用。
本研究进一步分析了NC 组、MC 组和MDYY 组肠道菌群的多级物种差异,结果发现,MDYY 组的主要差异物种有Lachnospiraceae_UCG-006和瘤胃球菌属。有研究报道,Lachnospiraceae_UCG-006相对丰度与肺部疾病密切相关,肺癌患者和小鼠粪便中Lachnospiraceae_UCG-006、瘤胃球菌属的相对丰度和SCFAs 的含量均明显减少[19-20]。
综上所述,达原饮可能通过改善小鼠肺组织损伤、减轻炎症、调节胃肠激素水平和淋巴细胞百分比来减轻RSV 感染引起的肺部损伤;同时,达原饮还可能通过优化肠道菌群结构、调节有益菌和有害菌的相对丰度来改善肺部损伤。
