孤独症谱系障碍相关转录因子EB基因罕见变异导致神经元轴突发育障碍
2024-01-03胡龙妃谭洁琼胡章雪
胡龙妃, 谭洁琼, 胡章雪
1.陆军特色医学中心儿科,重庆 400010;2.中南大学生命科学学院医学遗传学研究中心,湖南长沙 410000
孤独症谱系障碍(autism spectrum disorder,ASD)是一种神经发育障碍性疾病,全球患病率约为1%[1],具有高度遗传性和病因异质性[2-3],ASD发病机制尚不明确,有研究表明,遗传是ASD的主要病因,其与环境因素交互作用导致神经连接和大脑发育异常,从而导致ASD发生[4]。目前已发现100多个ASD的易感或致病基因[5-8],遗传学研究提示,染色体异常、常见风险变异、新发和罕见的拷贝数变异及新发和罕见的基因变异等均参与ASD的发生[9-10]。有研究发现,转录因子EB(transcription factor EB,TFEB)的3个罕见新发变异c.A520T、c.G65A和c.C1393T可能与神经发育障碍发生有关[11-12]。TFEB是转录因子家族MiTF/TFE的成员之一,可参与调控溶酶体生物发生及功能、细胞代谢及自噬等生命活动[13-14]。本文旨在探究TFEB的3种变异是否参与ASD的发生及其致病机制,为ASD提供新的治疗靶点。
1 材料和方法
1.1 主要试剂、细胞及仪器
Torin1(Selleckchem公司),Rapamycin(Sigma公司),DMSO和DAPI(Sigma-Aldrich公司),DMEM高糖培养基、0.05%胰蛋白酶、Opti-MEM(GibcoTM公司),Lipofectamine 2000及Lipofectamine 3000(Invitrogen公司),QIAGEN质粒Midi试剂盒、Qiagen RNeasy mini Kit、SuperScript III First-Strand Synthesis System(Qiagene公司),SYBR Green qPCR混合物(TAKARA公司),Dual-Luciferase® Reporter(DLRTM)Assay System(Promaga公司)。小鼠脑神经瘤N2a细胞、人胚胎肾细胞293(HEK293细胞)系中南大学生命科学学院医学遗传学研究中心保存。神经元细胞取自B6品系小鼠(湖南斯莱克景达实验动物有限公司)胎鼠。实时定量PCR仪、水平电泳槽、蛋白电泳仪、转膜仪及电源(Bio-Rad公司),解剖显微镜、荧光显微镜及激光共聚焦显微镜(Leica公司),超净工作台、CO2细胞培养箱(Thermo Scientific公司)。
1.2 构建点突变质粒及细胞转染
通过生物学信息筛选出TFEB的3个有害变异c.G65A(p.R22Q)、c.A520T(p.I174F)和c.C1393T(p.R465W),构建点突变质粒:引物设计与突变位点两侧的序列互补,突变包含在引物序列的中间。引物退火连接。DpnI酶切1 h、转化,提取质粒DNA并通过测序验证。提前将N2a细胞种至24孔板中,待细胞生长至70%~90%汇合时开始转染,每孔用50 μL Opti-MEM培养基稀释200 ng质粒DNA,充分混匀后加入0.5 μL NeofectTM试剂,室温静置15~30 min。缓慢均匀地添加DNA-脂质体复合物到孔板中,37 ℃孵育细胞24~48 h进行收样。
1.3 免疫荧光检测TFEB WT及突变体亚细胞定位
实验分为过表达TFEB野生型(WT)组、过表达p.R22Q组、过表达p.I174F组及过表达p.R465W组。在N2a细胞中分别转染各组质粒,培养24 h后分别添加DMSO及1 μmol/L Torin 1(mTOR抑制剂)处理1 h,免疫荧光检测亚细胞定位:收集细胞,加入4%多聚甲醛固定液室温固定;PBS漂洗后加入0.1%Triton X-100/PBS室温透化;PBS漂洗,挑出爬片,封闭1 h;加一抗4 ℃过夜;PBS漂洗,加二抗室温避光孵育1 h;PBS漂洗,DAPI染核;PBS漂洗,封片,激光共聚焦显微镜扫描和拍摄。
1.4 蛋白免疫印迹检测细胞核质比及蛋白半衰期
为进一步证实突变体是否影响TFEB的细胞定位,N2a细胞分为过表达pEGFP-N1空载体组、过表达TFEB WT组、过表达p.R22Q组、过表达p.I174F组及过表达p.R465W组。细胞进行核质分离、免疫印迹检测细胞核质比:分别收集细胞核与细胞质,用BCA试剂盒进行蛋白定量。每组取等量样本进行凝胶电泳,先80 V电泳30 min,后改为120 V电泳60 min。电泳后290 mA恒流转膜1.5 h,封闭1 h,加一抗,4 ℃过夜,TBST洗膜,加二抗室温孵育1 h,洗膜,ECL发光法显影。内参为Lamin B1和Tubin。
变异也可以通过影响蛋白质的稳定性来增强或减弱蛋白功能,为证实突变体对蛋白稳定性的影响,实验分为过表达TFEB WT组、过表达p.R22Q组、过表达p.I174F组及过表达p.R465W组,通过核糖体抑制剂CHX处理抑制新生蛋白质合成,免疫印迹检测TFEB WT及点突变蛋白半衰期。各组质粒分别转染N2a细胞,培养48 h后,将培养基换为无血清培养基,用100 g/L CHX抑制新生蛋白的合成,处理0、6、12 h后用SDS裂解细胞进行免疫印迹检测TFEB的蛋白水平。内参为Actin。
1.5 原代小鼠神经元培养
将培养板涂覆0.1 g/L poly-D-lysine包被过夜。从E16-E18的小鼠胚胎中分离皮质组织,并小心去除脑膜和血管。将组织在37 ℃下用0.25%Trypsin-EDTA消化15 min,用含10%FBS的DMEM终止消化得到细胞悬液。计数并在添加了B27、GlutaMAX和青霉素/链霉素的Neurobasal培养基中以1×105个/cm2种植细胞。将神经元维持在37 ℃、5%CO2的湿润环境中培养,每3~4天更换一半培养基。
1.6 构建mTFEB-shRNA质粒
利用NCBI及Life Technologies网站设计出3条shRNA序列,通过公司订购合成引物。引物退火连接,酶切pLKO.1 puro克隆载体,EcoRI/AgeI酶切、连接、转化。获得重组质粒-pLKO.1 puro-shRNA-TFEB并经Sanger测序鉴定。
1.7 神经元磷酸钙转染
为研究TFEB在神经元轴突发育中的作用,实验分为干扰组(包括shRNA-NC组、TFEB-shRNA-1组和TFEB-shRNA-2组)和过表达组(包括空载体组、TFEB WT组)。同时共转染pEGFP-N1质粒以显示成功转染的神经元。首先,提前1天在24孔板中接种神经元细胞,次日开始转染。将2.5 μg待转染的质粒与1.9 μL 2 mol/L氯化钙混匀,并加入ddH2O补齐体系至15 μL,再次混匀后缓慢滴加15 μL 2×HBS(pH 7.07),混匀后,室温下避光静置30 min。缓慢添加转染体系到6孔板中,37 ℃孵育80 min。用Wash Solution清洗神经元,在Neurobasal培养基中继续培养神经元至第5天时进行收样。
为研究TFEB变异对神经元轴突发育的影响,设置NC组和TFEB-shRNA干扰组(包括过表达NC组、过表达TFEB WT组、过表达p.R22Q组、过表达p.I174F组及过表达p.R465W组)。体外培养2天时分别转染各组质粒,于3天后收样,通过免疫荧光检测神经元轴突长度。
Rapamycin是自噬调控因子mTOR的抑制剂,可以激活自噬-溶酶体功能,因此设置shRNA-NC组、TFEB-shRNA组和TFEB-shRNA+Rapamycin组。在体外培养2天的胎鼠原代皮层神经元细胞中分别转染各组质粒,于3天后收样,通过免疫荧光检测神经元轴突长度。
1.8 实时定量PCR检测TFEB下游自噬-溶酶体基因表达
提取总RNA,合成互补DNA(cDNA),然后进行qPCR。条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,循环40次。使用2-ΔΔCt方法计算感兴趣基因的相对表达水平,以GAPDH基因为内参。所有实验重复3次。基因引物序列见表1。

表1 实时定量PCR的引物序列
1.9 荧光素酶报告基因测定检测TFEB变异对其转录活动的影响
将HEK293细胞种在24孔板中,然后使用Lipofectamine 2000转染4×CLEAR荧光素酶报告质粒以及Renilla荧光素酶对照质粒。48 h后,裂解细胞,荧光素酶活性使用Dual-Luciferase® Reporter(DLRTM)Assay System进行检测。Firefly荧光素酶活性使用Renilla荧光素酶活性来进行标化,以校正转染效率和细胞活性的变化。
1.10 统计方法
每个实验至少重复3次,使用Image J软件对原始图片进行图像分析,使用GraphPad Prism9软件进行统计分析和统计图像绘制。两组数据的比较采用t检验,3组以上数据采用单因素方差分析(one-way ANOVA)。P<0.05为差异具有显著性。
2 结 果
2.1 变异导致TFEB细胞内分布异常
过表达TFEB WT和突变体免疫荧光结果显示TFEB亚细胞定位,TFEB WT主要定位于细胞质,突变体p.R22Q及p.R465W主要定位于细胞核,而突变体p.I174F定位于细胞质,但所有的突变体在自噬激活剂Troin处理后,与WT一样都能正常定位于细胞核内(图1)。分离细胞质和细胞核,免疫印迹检测显示,点突变p.R22Q及p.R465W与野生型相比,核质比增加;而点突变p.I174F核质比较野生型差异无显著性(图2)。
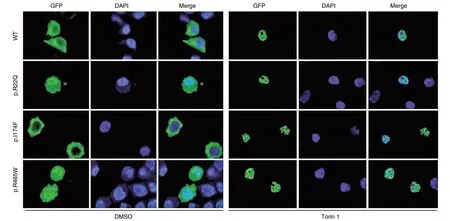
图1 TFEB变异对其亚细胞定位的影响(600×)绿色为TFEB-GFP WT及突变体,蓝色为DAPI标记的细胞核。
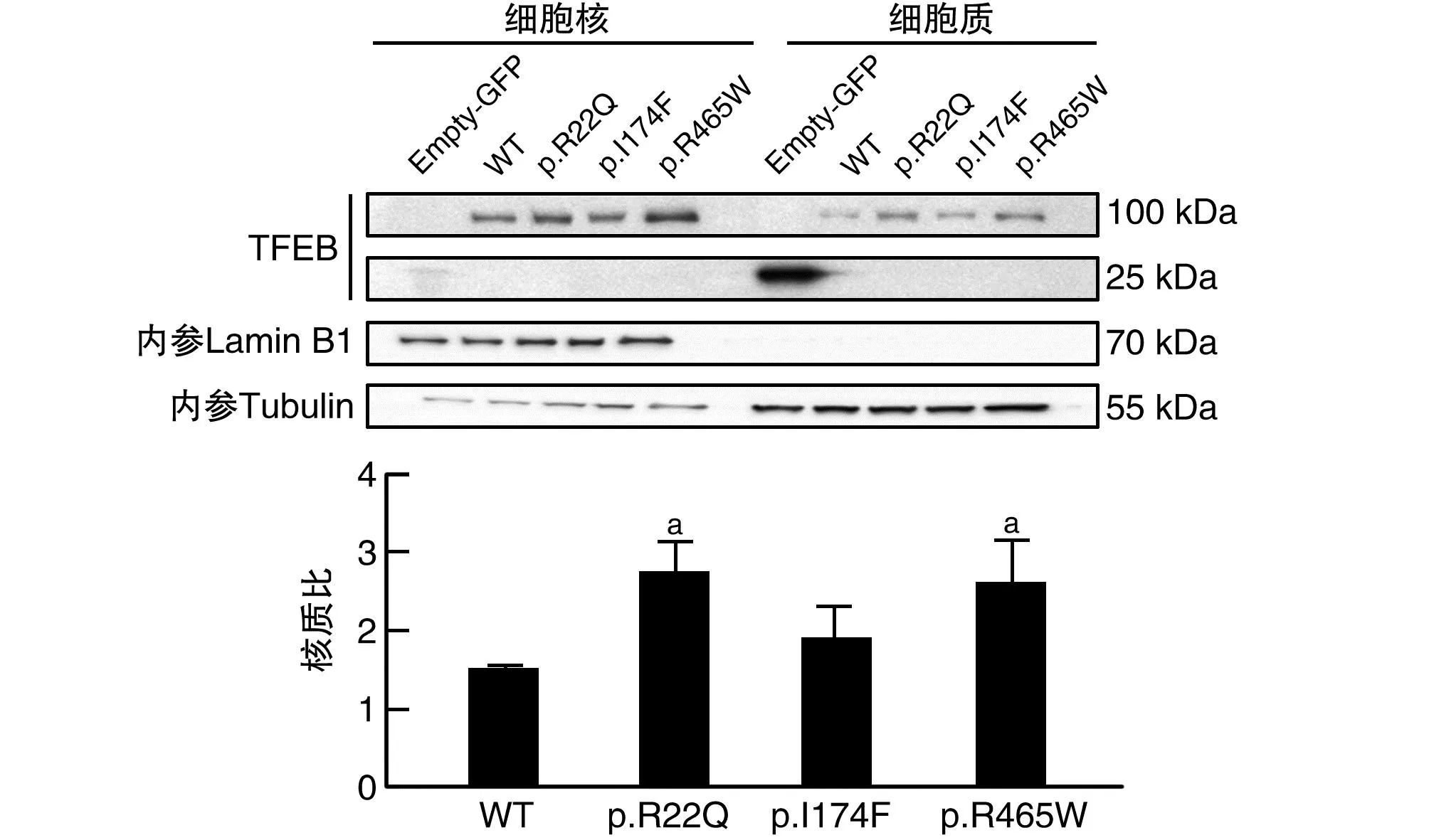
图2 变异对TFEB核分布的影响(n=4)a为P<0.05,与WT比较。
2.2 变异不影响TFEB蛋白的稳定性
如图3所示,TFEB的这3种变异蛋白的稳定性均未发生显著改变。
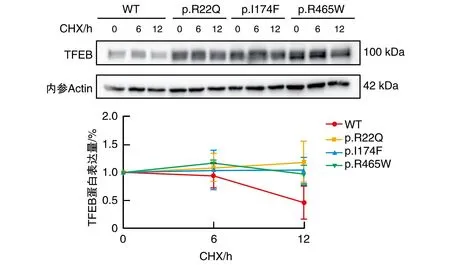
图3 变异对TFEB蛋白稳定性的影响(n=3)
2.3 TFEB调控原代培养神经元的轴突生长
通过在原代培养的神经元中转染两个靶向TFEB不同位点的shRNA来干扰TFEB的表达,探讨TFEB对神经元轴突发育的影响,结果显示,TFEB干扰后能显著减少神经元的轴突长度(图4A),而过表达TFEB-GFP则能增加神经元轴突的长度(图4B)。
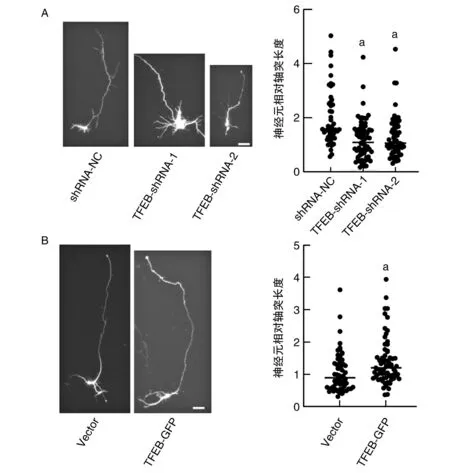
图4 TFEB在体外调控原代培养神经元的轴突生长A为干扰内源性TFEB;B为过表达TFEB。a为P<0.001,与shRNA-NC或Vector比较。
2.4 TFEB变异导致轴突长度缩短
如图5A所示,p.R22、p.I174和p.R465在人、猴、小鼠和大鼠中都非常保守,这些位点的变异可能导致蛋白质功能的改变。在干扰TFEB后,再过表达TFEB WT可以恢复由干扰内源性TFEB引起的神经元突触缩短,而p.R22Q、p.I174F和p.R465W变异则不能恢复该神经元突触缩短(图5B、C),表明这些突变体已经损害了TEFB的神经轴突发育促进功能。
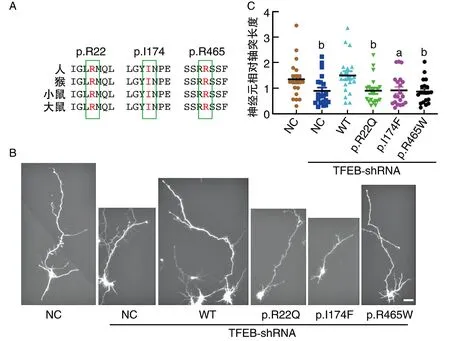
图5 ASD相关的TFEB变异导致体外原代培养神经元的轴突长度缩短A为TFEB氨基酸序列的保守性分析;B和C为干扰内源性TFEB后分别过表达野生型TFEB及突变体的轴突生长情况。a为P<0.05,b为P<0.01,与WT比较。
2.5 自噬激动剂Rapamycin恢复由TFEB缺陷引起的轴突缩短
Rapamycin可以恢复由TFEB干扰引起的神经元轴突缩短(图6),这表明TFEB可能通过调节自噬-溶酶体功能影响神经元轴突发育。
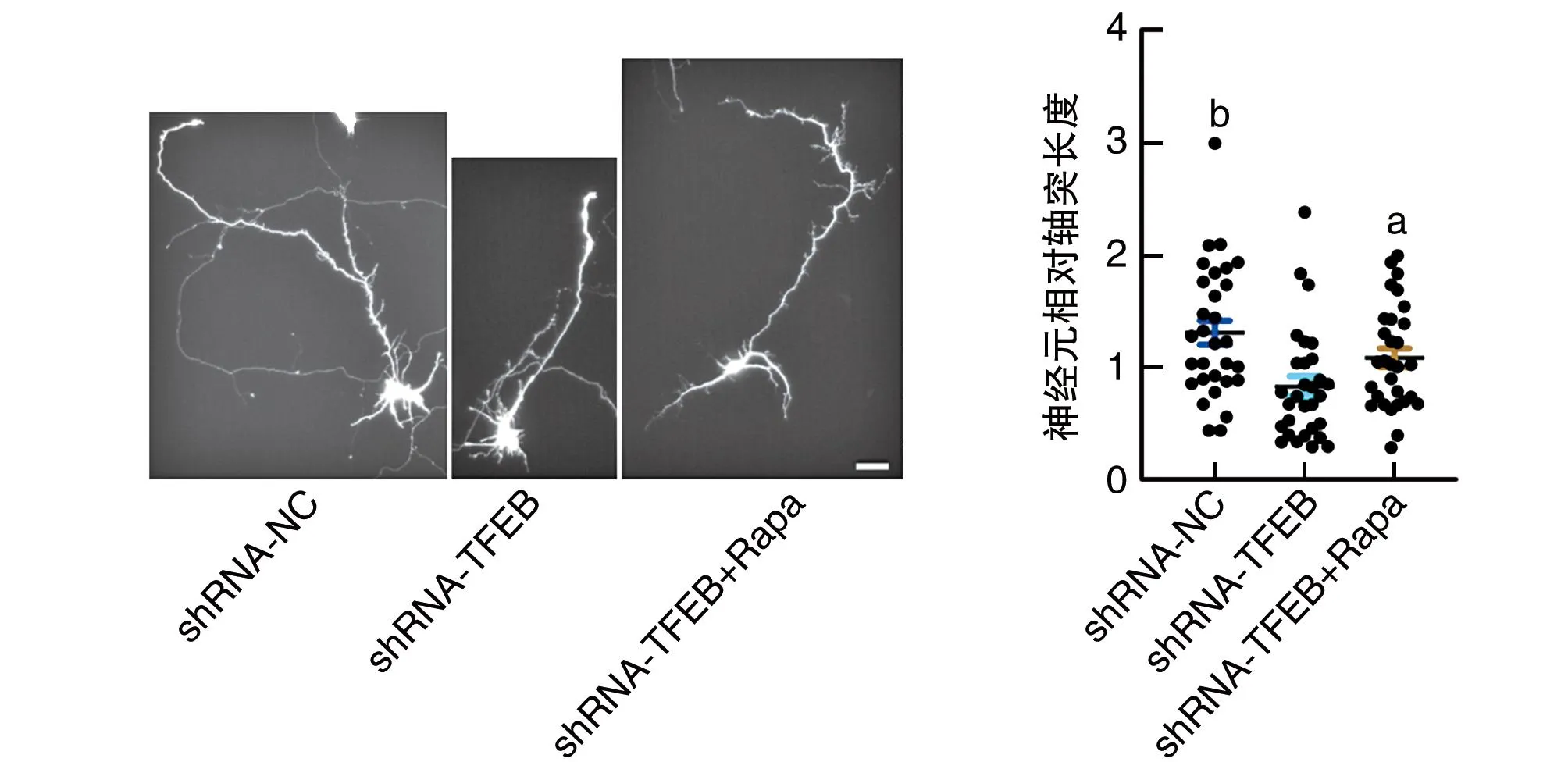
图6 Rapamycin恢复由TFEB缺陷引起的轴突缩短a为P<0.05,b为P<0.01,与shRNA-TFEB比较。
2.6 TFEB变异导致自噬-溶酶体基因表达降低
过表达野生型TFEB可以增加自噬-溶酶体相关基因的表达,而p.R22Q、p.I174F和p.R465W变异则不能(图7),表明这些突变体已经损害了TEFB的自噬-溶酶体基因的转录活性。
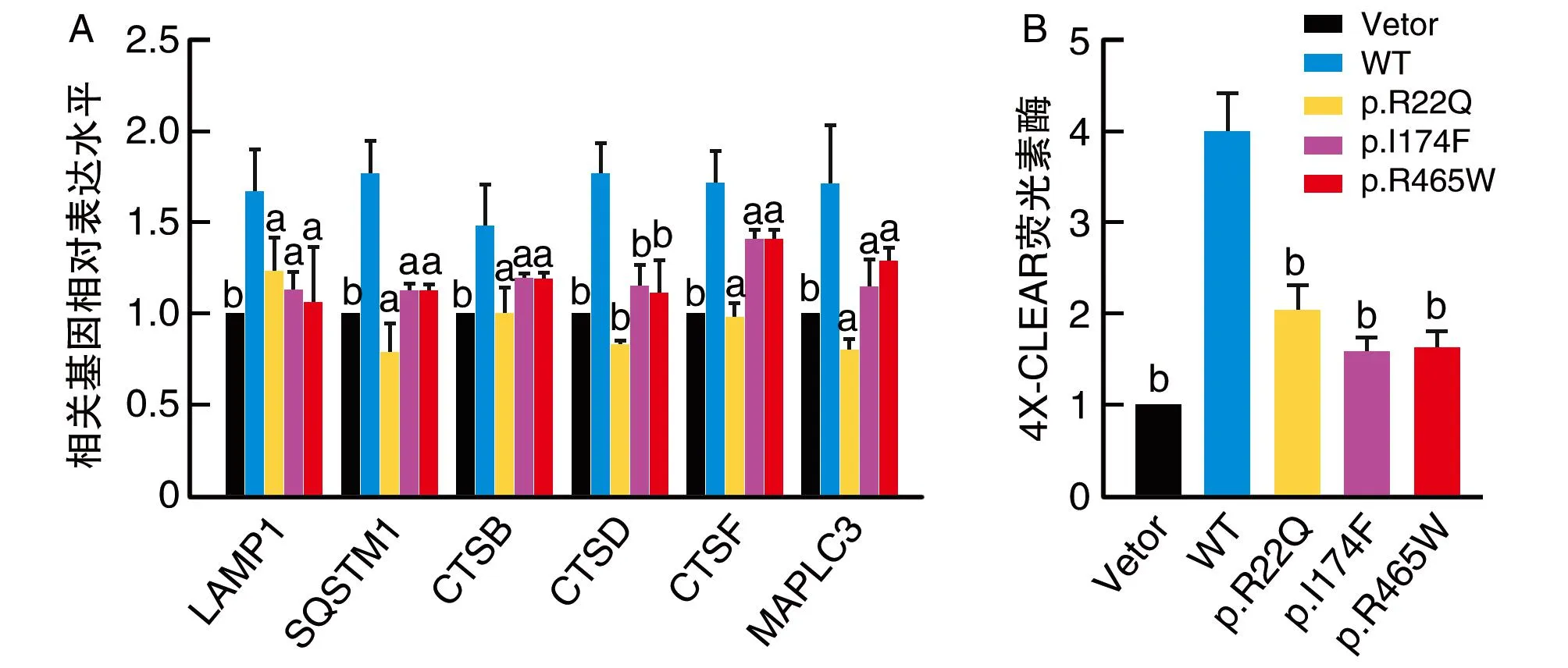
图7 ASD相关的TFEB变异导致自噬-溶酶体基因表达降低A为过表达野生型TFEB和突变体后自噬-溶酶体相关基因的表达水平;B为野生型TFEB及突变体的4X-CLEAR荧光素酶活性。a为P<0.05,b为P<0.01,与WT比较。
3 讨 论
自噬是所有真核生物中高度保守的细胞分解过程,参与多种维持细胞稳态的生理过程,例如适应代谢应激、清除细胞异常和防止DNA损伤[15-16]。溶酶体通过mTORC1-TFEB轴在营养感知和信号转导中发挥积极作用[17-19]。TFEB是自噬-溶酶体形成的最重要的转录因子,对细胞代谢、生长、凋亡、分化和其他细胞生理功能起着关键作用。TFEB的功能异常可以导致自噬-溶酶体功能障碍,Rapamycin是自噬调控因子mTOR的抑制剂,可以激活自噬-溶酶体功能。自噬途径可能参与了ASD的发病机制。文献[20]在ASD病例中发现自噬途径相关的基因外显子拷贝数变异增加,通过富集和通路分析ASD病例中的相关基因,他们观察到包括GABARAPL2、GABARAPL1、MAP1LC3A、GABARAP和MAP1LC3B在内的5个与自噬相关的基因的显著富集,这些基因是酵母自噬基因Atg8的哺乳动物同源物,这项研究表明自噬在ASD中发生了失调。PTEN变异介导的mTOR的激活(抑制自噬)在小鼠中表现出孤独症样行为和异常的神经元树突结构,这也表明自噬在ASD的发生中可能起重要作用[21]。同时,缺乏ambra-1(beclin-1的一个正调控因子,是自噬体形成的主要参与者)的雌性小鼠观察到了类似于孤独症的表型,这进一步表明ASD中自噬可能存在失调[22]。雷帕霉素作为mTOR的抑制剂可以激活自噬,恢复孤独症症状,并改善PTEN变异小鼠的异常神经解剖结构[23-24]。最近的研究在ASD患者死亡后的颞叶皮层中也观察到过度活跃的mTOR和受损的自噬[25]。
总之,本研究发现,作为自噬-溶酶体功能最重要的转录调节因子TFEB变异可能参与ASD的发生,导致神经元轴突生长的损害,同时,自噬的激活能恢复TFEB变异引起的神经轴突缩短,提示TFEB和自噬溶酶体功能缺陷参与了ASD疾病的发生。
