掺硼金刚石/Si-Ti电极体系处理沙坦类制药生化尾水溶解性有机物的研究*
2024-01-02郑睿豪金玺正王帅然王家德
黄 燕 郑睿豪 金玺正 王帅然 王家德#
(1.德清县生态环境监测站,浙江 湖州 313200;2.浙江省工业污染微生物控制技术重点实验室,浙江 杭州 310014;3.浙江工业大学环境学院,浙江 杭州 310014)
沙坦类药物是临床应用最广的抗高血压药物之一[1],常用的氯沙坦和缬沙坦具有高度的环境持久性[2],相应制药废水经生化处理后仍残留部分溶解性有机物(DOM),需要进行深度处理。相较于膜分离、炭(树脂)吸附、臭氧氧化等工艺,形稳电极(DSA)电解通过电场电子作用直接分解或产生活性基团(如·OH)间接氧化污染物,不涉及药剂投加,效率高,设备操作简单、占地小,是一种环境友好型社会背景下的绿色氧化技术[3-4]。
PbO2和金刚石薄膜是当前水处理领域研究和应用较多的两种形稳电极材料,具有高析氧电位和低析氧产率特性[5]。不同于PbO2/Ti电极体系,掺硼金刚石(BDD)电极是一种新型高效电极,具有宽电势窗口、低背景电流、高析氯析氧电位等特点,抗腐蚀,稳定性强[6-7]。在实际废水处理中,BDD电极惰性表面对·OH的吸附性能弱,氧化反应·OH参与率强于水合性PbO2电极[8],因此,BDD电极具有更强的矿化能力[9-10]。
废水DOM组分可通过其荧光特征光谱进行快速区分,从而反映水质指标变化的本质[11-13]。荧光光谱与色谱、质谱等DOM表征手段相比,操作简单,检测迅速,被广泛应用[14-16]。于本心等[17]应用二维相关同步荧光光谱剖析市政污水中DOM组分;FAN等[18]通过荧光光谱表征木醋废水处理前后蛋白质变化,从而分析废水毒性变化;郑睿豪等[19]通过荧光光谱表征揭示了印染废水电解过程中可生化性变化的本质。本研究在剖析了沙坦类制药生化尾水荧光特征的基础上,开展BDD/Si-Ti电极体系处理沙坦类制药生化尾水DOM的试验研究,评估BDD/Si-Ti电极体系深度处理此类废水的性能。
1 材料和方法
1.1 水样及样品采集
沙坦类制药生化尾水取自中国东部某医化园区多家药企,采样时间为2022年4月,于企业纳管口采用自动采样器每6 h采样1次,连续采样7 d,具体水质指标如表1所示。所有样品4 ℃运输,-80 ℃保存。测试前解冻,并通过0.45 μm滤膜过滤悬浮物。

表1 沙坦类制药生化尾水水质指标Table 1 Water quality parameters of biochemical effluent of sartan pharmaceuticals
1.2 试验装置及条件
废水电解处理装置采用BDD/Si-Ti电极体系,阳极为BDD/Si电极,阴极为Ti电极,电极板尺寸均为10 cm×10 cm,极板间距为10 mm[20]。电解装置有效容积为600 mL,沟渠型结构。恒电流模式供电,电流密度参数综合考虑COD去除和电流效率优化。电解废水选用其中污染物浓度较高的药企水样。
1.3 分析方法
1.3.1 常规水质分析
COD按照《水质 化学需氧量的测定 快速消解分光光度法》(HJ/T 399—2007)测定;TN按照《水质 总氮的测定 碱性过硫酸钾消解紫外分光光度法》(HJ 636—2012)测定;DOC采用TOC-5000总有机碳分析仪测定;pH采用PL-700PD便携式水质测定仪测定;电导率采用DDS-307电导率仪测定;阴离子采用ICS-2000离子色谱仪测定,色谱柱为lonPac AG19。
1.3.2 三维荧光光谱表征
荧光光谱亦称荧光激发/发射矩阵(EEM),采用F-4700FL荧光分光光度计进行测试,测试参数如下:激发波长(Ex) 200~500 nm,发射波长(Em) 250~600 nm,扫描速率为40 nm/s。采用荧光区域积分(FRI)法[21]结合平行因子(PARAFAC)法[22]分析荧光组分。所有水样经过稀释以减少内滤效应,样品集EEM样本剪除瑞利散射和拉曼散射,在Matlab 2020b中用drEEM-0.6.3工具箱进行PARAFAC分析[23-24]。PARAFAC模型通过了核心一致性分析[25]、光谱荷载分析、残差分析、拆半分析,初步探索性分析未发现异常值。
1.3.3 红外光谱表征
取50 mL待测样品经0.22 μm滤膜过滤,-75 ℃下冷冻成固体后,放置在真空冷冻干燥机中冷冻干燥。取1 mg干燥样品与200 mg烘干处理后的溴化钾混合研磨,混合样品经压片机压成透明薄片,送入Nicolet 6700傅立叶变换红外光谱(FT-IR)仪分析。扫描波数为400~4 000 cm-1,分辨率为4 cm-1。
1.4 参数计算方法
电流效率(η,%)计算方式见式(1)。
η=n×F×V×(C0-Ct)×100%/(M×I×t)
(1)
式中:n为水氧化所需电子数,取值为4;F为法拉第常数,96 487 C/mol;V为体积,L;C0、Ct分别为初始COD和t时COD,g/L;M为氧气摩尔质量,32 g/mol;I为电流,A;t为时间,s。
2 结果与讨论
2.1 沙坦类制药生化尾水荧光特征分析
EEM根据荧光区域积分法划分为5个区域,Ⅰ区为类酪氨酸物质(Ex 200~250 nm,Em 250~325 nm);Ⅱ区为类色氨酸物质(Ex 200~250 nm,Em 325~375 nm);Ⅲ区为类富里酸物质(Ex 200~250 nm,Em 375~550 nm);Ⅳ区为可溶性微生物降解产物等类蛋白质物质(Ex>250 nm,Em 250~375 nm);Ⅴ区为类腐殖酸物质(Ex>250 nm,Em 375~550 nm)。选择具有代表性的3家企业水样,测得EEM。如图1所示,荧光集中在Ⅳ区,3个水样均含有1个相似荧光峰,中心位于Ex=250 nm,Em=350 nm处(T1峰)。此外,水样1、水样2存在T2峰(中心Ex=290 nm,Em=350 nm),水样3在Ⅴ区存在微弱的荧光峰B峰(中心Ex=360 nm,Em=425 nm)。

图1 沙坦类制药生化尾水的典型EEMFig.1 Typical EEM of biochemical effluent of sartan pharmaceuticals
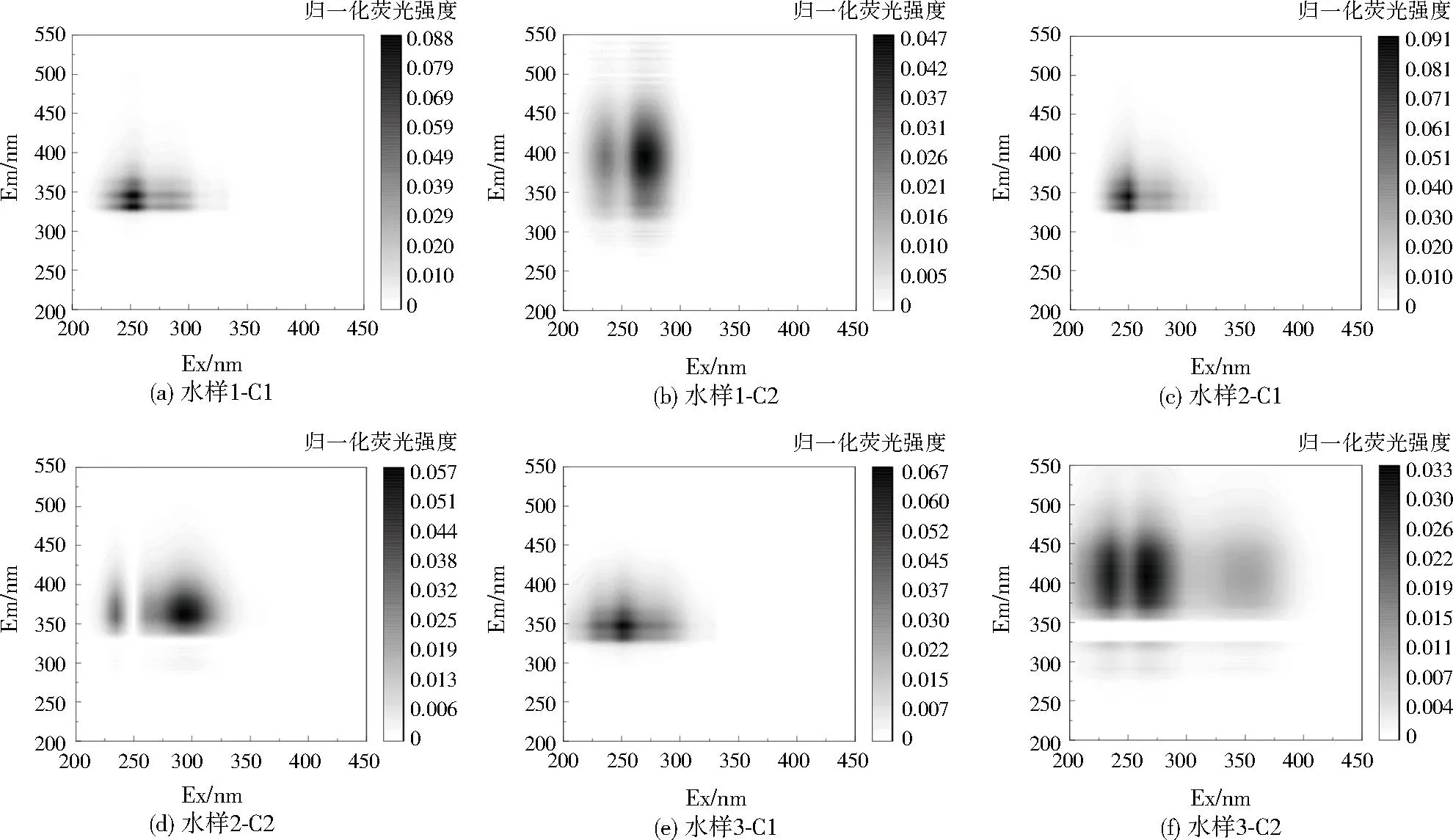
注:为便于比较和分析,对荧光强度进行了归一化处理。图2 沙坦类制药生化尾水的典型PARAFAC模型组分Fig.2 Typical PARAFAC model components of biochemical effluent of sartan pharmaceuticals
如图2所示,经PARAFAC分析,沙坦类制药生化尾水具有2种独立荧光组分,色氨酸组分C1和微生物代谢产物组分C2。采用同余系数法进行相似度评估,水样1-C1、水样2-C1、水样3-C1三者间的相似度≥93%,可认为3种样品C1组分(中心Ex和Em分别为250、350 nm )是相同的,即T1峰。
通过OpenFluor[26]地表水数据库匹配,仅WÜNSCH等[27]从太平洋、塔帕若斯河水样拆分出太平洋-C1、塔帕若斯河-C5与本研究的C1组分相似度在95%以上,其他研究暂未发现类似组分,说明C1在地表水中不常见,可作为沙坦类制药生化尾水特征荧光组分。C2组分为微生物代谢产物,受企业制药工艺影响,存在明显不同。
2.2 电流密度参数优化
BDD/Si电极析氯析氧电位如图3(a)所示。BDD/Si电极析氧电位为2.45 V,析氯电位为1.91 V,能实现常见有机物矿化。
沙坦类制药生化尾水电解试验数据如图3(b)所示。一般地,低浓度废水电氧化过程遵循拟一级动力学[28-29]。电氧化/还原本质上是电极表面物质电子得失反应的过程[30]。COD去除率随输入Qsp增大而上升,但电流效率随之下降,处理成本增加。Qsp持续输入,的确会有利于污染物去除(见式(2)、式(3)),同时,会增大电极表面析氯析氧副反应(见式(4)、式(5)),特别是高电流密度下,电极电位增高,副反应比例增大,且部分电能转化为热能(溶液温度上升),导致电流效率下降[31]。当Qsp大于1.25 A·h,COD去除率提升缓慢,且处于低电流效率区。综合考虑污染物去除效率、电流效率等因素,BDD/Si-Ti电极体系深度处理沙坦类制药生化尾水的经济电流密度为10~15 mA/cm2,电解时间小于等于60 min。试验选取电流密度10 mA/cm2,考察BDD/Si-Ti电极体系分解沙坦类制药生化尾水DOM的性能。
BDD + H2O → BDD(·OH)+ H++ e-
(2)
有机物 + ·OH → CO2+ H2O+无机离子
(3)
2Cl-- 2e-→ Cl2
(4)
4OH-→ 2H2O + O2+ 4e-
(5)
2.3 DOM荧光分析
DOM组分变化可通过三维荧光表征,进而解析DOM去除机理(以浓度较高的水样3为例)。0 min时电解水样类腐殖酸物质(Ⅴ区)、可溶性微生物降解产物(Ⅳ区)、类酪氨酸物质(Ⅰ区)、类色氨酸物质(Ⅱ区)、类富里酸物质(Ⅲ区)分别占20.24%、70.49%、0.61%、5.45%、3.21%。
电解15 min,COD从304.21 mg/L降至172.11 mg/L。类腐殖酸物质最先降解,类腐殖酸物质(Ⅴ区)从20.24%降至5.44%,可溶性微生物降解产物(Ⅳ区)产生新的荧光峰。随电解继续进行,总荧光强度逐渐降低,荧光强度减弱直至几乎完全消失。整个电解过程,DOM中大分子类腐殖酸物质转变为小分子的可溶性微生物降解产物,基本无残留荧光有机物。
2.4 DOM的FT-IR分析
试验采用FT-IR分析物质结构[32],解释电解过程DOM荧光内在变化。图4为沙坦类制药生化尾水经BDD/Si-Ti电极体系(电流密度10 mA/cm2)电解(60 min)前后的FT-IR图谱对比。原水在3 500、1 639、1 384 cm-1处存在明显吸收峰,其中3 500 cm-1附近的峰代表强而宽的—OH伸缩振动吸收峰和N—H伸缩振动峰,是由样品水干扰和碳水化合物共同造成的;1 384 cm-1附近为苯环特征峰或CH2烷烃面外摇摆峰,代表废水中含有苯的衍生物或烷烃;1 637 cm-1附近是芳香族苯环上的C=C、共轭羰基C=O伸缩振动峰[33],废水中可能含有醇、酮或醚类有机物;1 118 cm-1是伯胺N—H伸缩峰,代表废水中含有胺类物质。

注:Qsp为电量,A·h,计算方式为电流密度×电极面积×电解时间。图 3 BDD/Si电极析氯析氧电位及 Qsp对COD去除率和电流效率的影响Fig.3 BDD/Si electrode chlorine and oxygen precipitation potentials and effect of Qsp on COD removal rate and current efficiency
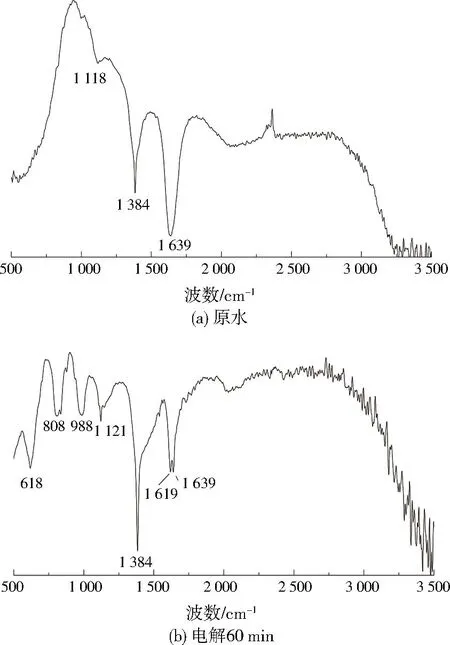
图 4 电解原水及电解60 min 后的FT-IR图谱(10 mA/cm2)Fig.4 FTIR spectra of electrolytic raw water and electrolysis for 60 min (10 mA/cm2)
电解60 min后,988 cm-1处出现烯烃扭曲峰,808、618 cm-1附近的特征峰为C—Cl伸缩振动峰,C原子上连接的Cl原子数目越多,振动频率越高,表明电解过程可能出现了苯环开环形成烯烃,以及形成含氯有机副产物的情况,1 639 cm-1处特征峰减弱,1 384 cm-1处CH2特征峰增强,荧光物质基本消失,说明共轭有机物及共轭基团是沙坦类制药生化尾水荧光的主要来源,BDD/Si-Ti电极体系对于不饱和基团氧化能力强,彻底破坏了物质的共轭结构并生成烷烃类物质导致荧光消失,烷烃类物质在电场电子和活性基团作用下进一步矿化分解为CO2、H2O[34-35]。因此,BDD/Si-Ti电极体系能有效分解沙坦类制药生化尾水DOM。
3 结 论
1) 通过EEM和PARAFAC分析,3家典型沙坦类制药生化尾水鉴定出2种独立荧光组分,其中不同水样C1组分相似度≥93%,可作为沙坦类制药生化尾水特征荧光组分。
2) BDD/Si电极析氧电位为2.45 V,析氯电位为1.91 V,能实现常见有机物矿化。综合考虑污染物去除效率、电流效率等因素,BDD/Si-Ti电极体系深度处理沙坦类制药生化尾水经济电流密度为10~15 mA/cm2,电解时间小于等于60 min。
3) BDD/Si-Ti电极体系电流密度为10 mA/cm2,电解时间为15min时,沙坦类制药生化尾水降解效果较好。FT-IR分析显示,共轭有机物及共轭基团是沙坦类制药生化尾水荧光的主要来源,共轭结构被BDD/Si-Ti电极体系有效分解,生成烷烃类物质,后者进一步矿化分解为CO2、H2O。
