基于肿瘤相关巨噬细胞的子宫内膜癌预后模型建立和验证*
2024-01-02何心勤陈丽红
何心勤,张 霞,陈丽红,江 洪
(福建医科大学附属第一医院,福州 350001)
子宫内膜癌(endometrial carcinoma,EC)是最常见的妇科癌症之一,在女性恶性肿瘤中居第六位,其发病率在全球范围内呈上升趋势,与疾病相关的死亡率很高[1]。2020年,全球新增约417367例子宫内膜癌病例,其中约97370例死亡病例。发病年龄、病理分期、肿瘤分化程度和病理类型是EC发病率和死亡率的重要决定因素[2]。Ⅰ期EC患者的5年生存率可高达80%~90%,Ⅲ期和Ⅳ期患者的5年生存率分别仅为50%~65%和15%~17%[1]。因此,准确的早期诊断和及时的治疗是有效治疗EC的关键。手术联合辅助治疗(如放疗和化疗)是目前治疗EC患者的标准方法。免疫疗法作为一种新兴的辅助治疗方法,有望改善晚期/复发患者的预后,但许多EC患者的预后仍很差[3]。因此,需要更好、更准确的生物标志物来预测、诊断和治疗EC。
肿瘤微环境(tumor micro-environment,TME)是一种复杂而丰富的多细胞介质,与肿瘤发生和发展密切相关。肿瘤微环境通常包括免疫细胞、间充质细胞、内皮细胞、炎症细胞介质和细胞外基质分子。这些细胞和分子之间的相互作用与肿瘤血管生成、侵袭、转移、免疫抑制、化疗耐药性和临床预后密切相关[4]。在特定类型的实体瘤中,肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)在肿瘤组织中的占比高达50%,是肿瘤组织中最丰富的免疫细胞类型之一[5]。在不同的肿瘤类型中,包括脑癌、乳腺癌、胰腺癌和肺癌,TAMs表现出明显的表型和功能异质性[5]。在TME内,TAMs可对各种局部刺激迅速做出反应。这些刺激包括细胞因子或治疗性扰动,它们随后会极化为从促炎到抗炎的各种表型。这些表型决定了TAMs是促进还是阻止肿瘤生长。TAMs可执行不同的功能,但先前的研究表明,肿瘤组织中TAM丰度的增加与不良临床预后和治疗效果最常相关。因此,TAMs可能是重要的潜在癌症预后生物标志物和治疗靶点[5]。
与正常子宫内膜标本相比,人EC标本中TAM浸润明显。TAM数量的增加与EC的恶性进展也呈正相关。与正常子宫内膜相比,EC标本的上皮和基质中CD68+TAM密度更高[6]。此外,CD163+M2-TAMs在晚期EC中的聚集程度更高,从EC标本中分离出的TAMs明显加速血管生成和促进癌症转移[7]。此外,TAMs似乎在EC中发挥着雌激素和孕激素介导的作用[8]。靶向抑制TAMs是减少抗肿瘤免疫治疗耐药性的有效方法,为开发EC的新型疗法提供了潜在机会[7]。因此,为了预测预后或设计靶向疗法,发现新型TAM特异性生物标志物至关重要。目前,针对EC的特异性TAM标记很少,也很少有研究证实EC与TAM相关的基因预后模型或特征。
本研究通过加权基因共表达网络分析(WGCNA)、单变量Cox分析和Lasso回归算法筛选出EC中与TAMs相关的六个生物标志物。使用单细胞RNA测序(scRNA-seq)和TCGA转录组数据,这些数据来自EC患者样本。此外,行基因本体(GO)和京都基因和基因组百科全书(KEGG)富集分析,以探索EC中与TAM相关的候选生物标志物所涉及的生物学功能和信号通路。通过从多个数据集中构建风险评分模型和预后预测提名图,研究了六种生物标志物在EC不同临床表型中的预后价值。本研究揭示了TAM相关生物标志物在预测EC预后中的潜在作用,并通过阐明TAM相关基因在TME中的功能,揭示了该疾病的潜在治疗靶点。
1 资料与方法
1.1 数据收集 EC相关单细胞测序(scRNA-seq)数据从基因表达综合数据库(GEO)(https://www.ncbi.nlm.nih.gov/geo/)下载以下数据:将包含5个EC样本scRNA-seq数据的GSE173682和包含10个健康子宫内膜组织样本scRNA-seq数据的GSE111976合并为scRNA-seq数据集,用于进一步的scRNA-seq分析。此外,癌症基因组图谱(TCGA)-EC队列中547个肿瘤样本和35个正常样本的RNA测序数据(RNA-seq),其中543个EC样本具有完整的存活信息。
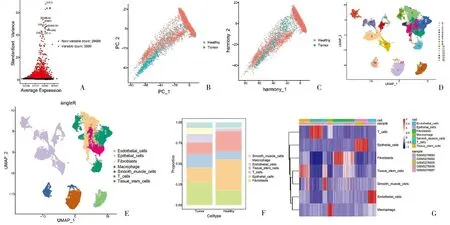
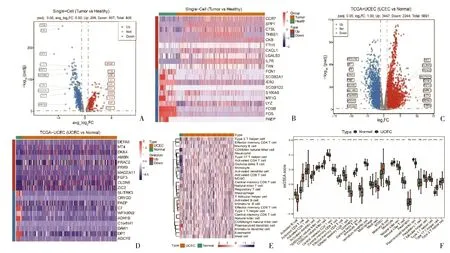
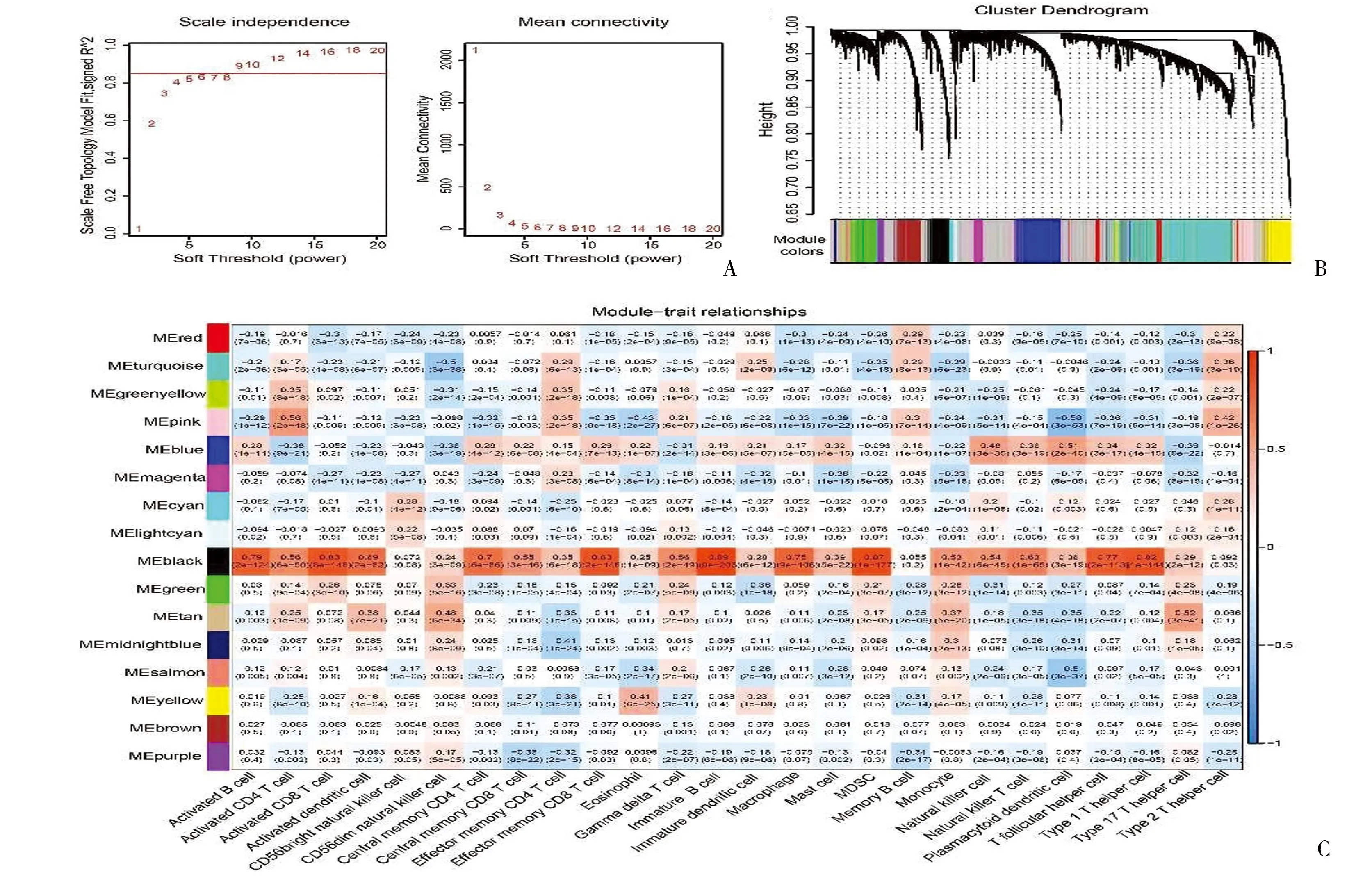
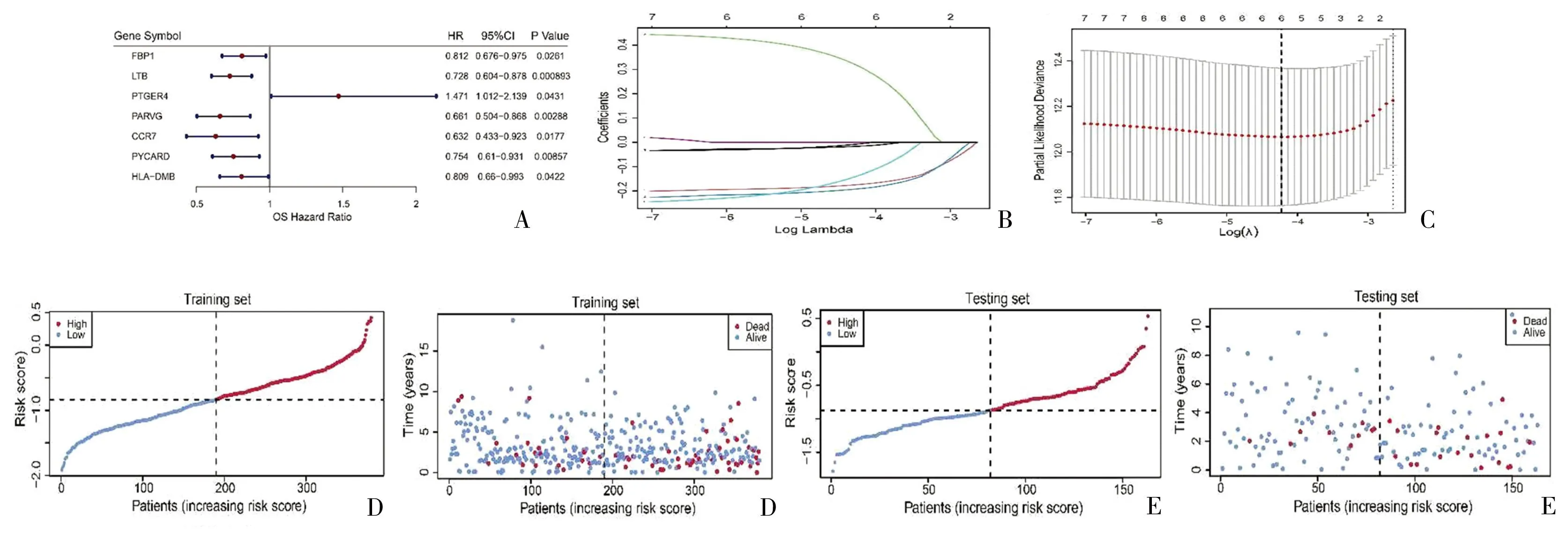
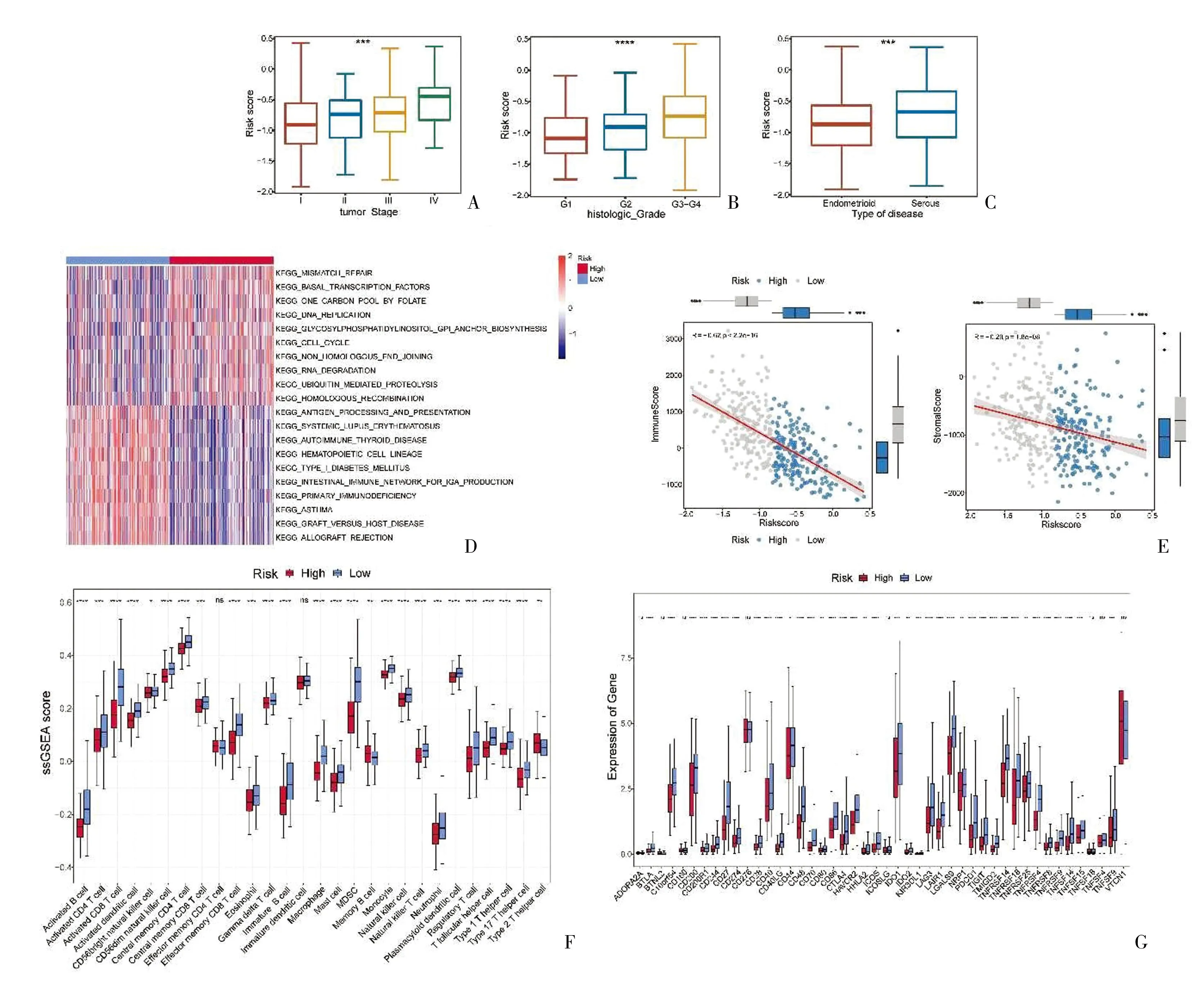
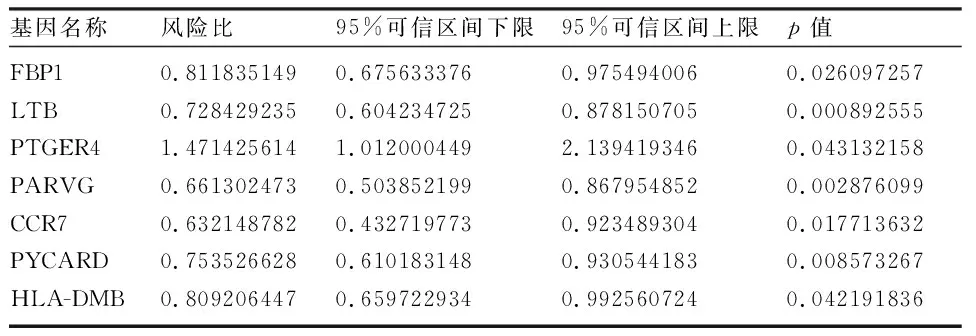
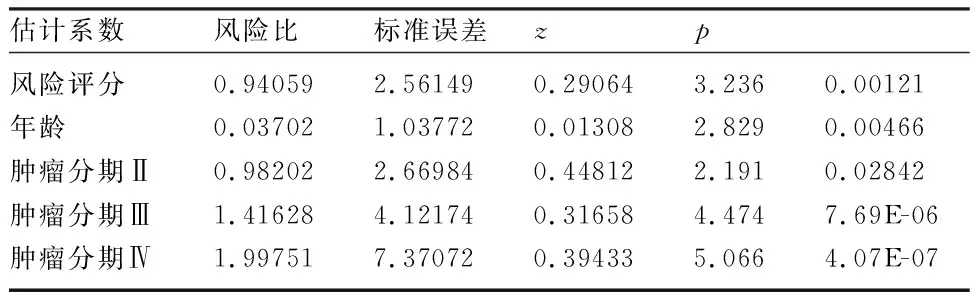
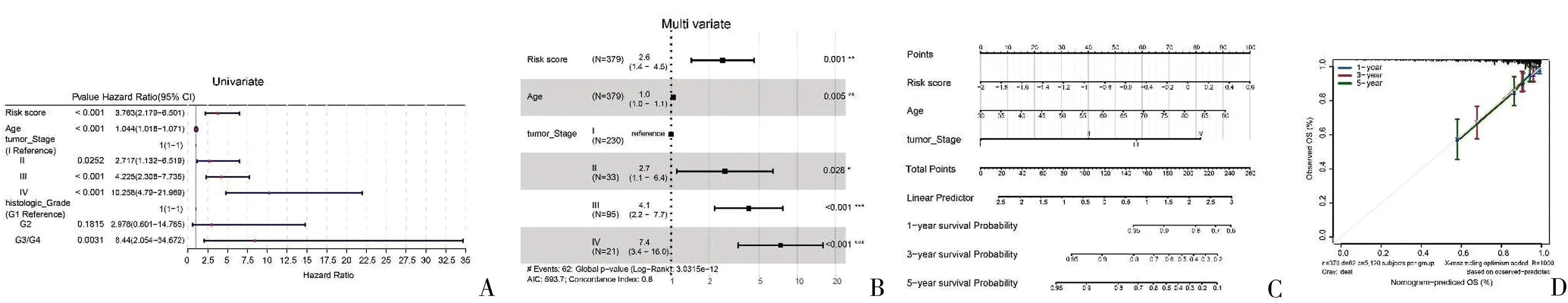
1.2 scRNA-seq分析 使用R软件包“Seurat”(4.1.0版)筛选基因少于200个的细胞和涉及少于3个细胞的基因。按100 1.3 差异分析 基于scRNA-seq数据集,根据adj.P<0.05和|avg log2 FC| >0.5,检测聚焦的细胞类型中肿瘤样本和健康样本之间的差异表达基因(differentially expressed genes,DEGs)。使用“DESeq2”软件包获取TCGA-EC队列中EC与正常样本之间的DEGs。利用单样本基因组富集分析(single sample gene set enrichment analysis,ssGSEA)计算28种免疫细胞的ssGSEA得分,并比较EC和正常样本的得分。 1.4 加权基因共表达网络分析(WGCNA) 利用“WGCNA”软件包(1.70.3版),以26个差异免疫细胞的ssGSEA分数为特征进行加权基因表达网络分析(Weighted gene co-expression network analysis,WGCNA),对EC和正常样本进行聚类,以检测和剔除离群样本[9]。随后,选择合适的软阈值功率构建无标度网络,并将基因划分为不同的模块。对这些模块和ssGSEA得分进行相关性分析,筛选出模块中与巨噬细胞ssGSEA得分相关性最高的中心基因。将这些中枢基因与巨噬细胞DEGs和DEGs相交,以获得候选基因,供进一步分析。 1.5 候选基因的富集分析 基于基因本体(geneontology,GO)和京都基因组百科全书(Kyoto Encyclopedia of Genes and Gnomes,KEGG)数据库的富集分析由“clusterProfiler”软件包(4.2.2版)执行,以检测候选基因的相关通路或功能[10]。 1.7 基于风险模型的临床分析和富集分析 在训练集的基础上,对比不同临床特征(年龄、肿瘤分期和组织学分级)分组之间以及浆液性囊腺癌和子宫内膜样腺癌分组之间的风险评分。利用“GSVA”软件包(1.42.0版),根据从MSigDB数据库中获得的KEGG基因组,进行基因组变异分析(Gene Set Variation Analysis,GSVA)https://www.gsea-msigdb.org/gsea/msigdb/,比较两个风险组的通路。 1.8 基于风险模型的免疫分析 利用表达数据估算恶性肿瘤组织中的基质细胞和免疫细胞,ESTIMATE算法计算EC样本的免疫和基质评分,并检测其与风险评分之间的相关性。用ssGSEA算法计算免疫细胞评分,并对两个风险组的评分进行对比。比较两个风险组之间46个免疫检查点的表达情况。 1.9 绘图 通过对风险评分和临床特征(年龄、肿瘤分期和组织学分级)进行单变量和多变量Cox分析,得出独立的预后因素。应用这些因素构建EC模型图,同时绘制校准曲线以评估模型图的性能。 2.1 通过scRNA-seq分析共筛选了七种细胞类型 初步筛选中,排除了基因少于200个的细胞和表达基因少于3个的细胞后,剩下106900个细胞和28689个基因。进一步筛选,得到65385个符合分析标准的细胞和28689个基因。筛选出表达变化程度最高的前2000个基因行进一步分析(图1A)。主成分分析(principal component analysis,PCA)结果显示,批量效应校正处理的结果更佳(图1B、C)。通过流形理论与拓扑分析(uniform manifold approximation and projection,UMAP)检测出17个细胞簇。在健康样本和EC样本之间,大多数细胞簇的水平不同(图1D、E)。然后,对这些细胞簇进行了注释,得到了七种细胞类型,包括内皮细胞、上皮细胞、成纤维细胞、巨噬细胞、平滑肌细胞、T细胞和组织干细胞(图1F)。发现成纤维细胞是EC样本中的主要细胞类型(图1F)。为了描述不同细胞类型的特征,计算每个样本中前10个标记基因的富集得分(图1G)。 图1 EC相关scRNA-seq数据集中的细胞聚类和注释A:用红色标出细胞间前2000个可变基因,并标出前10个可变基因;B、C:使用主成分分析(PCA)对原始数据(B)、和谐(C)进行定性评估;D:识别17个具有显著差异(P<0.05)的主成分(PC);E:通过统一流形理论与拓扑分析(UMAP)鉴定出七个细胞簇;F:7个细胞群在scRNA-seq数据集中肿瘤样本和健康样本中的比例柱状图;G:scRNA-seq数据集中肿瘤样本和健康样本之间7个细胞簇的GSVA富集得分热图 2.2 差异分析和WGCNA筛选出733个枢纽基因 通过差异分析检测TCGA-EC队列中肿瘤样本和健康样本之间的805个巨噬细胞DEGs(图2A、B)以及EC样本和健康样本之间的5691个DEGs(图2C、D)。计算EC和健康样本之间的ssGSEA免疫细胞得分,发现其中包括巨噬细胞在内的26种免疫细胞含量不同(图2E、F)。为了筛选枢纽基因,以26个差异免疫细胞的ssGSEA得分作为性状,实施了WGCNA。EC和健康样本被聚类,剔除四个离群样本(图3A、B)。通过选择阈值9,得到16个模块,并发现黑色模块与巨噬细胞ssGSEA评分的显著相关性最高(图3C)。黑色模块中的733个基因被定义为中心基因。这些基因与巨噬细胞DEGs及其他DEGs相互交叉,从而筛选出43个候选基因(图4A)。富集分析发现633个GO术语,包括巨噬细胞的分化和活化,它们参与了免疫反应和其他过程(图4B)。13个KEGG通路与候选基因相关,其中包括细胞因子-细胞因子受体相互作用、抗原处理和呈递以及其他通路(图4C)。 图2 scRNA-seq数据和TCGA-EC队列中差异表达基因(DEGs)的鉴定A、B:火山图和scRNA-seq数据集中肿瘤样本和健康样本中805个巨噬细胞DEGs的热图;C、D:火山图和TCGA-EC队列中EC和正常样本间5691个DEGs的热图;E、F:TCGA-EC队列中EC和正常样本之间26个差异免疫细胞的ssGSEA评分热图和箱线图 图3 识别与巨噬细胞的ssGSEA得分相关的模块A:分析无标度拟合指数(左)和平均连通性(右)以筛选最佳软阈值功率;B:基于相似表达模式用不同颜色表示的所有DEG的聚类树枝图;C:模块与26个差异免疫细胞的ssGSEA评分之间的相关性热图 图4 EC中43个候选基因的鉴定和分析A:黑色模块中巨噬细胞DEGs、DEGs和枢纽基因共享的43个候选基因维恩图;B:候选基因的基因本体(GO)分析;C:候选基因中最富集的京都基因组百科全书(KEGG)术语 2.3 构建了一个包括六种生物标志物的风险模型 以 HR≠1 &P<0.05 作为筛选条件,对上述43个基因进行单因素Cox回归分析,最终得到7个预后相关基因(图5A)。使用R包glmnet,对单因素Cox回归分析得到的7个预后相关基因进行Lasso回归分析。通过Lasso回归分析,最优lambda值为0.01459(图5B)。最佳lambda值的最低标准是通过10倍交叉验证确定的,重复100次,最终得到回归系数没有被惩罚为0的基因共6个,分别为FBP1、LTB、 PTGER4、PARVG、CCR7、HLA-DMB(图5C)。根据生物标记物计算出的中位风险评分,将训练集和测试集中的EC样本分为高风险组和低风险组(图5D、E)。训练集和测试集的Kaplan-Meier(K-M)曲线显示,高风险组的预后明显低于低风险组(图6A、B)。ROC的曲线下面积(AUC)值大多大于0.65。这一结果表明风险模型的预测效果更佳(图6C、D)。EC样本中五种生物标志物(CCR7、FBP1、HLA-DMB、LTB和PARVG)表达水平明显高于健康供体样本,而PTGER4表达则呈相反趋势(图6E)。相关性分析结果表明,CCR7和LTB水平与巨噬细胞水平高度相关(图6F)。此外,LTB、PTGER4和PARVG也在T细胞中高表达(图6G)。 图5 筛选EC的6个生物标志物以构建风险模型A:单变量Cox分析筛选与生存相关的候选基因;B、C:构建最小绝对收缩和选择算子(LASSO)模型以筛选生物标志物,包括LASSO系数图(B)和用于调整参数选择的交叉验证图(C);D、E:训练集(380例)(D)和测试集(163例)(E)中EC样本的风险评分和生存状态分布 图6 六种生物标志物的综合分析A、B:训练集(A)和测试集(B)中不同风险评分队列的Kaplan-Meier(K-M)生存分析;C、D:训练集(C)和测试集(D)中风险模型预测性能的接收者操作特征(ROC)分析;E:TCGA-UCEC队列中EC与正常样本之间生物标志物的表达;F:生物标志物与巨噬细胞之间的相关棒棒糖图;G:scRNA-seq数据集中七种细胞中生物标志物表达的点阵图;***P<0.001,****P<0.0001 2.4 筛选差异免疫细胞和检查点 根据肿瘤分期和组织学分级划分的各组之间以及浆液性囊腺癌和子宫内膜样腺癌样本之间的风险评分存在明显差异(图7A~C)。在两个风险组,基因组变异分析(GSVA)结果发现了186条不同程度激活的KEGG通路,如错配修复、抗原处理和表达等(图7D)。根据ESTIMATE,高风险组的免疫和基质评分明显低于低风险组。而且,这些分数与风险分数呈显著负相关(图7E)。在两个风险组发现了26种不同表达的免疫细胞类型,包括巨噬细胞、活化的CD8T细胞、肥大细胞和其他细胞类型(图7F)。发现38个不同调控的免疫检查点,在两个风险组显示出显著差异(图7G)。 图7 EC风险模型的临床相关性分析和免疫相关性分析A~C:不同临床特征组的风险评分方框图,包括肿瘤分期(A)、组织学分级(B)和不同疾病类型(C);D:以KEGG基因组为背景基因组的基因组变异分析(GSVA);E:风险评分和免疫评分以及基质评分的相关散点图;F:不同风险评分队列中免疫细胞的ssGSEA评分差异方框图;G:两个风险组间46个免疫检查点表达差异的方框图;*P<0.05,**P<0.01,***P<0.001,****P<0.0001 2.5 绘制了EC的列线图 单变量和多变量Cox分析结果表明,风险评分、年龄和肿瘤分期(Ⅱ、Ⅲ、Ⅳ期)可作为EC的独立预后因素(图8A、B)。因此,这些因素被用来构建一个列线图。校准曲线的斜率更接近于1,这表明列线图具有更好的预后预测性能(图8C、D)。见表1、2。 表1 单因素Cox模型中各变量参数 表2 多因素Cox模型中各变量的参数 图8 构建临床列线图A、B:单变量(A)和多变量(B)Cox回归分析筛选独立预后因素;C:根据风险模型、年龄和肿瘤分期构建的列线图;D:直方图的校准曲线 越来越多的研究表明,TAMs的丰度与EC的进展及不良预后有关,并可能在抑制抗肿瘤免疫和治疗耐药方面调节其治疗效果[6]。因此,发现用于EC预后和治疗的TAM特异性生物标记物势在必行。然而,在EC中,复杂的细胞异质性给TAMs的生物学功能和临床价值带来了挑战。应用scRNA-seq可评估单细胞之间的基因表达差异,并为阐明与肿瘤及其TME相关的细胞异质性提供了可能。本研究首次利用scRNA-seq转录组分析鉴定了EC中与TAM相关的生物标志物,并根据这些基因构建了一个新的预后模型。 本研究通过scRNA-seq分析获得了七种细胞类型,包括内皮细胞、巨噬细胞等。与之前的研究一致,与健康供体样本相比,UCEC样本中巨噬细胞的丰度更高。此外,通过一系列生物信息学分析和算法,发现了六个与TAM相关的生物标志物,包括FBP1、LTB、PTGER4、PARVG、CCR7和HLA-DMB。为了构建风险模型,根据这六个与TAM相关的生物标志物计算了与UCEC患者预后相关的风险分数。风险分数越高,预后越差,且与EC肿瘤分期和分级越高有关。此外,与低风险组相比,高风险组的EC样本与较低的免疫浸润水平相关。通过单变量和多变量Cox分析筛选了风险评分、年龄和肿瘤分期Ⅱ、Ⅲ、Ⅳ),得出了UCEC的列线图。本研究结果表明TAM相关DEGs在UCEC中的潜在价值,并为其预后和治疗潜力带来了新的见解。 与正常子宫内膜相比,CCR7、FBP1、HLA-DMB、LTB和PARVG在UCEC样本中明显上调。之前的研究也报道了较高的CCR7[12]、LTB[13]和PARVG[14-15]表达水平与EC较好的预后相关。本研究表明,CCR7和LTB与巨噬细胞水平高度相关。Liu等[15]在EC中发现了γ-Parvin(PARVG)的低甲基化和较高的mRNA表达水平。此外,PARVG表达减弱与EC患者较短的无病生存期(disease-free survival,DFS)和总生存期(overall survival,OS)相关[14]。Feng等[14]进一步发现,PARVG基因表达水平与TME中的免疫细胞浸润相关。更具体地说,PARVG上调与EC TME中CD4+T细胞、B细胞和树突状细胞(dendriticcells,DCs)的浸润呈正相关。表明PARVG有可能通过抗原递呈细胞(antigen-presenting cells,APC)、T细胞和B细胞启动针对EC的免疫反应。由于目前缺乏对PARVG的相关研究,其在EC中潜在的预后和功能调节价值有待进一步探讨。 C-C趋化因子受体7型(CCR7)是一种能与CCL19和CCL21配体结合的趋化因子受体,其最重要的生理功能包括T细胞向淋巴结归巢。CCR7通过平衡TME中免疫细胞的贩运调节免疫和耐受性[16]。在免疫攻击过程中,CCR7一旦与其配体结合,就调节体腔内的同源循环,并启动T细胞的胞内过程,引导T细胞趋化归巢至淋巴结、肿瘤组织和靶细胞。以往研究中,CCR7表达水平与肿瘤预后之间的关系在不同肿瘤类型中存在差异。在结直肠癌、肝细胞癌和颈部鳞状细胞癌等癌症类型中,CCR7可抑制血管生成,并通过细胞毒性肿瘤浸润淋巴细胞发挥抗癌作用[16]。淋巴毒素β(Lymphotoxin Beta,LTB)是一种TNF超家族蛋白,可激活NF-κB,并参与形成异三聚体LT-α1/LT-β2配体[17]。异三聚配体进一步与单核细胞、巨噬细胞和DC表面高表达的LTβ受体(LTβR)结合,并通过这些细胞发出信号。LTβR信号与I型IFN的产生有关,已被证实在自身免疫中发挥重要作用。此外,LTβR的激活被证明可介导细胞毒性效应。LTβR已被证明参与了CD169+巨噬细胞的分化。LTβR缺失导致病毒特异性CD8+T细胞扩增减少,从而显示出在多种肿瘤类型中抗癌治疗的潜力[18]。HLA-DMB是HLA Ⅱ类基因之一,是HLA-DM家族的成员,属于非肽结合型MHC Ⅱ分类。HLA-DM的功能是催化肽交换酶,将内体肽有效地负载到MHC-Ⅱ分子。肿瘤特异性抗原和抗原递呈MHC分子对于在肿瘤组织间质中有效开展免疫活动至关重要。HLA Ⅱ类抗原主要表达在B细胞、巨噬细胞和活化的T细胞等APC的表面。HLA Ⅱ类基因的上调与辅助性T细胞介导的免疫功能密切相关,可通过激活TME中的T细胞,增强细胞溶解活性和抗肿瘤免疫功能[19]。根据Callahan等研究,在晚期浆液性卵巢癌患者中,肿瘤细胞中较高的HLA-DMB表达水平与较高的肿瘤浸润性CD8+T淋巴细胞数量和较高的生存率相关[20]。已经证实,CCR7、LTB和HLA-DMB在TME中发挥关键作用。本研究揭示了其与TAMs的相关性,以及作为EC预后靶点的可能性。然而,关于其在EC中的相关功能和机制的研究很有限,尤其是关于其参与EC-TME中肿瘤细胞和免疫细胞相互调控的研究。 据报道,果糖-1,6-二磷酸酶(FBP1)是糖酵解的负调控因子,在多种肿瘤中发挥着重要的抑瘤作用[21]。除乳腺癌外,FBP1在多种实体瘤中被下调。FBP1通常被认为是多种癌症的保护性预后因子,包括胃癌、胰腺癌、卵巢癌、宫颈癌[22]。FBP1的抗肿瘤机制包括抑制糖酵解和直接抑制肿瘤生长[23]。FBP1过表达可抑制肿瘤细胞的上皮-间质转化(epithelial-mesenchymal transition,EMT)及其增殖、自噬、侵袭和转移,还可促进细胞凋亡[23]。最近,越来越多的证据揭示了FBP1在调节免疫细胞功能方面的新功能。Wang等发现,FBP1表达缺失会抑制程序性死亡配体1(programmed death ligand-1,PD-L1)的表达,增强癌症免疫力,从而促进肿瘤生长,并对免疫检查点阻断疗法产生抗药性[24]。Zhu等[25]证实,在关节炎中,FBP1可通过与促激肽原受体(PKR)的蛋白-物理相互作用调节巨噬细胞的活化。Cong等[26]证实,FBP1通过损害NK细胞的糖代谢和活力,导致NK细胞功能障碍。肥胖和高脂血症等代谢紊乱可改变TME,影响抗肿瘤免疫并促进肿瘤迁移。代谢紊乱也会影响UCEC的预后[26]。本研究表明,FBP1表达越高,EC的预后越好,这在一个独立的数据集中得到了验证。因此,认为FBP1可作为未来EC抗肿瘤免疫代谢研究的靶点。 前列腺素E受体4(PTGER4)是四种前列腺素E2(PGE2)受体之一,表达于肿瘤细胞、成纤维细胞和TME中的免疫细胞表面。先前的研究表明,肿瘤组织中PGE2高表达水平会抑制TME中的抗肿瘤免疫,导致肿瘤免疫逃逸和疾病进展[27]。如TAMs表达PTGER4并进一步促进VEGF-C和D的原位生成,从而促进淋巴管生成,这表明TAMs中的PTGER4在肿瘤进展和转移的多个细胞事件中发挥关键作用[28]。选择性抑制PTGER4可抑制肿瘤生长,恢复肿瘤免疫反应,达到抗肿瘤的目的[28]。PTGER4还可转导肿瘤细胞生存和进展的重要通路,如PI3K/AKT、ERK1/2、EGRF-1和cAMP/PKA/CREB[27]。本研究与前期研究在PTGER4表达水平上存在不一致。前期研究显示,EC和正常子宫内膜样本中PTGER4表达水平明显升高[29-30]。造成这些不同结果的原因之一可能是样本的异质性。本研究纳入了TCGA队列中的547个肿瘤样本,利用scRNA-seq数据在单细胞水平上证明了PTGER4在肿瘤巨噬细胞中的低表达水平。尽管表达趋势截然不同,但与本研究结果一致的是,Catalano等在体内证明了PTGER4在EC中的肿瘤促进作用,这表明PTGER4是EC的潜在治疗靶点[29]。 本研究发现的6个与TAM相关的生物标志物中,有4个基因(CCR7、LTB、PARVG和PTGER4)已被报道与EC的预后相关,这凸显了它们作为预后标志物和风险模型的可靠性。此外,发现两个与UCEC预后相关的新分子:FBP1和HLA-DMB。更重要的是,首次发现了它们与EC TME中TAMs的关联。基于这六个TAM相关基因,计算了TCGA-EC患者的风险评分,并构建了一个预后风险模型。高风险评分组与较低的免疫浸润水平、晚期肿瘤分期和分级、差(浆液性)组织型和预后有关。因此,从TAM的角度来看,风险预测模型可为EC高危人群提供更精确的个体化治疗策略。 本研究存在以下局限性:(1)六个TAM相关基因可能有不同的作用。这些基因可能与促进或抑制肿瘤发生有关,也可能与TAM在TME中的不同功能相对应。然而,本研究并未发现TAM亚群有任何独特的基因功能。(2)没有进行体外和体内实验来验证这些生物标志物的有效性。未来将考虑构建基因敲除小鼠,以进一步验证生物标志物的表达水平、潜在功能和机制,尤其是在巨噬细胞亚群中的表达水平、潜在功能和机制。 综上所述,本研究结合使用了scRNA-seq数据、转录组数据和TCGA-EC队列的生存信息,首次确定了六个TAM相关生物标志物的预后作用,并构建了一个风险模型。高风险评分组与较低水平的免疫浸润、晚期肿瘤分期和分级、不良(浆液性)组织型和预后有关。本研究为TAMs在TME中的作用提供了新的见解,也为EC患者的精准医疗提供了潜在的预后和治疗靶点。
2 结 果


3 讨 论
