磺胺二甲嘧啶钠注射液和磺胺间甲氧嘧啶钠注射液细菌内毒素检查方法的改进研究
2024-01-02韩宁宁彭文绣杨秀玉赵富华
韩宁宁,张 雯,王 轩,彭文绣,赵 晖,杨秀玉,戴 青,赵富华*
(1.中国兽医药品监察所,北京 100081;2.宁夏回族自治区兽药饲料监察所,银川 750011)
磺胺二甲嘧啶钠和磺胺间甲氧嘧啶钠均为磺胺类抗菌药物,可与对氨基苯甲酸竞争性作用于细菌体内的二氢叶酸合成酶,阻止叶酸的合成,减少具有代谢活性的四氢叶酸的量,从而抑制细菌的生长繁殖[1-2]。二者在动物体内外都具有很强的抗菌活性,对大多数革兰阳性菌和阴性菌都有较强的抑制作用,能用于由敏感菌引起的各类感染,也可用于弓形虫的感染[3]。磺胺二甲嘧啶钠注射液和磺胺间甲氧嘧啶钠注射液均为静脉用注射剂。根据《中国兽药典》附录0102[4]的要求,静脉用注射剂应进行细菌内毒素或热原的检查。但2015年版《中国兽药典》中上述两个注射液[5-6]均无相关检查项目。为提升标准对产品安全性的质量控制作用,按照农业行业(国家)标准项目兽药国家标准制修订计划,2020年版《中国兽药典》上述两个注射液质量标准中拟增加细菌内毒素检查项。该标准起草单位最初拟定的标准为“取本品,依法检查,每1 mL注射液中含内毒素的量应小于5 EU”。作为复核单位,研究发现,按照标准选择常规灵敏度的鲎试剂,供试品对鲎试剂的凝结产生干扰。通过对干扰作用产生的原因进行剖析,并用固定浓度的盐酸溶液溶解供试品,再使用无热原滤膜过滤的方法排除了干扰。通过上述供试品前处理方法的改进,检验人员无需采用特殊灵敏度的鲎试剂,亦可完全消除干扰作用,增强了标准的可执行性。改进后的标准被收载入2020年版《中国兽药典》[7-8]。
1 材料与方法
1.1 材料
1.1.1 供试品 共收集到来自2家兽药生产企业的3批磺胺二甲嘧啶钠注射液,见表1。共收集到来自3家兽药生产企业的3批磺胺间甲氧嘧啶钠注射液,见表2。

表1 磺胺二甲嘧啶钠注射液样品信息

表2 磺胺间甲氧嘧啶钠注射液样品信息
1.1.2 试剂 共采购了来自2个厂家的3种不同灵敏度的鲎试剂,见表3。细菌内毒素国家标准品购自中国食品药品检定研究院,规格为9000 EU/支。细菌内毒素检查用水购自中国食品药品检定研究院。
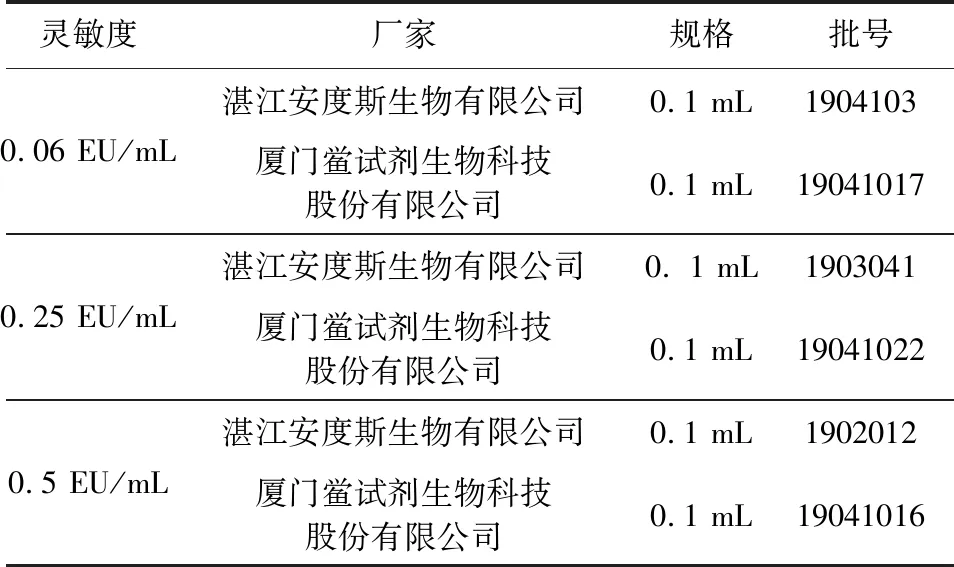
表3 鲎试剂信息
1.1.3 仪器和耗材 细菌内毒素检查仪(ET-96)购自天大天发科技有限公司。0.45 μm无热原滤膜购自Sartorius。
1.2 方法
1.2.1 原拟定标准方法的复核和问题分析
1.2.1.1 原拟定标准方法的复核 采用上述3种灵敏度的6批鲎试剂,分别对上述6批供试品进行内毒素检查。每批供试品均同时配制供试品阳性(PPC)和阳性(PC)。供试品、PPC、PC和阴性均配制两个平行管。观察采用不同灵敏度鲎试剂的PPC管凝结情况与PC管是否一致。
1.2.1.2 PPC管不凝结的原因分析及不同稀释倍数的供试品溶液pH值测定 采用0.25 EU/mL或0.5 EU/mL的鲎试剂,各批供试品PPC管均未凝结,显示供试品对鲎试剂凝结产生干扰作用。考虑磺胺二甲嘧啶钠注射液和磺胺间甲氧嘧啶钠注射液的pH值均为碱性(《中国兽药典》规定二者的pH值均为9.0~11.0),分析产生干扰作用的主要因素是供试品溶液pH值不在6.0~8.0的中性范围,影响了鲎试剂与内毒素的凝结反应[9-10]。为验证上述分析,对各批供试品原液的pH值和稀释后的pH值进行了测定。
1.2.2 细菌内毒素检查方法的改进
1.2.2.1 鲎试剂灵敏度复核 由于本方法的限值是5 EU/mL,按照鲎试剂灵敏度不得高于限值的要求[11-12],选择常规灵敏度的鲎试剂即可符合要求,因此拟选择0.25 EU/mL和0.5 EU/mL两个灵敏度的鲎试剂。按照《中国兽药典》一部附录1143的规定,对采购自两个厂家的上述两个灵敏度的鲎试剂分别进行标示灵敏度的复核。对应各浓度的细菌内毒素标准品溶液配制方法见图1。
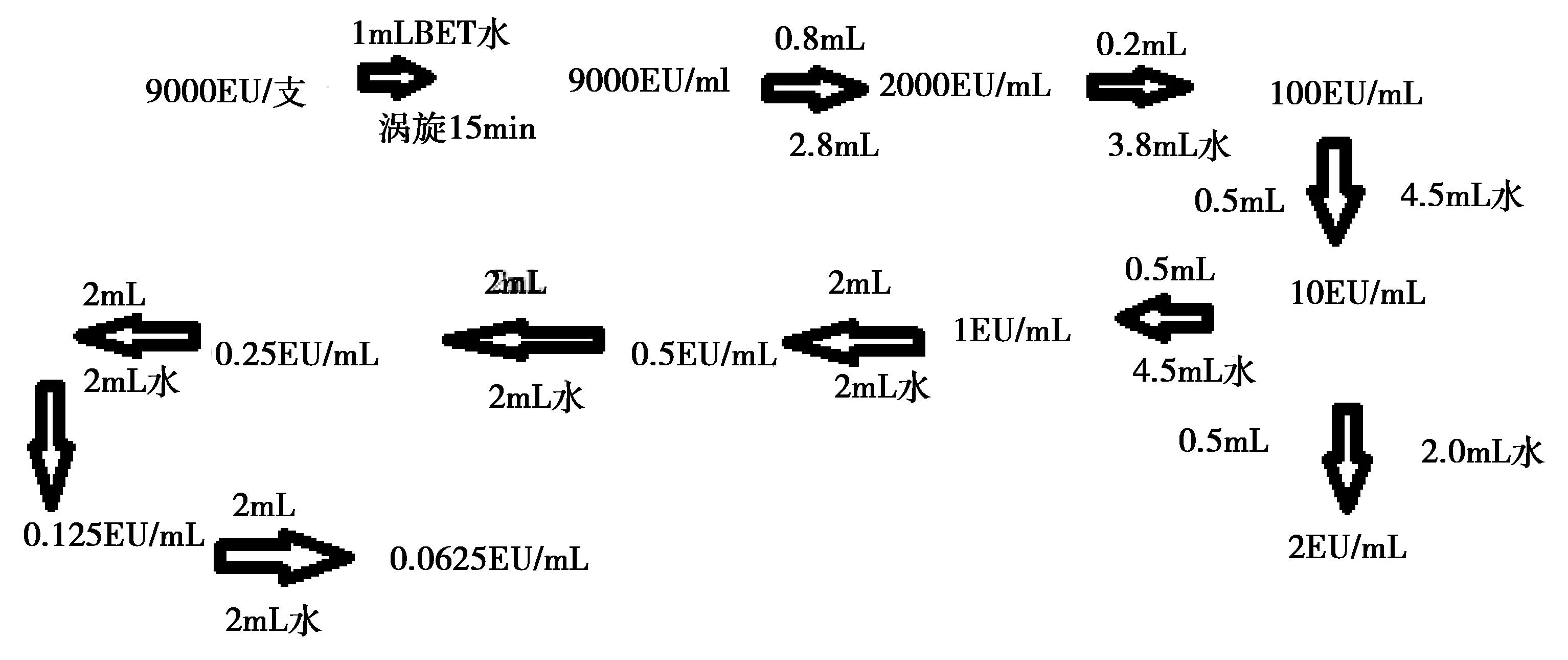
图1 各浓度内毒素标准溶液配制流程图
1.2.2.2 供试品前处理方法的改进 由于供试品呈碱性,在使用0.06 EU/mL的鲎试剂时,即便稀释至最大稀释倍数83倍仍不能满足pH值在6.0~8.0范围内的要求,故采用加入稀盐酸的方法调节供试品稀释液pH值。尝试采用不同浓度的盐酸溶液调节pH值,或采用不同浓度的盐酸溶液直接溶解供试品,以使供试品溶液pH值符合上述要求[13]。
采用确定浓度的盐酸溶液溶解后,磺胺二甲嘧啶钠或磺胺间甲氧嘧啶钠产生白色沉淀。而白色沉淀的产生会影响凝结现象的观察[14]。因此,进一步将混悬稀释液用0.45 μm无热原滤膜进行过滤后即得澄清稀释液。对采用上述方法配制的供试品溶液的pH值进行了测定,以确证其pH值符合上述要求。
1.2.2.3 前处理方法中使用滤膜是否会截留内毒素的验证试验 由于前处理方法中需要使用无热原的滤膜对供试品稀释液进行过滤,如果滤膜表面截留了内毒素,会影响供试品内毒素测定的准确性[15]。因此,将内毒素标准品溶液采用相同滤膜进行过滤,再进行灵敏度复核试验,以验证滤膜是否截留内毒素。
1.2.2.4 干扰试验 配制6批供试品的1∶5稀释液。使用上述4批鲎试剂进行干扰试验,具体配制流程图见图2~图3。
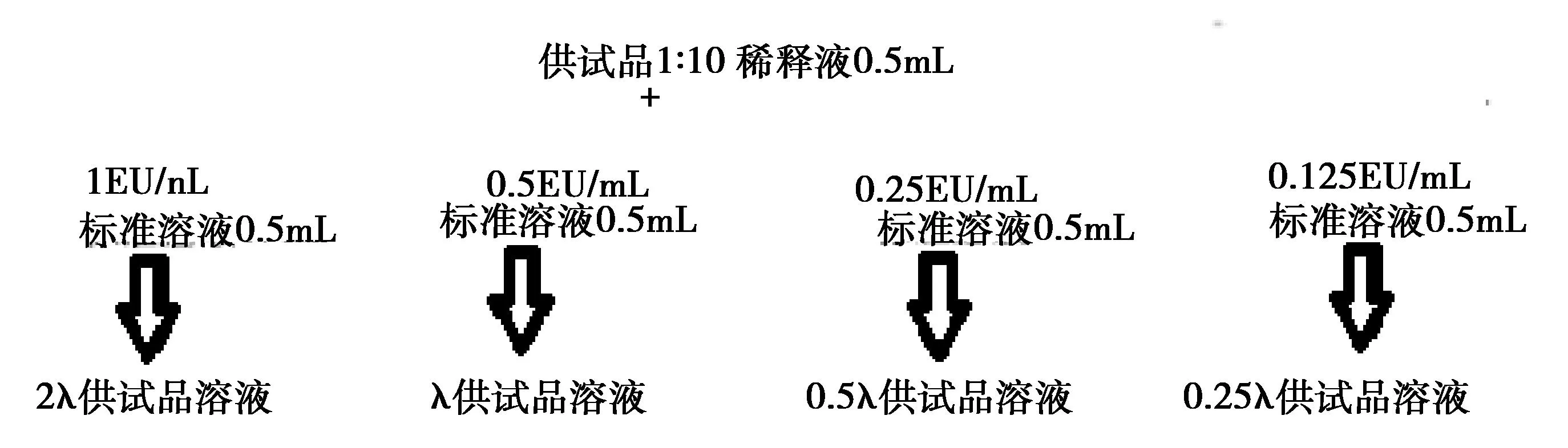
图2 使用灵敏度为0.25 EU/mL的鲎试剂供试品系列溶液B配制流程图
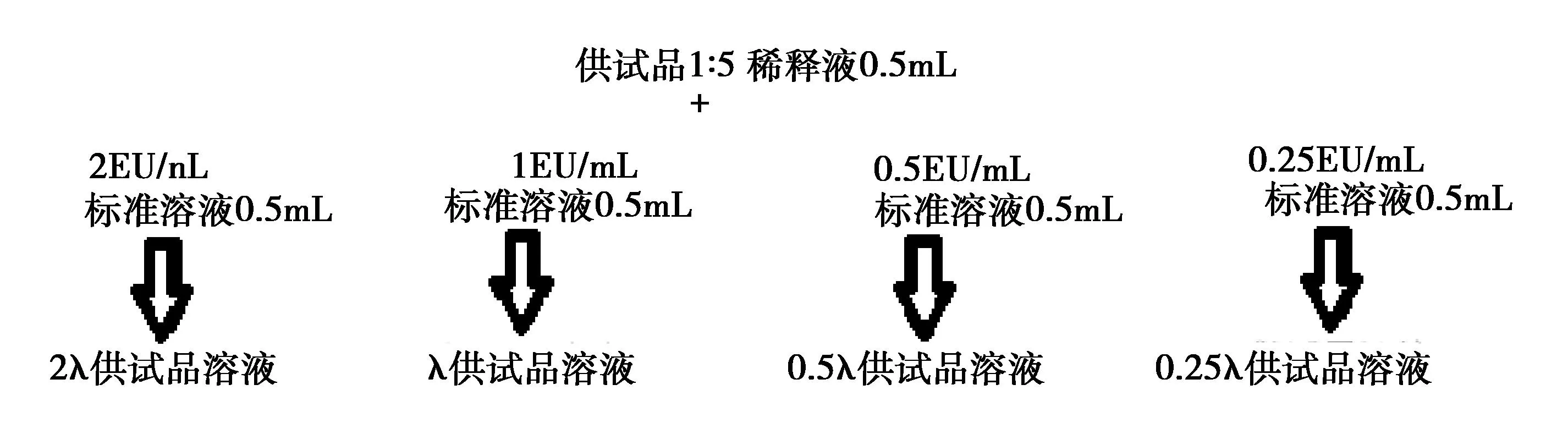
图3 使用灵敏度为0.5 EU/mL的鲎试剂供试品系列溶液B配制流程图
2 结果与分析
2.1 原拟定标准方法的复核和问题分析
2.1.1 原拟定标准方法的复核结果 采用3种灵敏度的6批鲎试剂,分别对6批供试品进行内毒素检查,见表4。该结果显示,当采用0.06 EU/mL的鲎试剂时,6批供试品的阳性(PPC)管均可凝结,与阳性对照(PC)管结果一致;但是当采用0.25 EU/mL或0.5 EU/mL的鲎试剂时,6批供试品的阳性(PPC)管均不凝结,与阳性对照(PC)管不一致。这表明使用0.25 EU/mL或0.5 EU/mL的鲎试剂,供试品对鲎试 剂与内毒素的凝结反应存在干扰作用[16-17]。

表4 原拟定标准方法复核结果
2.1.2 PPC管不凝结的原因分析及不同稀释倍数的供试品溶液pH值测定 对各批供试品原液的pH值和稀释后的pH值进行了测定(表5)。该结果显示,按照最大稀释倍数MVD进行稀释,6批供试品稀释10倍、20倍或83倍后,pH值均不在6.0-8.0的范围,只是稀释83倍后的供试品溶液pH值更接近8.0。供试品本身呈碱性,使用0.25 EU/mL或0.5 EU/mL的鲎试剂时,MVD仅为20倍或10倍,无法使供试品溶液处于pH中性范围,影响了鲎试剂与内毒素的凝结反应,是导致干扰产生的主要因素。而本方法的限值为5 EU/mL,按照鲎试剂灵敏度不低于限值即可的原则,0.25 EU/mL或0.5 EU/mL均是可选择的灵敏度,反而检验人员不易考虑到采用更高灵敏度的鲎试剂(0.06 EU/mL)。基于上述分析,原拟定标准的可执行性较差,需要进行进一步改进。
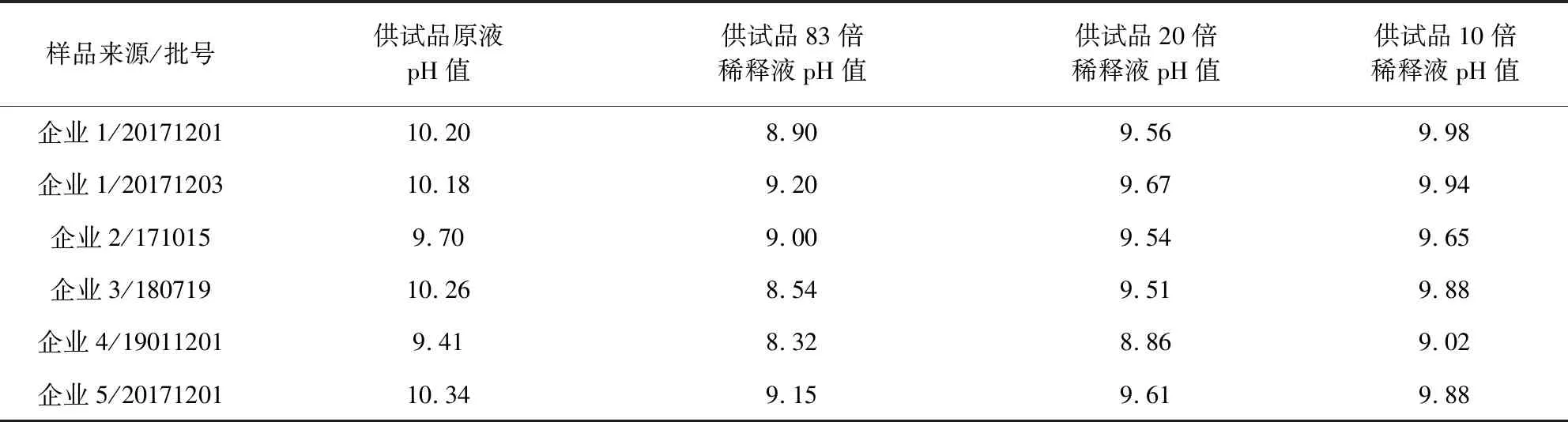
表5 供试品及稀释液pH值测定结果
2.2 细菌内毒素检查方法的改进
2.2.1 鲎试剂灵敏度复核 对两个厂家的0.25 EU/mL和0.5 EU/mL两种灵敏度的的鲎试剂分别进行标示灵敏度的复核,见表6、表7。该结果显示,4批鲎试剂的最大浓度2 λ管均为阳性,最低浓度0.25 λ管均为阴性,阴性对照管阴性,试验有效。4批鲎试剂的计算灵敏度λc均在0.5~2λ范围内,灵敏度复核结果符合要求。

表6 0.25 EU/mL鲎试剂灵敏度复核结果

表7 0.5 EU/mL鲎试剂灵敏度复核结果
2.2.2 供试品前处理方法的改进 采用盐酸溶液直接调节供试品溶液的pH值时,由于溶液没有缓冲能力,容易出现少滴加一滴pH值仍处于碱性范围,但再滴加一滴pH值又处于酸性范围的情况,不易操作。因此摸索了不同浓度的盐酸溶液溶解供试品的方法,结果发现,采用0.06 mol/L的盐酸溶液将供试品稀释5倍,可将所有批次的供试品溶液pH值均调节至6.0~8.0的范围。
采用上述方法配制供试品溶液,磺胺二甲氧嘧啶钠或磺胺间甲氧嘧啶钠由钠盐变为游离状态,溶解性降低,会产生白色沉淀。将磺胺间甲氧嘧啶钠注射液的混悬稀释液用0.45 μm无热原滤膜进行过滤后即得澄清稀释液。但将磺胺二甲嘧啶钠注射液的混悬稀释液立即过滤仍会再次产生白色沉淀,分析原因为立即过滤会使盐酸与磺胺二甲嘧啶钠反应不完全。故将磺胺二甲嘧啶钠注射液的混悬稀释液静置2 h后过滤,即可得澄清稀释液。具体配制方法见表8。
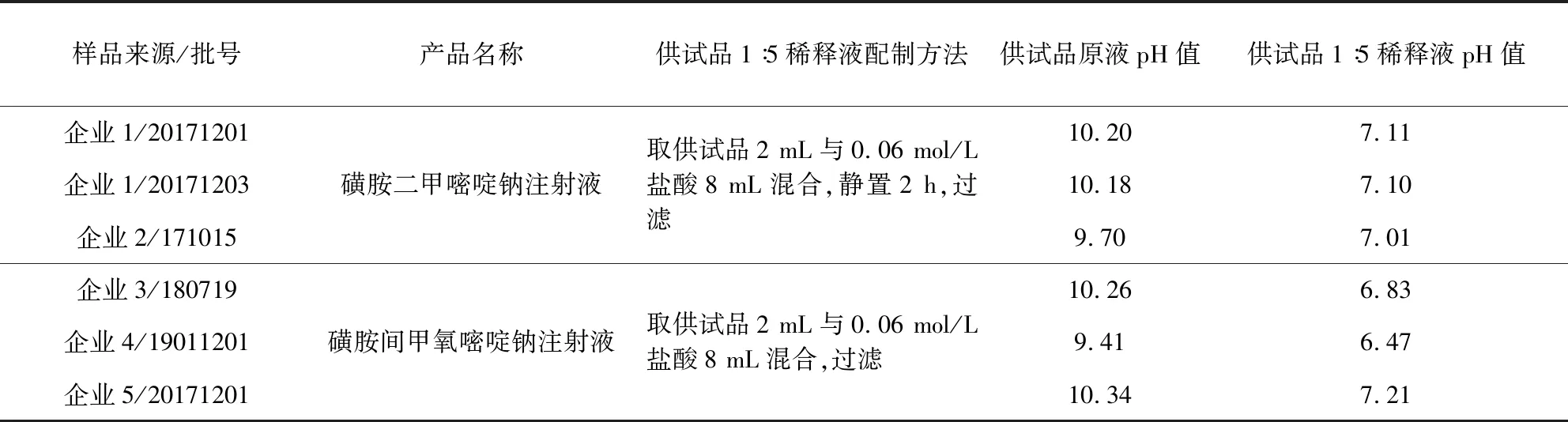
表8 供试品稀释液配制方法及稀释液pH值
2.2.3 前处理方法中使用滤膜是否会截留内毒素的验证试验 将内毒素标准品溶液采用相同滤膜进行过滤,再进行灵敏度复核试验。结果表明,即便内毒素标准品溶液经滤膜过滤处理,计算灵敏度均符合要求,进而验证了滤膜过滤对供试品中内毒素无截留作用。
2.2.4 干扰试验 结果见表9~表12。该结果显示6批供试品系列溶液A和阴性对照D都为阴性,并且系列溶液C的结果在鲎试剂灵敏度范围内,判定试验有效。ES在0.5~2.0 λ范围内,6批供试品Et均在0.5~2.0 ES范围内,判定供试品10倍或20倍稀释液对0.5 EU/mL或0.25 EU/mL的鲎试剂与内毒素的反应均无干扰作用。

表9 使用安度斯/1903041(灵敏度为0.25 EU/mL)鲎试剂的干扰试验结果

表10 使用厦门/19041022(灵敏度为0.25 EU/mL)鲎试剂的干扰试验结果

表11 使用安度斯/1902012(灵敏度为0.5 EU/mL)鲎试剂的干扰试验结果

表12 使用厦门/19041016(灵敏度为0.5 EU/mL)鲎试剂的干扰试验结果
3 讨论与结论
考虑到本试验仅收集到磺胺二甲嘧啶钠注射液和磺胺间甲氧嘧啶呐注射液各3批供试品,样本量较小。而不同企业的处方组成和生产工艺的差异导致供试品的pH值可能存在更大差异性。因此检验人员可参考本方法所提供的供试品溶液pH值调节方法,如采用该方法仍无法使供试品溶液处于6.0~8.0的pH值范围,可适当调整盐酸溶液的浓度。
本标准经复核后被收载入2020年版《中国兽药典》,标准规定为“取本品(必要时,可调节被测溶液的pH值,使其和鲎试剂混合后溶液的pH值在6.0~8.0的范围内),依法检查,每1 mL注射液中含内毒素的量应小于5 EU”。在执行该标准时,检验人员可选择使用灵敏度较高的鲎试剂,也可采用盐酸溶液调节pH值的方法,甚至也可以选用一些市售的商品化缓冲液进行稀释[18],以达到消除干扰的作用。但无论采用哪种方法,均应进行干扰试验,以确证消除了供试品溶液pH值对凝结作用的干扰。
目前《中国兽药典》中收载的各品种项下的细菌内毒素检查项,大多没有供试品溶液配制方法的描述,这是基于保证方法通用性的考虑,检验人员执行标准时可自行选择适宜灵敏度的鲎试剂和对应的稀释方法。但对于本身呈强酸性或强碱性的供试品,稀释后可能仍无法处于中性范围。除本试验所述磺胺类注射液外,可能存在类似干扰作用的品种还有注射用盐酸土霉素、注射用盐酸四环素、维生素B1注射液、维生素B6注射液等。检验人员在供试品溶液配制完毕后,需先进行pH值的测定,必要时采用适宜的酸或碱进行调节,以防止对凝结反应的干扰。
对磺胺二甲嘧啶钠注射液和磺胺间甲氧嘧啶呐注射液的细菌内毒素检查方法的拟定标准进行了改进,通过固定浓度的盐酸溶液溶解供试品,再使用无热原滤膜过滤的方法排除了干扰。通过上述供试品前处理方法的改进,检验人员无需采用特殊灵敏度的鲎试剂,亦可完全消除干扰作用,增强了标准的可执行性[19-20]。
