阿莫西林可溶性粉在猪体内的药代动力学和绝对生物利用度研究
2024-01-02瞿红颖杨国辉李红园李卓伟王建锋
张 沛,瞿红颖,杨国辉,李红园,李卓伟,贾 兴*,王建锋
(1.河北远征药业有限公司/河北省兽药技术创新中心,石家庄050041;2.吉林大学,长春471800)
阿莫西林属于半合成的第二代广谱青霉素类抗生素,别名羟氨苄青霉素,属于β-内酰胺类,由英国比彻姆(Beecham)公司在20世纪60年代开发研制而成,对革兰氏阳性菌如葡萄球菌、棒状杆菌、梭杆菌、链球菌、丹毒丝菌等的抗菌机理与青霉素相似。对多种革兰氏阴性菌如变形杆菌、沙门氏菌、嗜血杆菌、大肠杆菌等亦有杀灭作用,可广泛用于治疗各种动物的尿道、呼吸道及皮肤的敏感菌感染[1-3]。临床使用的主要为注射用阿莫西林钠及阿莫西林三水化合物,具有口服吸收好、杀菌迅速,选择性高、毒性低、副反应少,临床使用方便等特点[4-7]。
目前国外已批准阿莫西林可溶性粉主要用于猪、鸡等动物,常见给药方式为饮水或拌料。国内给药方式与国外相同,主要靶动物为鸡。阿莫西林对胃酸相当稳定,口服吸收后,同等给药剂量,血清浓度比氨苄西林高1.5~3倍。阿莫西林钠已批准用于猪、牛、羊、马、猫、狗等家畜,给药方式为注射给药。二者主要用于对阿莫西林敏感的革兰氏阳性菌和革兰氏阴性菌感染。关于口服阿莫西林混悬剂、肌注阿莫西林三水合物、肌注阿莫西林钠的药代动力学已有报道[8-15],本试验主要研究口服阿莫西林可溶性粉在猪体内的药代动力学参数及与静脉注射阿莫西林钠比较的绝对生物利用度,为临床用药提供依据。
1 材料与方法
1.1 实验动物 本次试验选择8头健康状态良好的大白-长白杂交猪(体重20~30 kg,雌雄各半)为受试靶动物。给药前饲喂1周,自由饮水,饲喂不含药物的饲料,每天定时饲喂三次。试验开始前,受试动物在试验场所适应7 d,减少环境变化对其造成的应激。
1.2药品和试剂 阿莫西林可溶性粉(用于内服)含量10%,批号DVA210902;注射用阿莫西林钠(用于静脉注射)含量85.5%,批号E8G210103;均为河北远征禾木药业有限公司。阿莫西林对照品:含量86.6%,批号K0221703,中国兽医药品监察所。甲醇:含量>99.9%,色谱纯,批号21115270,赛默飞世尔科技(中国)有限公司;磷酸:含量85%~90%,色谱纯,批号RH238446,上海麦克林生化科技有限公司;磷酸二氢钾:含量>99.5%,批号G2117143,上海阿拉丁生化科技有限公司。
1.3 仪器与设备 高效液相色谱仪:厂家:日本岛津公司,型号:LC-2010A HT;电子天平:感量0.00001 g,厂家:赛多利斯,型号:QUINTIX125D-1CN;台式冷冻离心机:厂家:长沙湘仪离心机仪器有限公司,型号:H1850R;旋涡混合器:厂家:其林贝尔,型号:XW-80A;智能静音超声波清洗机:厂家:小美超声,型号:XM-300UVF;真空抽气泵:厂家:上海亚荣生化仪器厂,型号:SHZ-Ⅲ;移液器:规格:10、20、200、1000 μL,厂家:吉尔森实验仪器(上海)有限公司。
1.4 试液的配制
1.4.1 阿莫西林标准储备液(1 mg/mL) 精密称取阿莫西林对照品适量于10 mL棕色容量瓶中,用5%甲醇水定容至刻度,配制成1 mg/mL的阿莫西林标准储备液,密封,分装后,于-80 ℃避光保存,有效期30 d。
1.4.2 阿莫西林标准工作液 准确量取1 mL阿莫西林标准储备液于10 mL容量瓶中,用5%甲醇水定容至刻度,摇匀,使其浓度为100 μg/mL,并通过稀释最终配制成7个浓度的阿莫西林标准工作液,分别为100、50、25、10、5、2.5和1 μg/mL。
1.4.3 空白基质溶液 采用不含待测组分的空白样品,按血浆样品前处理方法进行操作,制得空白基质溶液。
1.5 方法
1.5.1 试验设计与试验方案 在动物入选完成后,使用EXCEL随机数字函数给每头猪赋予一个随机数字,根据随机数字由小到大排列,将8头受试猪随机分成2 组,每组4头,采用单剂量、双周期、两处理、随机、交叉研究,设置内服组和静注组。内服组(阿莫西林可溶性粉)以口服方式给药20 mg/kg B.W.,静注组(注射用阿莫西林钠)以耳缘静脉注射方式给药10 mg/kg B.W.。在进行给药之前,记录每头动物的体重,计算给药剂量。
1.5.2样品采集 在每个周期的不同时间点,从猪的前腔静脉采血5 mL,置于肝素抗凝采血管中。具体的采血时间点如下:给药前一次(0 h)、给药后5、10、15、30、45 min及1、1.5、2、3、4、6、8、10、12、18 h各一次,采集血样于3800 rpm离心10 min,吸取上层血浆(采集颈静脉血置于含0.5%肝素钠的离心管中,混匀,3800 rpm,离心10 min。),置于标识好的试管中,同时取空白猪血浆样品,作为空白试样。-80 ℃保存备用。
1.5.3 液相色谱条件 色谱柱:WondaSil C18-WR(4.6 mm×250 mm,5 μm),日本岛津公司。流动相:0.01 mol/L磷酸二氢钾溶液:甲醇=90∶10(V∶V)。流速:1.0 mL/min。柱温:35 ℃。进样量:20 μL;检测波长:225 nm。
1.5.4 血浆样品的处理 取出冷冻血浆样品,室温化冻,涡旋混匀。准确吸取500 μL猪血浆样品,加入500 μL含1%磷酸的甲醇溶液,涡旋混匀30 s,于4 ℃条件下,15000 rpm离心10 min,转移上清液至2 mL离心管中,过0.22 μm有机相针式过滤器至棕色进样瓶中,供HPLC上机检测。
1.5.5 检测限和定量限 取450 μL空白猪血浆,加入50 μL相应浓度的阿莫西林标准工作溶液(500、1000 ng/mL),制得50、100 ng/mL添加浓度的标准添加样品,每个浓度设置6个重复,按血浆样品前处理方法处理后上机检测。以最低检出浓度计算,S/N≥3时的加标样品浓度为检测限,S/N≥10且具有可接受的准确度和精密度的加标样品浓度为定量限。
1.5.6 标准曲线 设置7个不同的阿莫西林标准工作液浓度,依次为1、2.5、5、10、25、50和100 μg/mL。准确吸取450 μL空白猪血浆样品,分别加入50 μL上述阿莫西林标准工作液,涡旋混匀。如下表所示,制得血浆药物浓度为100、250、500、1000、2500、5000和10000 ng/mL的基质标准工作溶液,按照血浆样品前处理方法处理后进行上机检测。以测得阿莫西林峰面积为纵坐标,对应药物浓度为横坐标,绘制标准曲线,求得线性回归方程和相关系数(表1)。
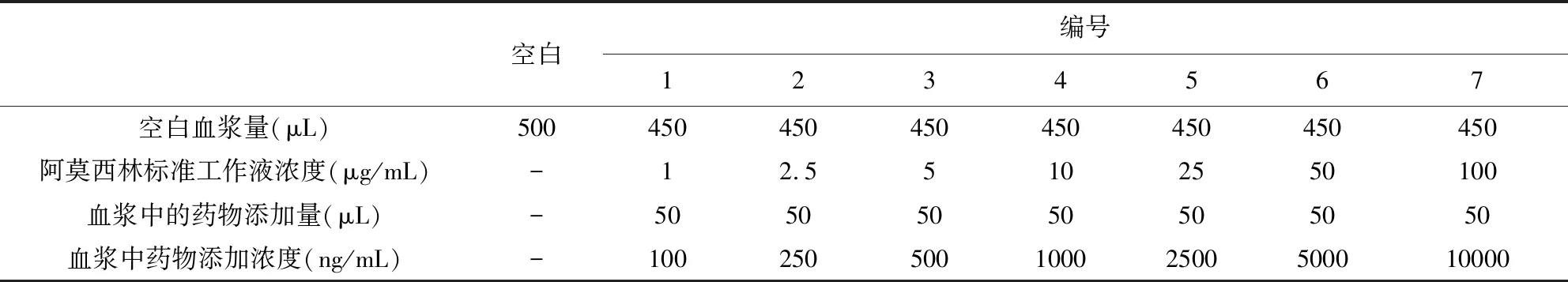
表1 标准曲线的制作
1.5.7 准确度和精密度 取450 μL空白猪血浆,加入50 μL相应浓度的阿莫西林标准工作液(1、2.5、10和75 μg/mL),制得100、250、1000和7500 ng/mL四个添加浓度水平的添加样品,每个浓度设置6个重复,按照血浆样品前处理方法处理后上机检测。以现配随行标准曲线进行定量,于三个不同工作日每天检测一批,计算准确度、批内和批间精密度。
1.5.8 基质效应 纯标:用纯水配制成浓度分别为125、500和3750 ng/mL的阿莫西林标准工作液,每个浓度设置6个重复,作为基质效应考察的参照溶液。基质匹配:取空白猪血浆样品,按血浆样品前处理方法处理血浆样品得到空白基质,用空白基质配制成浓度分别为125、500和3750 ng/mL的阿莫西林基质标液,每个浓度设置6个重复。
按照色谱工作条件对上述样品进行检测,比较相同浓度下空白基质对检测的影响。
1.5.9 方法的稳定性试验
1.5.9.1 样品反复冻融稳定性 取450 μL空白猪血浆,分别添加50 μL三个不同浓度(2.5、10和75 μg/mL)的阿莫西林标准工作液,混匀,制得250、1000和7500 ng/mL三个添加浓度水平的添加样品,每个浓度分成6份,3份当天检测,其余3份在-80 ℃与常温条件下反复冻融3次后,按血浆样品前处理方法处理血浆样品,供HPLC检测分析。以现配随行标准曲线进行定量,分析待测药物在冻融过程中的稳定性。
1.5.9.2 样品室温放置稳定性 取450 μL空白猪血浆,分别添加50 μL三个不同浓度(2.5、10和75 μg/mL)的阿莫西林标准工作液,混匀,制得250、1000和7500 ng/mL三个添加浓度水平的添加样品,每个浓度分成6份,分2个批次,室温放置0、12 h后按血浆样品前处理方法处理样品,供HPLC检测分析。以现配随行标准曲线进行定量,考察血浆样品室温放置后的稳定性。
1.5.9.3 样品前处理后进样盘放置稳定性 取450 μL空白猪血浆,分别添加50 μL三个不同浓度(2.5、10和75 μg/mL)的阿莫西林标准工作液,混匀,制得250、1000和7500 ng/mL三个添加浓度水平的添加样品,每个浓度分成6份,分2个批次,按血浆样品前处理方法处理样品,进样盘放置0、12 h后上机检测。以现配随行标准曲线进行定量,考察前处理后的血浆样品在进样盘放置后的稳定性。
1.5.9.4 样品前处理后-20 ℃放置稳定性 取450 μL空白猪血浆,分别添加50 μL三个不同浓度(2.5、10和75 μg/mL)的阿莫西林标准工作液,混匀,制得250、1000和7500 ng/mL三个添加浓度水平的添加样品,每个浓度分成6份,分2个批次,按血浆样品前处理方法处理样品,-20 ℃放置0、24 h后上机检测。以现配随行标准曲线进行定量,考察血浆样品前处理后在-20 ℃放置的稳定性。
1.5.9.5 储备液长期冻存稳定性 取新配制的阿莫西林标准储备液,分装,于-80 ℃条件下密封避光保存。分别在配置后的0 d和30 d,用纯水稀释成浓度为125、500和3750 ng/mL三个浓度的待测液,每个浓度设置3个重复,供HPLC检测分析。每次重新称量标准品配制阿莫西林储备液并配制标准曲线,用来定量。将放置后样品测定浓度与标示浓度相比,考察储备液在-80 ℃的储存条件下的稳定性。
1.5.9.6 样品长期冻存稳定性 取450 μL空白猪血浆,分别添加50 μL三个不同浓度(2.5、10和75 μg/mL)的阿莫西林标准工作液于空白血浆中混匀,制得250、1000和7500 ng/mL三个添加浓度水平的添加样品,每个浓度分成6份,分2个批次,于-80 ℃条件下储存,分别于0、30 d后按血浆样品前处理方法处理血浆样品,供HPLC分析。以现配随行标准曲线进行定量,考察样品长期冻存的稳定性。
1.5.10 稀释可靠性 10倍稀释效应-质控样本:取空白血浆450 μL,加入1000000 ng/mL的阿莫西林标液50 μL,涡旋混匀配制成100000 ng/mL的质控样本原液。取样本原液50 μL,加入空白血浆450 μL,配制成10000 ng/mL的10倍稀释-质控样本。
100倍稀释效应-质控样本:取空白血浆450 μL,加入1000000 ng/mL的阿莫西林标液50 μL,涡旋混匀配制成100000 ng/mL的质控样本原液。取样本原液50 μL,加入空白血浆450 μL,配制成10000 ng/mL的10倍稀释-质控样本。取上述10倍稀释效应-质控样本50 μL,加入450 μL空白血浆,配制成1000 ng/mL的100倍稀释质控-样本。
取上述10倍、100倍稀释效应-质控样本,每一浓度设置6个平行样本,按照“血浆样品前处理方法”进行处理后进行HPLC检测,以现配随行标准曲线进行定量。
1.6 数据处理与分析 根据液相检测测定的血浆浓度值,采用非房室模型分析方法对药代动力学参数进行评价,采用Data Analysis System(DAS 3.0,中国)对药代动力学参数进行分析,计算出以下药代动力学参数:λz,T1/2,Tmax,Cmax,AUC (0-t),AUC(0-∞),MRT(0-t),MRT(0-∞),Vz/F,CLz/F。
2 结果与分析
2.1 特异性 通过对空白血浆基质和添加阿莫西林标准工作液的空白血浆添加样品进行测定,结果如图1、图2所示,血浆内源性杂质不干扰样品的测定,色谱峰保留时间在11.217 min左右,且色谱图中目标化合物的保留时间处没有杂质干扰,药峰与杂质峰分离良好,表明该方法有较好的特异性。
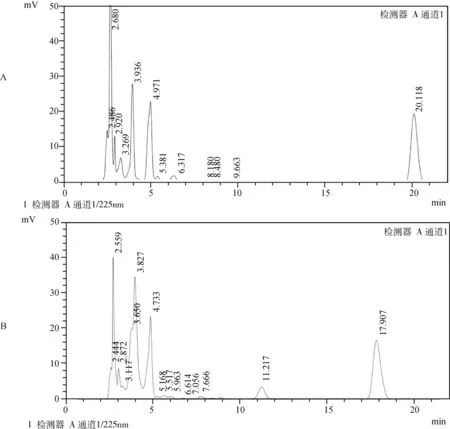
图1 A:猪空白血浆的色谱图;B:猪空白血浆添加阿莫西林标准工作液(100 ng/mL)的色谱图
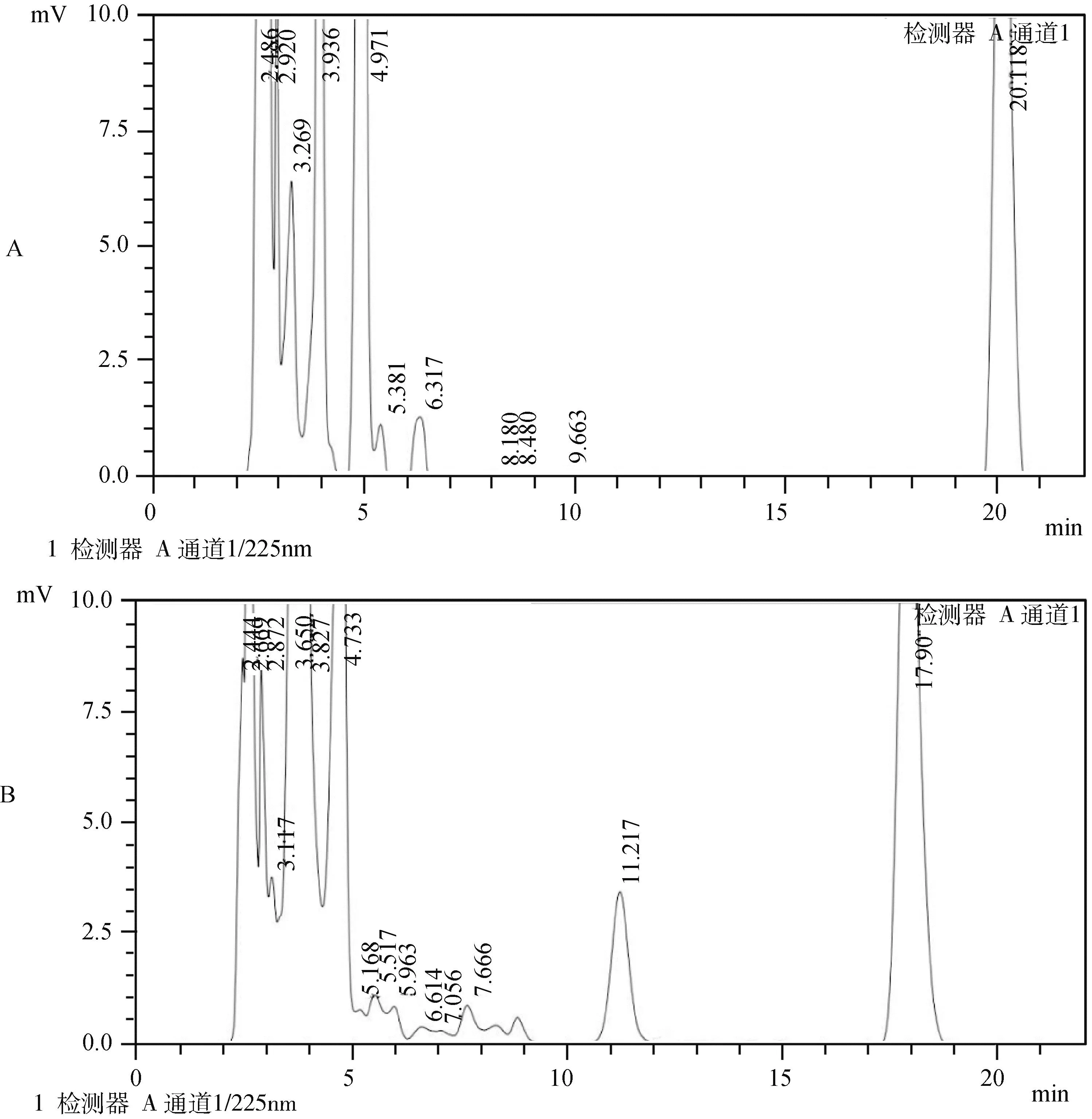
图2 (目标峰放大) A:猪空白血浆的色谱图;B:猪空白血浆添加阿莫西林标准工作液(100 ng/mL)的色谱图
2.2 检测限和定量限 以最低检出浓度计算,S/N≥3时的加标样品浓度为检测限,S/N≥10且具有可接受的准确度和精密度时的加标样品浓度为定量限。本方法中阿莫西林的检测限定为50 ng/mL(信噪比S/N均值为8.80)、定量限为100 ng/mL(信噪比S/N均值为20.16),满足上述要求。
2.3 标准曲线 以测得阿莫西林峰面积为纵坐标,对应药物浓度为横坐标,以1/C为权重系数,绘制标准曲线,求得线性回归方程和相关系数。测得标准曲线如图3所示,线性关系良好f(x)=83.0974x+5072.44,R≥0.9999,符合检测要求。
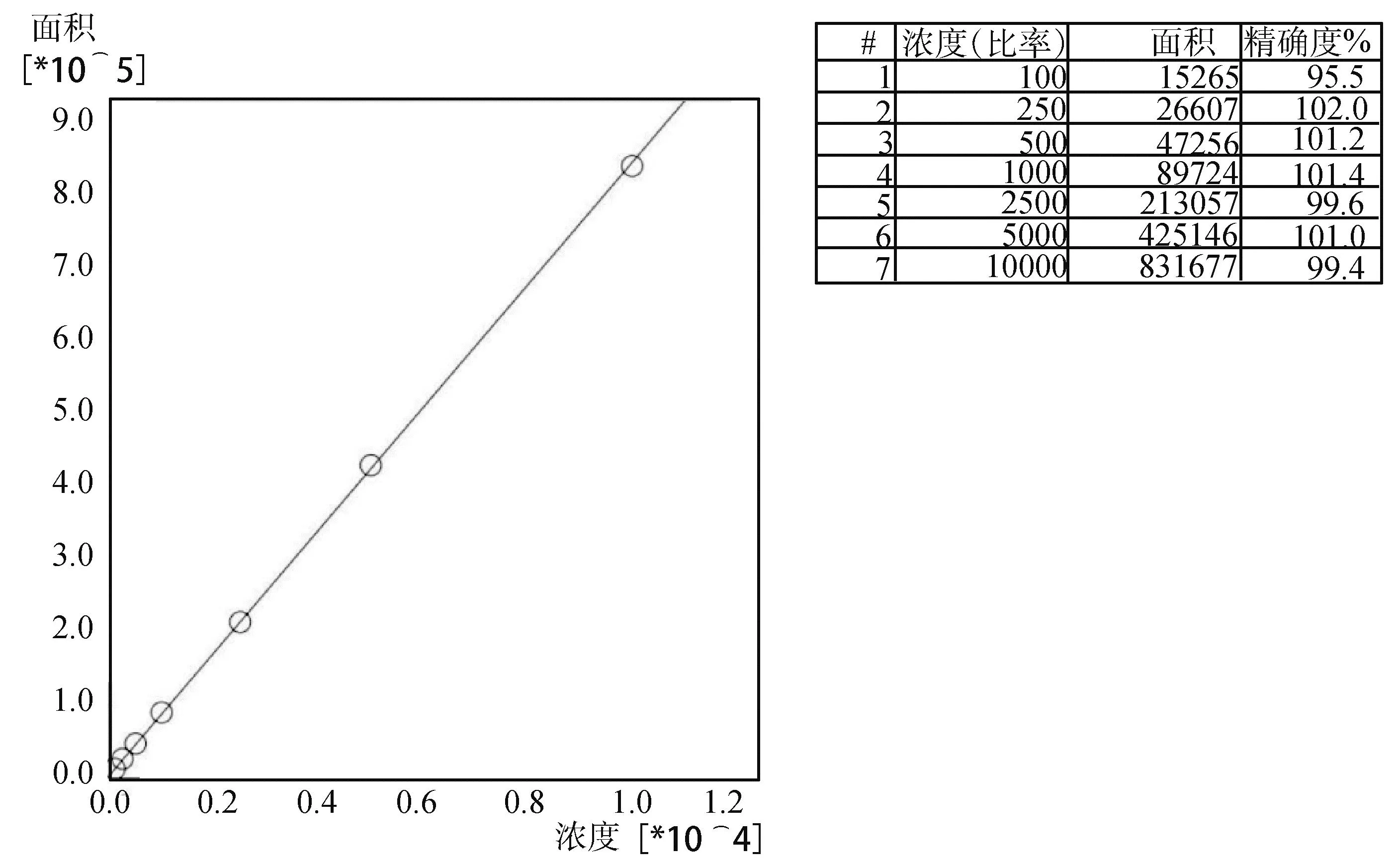
图3 阿莫西林猪血浆基质标准曲线
2.4 准确度和精密度 结果显示,阿莫西林100、250、1000和7500 ng/mL添加浓度回收率分别为88.9%~114.6%、88.3%~97.1%、95.9%~105.0%、91.4%~105.1%;批内变异系数分别为1.22%~3.92%、0.71%~2.76%、0.29%~3.75%、0.88%~3.97%;批间变异系数分别为8.55%、2.68%、2.82%、5.32%。
2.5 基质效应 通过计算基质存在下的峰面积(由空白基质提取后加入分析物测得),与不含基质的相应峰面积(分析物纯溶液)比值,计算每一分析物的基质因子,从6批基质计算的基质因子的变异系数不应大于15%。结果显示:阿莫西林在125、500和3750 ng/mL浓度下几乎无基质效应。
2.6 方法的稳定性试验
2.6.1 样品反复冻融稳定性 按1.5.9.1项方法考察-80 ℃与室温条件下样品反复冻融三次后的稳定性。以现配随行标准曲线进行定量,以检测的未冻融质控样品的平均浓度作为标示浓度考察放置前后待测药物浓度的变化。结果显示:血浆样品在-80 ℃与室温条件下反复冻融3次后,每个浓度的均值与标示浓度的偏差在±15%范围,变异系数均≤7.59。
2.6.2 样品室温放置稳定性 按1.5.9.2项方法考察血浆样品在室温放置0、12 h的稳定性,以现配随行标准曲线进行定量,以0 h检测的质控样品平均浓度作为标示浓度,考察放置前后待测药物浓度的变化。结果显示:血浆样品在室温条件下放置12 h,每个浓度的均值与标示浓度的偏差在±15%范围,变异系数均≤3.00。
2.6.3 样品前处理后进样盘放置稳定性 按1.5.9.3项方法考察样品经前处理后在进样盘放置0、12 h的稳定性。以现配随行标准曲线的进行定量,以0 h检测的质控样品平均浓度作为标示浓度,考察放置前后待测药物浓度的变化。结果显示:血浆样品前处理后,在进样盘放置12 h,每个浓度的均值与标示浓度的偏差在±15%范围,变异系数均≤4.24。
2.6.4 样品前处理后-20 ℃放置稳定性 按1.5.9.4项方法考察血浆样品经前处理后在-20 ℃冰箱放置0、24 h的稳定性,以现配随行标准曲线进行定量,以0 h检测的质控样品平均浓度作为标示浓度,考察放置前后待测药物浓度的变化。结果显示:血浆样品前处理后,在-20 ℃条件下放置24 h,每个浓度的均值与标示浓度的偏差在±15%范围,变异系数均≤8.68。
2.6.5 储备液长期冻存稳定性 按1.5.9.5项方法考察储备液在-80 ℃条件下储存的稳定性,以现配随行标准曲线的进行定量,以0 d 取样检测的质控样品平均浓度作为标示浓度考察放置前后待测药物浓度的变化。结果显示,阿莫西林标准储备液在-80 ℃条件下放置30 d,每个浓度的均值与标示浓度的偏差在±15%范围,变异系数均≤5.19。
2.6.6 样品长期冻存稳定性 按1.5.9.6项方法考察样品在-80 ℃条件下放置后样品的稳定性。以现配随行标准曲线进行定量,以0 d取样检测的质控样品平均浓度作为标示浓度考察放置前后待测药物浓度的变化。结果显示:血浆样品在-80 ℃条件下储存30 d,每个浓度的均值与标示浓度的偏差在±15%范围,变异系数均≤7.53。
2.7 稀释可靠性 按1.5.10项方法考察10倍和100倍稀释对阿莫西林的影响,以现配随行标准样品进行定量。结果显示:用猪空白血浆稀释含阿莫西林的猪血浆样品10倍时平均稀释效应为106.53%,稀释100倍时平均稀释效应为106.41%。
2.8 药代动力学参数结果 猪以20 mg/kg(以阿莫西林计)单次口服阿莫西林可溶性粉和10 mg/kg单次颈静脉注射阿莫西林钠注射液,检测结果使用药代动力学分析软件Data Analysis System的非房室模型处理药-时浓度数据得到主要的药代动力学参数。口服阿莫西林可溶性粉和静脉注射阿莫西林钠注射液在血浆中的药时曲线见图4、图5。
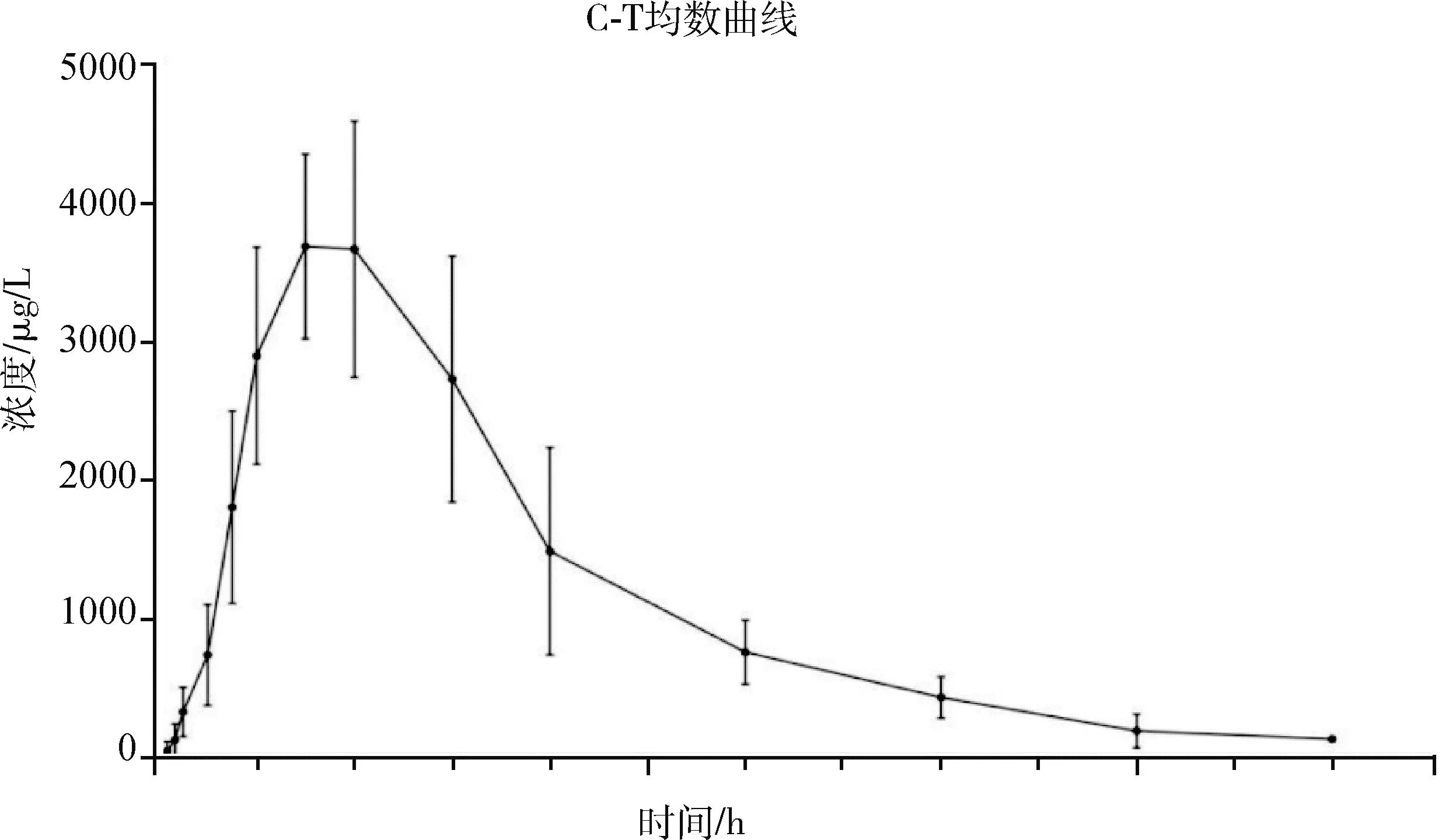
图4 猪口服阿莫西林平均药-时曲线拟合图
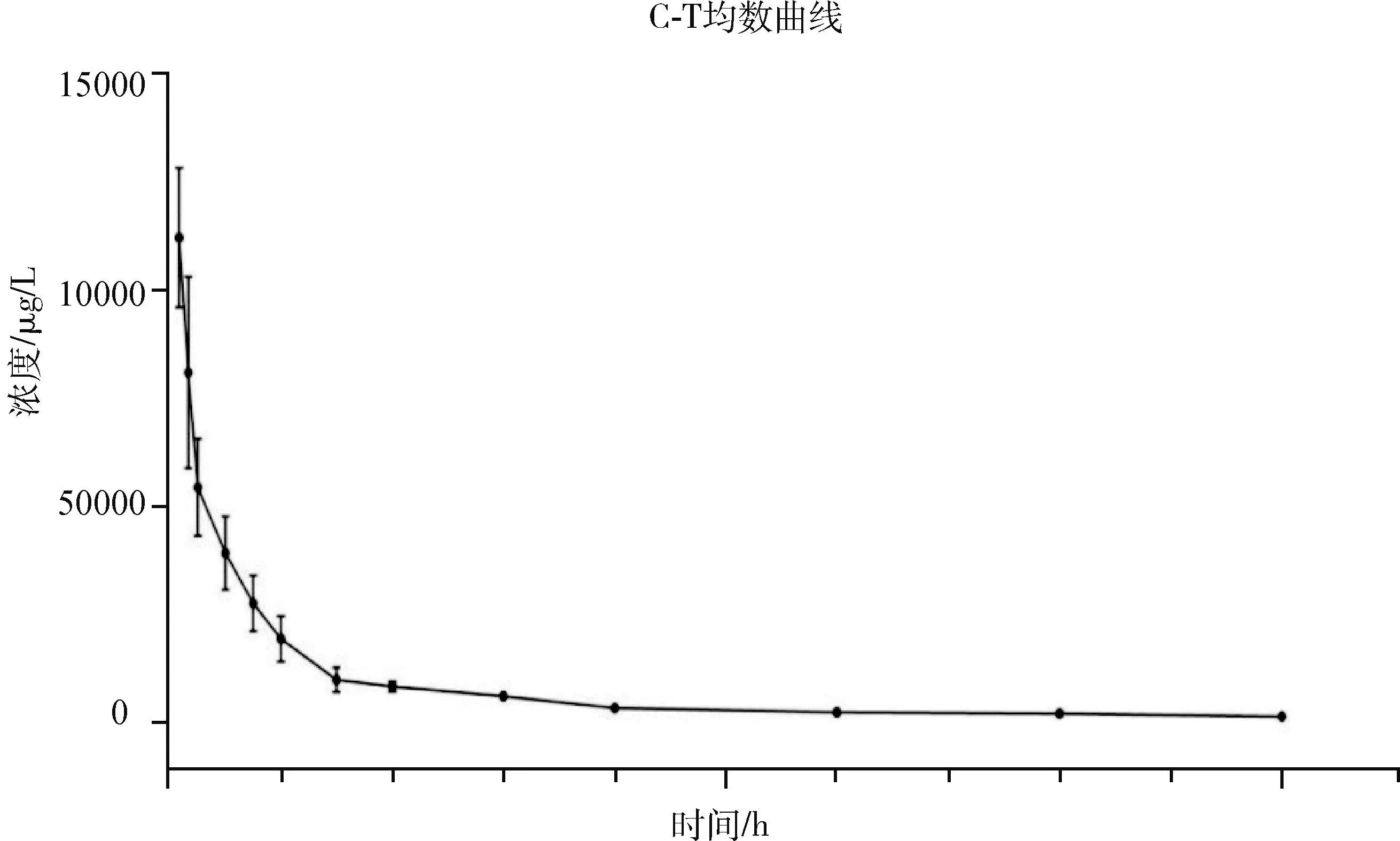
图5 猪静脉注射阿莫西林平均药-时曲线拟合图
口服给药阿莫西林可溶性粉(20 mg/kg B.W.)后,阿莫西林的主要药动学参数为:平均达峰时间Tmax为1.63±0.35 h,药物平均滞留时间MRT(0-t)为3.12±0.41 h,消除半衰期t1/2z为2.48±1.73 h,具有较快的吸收速度,吸收进血液后在体内的停留时间较短,代谢较快。
猪经静脉注射给药(10 mg/kg B.W.)后,平均滞留时间MRT(0-t)为1.54±0.35 h,平均药-时曲线下面积AUC(0-t)为8522.56±1430.51 μg/L×h,消除速率常数λz为0.23±0.12/h,半衰期t1/2z为3.84±2.03 h。说明阿莫西林静脉注射后与口服给药相比半衰期较稍长,消除较慢。
将口服给药的药-时曲线下面积AUC(0-t)与静脉注射给药的药-时曲线下面积AUC(0-t)比较,经公式F=AUC(0-t)P.O./(AUC(0-t)I.V.×2)×100计算阿莫西林受试品的平均绝对生物利用度为79.44%,说明阿莫西林口服给药吸收较好。
口服阿莫西林可溶性粉和静脉注射阿莫西林钠的主要药代动力学参数见表2。
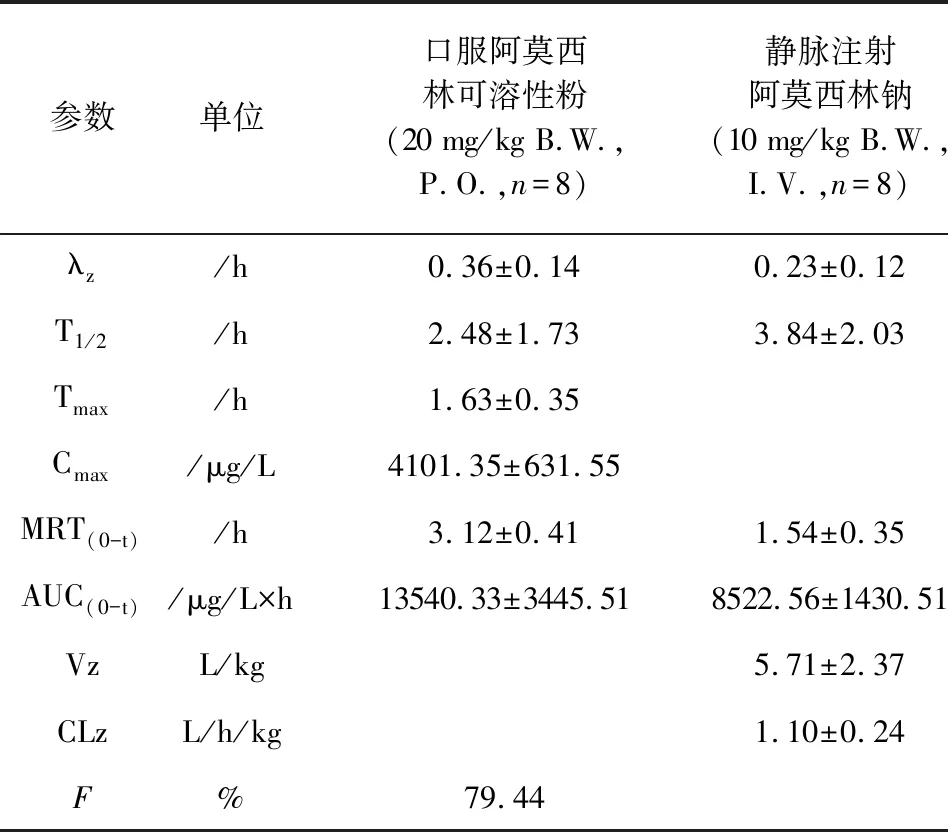
表2 口服阿莫西林可溶性粉药动参数(20 mg/kg B.W.,P.O.,n=8)及静脉注射阿莫西林钠药动参数(10 mg/kg B.W.,I.V.,n=8)
3 讨 论
本试验建立了猪血浆中测定阿莫西林药物的HPLC含量测定方法,该方法具有良好的专属性、准确度和精密度,能很好的满足猪后期血浆样品中血药浓度的测定。实验中空白血浆基质中目标化合物的保留时间附近没有杂质干扰;方法在猪血浆中的检测限为0.05 μg/mL,定量限为0.1 μg/mL;基质标准曲线范围为0.1~10 μg/mL,相关系数>0.9999;阿莫西林100、250、1000、7500 ng/mL添加浓度回收率分别为88.9%~114.6%、88.3%~97.1%、95.9%~105.0%、91.4%~105.1%,批内变异系数均小于3.97%,批间变异系数均小于8.55%;反复冻融3次后待测药物响应值的变异系数均低于7.59%,血浆样品室温放置12 h待测药物响应值的变异系数均低于3.00%,血浆样品前处理后室温放置12 h待测药物响应值的变异系数均低于4.24%,血浆样品前处理后-20 ℃保存24 h待测药物响应值的变异系数均低于8.68%,储备液冻存30 d待测药物响应值的变异系数均低于5.19%,样品冻存30 d待测药物响应值的变异系数均低于7.53%。结果表明,本方法的重复性、灵敏度、特异性、线性范围、准确度、精密度能够满足猪血浆中阿莫西林血药浓度检测要求。
试验研究了阿莫西林可溶性粉在猪体内的药代动力学和生物利用度,阿莫西林可溶性粉口服(20 mg/kg B.W.)给药后,测得MRT(0-t)、Tmax、Cmax、AUC(0-t)、t1/2z分别为3.12±0.41 h、1.63±0.35 h、4101.35±631.55 μg/L、13540.33±3445.51 μg/L×h、2.48±1.73 h。杨洁研究发现猪口服阿莫西林混悬液后主要药动学参数:Tmax为1.38±0.35 h,Cmax为4.69±0.91 μg/mL,AUC(0-t)为13.27±3.63 μg/mL×h,与本研究结果比较接近;t1/2为1.52±0.46 h ,生物利用度为(90.55±16.14)%,与本研究结果比较有所差异,可能与给药剂量、制剂剂型和试验动物品种有关。
猪静脉注射阿莫西林钠(10 mg/kg B.W.)后,具体药代动力学参数:MRT(0-t)、AUC(0-t)、λz、t1/2z、Vz、CLz为分别为1.54±0.35 h,8522.56±1430.51 μg/L×h,0.23±0.12/h,3.84±2.03 h,5.71±2.37 L/kg,1.10±0.24 L/h/kg。曾振灵等研究了健康猪静注阿莫西林钠(10 mg/kg)后,t1/2β为2.29±0.94 h ,Vd为1.06±0.45 L/kg,AUC为31.67±7.09 mg/L×h,与本试验相比,有所不同,可能与动物个体之间的差异、制剂工艺、辅料有关。
按照20 mg/kg的剂量口服阿莫西林可溶性粉,其平均绝对生物利用度为79.44%,吸收程度较好,临床上可考虑多剂量、连续给药来增加药效。
试验研究了阿莫西林可溶性粉在猪体内的药代动力学和生物利用度,药代试验结果表明,阿莫西林可溶性粉经内服给药后,平均绝对生物利用度较高,口服阿莫西林可溶性粉药动学的研究为新药增加靶动物猪的研发及临床试验剂量和休药期的制定提供重要参考。
