电针对干眼兔泪腺细胞凋亡及相关蛋白表达的影响
2024-01-02杨光王雪君刘婕杨延婷张丹刘力卢云琼曹姚佳妮魏邦基马晓芃
杨光,王雪君,刘婕,杨延婷,张丹,刘力,卢云琼,曹姚佳妮,魏邦基,马晓芃,
(1.上海市针灸经络研究所,上海 200030;2.复旦大学附属眼耳鼻喉科医院,上海 200031;3.上海中医药大学附属岳阳中西医结合医院,上海 200437)
干眼是一种临床常见的多因素眼表疾病,可伴有眼表炎症、组织损伤及神经异常[1]。全球干眼患病率为5%~50%[2]。中国干眼患病率为6.1%~59.1%,高于全球平均水平,并呈现逐年上升和低龄化趋势[3]。现代医学治疗轻度干眼常采用人工泪液等治疗手段,对于中、重度干眼患者,可采用局部免疫抑制剂、强脉冲光、泪道栓塞等措施,但疗效有限且存在不良反应[4]。针灸是被广泛接受的一种补充和替代疗法。针刺治疗干眼临床疗效肯定,能显著缓解干眼症状,提高泪液分泌量,增加泪膜稳定性,修复角膜损伤,疗效优于人工泪液[5-6];同时还能改善患者生活健康质量和缓解焦虑情绪[7]。在促进泪液分泌方面电针疗效优于单纯针刺[8]。干眼主要发病机制包括泪膜不稳定、泪液渗透压升高、眼表细胞凋亡和眼表炎症。泪液高渗透压引发的眼表炎症和眼表细胞凋亡是干眼发病的主要原因[9],也可能是针灸治疗干眼的关键靶点[10-11]。因此,本研究通过观察电针对干眼兔泪腺细胞凋亡及凋亡相关蛋白天冬氨酸特异性半胱氨酸蛋白酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)、凋亡相关因子(factor related apoptosis,Fas)和B细胞淋巴瘤-2(b cell lymphoma-2,Bcl-2)表达的影响,从调节细胞凋亡角度探讨电针治疗干眼的作用机制。
1 材料与方法
1.1 实验动物
健康雄性新西兰兔24 只,体质量(2.2±0.2)kg,由上海中医药大学实验动物中心提供。实验开始前,所有动物适应性饲养于室内温度(20±2)℃,相对湿度50%~70%的环境下,接受12 h 光暗周期,自由摄食与饮水。眼表功能检查无异常的动物方可用于实验。本次动物实验所有操作均符合国家科技部颁发的《关于善待动物的指导性意见》[12]。
1.2 主要试剂与仪器
苯扎氯铵(美国sigma 公司,12060);无水乙醇、甲醛、多聚甲醛、二甲苯、中性树胶粘合剂、十二水合磷酸氢二钠、氯化钾、磷酸二氢钾、0.9%氯化钠注射液(国药集团化学试剂有限公司);苏木素-伊红染色液(南京建成生物科技有限公司);DNA 断裂原位末端标记试剂盒(瑞士Roche 有限公司,11772465001);Fas 抗体(美国GeneTex 公司,GTX88349);Caspase-3 抗体(英国Abcam 公司,ab4051);Bcl-2 抗体(美国Abnova 公司,PAB19562);荧光素钠眼科检测试纸、泪液检测滤纸条(天津晶明新技术开发有限公司);毫针(吴江市云龙医疗器械有限公司);裂隙灯显微镜(苏州六六视觉科技股份有限公司);光学显微镜及分析软件(日本OLYMPUS 公司);韩氏电针仪(南京济生医疗器械科技有限公司)。
1.3 模型制备
参考文献[13]方法,采用苯扎氯铵溶液滴眼制备兔干眼模型。造模结束后,通过观察实验兔泪液分泌量、泪膜破裂时间和角膜荧光素钠染色评分,鉴定模型制备是否成功。
1.4 动物分组与处理
24 只新西兰兔采用随机数字表法随机分为正常组、模型组、电针组和假电针组,每组6 只。除正常组外,其余3 组均进行干眼模型制备。在模型制备成功的基础上进行干预。正常组不造模、不干预;模型组造模后不进行任何干预,只做与其他组相同的固定;电针组造模成功后给予电针干预;假电针组造模成功后给予假电针干预。电针组和假电针组取穴均为双侧攒竹、太阳、丝竹空和风池。穴位定位方法参考《实验针灸学》[14]中常用动物穴位定位及相关文献[15]。采用0.20 mm×25 mm 毫针针刺。电针组进针得气后,双侧攒竹和太阳分别连接韩氏电针仪,连续波,频率2 Hz,强度2 mA。假电针组进针透皮即止,双侧攒竹和太阳接韩氏电针仪后不通电。两组均留针20 min,每日1 次,连续干预7 d。在实验过程中假电针组兔死亡1 只,具体死亡原因尚不明确。
1.5 标本采集
采用空气栓塞法处死实验动物,用眼科剪分离其主泪腺,并一分为二。一部分用4%多聚甲醛溶液固定,另一部分液氮速冻后储存于-80 ℃冰箱。
1.6 指标检测
1.6.1 泪液分泌量
实验兔用固定架固定,采用Schirmer Ⅰ test(SⅠT)进行泪液分泌量检测。将泪液检测滤纸条首端于5 mm 处反折,分别置于兔睑结膜囊内约中、外1/3处,计时5 min,取出纸条,观察并记录滤纸湿长[16]。测量3 次,取平均值。
1.6.2 泪膜破裂时间(tear break-up time,TBUT)
用1 滴生理盐水润湿荧光素钠检测试纸,抖去多余液体。轻轻翻开实验兔下眼睑,使试纸顶端轻触下眼睑内侧黏膜,辅助瞬目几次使荧光素钠均匀分布于眼表,末次瞬目后裂隙灯钴蓝光下观察角膜出现第一个黑色干燥斑点的时间,记录TBUT[16]。测量3 次,取平均值。
1.6.3 角膜荧光素钠染色(corneal fluorescein sodium,CFS)评分
TBUT 检测完成后,继续观察角膜荧光素钠染色情况。无染色为0 分,轻度染色(染色少于5 个点)为1 分;中度染色(染色多于5 个点,但未出现块状染色或丝状物)为2 分;重度染色(出现块状染色或丝状物)为3 分。将角膜分成4 个象限分别评分后计算总分,范围为0~12 分[17]。
1.6.4 泪腺组织形态学观察
将4%多聚甲醛溶液固定的泪腺组织进行脱水处理,石蜡包埋,连续切片(6 µm)。脱蜡水化后采用苏木精-伊红染色(hematoxylin-eosin staining,HE)。再依次经梯度乙醇脱水,二甲苯透明,中性树胶封片后在光学显微镜下观察其形态学变化。
1.6.5 泪腺细胞凋亡检测
采用DNA断裂原位末端标记(terminal deoxynucleotidyl transferase mediated dUTPnick-end labeling,TUNEL)法检测,在光学显微镜下观察,凋亡细胞的细胞核被染成棕黄色,正常细胞细胞核呈蓝色。每张切片随机选取5 个视野拍照。采用Image-Plus Pro 软件分析,计算出每张照片的凋亡细胞积分光密度(integrated optical density,IOD),取平均值作为该切片的IOD 值。
1.6.6 泪腺细胞Caspase-3、Fas 和Bcl-2 蛋白表达检测
应用免疫组化法检测。切片经脱蜡至水,修复抗原后,滴加一抗稀释液50 µL,浓度分别为Caspase-3(1:500)、Fas(1:500)、Bcl-2(1:400),湿盒4 ℃冰箱孵育过夜;次日复温后滴加50 µL 二抗稀释液,湿盒37 ℃烤箱孵育1 h;再依次应用DAB 混合液显色,苏木素复染,1%盐酸乙醇溶液分化,梯度乙醇脱水,二甲苯透明后中性树胶封片,在光学显微镜下观察拍片。采用Image-Plus Pro 软件分析,计算IOD 值。
1.7 统计学方法
采用SPSS24.0 软件进行统计分析。符合正态分布的数据采用均数±标准差表示;不符合正态分布的数据,采用中位数(最小值,最大值)表示。组内比较采用配对样本t检验或Wilcoxon符号秩检验。组间比较时,若数据符合正态分布且方差齐,采用单因素方差分析进行检验,两两比较采用Tukey 检验;若数据符合正态分布但方差不齐,则采用Welch 方差分析,两两比较使用Games-Howell 检验;若数据不符合正态分布,则采用Kruskal-WallisH检验,两两比较采用Bonferroni法进行校正。以P<0.05 为差异有统计学意义。
2 结果
2.1 4 组不同时间兔泪液分泌量比较
造模前,各组兔泪液分泌量差异无统计学意义(P>0.05)。造模后,模型组、电针组、假电针组兔泪液分泌量较造模前均明显降低(P<0.05),且低于正常组(P<0.05);模型组、电针组和假电针组组间比较差异均无统计学意义(P>0.05)。干预后组内比较显示,电针组泪液分泌量较造模后显著增加(P<0.05),其余组组内比较差异均无统计学意义(P>0.05)。干预后,与正常组比较,模型组泪液分泌量显著降低(P<0.05);与模型组比较,电针组泪液分泌量显著增加(P<0.05),其余组间比较差异均无统计学意义(P>0.05)。详见图1。
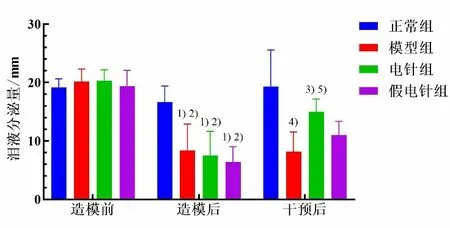
图1 4 组不同时间兔泪液分泌量比较(±s,n=5~6)
2.2 4 组不同时间兔TBUT 比较
造模前,各组兔TBUT 差异无统计学意义(P>0.05)。造模后,模型组、电针组、假电针组兔TBUT较造模前均明显缩短(P<0.05),且短于正常组(P<0.05);模型组、电针组和假电针组组间比较差异无统计学意义(P>0.05)。干预后组内比较显示,模型组TBUT 较造模后显著缩短(P<0.05),电针组TBUT 较造模后显著延长(P<0.05),其余组组内比较差异均无统计学意义(P>0.05)。干预后,模型组、电针组和假电针组TBUT 仍显著短于正常组(P<0.05),且模型组和假电针组TBUT 均显著短于电针组(P<0.05),其余组间比较差异均无统计学意义(P>0.05)。详见图2。
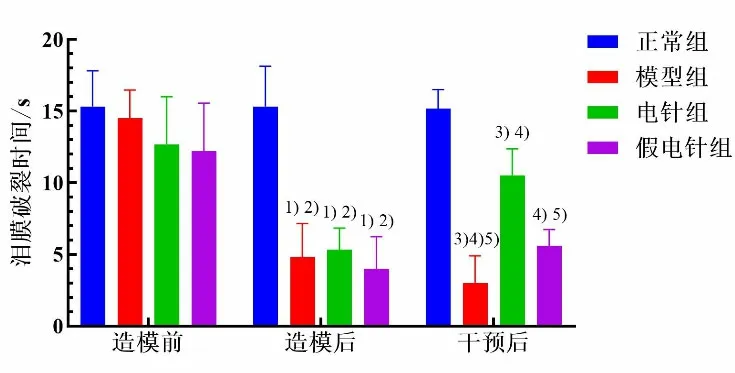
图2 4 组不同时间兔TBUT 比较(±s,n=5~6)
2.3 4 组不同时间兔CFS 评分比较
造模前,各组兔CFS 评分均为0 分。造模后,模型组、电针组、假电针组兔CFS 评分较造模前均明显升高(P<0.05),且高于正常组(P<0.05);模型组、电针组和假电针组组间比较差异无统计学意义(P>0.05)。干预后组内比较显示,电针组CFS 评分较造模后显著降低(P<0.05),其余组组内比较差异均无统计学意义(P>0.05)。干预后,与正常组比较,模型组和假电针组CFS 评分显著升高(P<0.05),且模型组和假电针组CFS 评分均高于电针组(P<0.05),其余组间比较差异均无统计学意义(P>0.05)。详见图3。
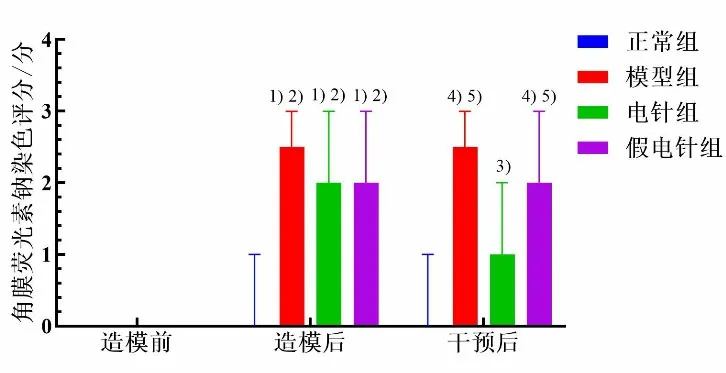
图3 4 组不同时间兔CFS 评分比较(±s,n=5~6)
2.4 4 组兔泪腺组织病理学比较
正常组兔泪腺组织由大小不等的小叶组成,腺泡大小均匀,排列紧密,腺上皮细胞结构完整并呈高柱状,胞浆内富含分泌泡,腺泡腔内可见泡状黏液。与正常组比较,模型组兔泪腺细胞萎缩,排列欠规则,结构不清晰,腔内黏液物质明显减少,小叶间隙增大,结缔组织明显水肿。与模型组比较,电针组兔泪腺病理组织损伤减轻,表现为泪腺结构尚完整,腺上皮细胞形态规则且饱满,腔内可见较多黏液成分,小叶间结缔组织呈轻度水肿,结果提示电针一定程度上改善了泪腺组织损伤修复。与模型组比较,假电针组兔泪腺组织病变差异不显著。详见图4。
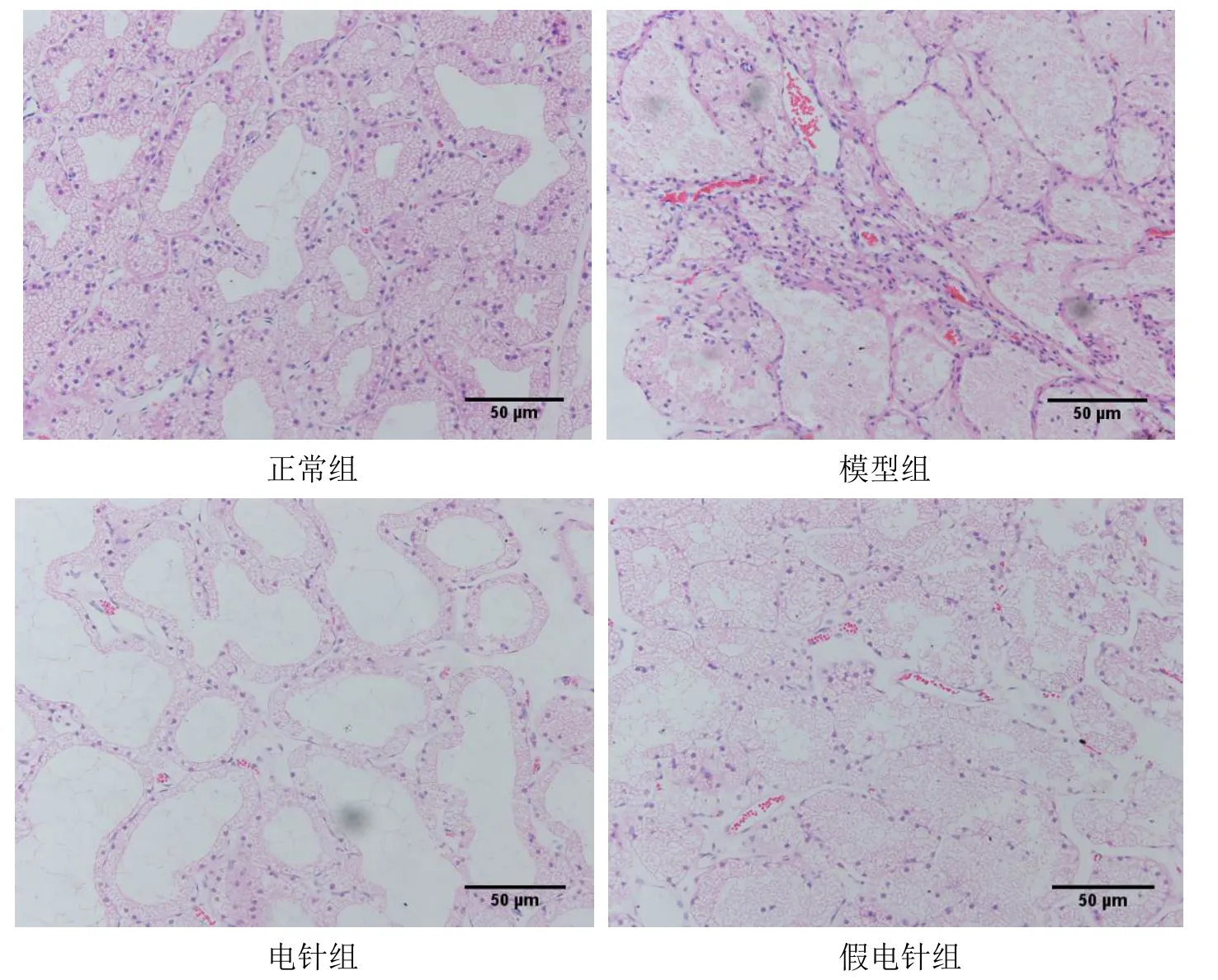
图4 4 组兔泪腺组织病理学比较(HE 染色,×400)
2.5 4 组兔泪腺细胞凋亡TUNEL 染色结果比较
TUNEL 染色结果显示,与正常组比较,模型组兔泪腺细胞排列紊乱,可见散在分布的棕黄色细胞核,并伴有细胞核破裂或染色质浓集,提示凋亡的发生。与正常组比较,模型组兔泪腺细胞凋亡显著增多(P<0.05)。与模型组比较,电针组兔泪腺细胞凋亡显著降低(P<0.05),假电针组差异无统计学意义(P>0.05)。与假电针组比较,电针组泪腺细胞凋亡显著降低(P<0.05)。详见图5 和图6。
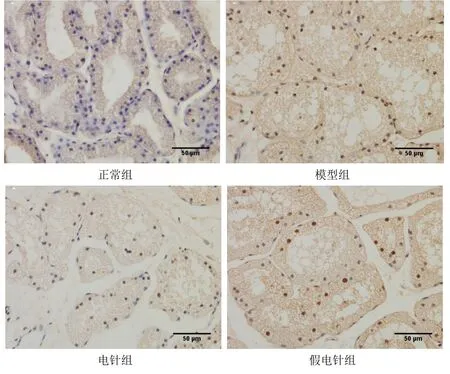
图5 4 组兔泪腺细胞凋亡TUNEL 染色图(×400)
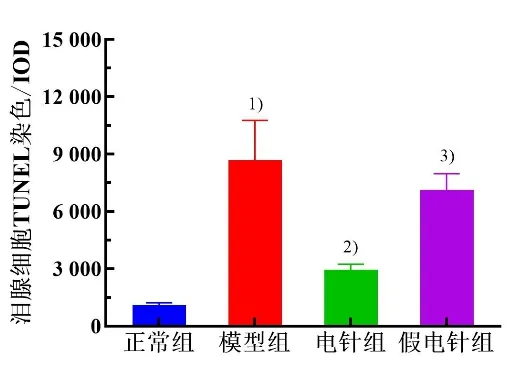
图6 4 组兔泪腺细胞凋亡TUNEL 染色结果比较(±s,n=5~6)
2.6 4 组兔泪腺细胞Caspase-3 蛋白表达比较
Caspase-3 阳性细胞主要在细胞质着色,呈棕褐色颗粒。与正常组比较,模型组兔泪腺细胞Caspase-3蛋白表达均增高(P<0.05)。与模型组比较,电针组泪腺细胞Caspase-3 蛋白表达显著降低(P<0.05),假电针组差异无统计学意义(P>0.05)。与假电针组比较,电针组泪腺细胞Caspase-3 蛋白表达降低(P<0.05)。详见图7 和图8。
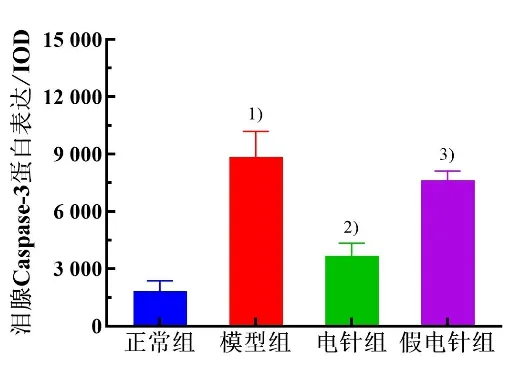
图8 4 组兔泪腺细胞Caspase-3 蛋白表达比较(±s,n=5~6)
2.7 4 组兔泪腺细胞Fas 蛋白表达比较
Fas 阳性细胞主要在细胞膜着色,呈深褐色颗粒。与正常组比较,模型组泪腺细胞Fas 蛋白表达显著增高(P<0.05)。与模型组比较,电针组泪腺细胞Fas 蛋白表达显著降低(P<0.05),假电针组差异无统计学意义(P>0.05)。与假电针组比较,电针组泪腺细胞Fas蛋白表达显著降低(P<0.05)。详见图9 和图10。
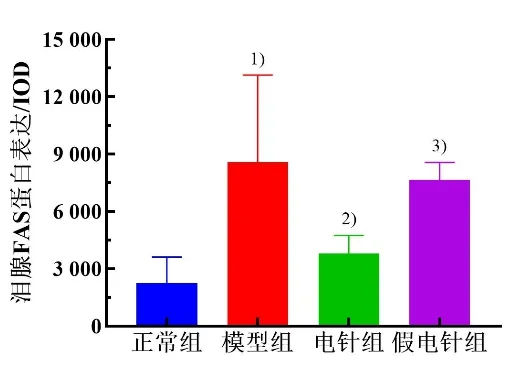
图9 4 组兔泪腺细胞Fas 蛋白表达比较(±s,n=5~6)
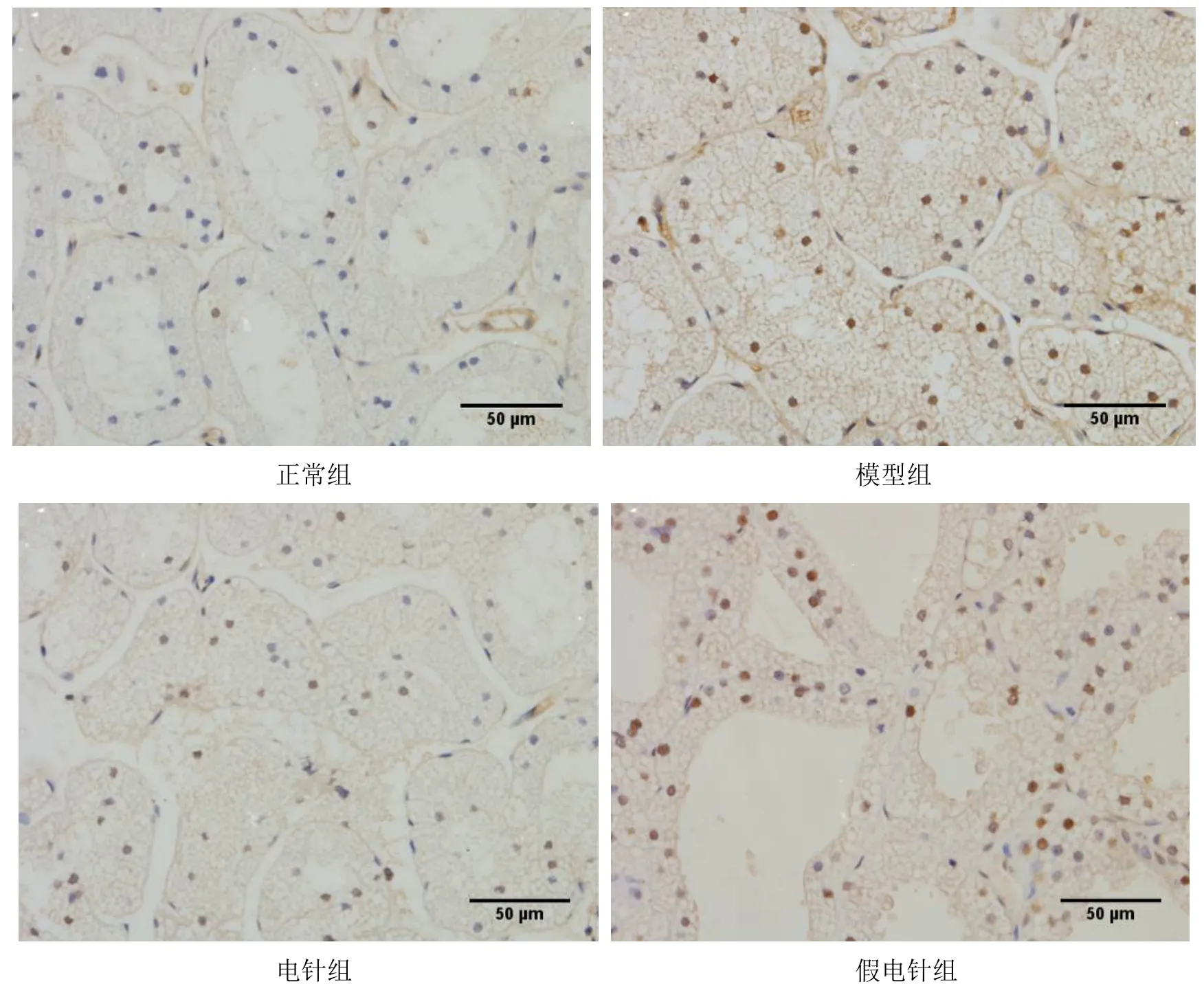
图10 4 组兔泪腺细胞Fas 蛋白表达免疫组化结果(×400)
2.8 4 组兔泪腺细胞Bcl-2 蛋白表达比较
Bcl-2 阳性细胞主要在细胞胞浆着色,呈深褐色颗粒。与正常组比较,模型组泪腺细胞Bcl-2 蛋白表达显著降低(P<0.05)。与模型组比较,电针组泪腺细胞Bcl-2 蛋白表达显著增加(P<0.05),假电针组差异无统计学意义(P>0.05)。与假电针组比较,电针组兔泪腺细胞Bcl-2 蛋白表达显著增加(P<0.05)。详见图11 和图12。
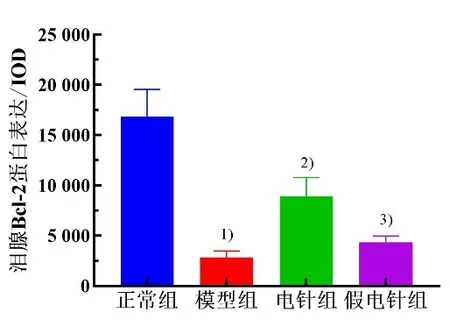
图11 4 组兔泪腺细胞Bcl-2 蛋白表达比较(±s,n=5~6)
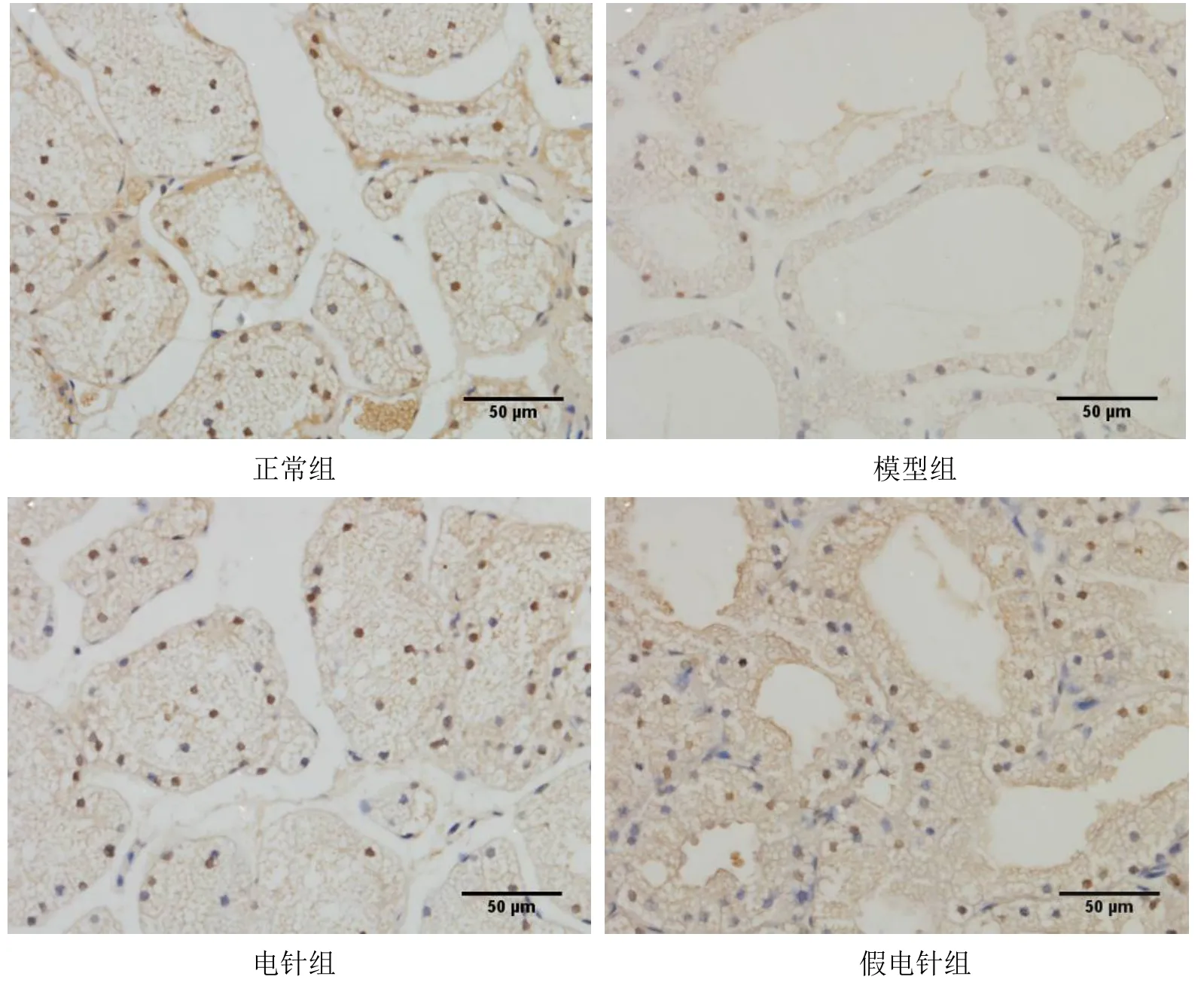
图12 4 组兔泪腺细胞Bcl-2 蛋白表达免疫组化结果(×400)
4 讨论
细胞凋亡又称“程序性细胞死亡”,是细胞在各种刺激下主动死亡的一种模式。生理状态下细胞凋亡保证了机体生命活动和内环境的稳定;病理状态下细胞凋亡失衡是疾病发生发展的重要机制。凋亡细胞清除功能受损或细胞凋亡率增加可导致游离凋亡细胞的继发性坏死,从而诱导促炎细胞因子的分泌;死亡细胞则释放自身抗原引起T细胞活化和B细胞表达,产生自身抗体,引起自身免疫[18]。因此,调控细胞凋亡对疾病的治疗具有重要意义。
细胞凋亡通过两种途径发生,一种是外源性途径,涉及死亡配体与其对应受体间的相互作用;另一种是内源性途径,由DNA 损伤启动,如紫外线和化疗药物。这两种途径均会导致线粒体损伤,释放细胞色素c 并激活下游的执行 Caspase,导致细胞凋亡[19]。Caspase-3 是参与细胞凋亡的Caspase 中重要的执行者,上游激活的起始 Caspase 可通过剪切下游Caspase-3 亚基间的连接使其活化,引起细胞凋亡的特征形态和生化改变,包括膜泡化、细胞皱缩、“凋亡小体”形成和染色体DNA 片段化[20],此为细胞凋亡的中心环节。Fas 作为肿瘤坏死家族受体成员参与诱导细胞凋亡的外源性途径。活化的Fas 可招募Fas 相关死亡域蛋白(fas-associated with death domain protein,FADD),同时FADD 可募集procaspase-8 形成Fas-FADD-procaspase-8 死亡诱导信号复合体,进而启动Caspase 酶级联反应,导致细胞凋亡[21-22]。Bcl-2蛋白家族是细胞凋亡内源性信号通路中主要的调控因子,分为促凋亡和抗凋亡因子。抗凋亡蛋白Bcl-2 可通过Bcl-2 同源3(Bcl-2 homology 3,BH3)结构域与促凋亡蛋白Bcl-2 相关X 蛋白(bcl-2-associated X protein,Bax)、Bcl-2 同源拮抗剂/杀手(bcl-2 homologous antagonist/killer,Bak)结合,抑制促凋亡蛋白的活性和齐聚,从而抑制线粒体外膜通透性,减少细胞色素c的释放和下游Caspase的活化,最终抑制细胞凋亡[23]。
细胞凋亡在多种眼病的病理过程中具有重要作用,其中包括干眼[24-25]。在干眼患者或动物模型角膜、结膜、泪腺细胞中均可观察到细胞凋亡的发生,以及凋亡相关因子的异常表达[9,26-27]。在眼表组织中,泪腺通过分泌泪液,保证眼表湿润,保护眼表上皮细胞免受暴露和物理损伤,并维持上皮内稳态[28]。泪腺功能异常可引起泪膜水液层缺乏,使角膜表面润滑不充分,引发眼表炎症、角膜溃疡和视力丧失[29]。临床研究显示,在干燥综合征和非干燥综合征干眼患者泪腺腺泡细胞中均能观察到Fas 的表达,且凋亡相关因子配体(factor related apoptosis ligand,FasL)的表达与泪液分泌量呈显著负相关,提示泪腺功能与泪腺腺泡细胞凋亡有关,Fas-FasL 相互作用可能是泪腺功能障碍的重要机制[26]。GAO J 等[11]发现与正常泪腺相比,干眼模型犬的泪腺细胞凋亡增加,泪腺组织p53、Fas、FasL 蛋白呈高表达;局部使用环孢素治疗后,泪腺上皮细胞凋亡被抑制,p53 表达明显降低,而Bcl-2 表达升高。在IL-1α诱导的泪腺炎症干眼兔模型中,泪腺氧化应激、炎症、细胞凋亡和纤维化表现均增强;应用左旋肌肽治疗后,模型兔泪腺FasL、干扰素-γ(interferon-γ,IFN-γ)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、转化生长因子-β1(transforming growth factor-β,TGF-β)、丙二醛(malonaldehyde,MDA)和活性氧(reactive oxygen species,ROS)表达均降低,抗氧化生物标志物表达升高,提示泪腺炎症、氧化应激、细胞凋亡和纤维化是干眼发病的重要环节[30]。抑制泪腺细胞凋亡可能是治疗干眼的有效途径,这在中医药领域已得到验证,如密蒙花颗粒[31-33]、润目灵颗粒[34]、养阴润目丸[35]、淫羊藿总黄酮[36-37]、鬼针草[38]、针刺[39-40]治疗后的泪液分泌量、泪膜稳定性和眼表损伤均得到改善,同时能抑制泪腺细胞凋亡。
本研究结果显示,苯扎氯铵诱导的兔干眼模型泪液分泌量减少、泪膜稳定性降低、泪腺病理损伤明显,泪腺细胞凋亡显著增多,Caspase-3 和Fas 蛋白表达显著升高,Bcl-2 蛋白表达显著降低;电针干预后,干眼模型兔眼表功能显著改善,泪腺病理损伤减轻,泪腺细胞凋亡减少,凋亡相关蛋白Caspase-3、Fas 表达降低,Bcl-2 表达增加,提示下调泪腺细胞凋亡相关蛋白Caspase-3 和Fas 表达、上调Bcl-2 表达,抑制泪腺细胞凋亡,进而促进泪腺损伤修复可能是电针改善干眼眼表功能的作用机制。此外,课题组既往研究发现,电针对干眼模型兔结膜细胞凋亡同样具有抑制作用[41]。因此,推测调节眼表细胞凋亡可能是电针治疗干眼的作用机制之一。细胞凋亡是一个复杂的过程,尚需更深入的研究,以明确电针抑制眼表细胞凋亡治疗干眼的具体机制。
