miR-378通过抑制小鼠肝炎症反应改善非酒精性脂肪性肝炎的损伤*
2024-01-02佘明豪杨文辉刘寒松
佘明豪 杨文辉 刘寒松 余 洋 张 磊
(郑州大学附属郑州中心医院,1 普通外科,2 消化内科,郑州 450007)
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)特征为肝脂肪变性和炎症[1]。西方国家NASH的发病率为20%~45%[2-3]。据报道,慢性肝脏炎症被认为是导致NASH发生发展的主要因素[4]。微小RNA(microRNA,miRNA)是具有18~25个核苷酸的RNA,为非编码RNA的一种。有研究显示,肝病患者与正常人群中miRNA表达谱存在显著差异[5]。越来越多的证据表明miRNA在多种生物学过程和许多疾病的发病机制中发挥重要作用,如miR-33a、miR-34a和miR-24已显示出作为NASH发展的因素,有可能成为NASH进展中肝炎的标志物[6]。目前,有研究证实miR-378在引发肝炎和促进肝纤维化中起到重要作用,其可通过核因子κB(nuclear factor κB,NFκB)-肿瘤坏死因子-α(tumor necrosis factor-α,TNFα)信号通路促进肝组织发生炎症甚至纤维化[7]。然而其在NASH中的作用及其机制尚不明确。因此,本研究通过建立NASH小鼠模型组及miR-378干预组,探讨miR-378在NASH发生及发展中的作用及其机制,为NASH的靶向治疗提供理论依据。
1 材料和方法
1.1 实验动物与分组
SPF级健康C57BL/6雄鼠20只,雌鼠20只,8周龄,由北京维通利华实验动物技术有限公司提供,许可证号SCXK (京) 2012-0001、SYXK (辽)-2010-0002。动物饲养在符合GB14925—2010《实验动物环境及设施》有关要求的屏障环境中,12 h/12 h昼夜光照循环,动物室温度 25℃±2 ℃,相对湿度50%±2%,自由进食、饮水。
适应性饲养1周后,将40只C57BL/6小鼠按照体质量随机分为对照组(正常饮食组)、NASH模型组(高脂饮食组)、miR-378抑制剂组(高脂饮食+antagomir-378)、阴性抑制剂组(高脂饮食+antagomir阴性对照)。NASH模型组通过高脂饮食处理8周,其中高脂饮食包含15%的可可脂、1.25%的胆固醇但不含胆酸盐;miR-378抑制剂组及阴性抑制剂组均每周以2 mg/kg的剂量进行尾静脉注射miR-378抑制剂antagomir和antagomir阴性对照溶液,共6周。麻醉处死各组小鼠,取血清和肝组织,-80℃保存。
1.2 主要试剂
cDNA逆转录试剂盒、SYBR®Premix Ex TaqTMⅡ试剂盒(TaKaRa,中国);TRIzol(BBI,中国);抑制剂miR-378 antagomir、阴性对照抑制剂(吉玛吉因,中国);高脂饲料(维通利华,中国)。
1.3 小鼠肝系数测定
乙醚麻醉小鼠,腹主动脉采血后处死,摘取肝,剥去周围结缔组织及脂肪组织,对肝进行称重,计算肝系数。肝系数 (%) =肝湿重 (g) /体质量 (g)×100%
1.4 小鼠肝代谢分析
根据制造商的说明,使用Olympus AU5400自动化学分析仪检测各组小鼠血清肝炎症损伤指标丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)水平。
1.5 小鼠肝组织的病理学检测
每组随机选取3只小鼠的肝,置于4%多聚甲醛固定液中固定,1周后石蜡包埋切片(3 μm),分别采用H-E、油红O、Masson染色试剂盒对各组肝组织进行染色,光学显微镜下观察组织形态。
1.6 免疫荧光检测肝纤维化蛋白的表达
挑选所需组织切片,常规脱蜡,置于封闭液(0.01 mol/L PBS,0.3% Triton X-100,3%山羊血清)1 h,一抗转化生长因子-β(transforming growth factor-β,TGF-β,1∶500 稀释,Abcam 公司,美国)和胶原蛋白1α2(collagen type l α2,Col1α2,1∶1 000 稀释,Abcam 公司,美国),4℃孵育过夜。加入二抗(1∶1 000,Abcam公司,美国),室温、避光、摇床孵育2 h。防淬灭封片剂封片,避光风干,共聚焦显微镜观察、拍片记录。
1.7 肝组织TNF-α、白细胞介素4(interleukin 4,IL-4)、白细胞介素6(interleukin 6,IL-6)、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、TGF-β和Col1α2基因表达的检测
采用总RNA 提取分离试剂盒(TIANGEN,中国)对肝样本进行总RNA的提取,然后将提取的miRNA通过 miRcute miRNA第一链合成试剂盒(TIANGEN,中国)进行cDNA的合成,按逆转录试剂盒反应说明书操作。通过miRcute miRNA荧光定量检测试剂盒(TIANGEN,中国)对miR-378表达量进行检测,内参基因为U6;用SYBR®Premix Ex TaqTMⅡ试剂盒对肝组织TNF-α、IL-4、IL-6、MCP-1、TGF-β和Col1α2 mRNA表达量进行检测,内参基因为GAPDH,依据 2-△△ct计算各miRNA及mRNA的相对表达量。引物序列见表1。
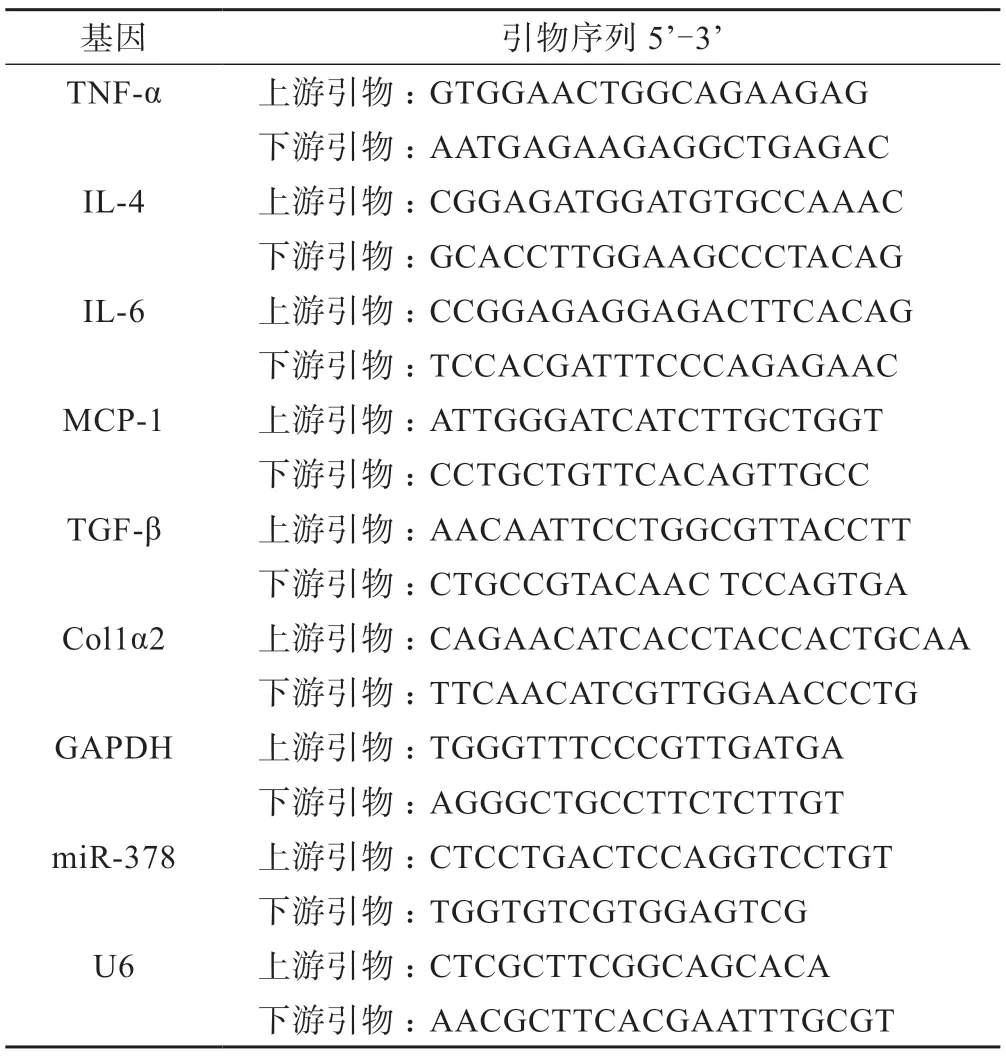
表1 荧光定量PCR引物序列
1.8 统计学处理
采用SPSS 22.0软件进行统计学分析。符合正态分布且方差齐性检验合格后,采用单因素方差分析(one-way ANOVA),与对照组比较采用Dunnett 法分析;不符合则用非参数检验进行分析。检验水准α=0.05。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠肝系数及肝病理学变化
与对照组(0.0518±0.0033)g/100 g比较,NASH模型组(0.0642±0.0012)g/100 g和阴性抑制剂组(0.0594±0.0049)g/100 g的肝系数显著升高;与NASH模型组比较,miR-378抑制剂组(0.0532±0.0024)g/100 g肝系数下降,差异均有统计学意义(P<0.05)。
对照组小鼠肝呈鲜红色,表面光滑且无纤维化及脂肪浸润;NASH模型组肝小叶结构不清,出现明显的肝细胞坏死、脂肪及炎症细胞浸润,且阴性抑制剂组与之相似;然而miR-378抑制剂组肝小叶结构正常,肝细胞排列整齐,脂肪样变已经明显得到缓解(图1)。

图1 各组小鼠肝组织病理学组织形态,标尺=50 μm。A1~D1:H-E染色;A2~D2:Masson染色;A3~D3:油红O染色。A:对照组;B:NASH模型组;C:miR-378抑制剂组;D:阴性抑制剂组.
2.2 各组肝组织miR-378表达比较
与对照组比较,NASH模型组和阴性抑制剂组miR-378表达量明显升高(1.17±0.32比2.13±0.44,1.17±0.32比1.89±0.21),差异有统计学意义(P<0.05);与NASH模型组比较,miR-378抑制剂组miR-378表达量明显下降(2.13±0.44比0.55±0.12),差异有统计学意义(P<0.05)。
2.3 各组血清ALT、AST水平比较
与对照组比较,NASH模型组和阴性抑制剂组ALT和AST含量明显升高;而miR-378抑制剂组与NASH模型组比较,ALT和AST含量出现明显下降,差异均有统计学意义(P<0.05)(图2)。
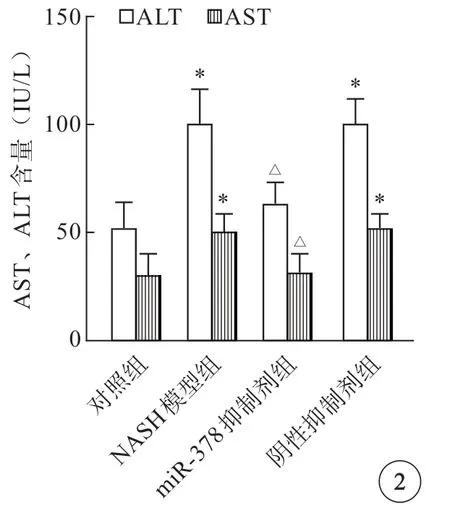
图2 各组小鼠血清中AST和ALT含量比较。*P<0.05 vs 对照组 ;△P<0.05 vs NASH模型组.
2.4 各组肝组织炎症因子表达比较
与对照组比较,NASH模型组和阴性抑制剂组肝组织TNF-α、IL-6 mRNA表达量明显升高,而IL-4明显下降,差异均有统计学意义(P<0.05);而miR-378抑制剂组与NASH模型组比较,TNF-α、IL-6 mRNA表达量明显下降,而IL-4明显上升,差异均有统计学意义(P<0.05)(图3)。
2.5 各组肝组织纤维化基因及蛋白表达水平比较
NASH模型组和阴性抑制剂组与对照组比较,TGF-β和Col1α2 mRNA表达量出现明显升高,而miR-378抑制剂组较NASH模型组明显下降,差异有统计学意义(P<0.05)(图4)。进一步免疫荧光检测结果显示,NASH模型组和阴性模拟物组与对照组比较,TGF-β和Col1α2 蛋白表达量明显升高,而miR-378抑制剂组较NASH模型组明显下降(图5)。
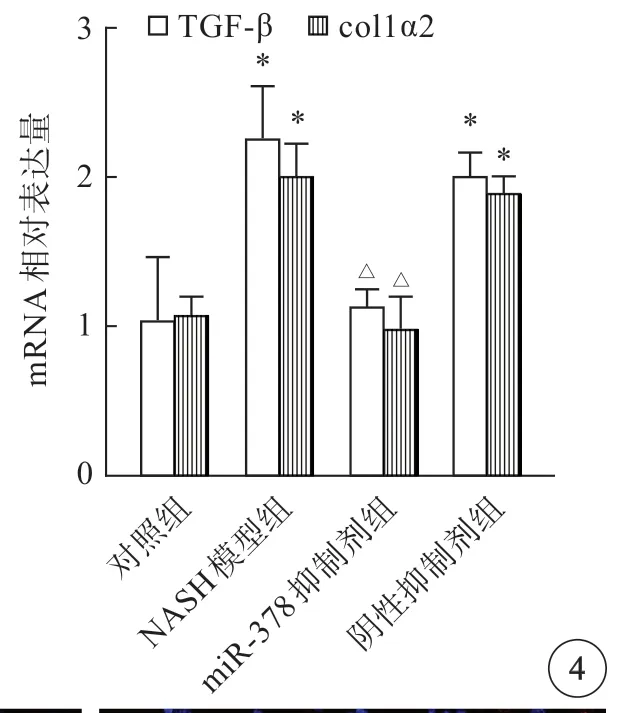
图4 各组小鼠肝组织纤维化基因表达比较。*P<0.05 vs 对照组;△P<0.05 vs NASH模型组.
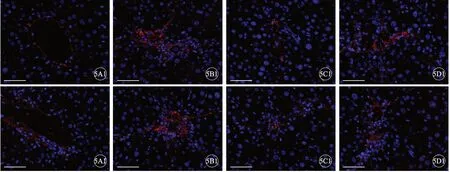
图5 各组小鼠肝组织Col1α2(A1~D1)和TGF-β(A2~D2)免疫荧光表达,标尺=50 μm。A:对照组;B:NASH模型组;C:miR-378抑制剂组;D:阴性抑制剂组.
3 讨论
NASH是一种严重的肝脏疾病,可通过炎症坏死、不同程度的纤维化进而发展成为肝硬化甚至肝癌[6]。越来越多的研究表明,NASH中大量的miRNA表达异常,提示miRNA可能是NASH潜在的生物标志物和治疗靶点[8]。Kim等[9]报道miR-122在非酒精性脂肪性肝炎小鼠血清中显著增加,提示miR-122可能是早期检测肝毒性的潜在敏感生物标志物。Loyer等[10]研究显示miR-21在NASH中上调并抑制过氧化物酶体增长因子活化受体α的表达。尽管越来越多的数据表明miRNA在NASH中扮演重要角色,但NASH中miRNA具体的调控机制及作用靶点尚不明确。
miRNA通过与靶基因不完全互补结合的方式影响靶基因表达,进而发挥其生物学功能[11]。miRNA具有高度保守性及表达特异性等特点,因此其在不同物种间的差异较小,故可能有潜力成为疾病诊断及靶向治疗的分子标志物[12]。目前,有研究证实miR-378在引发肝炎症和促进肝纤维化中起重要作用[7]。本研究通过建立NASH模型,结果显示NASH模型组miR-378的表达量出现明显升高,进一步验证了miR-378在NASH中扮演重要角色。
ALT和AST是反映肝功能的重要指标之一,其含量升高往往是肝功能出现损伤的重要标志[13]。TNF-α、IL-6、MCP-1和IL-4是重要的炎症因子或抗炎因子,是反映肝组织损伤的指标[14-16]。本研究通过组织形态学观察结合生物化学指标及相关因子表达检测miR-378对NASH的作用及是否产生治疗作用进行验证,结果显示TNF-α、IL-6和IL-4在miR-378抑制剂组与NASH模型组比较发生显著改变,然而MCP-1虽有下降趋势但差异无统计学意义,其可能由于治疗时间较短未导致明显改变有关,也可能是MCP-1和其受体C-C趋化因子受体-2相互作用是促进早期肝炎症反应的因子,并且MCP-1在肝中的作用是双重的有关。在损伤反应中,肝细胞和Kupffer细胞分泌MCP-1导致单核细胞和巨噬细胞浸润肝。巨噬细胞分泌TNF-α和干扰素-γ,促进炎症和肝细胞死亡,同时清除坏死细胞,可协助肝重塑和恢复正常肝功能。但相关炎症因子mRNA水平的改变说明miR-378具有治疗NASH炎症的作用。而ALT和AST的含量在miR-378抑制剂组也出现明显下降,且结合病理形态指标,说明低表达miR-378的NASH模型肝损伤出现了明显好转。肝组织纤维化是NASH加重的一项重要指标[8]。因此,本研究进一步探讨miR-378对肝组织纤维化的影响。结果显示,miR-378抑制剂组与NASH模型组比较,TGF-β和Col1α2 mRNA表达量出现明显下降。TGF-β 和Col1α2 是肝组织纤维化中2个重要的相关因子,提示抑制miR-378能够延缓甚至逆转纤维化的进程,与Zhang等[7]的研究相似。
综上所述,本研究结果表明miR-378是NASH的危险因素,抑制miR-378的表达能够有效减缓NASH小鼠肝组织纤维化的进程,进而减缓或阻断其进展为肝硬化的可能。
