散结片对肝癌大鼠巨噬细胞极化及MAPK/JNK信号通路的作用机制*
2024-01-02徐振华李金芳
张 远 董 晶 国 滨△ 徐振华 时 桢 李金芳
(1 广州中医药大学金沙洲医院,广州 510080;2 寿光市人民医院肿瘤放疗科,寿光 262700;3 贵州医科大学附属医院,贵阳 550004)
肝癌病因相对较多,目前除与最常见的肝硬化、病毒性肝炎等原因所导致的肝纤维化和硬化有关,还有研究证实其与炎症及免疫系统紊乱密切相关,而巨噬细胞在其中扮演重要的角色[1-2]。巨噬细胞是一类天然的免疫细胞,具有强大的起源及功能异质性,一般可通过极化转变自身功能及角色从而发挥作用,其通常可极化为M1型经典活化巨噬细胞及M2型替代性活化巨噬细胞,M1型巨噬细胞可参与炎症反应,抑制肿瘤免疫逃逸及自身生长,M2型巨噬细胞可促进肿瘤的增殖、侵袭、转移及新生血管的生成[3]。近年来有研究表明,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/氨基末端激酶(Jun N-terminal kinase,JNK)信号通路可参与生长发育、增殖分化、凋亡等多种细胞生理过程的调节,同时有研究表明,该信号通路的转导异常可能在肝癌的发生、发展中发挥重要作用[4-5]。中医治疗肝癌具有广阔的前景[6]。而散结片是我院根据多年临床经验改进而成的中药抗癌新药,共凑白鲜皮、海藻、白附子、牛黄等多种中药材,具有活血化瘀、清热解毒、软坚散结之功效,且疗效已经得到证实,尤其是对中、晚期肝癌疗效显著[7]。但其具体的作用机制目前尚未明确,因此,本研究就MAPK/JNK信号通路在散结片对大鼠肝癌抑制及巨噬细胞极化的作用机制进行探讨,为临床治疗肝癌提供理论基础。
1 材料和方法
1.1 实验动物
本实验选取广东省医学实验动物中心提供的40只SPF级SD雄性大鼠,大鼠为裸鼠(合格证书为:SCXK(粤)2019-0017),平均体质量15~25 g,大鼠单笼喂养,室温生长,模仿12 h昼夜交替,在常温下进行无菌自由进食、饮水2周,按照《实验动物管理条例》规定进行实验。
1.2 仪器与试剂
肝癌细胞(深圳豪地华拓有限公司);索拉非尼(规格:200 mg/片,秘鲁利马秘鲁巅峰药业有限公司);散结片(本院中医部熬制);SP600125(美国MedChemExpress LLC公司);CD11c抗体(上海科敏有限公司);CD163抗体(北京义翘神州股份有限公司);全蛋白抽提试剂盒(江苏凯基有限公司);SDS-PAGE凝胶电泳试剂盒(江苏凯基有限公司);ECL检测试剂盒(江苏凯基有限公司);p38MAPK抗体(上海彩佑实业有限公司);JNK抗体(武汉菲恩有限公司);甘油醛-3-磷酸脱氢酶(GAPDH)抗体(美国Proteintech公司)。
1.3 实验分组与模型制备
40只SPF级SD雄性大鼠,随机分为正常组、模型组、索拉非尼组、散结片组,每组10只。对模型组、索拉非尼组、散结片组进行肝癌建模,向各组大鼠的肝叶注射0.5 mL的1×107个/ mL的肝癌细胞悬液,10 d后若超声观察到出现肿瘤组织块,则视为建模成功;正常组不建立该模型,同期给予同体积生理盐水。建模成功后,对索拉非尼组灌胃68 mg/kg的索拉非尼,对散结片组灌胃12.5 g/kg的散结片,2组均1次/天,持续28 d,每隔4 d记录大鼠死亡数量,正常组、模型组同期以同体积生理盐水灌胃。
另取20只大鼠,建模后随机分为2组,一组给予灌胃50 mg/kg的JNK抑制剂SP600125,记为抑制剂组,另一组给予罗格列酮联合益气活血冲剂,记为联合组。
1.4 标本采集
各组大鼠在实验结束后使其安乐死,分离肿瘤组织,生理盐水洗净后称重,并对其长径及短径进行测量(肿瘤体积=长径×短径×短径/2),同时取大鼠肝组织,用4%多聚甲醛固定96 h,进行常规石蜡包埋、切片处理,处理完成后放入冰箱中密封保存。
1.5 大鼠肝组织的H-E染色
取部分肝组织,二甲苯浸泡15 min,梯度乙醇各浸泡3 min以进行脱水,用苏木精-伊红染液进行H-E染色,染色完成后除去多余染液,用梯度乙醇进行脱水、二甲苯透明后,用中性树胶封片,然后用光学显微镜进行组织病理学观察。
1.6 巨噬细胞CD11c、CD163免疫组织化学显色
取各组肝组织切片,进行脱蜡、水化处理,用蒸馏水浸泡2 min后,将切片放入预热的柠檬酸盐缓冲液中,用微波炉进行组织抗原修复,修复完成后加入3% H2O2灭活内源性过氧化物酶,温室孵育10 min,10%山羊血清封闭2 h,加入CD11c、CD163的一抗(1∶100),4℃过夜,PBS洗涤,加入生物素标记的二抗及辣根过氧化物酶标记的链霉卵白素,37℃孵育30 min,PBS洗涤,DAB显色,苏木精复染,乙醇梯度脱水,二甲苯透明,中性树胶封片,在光学显微镜下观察结果。
1.7 免疫印迹法检测p38MAPK、JNK蛋白的表达
取各组肝组织,剪碎后加入1 mL RIPA裂解液于冰上充分裂解10 min,在4℃、12 000 r/min的条件下离心15 min,取上清液,用BCA法测定蛋白浓度,常规转膜、封闭,加入p38MAPK、JNK一抗(1∶1 000),4 ℃摇床振荡孵育过夜,PBS洗涤后加入二抗(1∶5 000),37 ℃轻摇室温孵育2 h;PBS洗涤后用ECL荧光试剂盒测定结果,计算与GAPDH比值求得p38MAPK、JNK蛋白的相对表达含量。
1.8 统计学处理
应用GraphPad Prism 8.0对各组大鼠巨噬细胞标志蛋白及MAPK/JNK蛋白表达进行统计分析,KaPlan-Meier法绘制各组生存曲线,组间比较采用t检验、χ2检验,多组间比较采用单因素方差分析,用F表示,计量资料描述采用±s表示,P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠生存和肿瘤生长
与正常组比较,模型组大鼠死亡数量明显增多(P<0.05),生存曲线明显降低(P<0.05);与模型组比较,索拉非尼组、散结片组死亡数量显著减少(P<0.05),生存曲线显著升高(P<0.05),且散结片组比索拉非尼组变化显著(P<0.05)(图1)。
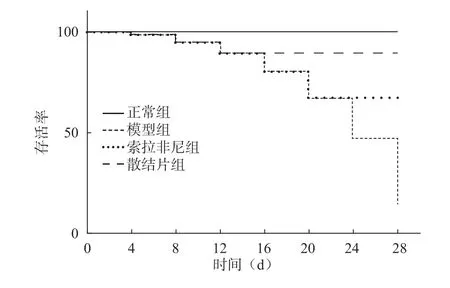
图1 各组大鼠生存曲线
与模型组比较,索拉非尼组大鼠肿瘤质量及体积均显著降低(P<0.05);与索拉非尼组比较,散结片组大鼠肿瘤质量及体积显著降低(P<0.05)(图2)。
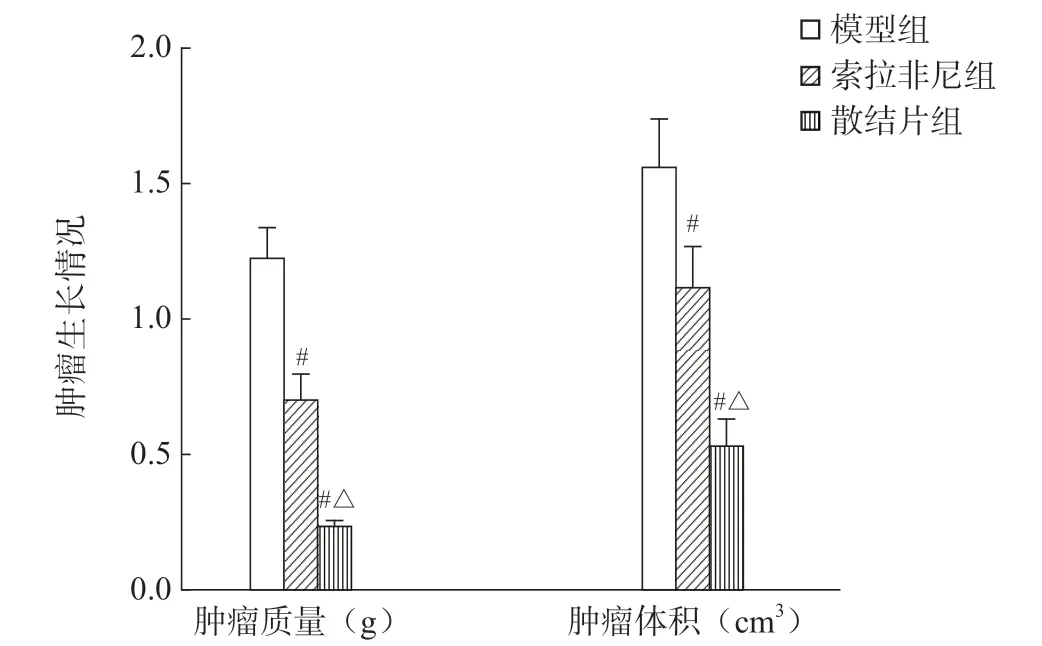
图2 各组大鼠肿瘤生长情况
2.2 各组大鼠肝组织H-E染色结果
正常组大鼠肝细胞结构正常、形态良好,肝小叶、肝小梁、肝血窦结构清晰完整且排列有序,未见明显纤维组织增生及炎性细胞浸润;而模型组可见明显肿瘤病灶,大部分肝小叶被肿瘤组织代替,且癌变细胞已深染,成空泡样变,可见纤维组织增生及大量炎症细胞浸润;与模型组相比,索拉非尼组、散结片组症状明显改善,癌变细胞数量明显减少,且散结片组比索拉非尼组改善明显(图3)。

图3 各组大鼠肝组织结构H-E染色,标尺=25 μm。A:正常组;B:模型组;C:索拉非尼组;D:散结片组.
2.3 各组大鼠肝组织中巨噬细胞的极化
与正常组比较,模型组肝组织中CD11c显著降低(P<0.05),CD163蛋白表达显著升高(P<0.05);与模型组比较,索拉非尼组、散结片组肝组织中CD11c显著升高(P<0.05),CD163蛋白表达显著降低(P<0.05),且散结片组比索拉非尼组变化显著(P<0.05)(图4)。
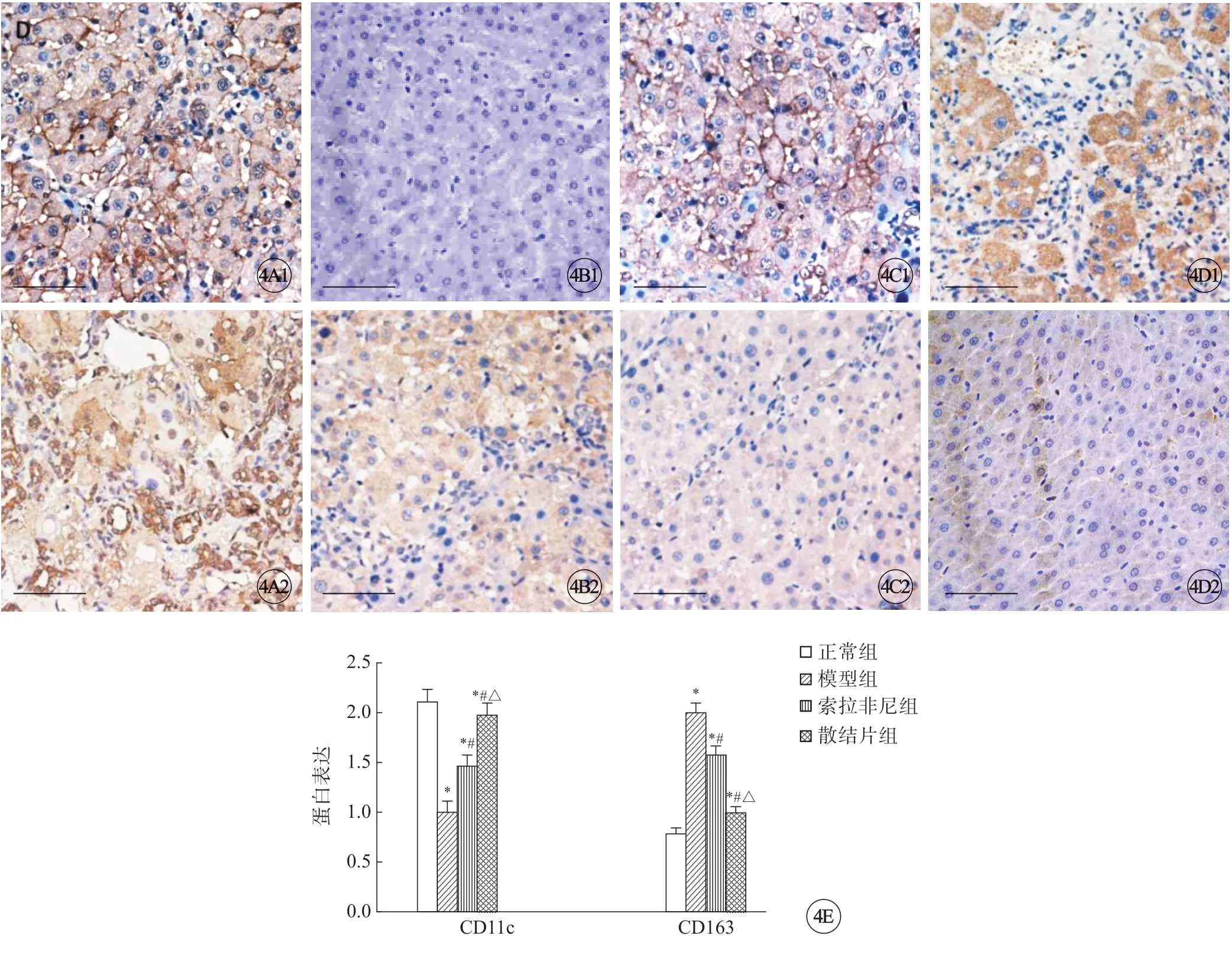
图4 各组大鼠肝组织中CD11c(A1~D1)、CD163(A2~D2)的阳性表达,标尺=25 μm。A:正常组;B:模型组;C:索拉非尼组;D:散结片组;E:各组大鼠肝组织中CD11c、CD163的蛋白表达比较。*P<0.05 vs正常组;#P<0.05 vs模型组;△P<0.05 vs索拉非尼组.
2.4 各组大鼠肝组织中MAPK/JNK信号通路相关蛋白的表达
与正常组比较,模型组肝组织中p38MAPK、JNK蛋白表达显著升高(P<0.05);与模型组比较,索拉非尼组、散结片组、抑制剂组、联合组肝组织中p38MAPK、JNK蛋白表达显著降低(P<0.05),且散结片组比索拉非尼组降低显著(P<0.05),而抑制剂组与散结片组相比差异无统计学意义(P>0.05),联合组比抑制剂组明显降低(P<0.05)(图5)。

图5 各组大鼠肝组织中的p38MAPK、JNK蛋白表达
3 讨论
肝癌是常见的消化系统恶性肿瘤,其早期由于病情隐匿,待患者确诊时多数都已到中晚期,使得其治疗效果及预后极差,从而导致该病已经成为我国恶性肿瘤的第2号杀手[8]。目前现代医学在治疗肝癌方面占据主导地位,但中医药在肿瘤治疗中同样不可小觑,中药具有促进癌细胞凋亡、抑制癌细胞转移、提高机体免疫功能等多个优势,因此对于中医药靶向治疗肝癌的机制也是我们未来发展的方向[9]。
本研究结果显示,散结片可显著改善肝癌大鼠病理形态,提高大鼠生存率,并有效降低大鼠肿瘤质量与体积,这说明其具有很好的疗效,可显著抑制大鼠肿瘤生长。索拉菲尼是一种新型多靶向性治疗肿瘤的药物,属于小分子蛋白激酶抑制剂,其在血管新生中发挥着重要作用,同时是目前唯一被FDA批准用于治疗晚期肝癌的靶向药物,因此本研究用其作为对照组[10]。散结片是我院根据中医理论及多年临床实践经验研制而成,经过多年实验研究已证实其对肝癌细胞有显著的杀伤力及抑制作用[11]。肝癌在中医中属于“鼓胀”“肝积”“心积”等范畴,其主要由正气不足、气滞血疲、痰湿互结、癌毒稽留、湿热蕴结所致,故中医治疗肝癌多侧重于扶正培本、活血化瘀、清热解毒、软坚散结[12]。而对于肝癌大鼠,散结片可能是通过活血化瘀、软坚散结等功效,来化痰解毒、扶助正气、补气养血、祛邪逐癖,从而调节机体阴阳平衡、增强机体免疫力、改善局部微循环,进而抑制原癌基因、促进抑癌基因、抑制癌细胞的核酸与蛋白质合成,抑制过氧化脂质的形成、促进受损黏膜修复等,最终达到抑制肿瘤组织生长、改善患者症状、提高生存率的目的。肖正明等[13]研究显示,散结片具有显著抑瘤作用,可显著提高淋巴细胞及吞噬细胞活性,这与本研究结果类似。
本研究结果还显示,散结片可显著升高大鼠肝组织中CD11c蛋白表达,降低CD163表达,说明其可诱导巨噬细胞向M1极化,抑制M2极化。已有证据表明,炎症是绝大多数癌症的发病根源及后果,其不充分或不完全消退是导致疾病出现的主要原因,肝癌同样如此,而其中与炎症反应息息相关的巨噬细胞在癌症的发生、发展中占有不可忽视的地位[14]。有研究表明,肿瘤浸润巨噬细胞为M2样表型,M2型巨噬细胞可介导免疫抑制的形成,从而促进肝癌细胞的生长及转移,因此如何抑制巨噬细胞向M2型极化一直是肿瘤治疗领域的研究热点[15]。而CD11c和CD163分别是M1型及M2型特异型标志物,通过对其表达的检测,可明确巨噬细胞极化情况[16]。对于肝癌大鼠,散结片可能是通过影响肿瘤细胞释放细胞因子,破坏肿瘤微环境的平衡,从而抑制巨噬细胞聚集、浸润、抑制多种炎性相关通路的激活,进而达到调节机体免疫系统、抑制免疫炎症反应的目的,最终有效改善疾病症状,提高机体免疫力。吴婧婧等[17]研究表明,随着肝癌进展,M2型巨噬细胞相关蛋白表达显著升高,说明其可能促进肝癌进展,这与本研究结果类似。
本研究结果显示,散结片可有效抑制MAPK/JNK信号通路激活。中医认为包括肝癌在内的肿瘤的发生均可归纳为两大类因素,即内源性及外源性因素,这些致肿瘤的内、外因素都可能引发机体细胞分化异常、细胞凋亡障碍、信号转导通路异常等,最终导致肝癌的发生[18]。而MAPK所在通路是信号从细胞表面到细胞核内部一条重要的传递途径,p38MAPK、JNK均是该家族的重要成员,其中p38MAPK被认为是介导炎症所致多种细胞反应中最重要的激酶,JNK则在细胞因子及应激诱导的细胞凋亡过程中起着关键作用[19]。而对于肝癌大鼠,散结片可能是通过抑制病毒与宿主肝细胞内的某些基因序列发生整合,来抑制MAPK信号通路异常活化,从而影响表观遗传、有效调节细胞周期,进而抑制肝癌细胞生长、诱导肝癌细胞凋亡、促进肝癌细胞分化、抑制肿瘤血管生成等,最终使肿瘤组织停止生长,改善疾病症状。Gao等[20]研究表明,多耐药肝癌细胞中,p38MAPK、JNK的蛋白升高,经过治疗后的表达显著降低,这与本研究结果类似。
综上所述,散结片可能是通过抑制MAPK/JNK信号通路,抑制巨噬细胞向M2型极化,促进其向M1型极化,进而抑制肝癌大鼠肿瘤生长。但本研究还存在一定局限性,如样本量小,未单独进行药物对大鼠生存情况的影响等,在今后的实验中将继续深入研究,以期为临床提供更多的诊疗依据。
