小江不同食性鱼类氮磷排泄及其对养分循环的影响
2024-01-01唐海滨张三峰朱利明邹曦史方杨晴胡莲朱稳时玉龙李博






摘要:探究小江流域不同食性鱼类排泄对初级生产养分循环的作用,为三峡库区支流鱼类群落调控及养分再循环提供理论参考。2019年在小江设置5个断面对水质、浮游物、鱼类进行监测和采样,并选取小江4种典型食性鱼类,即滤食性鱼类鳙、草食性鱼类草鱼、杂食性鱼类鲫和肉食性鱼类黄颡鱼,分析其氮磷排泄率的差异及其与温度的关系,通过模型反演估算不同食性鱼类排泄对小江藻类初级生产的贡献。结果表明:(1)滤食性鱼类氮排泄率最高,滤食性鱼类和肉食性鱼类磷排泄率相对较高;(2)不同食性鱼类氮磷排泄率随水温升高均有所增大,且杂食性鱼类氮排泄率受水温变化影响最大,而草食性鱼类磷排泄率受水温变化影响最小;(3)小江鱼类总生物量约11.08 t,氮、磷排泄率分别为16.92、2.11 ng/(L·d);(4)小江鱼类氮磷排泄对藻类养分循环贡献均较小,分别占初级生产力所需氮、磷含量的0.015%和0.022%;(5)在4种食性鱼类中,肉食性鱼类对初级生产力的贡献率最高。
关键词:鱼类食性;排泄率;初级生产;养分循环;小江;三峡库区
中图分类号:Q178.1" " " " 文献标志码:A" " " " 文章编号:1674-3075(2024)05-0076-09
鱼类作为水生态系统重要消费者,在水体营养盐养分循环中扮演着重要作用(Menezes et al,2010)。一方面,鱼类可以通过摄食作用吸收水中营养盐,并转化储存于体内(Zimmer et al,2006;Vanni et al,2013);另一方面,鱼类还会排泄释放营养盐,使氮磷重新进入水体,改变水体营养状态,影响其他水生生物群落,促进水体营养盐再循环(Capps et al,2015)。有研究表明,投放滤食性鱼类可有效控制水体营养盐含量,鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys nobilis)的捕食可快速降低水中浮游植物的生物量,控制藻类暴发,并将营养盐固定到鱼类组织中,由于鱼类氮磷周转率往往较长,从而减缓营养盐在水体中的迁移转化过程(Griffiths,2006;Zhang et al,2009)。也有学者认为,鱼类会加速水体中营养物再生过程,因为鱼类排泄物中的营养盐主要为生物利用率较高的溶解性氨态氮和正磷酸盐,进入水体后极易被藻类再次吸收,进而增加浮游植物的生物量(Susana,2004;Hillebrand et al,2008)。
国内外研究者进一步研究了鱼类排泄对藻类初级生产的影响。Schaus等(1997)研究发现,鱼类氮磷排泄可以成为水体营养盐的重要来源,特别是在其他营养来源减少时,磷排泄量可达到藻类需求量的36%。Zimmer等(2006)通过排泄物和藻类磷需求评估的比较发现,4个湿地生态系统中有2个系统鱼类营养盐排泄量超标。在梯级水库的研究结果显示,斑鰶(Konosirus punctatus)排泄能显著增加湖泊生产力,对初级生产的贡献率达18%(Vanni,2006)。对富营养化湖泊的长期监测发现,鱼类生长季节氮排泄量对水体营养盐的供给率超过流域氮磷负荷,且会对藻类生物量和群落组成产生强烈影响(Williamson et al,2018)。在生态养殖模式和非经典生物操纵理论背景下,国内有关滤食性鱼类排泄研究相对较多。李培培(2012)在千岛湖鲢、鳙养分驱动循环研究中发现,鲢鳙排泄氮磷含量占藻类初级生产所需含量的比例低于1%,即所采用的生态养殖模式对千岛湖初级生产影响较少,不会加剧水体富营养化。在长寿湖研究中,滤食性鱼类氮磷的排泄虽然会向水体释放营养盐,促进水体氮磷的再循环,但不是引起初级生长量增加的主要原因(李晓洁等,2018)。
目前,有关滤食性鱼类的报道相对较多,且研究区域多以湖、库为主,而关于不同食性鱼类氮磷排泄率以及鱼类排泄对河流初级生产养分循环驱动的研究相对较少。本研究以三峡库区典型支流小江为对象,在小江鱼类资源调查基础上,选取滤食性鱼类鳙、草食性鱼类草鱼(Ctenopharyngodon idella)、杂食性鱼类鲫(Carassius auratus)和肉食性鱼类黄颡鱼(Pelteobagrus fulvidraco)等4种不同食性鱼类优势种,分析不同温度下4种食性鱼类排泄率的变化特征,结合鱼类资源特征、水质、水温、水域面积等参数,利用模型反演估算不同食性鱼类氮磷排泄对小江藻类初级生产的贡献率,以期为三峡库区各支流鱼类群落调控提供理论参考。
1" "材料与方法
1.1" "断面设置
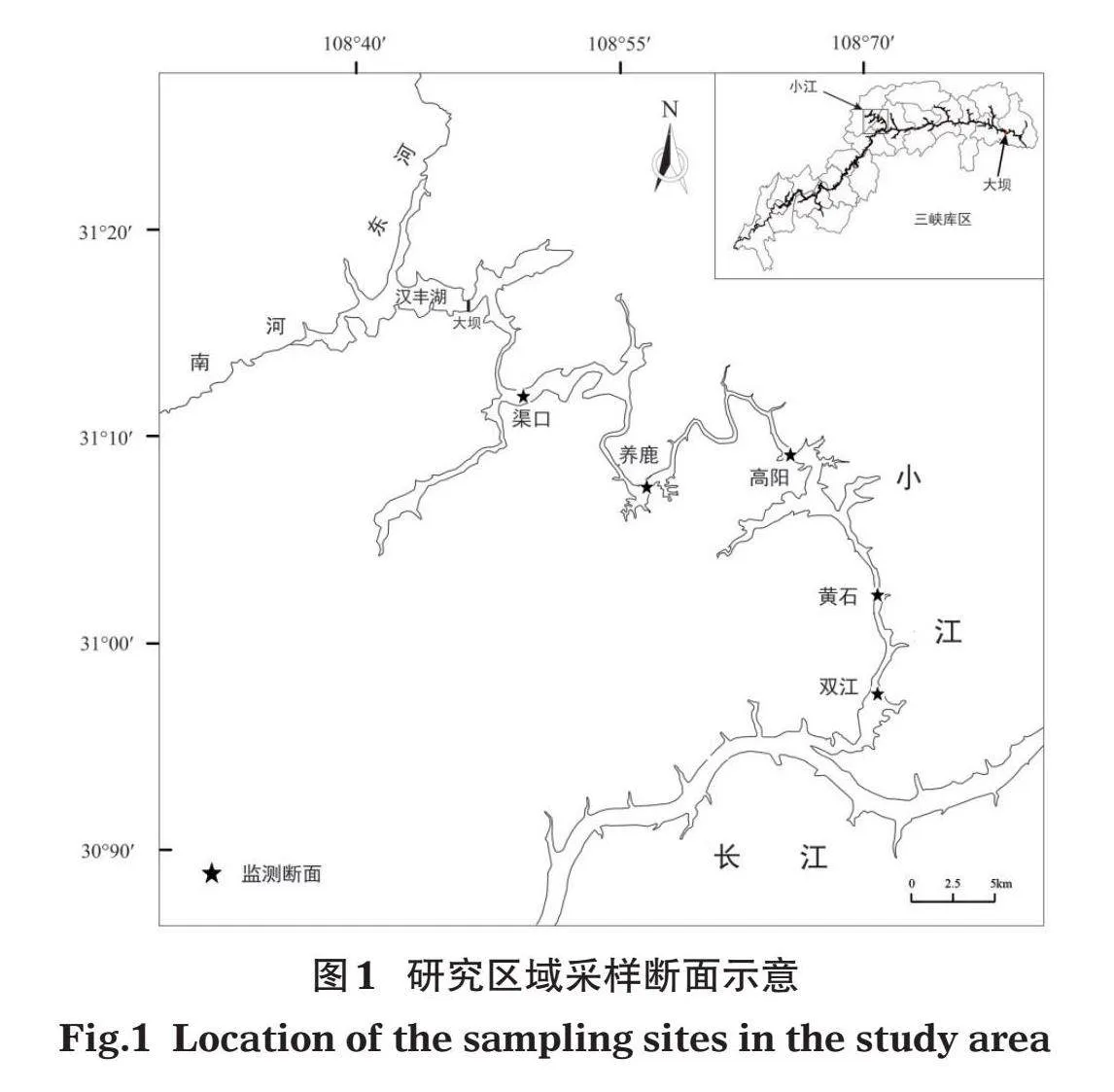
根据小江水系分布特点、地形地貌特征及重要闸坝分布等情况,设置研究区域主要为汉丰湖大坝以下至入长江口,共5个采样断面,分别为渠口、养鹿、高阳、黄石和双江,如图1所示。每个断面均开展水质、浮游物、鱼类监测和样品采集,水质监测时间为2019年1-12月,浮游物采集和鱼类资源调查于2019年7月进行。
1.2" "样品采集与试验设置
2019年每月月初现场采集5个监测断面的表层水样,4℃保存并在24 h内带回实验室测定总磷(TP)含量,采用YSI Pro多参数水质测量仪在现场原位测定水温、pH、溶解氧等监测指标。TP的测定按照《水和废水监测分析方法》(国家环境保护总局,2002)进行。
用聚乙烯瓶采集表层0.5 m水样,用0.7 μm滤膜过滤水样,刮取滤膜表面的浮游物并放于烘箱内,在60℃下烘至恒重,混合均匀备用。用铝箔包被1.5 mg样品后,使用元素分析仪(vario PYRO ube)耦合同位素质谱仪(ISOPRIME-100)测定浮游物碳氮元素含量;采用微波消解法测定浮游物中磷元素含量,先将0.5 mg样品放入消解管中,加5 mL的HNO3,放入微波消解炉消解后,用电感耦合等离子发射光谱仪进行测定。
鱼类密度调查采用Simrad EY60型分裂波束回声探测系统对监测断面进行探测,探测时将鱼探仪固定于船体左舷,探头置于水面下0.5 m深度,探测换能器频率为70 Hz,-20 dB探测张角7°,采样间隔128 μs,分辨精度0.024 m,采样功率设置为150 W,并通过Echoview 8.0分析软件进行数据分析处理。
鱼类种类和生物量调查采用网捕法。根据渔获物各食性鱼类的分布特征,选取4种较为常见的优势种鱼类,即滤食性鱼类鳙、草食性鱼类草鱼、杂食性鱼类鲫和肉食性鱼类黄颡鱼,进行不同食性鱼类氮磷排泄率模拟试验。由于鱼类所排泄的氮磷主要以氨氮(NH3-N)和溶解态正磷酸盐(SRP)为主,且其极易被藻类吸收利用,进而影响初级生产力(Andre et al,2003;阮景荣,2005),故本研究通过测定水中增加的NH3-N和SRP含量来代表鱼类氮磷排泄量。
鱼类氮磷排泄率测定参考国外已建立的方法,并进行适当优化(Schaus et al,1997;Shostell amp; Bukaveckas,2004)。试验水温参考小江2019年月平均水温(11.8~29.1℃),共设置14、18、22、26和30℃等5个温度梯度。试验装置采用定制的玻璃鱼缸(20×30×40 cm),每个温度梯度均设1个空白对照组(无试验用鱼)和4个试验组,每组设4个平行。试验用鱼选取健康无病,大小均匀,肠胃充塞度3~4级,体长10~15 cm的个体。试验开始时,各组先注入经过1.0 μm规格玻璃纤维滤膜抽滤并充分曝气后的自来水20 L,采用自动控温加热器加热至相应水温后,试验组每个鱼缸中放入已称重的试验用鱼1尾,根据水温以及鱼的数量确定试验时间,一般为2 h,试验开始前后分别采集各组水样,用于监测水中氨氮(NH3-N)及可溶性磷(SRP)的含量。为保证整个试验的可靠性,试验过程中暂养箱用黑色塑料袋遮盖以维持一个黑暗、安静的试验环境。NH3-N测定采用纳氏试剂分光光度法,SRP采用磷钼酸铵分光光度法(国家环境保护总局,2002)。
1.3" "统计方法
采用回声计数方法进行小江鱼类平均密度(ϕ)估算,公式为:
ϕ = [NP×A]" " " " " "①
式中:ϕ为鱼类平均密度,单位为尾/hm2;N为探测到的鱼类数目,单位为尾;P为分析数据的ping数量;A为声束探测的水体水域面积,单位为hm2。
小江鱼类总生物量B的计算公式如下:
B = S[×][ϕ][×]N" nbsp; " " ②
式中:B为总生物量,单位为kg;S为小江水域面积,单位为hm2;N为个体平均生物量,单位为kg/尾。
采用室内模拟法计算鱼类排泄率,试验前后分别测定各个试验鱼缸水中NH3-N和SRP含量,进而得到不同温度下4种食性鱼类的氮排泄率(EN)和磷排泄率(EP),计算公式如下:
[Ei=1000×C1−C0×VW×t]" " " " " " ③
式中:Ei为鱼类氮或磷排泄率,单位为μg/(g·h);C1为试验结束时试验组鱼缸中的SRP浓度或NH3-N含量,单位为mg/L;C0为试验开始时对照组鱼缸中的SRP浓度或NH3-N含量,单位为mg/L;V为鱼缸实验用水容积,单位为L;W为试验鱼的湿重,单位为g;T为实验持续时间,单位为h。
采用回归模型构建温度与鱼类排泄率的关系,结合小江年平均水温,计算得出不同食性鱼类在小江中的氮磷排泄率。
根据小江上覆水总磷含量估算流域初级生产力,计算方法参考Smith经典模型(Smith,1979),计算公式如下:
Vp=10.4×CTP-79" " " " " ④
式中:Vp为初级生产力,单位为mg/(m3·d);CTP为小江上覆水TP浓度,单位为mg/L。
根据浮游物C:N:P质量比求出藻类初级生产所需的N、P含量。通过不同食性鱼类氮磷排泄率以及初级生产所需氮磷含量的比值,得出鱼类排泄对藻类初级生产的贡献。
1.4" "数据分析
采用Excel 2016进行数据整理,Origin 9.0作图,Rstudio 4.0.2进行统计分析。使用ANOVA单因素方差分析探讨不同食性鱼类氮磷排泄率之间是否存在统计学差异,并采用最小显著性差异法(least significant difference,LSD)进行组间多重比较,以Plt;0.05作为差异显著水平;采用回归分析拟合水温与鱼类磷排泄率的相关关系。
2" "结果与分析
2.1" "小江鱼类资源特征
2019年7月对小江5个监测断面进行鱼类资源现场调查,渔获物中不同食性鱼类分布情况如表1所示。本次调查共采集鱼类6 298尾,共45种,总生物量为599.56 kg,个体平均生物量为95.20 g/尾。其中,杂食性鱼类和肉食性鱼类种类数较多,合计40种,占比达88.90%;肉食性鱼类生物量和数量最大,占比分别为55.53%和52.50%;草食性鱼类生物量最低,仅占鱼类总生物量的5.82%;而滤食性鱼类个体数量最少,仅80尾,但个体平均生物量最大,为910.41 g/尾。各断面渔获物中不同食性鱼类组成详见表2。
水声学探测结果显示,小江鱼类平均密度约为50尾/hm2。彭乐根等(2021)研究指出渠口下游至入长江口的水域总面积为2 328 hm2,结合不同食性鱼类占比、小江鱼类平均密度以及水域面积等,计算得出小江鱼类总生物量约为11.08 t,不同食性鱼类生物量分别为:滤食性鱼类1.35 t、草食性鱼类0.64 t、杂食性鱼类2.94 t、肉食性鱼类6.15 t。
2.2" "温度对不同食性鱼类氮磷排泄率的影响
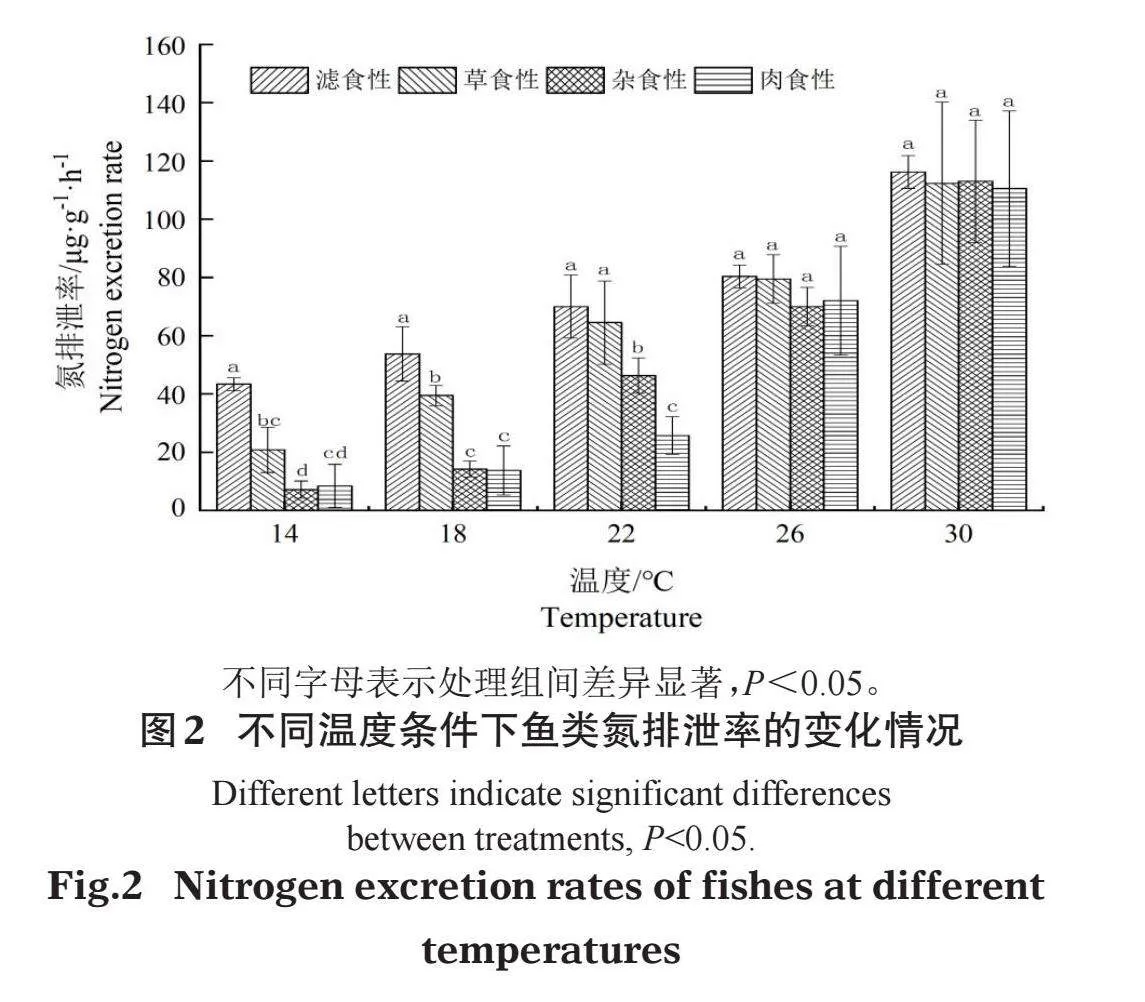
不同食性鱼类氮磷排泄率试验结果显示,4种食性鱼类氮排泄率随温度的升高均有所增大,且相同温度下滤食性鱼类氮排泄率均值最高(图2)。低温对不同食性鱼类氮排泄率有明显影响,14℃和18℃时滤食性鱼类显著高于其他3种食性鱼类,22℃时滤食性鱼类和草食性鱼类显著高于杂食性鱼类以及肉食性鱼类(Plt;0.05);高温时(26℃和30℃)各食性鱼类氮排泄率无显著性差异(Pgt;0.05)。
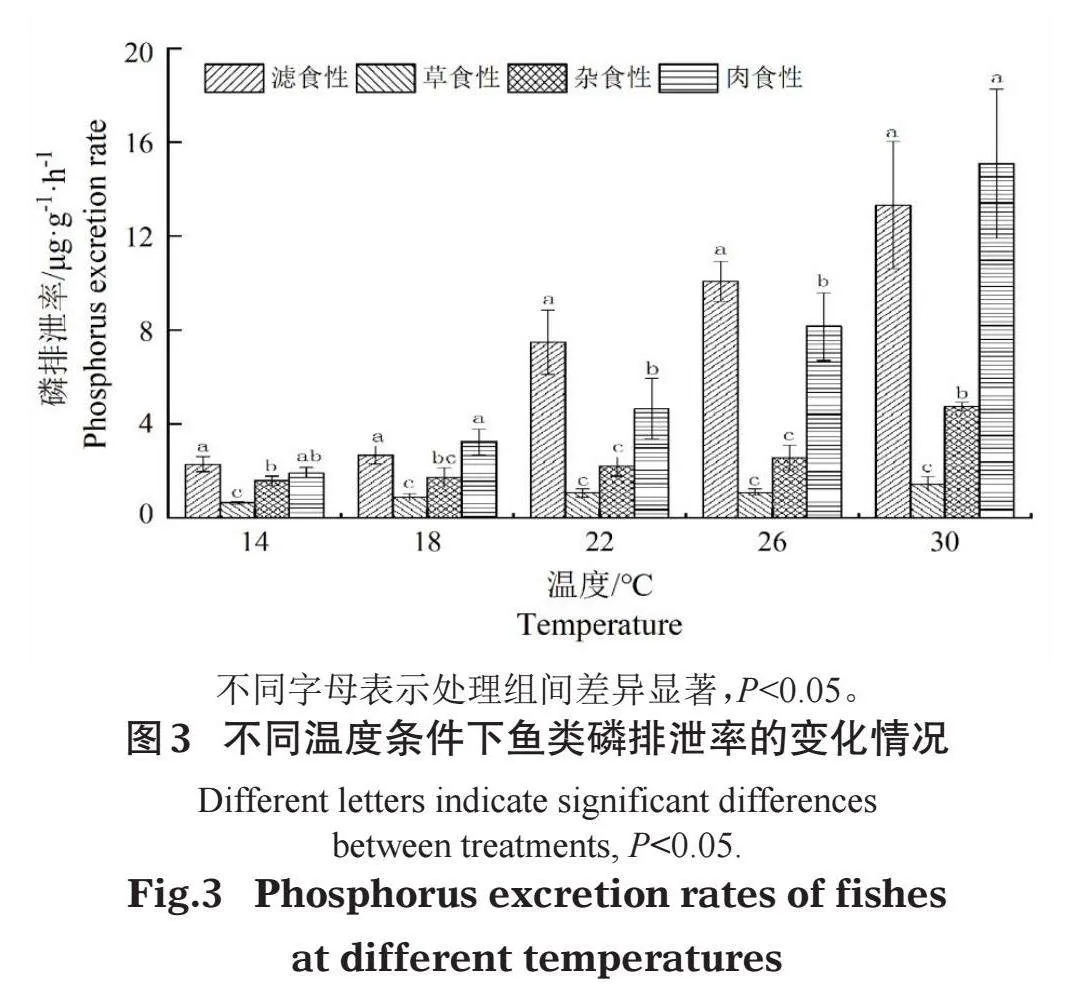
与氮排泄率相同,不同食性鱼类磷排泄率也随温度升高而增大(图3)。相同温度下,不同食性鱼类磷排泄率均值呈现相似规律,滤食性鱼类、肉食性鱼类gt;杂食性鱼类gt;草食性鱼类。方差分析结果显示,不同食性鱼类的磷排泄率存在显著差异(Plt;0.05)。LSD多重比较发现,草食性鱼类磷排泄率显著低于滤食性和肉食性鱼类。
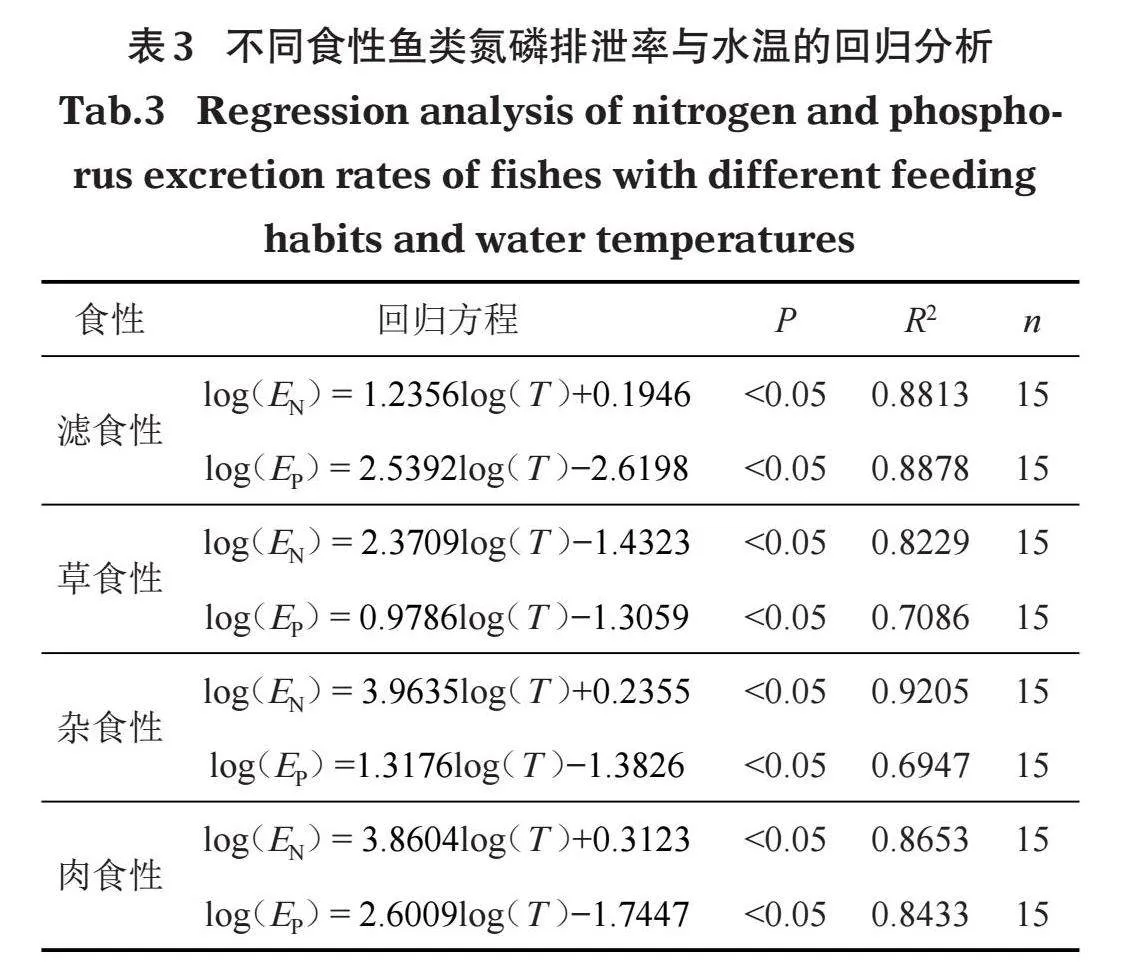
通过对不同方程模拟进行回归分析,结果显示回归方程都符合如下模型:
log(Y) = alog(X)+b" " " " " "⑤
且都达到了显著水平,故本研究采用幂指数函数构建鱼类氮磷排泄率与水温的回归关系。如表3所示,不同食性鱼类的回归方程中决定系数R2均大于50%,表明回归方程拟合度较好,水温对氮磷排泄率具有较高的解释度。鱼类氮磷排泄率与水温对数转换后均呈显著正相关关系(Plt;0.05)。其中,杂食性鱼类氮排泄率受水温变化影响最大,而草食性鱼类磷排泄率受水温变化影响最小。
2.3" "不同食性鱼类排泄对小江养分循环驱动的影响
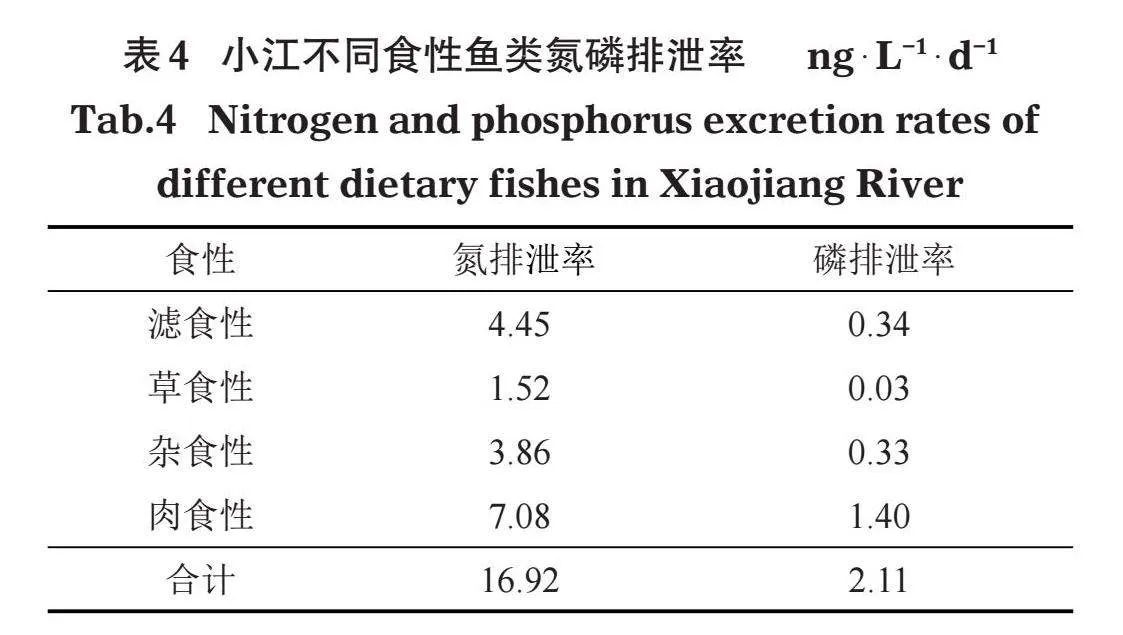
2.3.1" "小江不同食性鱼类排泄率的计算" "YSI监测结果显示,2019年小江水温为11.8~29.1℃,平均水温为20.1℃。利用表3构建的回归模型,结合小江水温、不同食性鱼类生物量和水域面积等参数,得出小江鱼类氮排泄率为16.92 ng/(L·d),磷排泄率为2.11 ng/(L·d)(表4)。其中,肉食性鱼类氮磷排泄率最高,分别为7.08、1.40 ng/(L·d);草食性鱼类氮磷排泄率最低,分别为1.52、0.03 ng/(L·d)。
2.3.2" "小江初级生产力所需氮磷含量" "通过Smith经典模型,结合2019年水体TP含量的月变化情况(TP浓度为0.049~0.122 mg/L,平均浓度约为0.075 mg/L),得出小江水体初级生产力(图4)。如图所示,小江初级生产力春夏较高,而秋冬相对较低。1-5月初级生产力逐渐增高,5月达最大值为1 198.91 mg/(m3·d),由于小江6月开始进入汛期,且7月时流量为全年最大,故6-7月初级生产力明显下降,7月份达最低值,为436.39 mg/(m3·d),8月有所回升,随后逐渐降低,年平均初级生产力为703.23 mg/(m3·d)。
5个监测断面浮游物碳氮磷含量监测结果显示,浮游物生物量为0.07~0.17 mg/L,均值为(0.14±0.05)mg/L,浮游物中的碳(C)含量、氮(N)含量、磷(P)含量分别为1.37%±0.47%、8.16%±2.58%、0.11%±0.02%,C:N:P质量比为73.4:12.1:1。
从藻类的元素组成角度,通过上述浮游物中碳氮磷含量之间的数量关系,结合小江年平均初级生产力,可得出小江藻类初级生产所需的氮磷含量分别为115.86、9.58 μg/(L·d)。
2.3.3" "小江不同食性鱼类排泄贡献率" "对比小江鱼类氮磷排泄率与初级生产所需的氮磷含量可知,目前小江鱼类氮磷排泄对藻类初级生产养分循环贡献较小。其中,鱼类氮排泄仅占初级生产力所需氮含量的0.015%,鱼类磷排泄占初级生产力所需磷含量的0.022%。
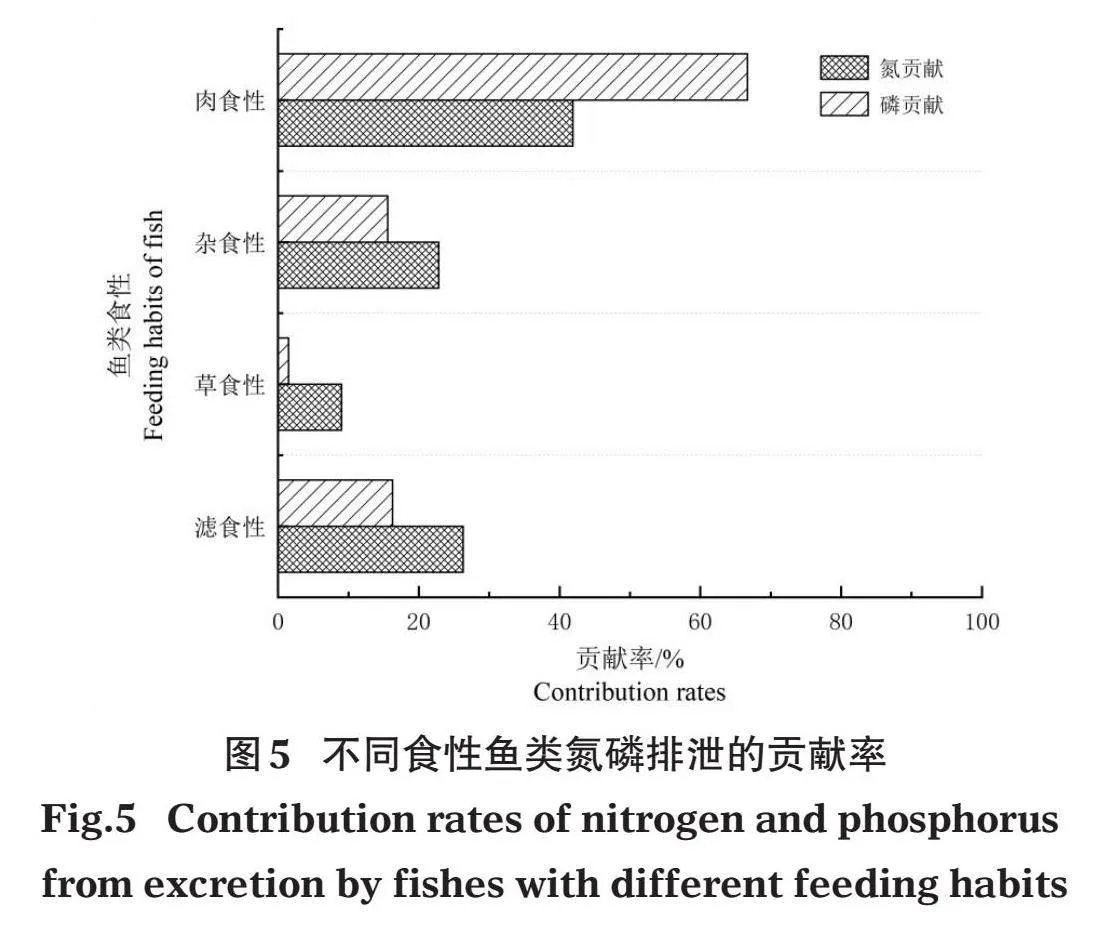
不同食性鱼类排泄供给初级生产所需的氮磷含量占鱼类供给氮磷总含量,即贡献率如图5所示,4种食性鱼类中,肉食性鱼类所提供的氮磷排泄率占鱼类提供初级生产力所需氮磷总量的比例最高,氮磷贡献率分别为41.800%和66.700%,草食性鱼类贡献率最低。
3" "讨论
3.1" "鱼类排泄率的影响因素
温度是影响鱼类代谢的最重要环境因子之一(Kieffer amp; Wakefield,2010;Booth et al,2013;Symons et al,2018)。本研究中,不同食性鱼类氮磷排泄率均与温度呈正相关关系,即随着温度的升高,氮磷排泄率逐渐增大,这与前人研究结果一致(江丽华和朱爱意,2009;张振华等,2017)。陈锦云和陈玉翠(2006)的研究表明,在一定温度条件下,随水温的升高,鱼类新陈代谢速率加强,好氧速率增加,代谢相关的酶活性增大,进而导致鱼类营养盐排泄速率增加。Liu等(2010)研究发现,在18~23℃水温范围内,温度越高,条纹狼鲈(Morone saxatilis)氨氮排泄率越大。当温度达到一定阈值后,代谢速率会有所降低(Neuheimer et al,2011;朱祥宇等,2013)。本研究中并没有类似的结果,可能与实验用鱼种类及个体差异有关。鱼类排泄率的模拟试验温度主要参考2019年小江实际的水温(11.8~29.1℃),没有设置极端温度,以保证构建最适的回归模型。
鱼类食性的不同,氮磷代谢产物也有显著差异,进而会对排泄率产生影响。红枫湖鲢、鳙肠道食物监测结果显示,鲢食物中浮游植物占比高达99%,浮游动物不足1%,而鳙肠道内浮游植物占比仅9%,浮游动物约92%(牟洪民等,2012)。本研究结果显示,不同食性鱼类排泄率有所差异,滤食性鱼类氮磷排泄率整体高于其他3种食性鱼类,且温度对不同食性鱼类磷排泄率的影响高于氮排泄率。李培培(2012)在千岛湖鱼类排泄率研究发现,鲢氮磷排泄率均高于鳙,前者约为后者的2~3倍。同时,鱼类排泄率随着食物营养水平的增加而增大(Higgins et al,2006)。不同水深条件下鱼类可摄食的食物种类和丰度不同,鱼类摄取营养物质成分占比也有所差异,从而引起不同水层鱼类排泄率的差异。摄食强度也会影响鱼类氮磷排泄率,而摄食强度又与温度密切相关。李大鹏等(2005)研究发现,随温度升高,施氏鲟(Acipenser schrencki)幼鱼摄食强度呈先增大后降低的变化趋势。此外,鱼类排泄率还与鱼类生长发育、食物周期率、饵料、水中营养盐浓度及氧含量等因素有关(Peck et al,2003;Torres amp; Vanni,2007;刘鉴毅等,2015;Fang et al,2017)。
3.2" "鱼类排泄对藻类初级生产力的影响
鱼类在营养盐迁移转化及水生态系统养分循环中扮演着重要作用(Allgeier et al,2014;Atkinson et al,2017)。鱼类排泄可以为底栖生物提供营养盐,而底栖生物生长、繁殖、代谢等过程又能影响其他水生动物,进而影响水体营养盐循环过程(Friedland et al,2005;Nobre et al,2019)。鱼类排泄的氮磷可被藻类再次利用,促进营养盐的迁移转化。但当鱼类氮磷排泄量过大时,会使水体营养盐增高,促进藻类生长,进而引起水体富营养化或导致富营养化程度加重(Schindler et al,1993)。本研究中,鱼类氮磷排泄率对小江藻类初级生产力的贡献率非常低,氮、磷排泄仅占藻类初级生产所需氮、磷含量的0.015%、0.022%。这可能与小江水体营养盐浓度较低有关。水体营养水平越高,鱼类排泄会对藻类生物量和群落组成影响越明显(Williamson et al,2018)。相反,营养盐水平较低的水体,鱼类排泄率对初级生产的贡献往往较低,尤其是以滤食性鱼类为主要优势种群的天然湖库。研究表明,在高生产力湖泊(以农业利用为主)中,鱼类提供的营养盐占植物初级生产的51%,而在生产力相对较低的湖泊(森林或混合土地利用)中,鱼类仅支持了18%的初级生产(Vanni,2006)。李培培(2012)在千岛湖研究中发现,鲢鳙氮、磷排泄对藻类初级生产所需氮、磷的贡献率仅占0.237%和0.788%。薛洋(2015)在三峡库区干井河的研究显示,鲢鳙氮、磷排泄贡献率也仅占0.038%和0.072%。李晓洁(2018)研究结果显示,鲢排泄释放的氮、磷排泄量分别占长寿湖初级生产所需氮、磷含量的1.190%和9.570%,而鳙排泄释放的氮、磷排泄量占初级生产所需氮、磷含量的0.790%和6.910%。滤食性鱼类排泄的氮磷总量明显低于水体其他营养盐,这是它们不会引起水体富营养化的主要原因之一(Parmenter amp; Lamarra,1991)。而在水体营养物质极度匮乏时,鱼类排泄物会成为藻类主要营养盐,鱼类磷排泄量可达到藻类需求量的36%(Schaus et al,1997)。此外,小江鱼类排泄对初级生产的贡献率低于千岛湖、长寿湖,可能还与鱼类密度有关,小江鱼类平均密度仅为50尾/hm2,导致单位水体鱼类排泄率偏低。虽然本研究中不同食性鱼类排泄率有差异,但它们对藻类初级生产的贡献率均非常低。总之,小江鱼类氮磷排泄率占初级生产所需氮磷含量较小,不会对藻类生物量的增加产生显著影响。
4" "结论
(1)小江鱼类个体平均生物量为95.20 g/尾,总生物量约为11.08 t,由高到低依次为肉食性鱼类、杂食性鱼类、滤食性鱼类和草食性鱼类。
(2)不同食性鱼类氮磷排泄率均随温度的升高而增大,相同温度下滤食性鱼类氮排泄率最高,滤食性鱼类和肉食性鱼类磷排泄率显著高于草食性鱼类。
(3)鱼类氮磷排泄率和水温有较好的幂指数回归关系,杂食性鱼类氮排泄率受水温变化影响最大,而草食性鱼类磷排泄率受水温变化影响最小。
(4)小江鱼类氮磷排泄对藻类养分循环贡献较小,4种食性鱼类中肉食性鱼类排泄提供的氮磷对初级生产力的贡献率最高。
参考文献
陈锦云, 陈玉翠, 2006. 温度对瓦氏黄颡鱼幼鱼氨氮排泄的影响[J]. 水产科学, 25(5):232-235.
国家环境保护总局, 2002. 水和废水监测分析方法[M].4版. 北京:中国环境科学出版社.
江丽华, 朱爱意, 2009. 温度和盐度对美国红鱼耗氧率和排氨率的影响[J]. 水产养殖, 30(10):27-30.
李大鹏, 庄平, 严安生, 等, 2005. 施氏鲟幼鱼摄食和生长的最适水温[J]. 中国水产科学, 12(3):294-299.
李培培, 2012. 千岛湖鲢、鳙的生态化学计量学及其驱动的养分再循环[D]. 上海:上海海洋大学.
李晓洁, 2018. 生态放养鲢鳙在长寿湖水生态系统氮磷循环中的作用[D]. 重庆:西南大学.
李晓洁, 唐敏, 李云, 等, 2018. 鲢鳙在长寿湖水生态系统氮磷循环中的作用[J]. 淡水渔业, 48(3):40-46.
刘鉴毅, 宋志明, 王妤, 等, 2015. 温度对点篮子鱼幼鱼生长、摄食和消化酶活性的影响[J]. 海洋渔业, 37(5):442-448.
牟洪民, 姚俊杰, 方贵镇, 等, 2012. 贵阳红枫湖鲢、鳙的食性研究[J]. 淡水渔业, 42(3):44-49.
彭乐根, 沈建忠, 吉芬芬, 等, 2021. 三峡库区小江太湖新银鱼时空分布[J]. 水生态学杂志, 42(5):103-109.
阮景荣, 2005. 三种鱼的磷排泄及其在微型生态系统磷再循环中的作用[J]. 水生生物学报, 29(1):55-60.
薛洋, 2015. 三峡库区水域牧场鲢鳙驱动的氮磷循环研究[D]. 重庆:西南大学.
张振华, 明瑞梁, 彭亮, 等, 2017. 南亚热带水体7种常见浮游动物的个体氮、磷含量及其排泄率的比较[J]. 湖泊科学, 29(6):1455-1463.
朱祥宇, 高勤峰, 董双林, 2013. 不同温度对草鱼C、N、P营养要素收支的影响[J].水产学报, 37(10):1521-1526.
Allgeier J E, Layman C A,Mumby P J, et al, 2014. Consistent nutrient storage and supply mediated by diverse fish communities in coral reef ecosystems[J]. Global Change Biology, 20:2459-2472.
Andre E R, Hecky R E, Duthie H C, 2003. Nitrogen and phosphorus regeneration by Cichlids in the Littoral zone of Lake Malawi, Africa[J]. Journal of Great Lakes Research, 29:190-201.
Atkinson C L, Capps K A, Vanni M J, 2017. Consumer-driven nutrient dynamics in freshwater ecosystems: from individuals to ecosystems[J]. Biological Reviews, 92(4):2003-2023.
Booth D J, Poulos D E, Poole J, et al, 2013. Growth and temperature relationships for juvenile fish species in seagrass beds: implications of climate change[J]. Journal of Fish Biology, 84(1):231-236.
Capps K A, Atkinson C L, Rugenski A T, 2015. Consumer-driven nutrient dynamics in freshwater ecosystems: an introduction[J]. Freshwater Biology, 60(3):439-442.
Fang L, Bai X L, Liang X F, 2017. Ammonia nitrogen excretion in Mandarin Fish (Siniperca chuatsi) and Grass Carp (Ctenopharyngodon idellus) fed practical diets: the effects of water temperature[J]. Aquaculture Research, 48(3):836-843.
Friedland K D, Ahrenholz D W, Haas L W, 2005. Viable gut passage of cyanobacteria through the filter-feeding fish atlantic menhaden, Brevoortia tyrannus[J]. Journal of Plankton Research, (7):715-718.
Griffiths D, 2006. The direct contribution of fish to lake phosphorus cycles[J]. Ecology of Freshwater Fish, 15:86-95.
Higgins K A, Vanni M J, González M J, 2006. Detritivory and the stoichiometry of nutrient cycling by a dominant fish species in lakes of varying productivity[J]. Oikos, 114(3):419-430.
Hillebrand H, Frost P, Liess A, 2008. Ecological stoichiometry of indirect grazer effects on periphyton nutrient content[J]. Oecologia, 155(3):619-630.
Kieffer J D, Wakefield A M, 2010. Oxygen consumption, ammonia excretion and protein use in response to thermal changes in juvenile Atlantic salmon Salmo salar[J]. Journal of Fish Biology, 74(3):591-603.
Liu F G, Yang S D, Chen H C, 2010. Effect of temperature, stocking density and fish size on the ammonia excretion in palmetto bass (Morone saxatilis×M. chrysops)[J]. Aquaculture Research, 40(4):450-455.
Menezes R F, Attayde J L, Vasconcelos F R, 2010. Effects of omnivorous filter-feeding fish and nutrient enrichment on the plankton community and water transparency of a tropical reservoir[J]. Freshwater Biology, 55(4):767-779.
Neuheimer A B, Thresher R E, Lyle J M, et al, 2011. Tolerance limit for fish growth exceeded by warming waters[J]. Nature Climate Change, 1(2):110-113.
Nobre R L G, Carneiro L S, Panek S E, 2019. Fish, including their carcasses, are net nutrient sources to the water column of a eutrophic lake[J]. Frontiers in Ecology and Evolution, 7:1-9.
Parmenter R R, Lamarra V A, 1991. Nutrient cycling in a fresh-water marsh the decomposition of fish and waterfowl carrion[J]. Limnology and Oceanography, 36(5):976-987.
Peck M A, Katersky R S, Menard L M, et al, 2003. The effect of body size on food consumption, absorption efficiency, respiration, and ammonia excretion by the inland silverside, Menidia beryllina (Cope) (Osteichthyes: Atherinidae)[J]. Journal of Applied Ichthyology, 19:195-201.
Schaus M H, Vanni M J, Wissing T E, 1997. Nitrogen and phosphorus excretion by detritivorous gizzard shad in a reservoir[J]. Limnology and Oceanography, 42(6):1386-1397.
Schindler D E, Kitchell J F, He X, et al, 1993. Food-web structure and phosphorus cycling in lakes[J]. Transactions of the American Fisheries Society, 122(5):756-772.
Shostell J, Bukaveckas P A, 2004. Seasonal and interannual variation in nutrient fluxes from tributary inputs, consumer recycling and algal growth in a eutrophic river impoundment[J]. Aquatic Ecology, 38:359-373.
Smith V H, 1979. Nutrient dependence of primary productivity in lakes[J]. Limnology and Oceanography, 24(6):1051-1064.
Susana R, 2004. Mesocosm experiments on nutrient and fish effects on shallow lake food webs in a Mediterranean climate[J]. Freshwater Biology, 49:1593-1607.
Symons C C, Schulhof M A, Cavalheri H B, et al, 2018. Antagonistic effects of temperature and dissolved organic Carbonon fish growth in California mountain lakes[J]. Oecologia, 189(1):231-241.
Torres L E, Vanni M J, 2007. Stoichiometry of nutrient excretion by fish: interspecific variation in a hypereutrophic lake[J]. Oikos, 116(2):259-270.
Vanni M J, 2006. Nutrient cycling by fish supports relatively more primary production as lake productivity increases[J]. Ecology, 87(7):1696-1709.
Vanni M J, Boros G, McIntyre P B, 2013. When are fish sources vs. sinks of nutrients in lake ecosystems?[J]. Ecology, 94(10):2195-2206.
Williamson T J, Vanni M J, Conroy J D, 2018. The importance of nutrient supply by fish excretion and watershed streams to a eutrophic lake varies with temporal scale over 19 years[J]. Biogeochemistry, 140(2):233-253.
Zhang L B, Wang Q S, Ding L L, et al, 2009. Controlling of phytoplankton by zooplankton in eutrophic waters[J]. Ecology and Environmental Sciences, 18(1): 64-67.
Zimmer K D, Herwig B R, Laurich L M, 2006. Nutrient excretion by fish in wetland ecosystems and its potential to support algal production[J]. Limnology and Oceanography, 51:197-207.
(责任编辑" "熊美华)
Nitrogen and Phosphorus Excretion of Fishes with Different Feeding Habits and Their Role in Nutrient Cycling in Xiaojiang River
TANG Hai‐bin1, ZHANG San‐feng1, ZHU Li‐ming1, ZOU Xi1, SHI Fang1, YANG Qing1,
HU Lian1, ZHU Wen1, SHI Yu‐long2, LI Bo2
(1. Key Laboratory of Ecological Impacts of Hydraulic-Projects and Restoration
of Aquatic Ecosystem of Ministry of Water Resources, Institute of Hydroecology, Ministry
of Water Resources and Chinese Academy of Sciences, Wuhan" "430079, P.R. China;
2. China Three Gorges Corporation, Wuhan" "430010, P.R. China)
Abstract:In this study, we investigated the impact of excretions from fish with different feeding habits on primary production and nutrient cycling in Xiaojiang River. Four typical fishes with different feeding habits (filter-feeding bighead carps, herbivorous grass carps, omnivorous crucian carps and carnivorous yellow catfish) were selected as representative species. We first investigated the variation of nitrogen and phosphorus excretion rates of the four species at different water temperatures and analyzed the relationship of excretion rate and temperature, and then we estimated the contribution of nitrogen and phosphorus excretions by each species to primary productivity using model inversion. In 2019, water quality was monitored monthly at five transects in Xiaojiang River, and plankton and fishery resources were surveyed in July. Results show: (1) The nitrogen excretion rate of the filter-feeding species was highest, and the phosphorus excretion rates of the filter-feeding and carnivorous species were highest. (2) The nitrogen and phosphorus excretion rates of all species increased with water temperature, and the nitrogen excretion rate of omnivorous fish was most affected by water temperature, while the phosphorus excretion rate of herbivorous fish was least affected by water temperature. (3) The total biomass of fish in Xiaojiang River was 11.08 t, the excretion rate of nitrogen was 16.92 ng/(L·d) and that of phosphorus was 2.11 ng/(L·d). (4) The contribution of nitrogen and phosphorus to the nutrient supply of algae" was small in Xiaojiang River, accounting for 0.015% of the nitrogen and 0.022% of the phosphorus required for primary production. (5) Among the four different feeding habits, the carnivorous fish contributed the most to primary production. The results of this study provide a theoretical reference for managing the fish community and nutrient cycling in the tributaries of Three Gorges Reservoir.
Key words:fish feeding habits; nutrient excretion rate; primary production; nutrient cycling; Xiaojiang River; Three Gorges Reservoir
