祁连山国家公园青海片区河流和湿地原生生物多样性研究
2024-01-01王浩骅张鹏罗帅谷思雨熊雄于瑶李仑缪炜熊杰




摘要:探索祁连山国家公园河流与湿地的原生生物群落结构特征及其对环境的响应,为片区生物多样性保护与利用提供依据。2020年7-8月对祁连山国家公园青海片区河流和湿地的21个水环境样点进行了水样采集和DNA分离,共获得DNA样品58份,利用宏基因组测序探究祁连山国家公园青海片区的原生生物种类组成和群落结构,并分析了其与环境因子之间的关系。结果显示:(1)共鉴定和注释到393个原生生物分类单元(operational taxonomic units,OTUs),分属于24门40纲95目126科162属,其中裸藻门、纤毛门种类最多,硅藻门、纤毛门丰度最高;(2)片区不同河流或湿地的原生生物群落结构存在显著差异,河流原生生物多样性显著高于湿地;(3)RDA分析显示原生生物群落主要受水体总磷、水温、pH、总有机碳、溶解氧、盐度、总氮、硝酸盐氮、氨氮和水流速度等环境因子的显著影响;(4)物种共现网络分析显示湿地原生生物群落共现网络较河流更稳定。
关键词:原生生物;多样性;宏基因组;河流;湿地;祁连山国家公园
中图分类号:X171.1" " " "文献标志码:A" " " " 文章编号:1674-3075(2024)05-0009-11
原生生物(protists)是一大类单细胞真核微生物,广泛分布于水环境中。原生生物包括原生动物和真核藻类,是水生生态系统中不可或缺的一部分,其不仅是水体食物网(链)中的初级生产者,也是消费者和分解者,在物质循环和能量流动中发挥着极其重要的作用(Pokarzhevskii et al,2003;Jiao et al,2010)。因其生命周期短,繁殖快,且对水环境变化较为敏感,故对水环境变化具有较好的指示作用(沈韫芬,1999;熊杰等,2019)。由于该类生物个体小、种类多,在高原河流环境中密度低,因此形态学鉴定容易忽视这部分类群,导致原生生物多样性被低估,从而对原生生物群落结构特征的认知存在误区(Fenchel amp; Jørgensen,1977;Keeling amp; Campo,2017;Zhu et al,2021)。随着高通量测序技术的发展,基于高通量测序技术对原生生物群落进行系统研究越来越普遍(黄平平,2017;Boscaro et al,2017;安瑞志,2021;罗帅等,2022),并且高通量测序具有数据量大,准确度高,对物种识别灵敏等特点(Jiang et al,2021;Zhang et al,2022)。基于宏基因组测序,研究原生生物群落特征,有助于揭示原生生物之间的互作关系,对探究原生生物的环境适应性机制及对水环境生物监测等具有重要意义(王莹莹等,2005;胡明慧等,2022;翟万营等,2022)。
河流是生命之源,是能量传递和物质循环的重要载体,对维持水生生物多样性发挥了重要作用;湿地作为淡水的重要来源,具有保护生物多样性的重要功能,是重要的生态系统之一(王玲慧等,2015;王学福,2020;刘斌等,2022)。祁连山国家公园作为黄河最重要的水源地,是国家关键生态功能区中的“水源涵养重要区”,是我国西部地区的重要生态安全屏障,也是我国生物多样性保护重点区域(李铁,1998;王新源,2018),其特殊的高原气候环境十分脆弱,人类活动和全球气候变化对其环境影响均较大(安瑞志等,2021;兰翔宇等,2021)。河流及相关湿地是祁连山国家公园重要的水生生态系统,其生态健康状况不仅关系到祁连山河流本身的健康,也关系到河水滋养和补给的各种动植物资源的健康安全。因此河流生态系统的健康对整个祁连山国家公园的生态安全都有着重要的意义(张华等,2021)。探索祁连山国家公园河流与湿地的原生生物群落结构特征及其对环境的响应等,对保持祁连山国家公园生物资源和水环境保护有着长远意义。但受多种因素限制,目前关于祁连山国家公园原生生物群落结构特征的相关研究还未见报道。
为探究祁连山国家公园青海片区河流与湿地原生生物群落结构特征及其与环境因子的关系,本研究于2020年7-8月在该区采集水体样品,基于宏基因组测序,对该片区原生生物种类、组成、群落结构及其与水环境因子的相关性进行了分析,旨在为该片区生物资源保护及水环境保护提供第一手资料,进而为该片区生物多样性保护与利用提供依据。
1" "材料与方法
1.1" "研究区概况及样点设置
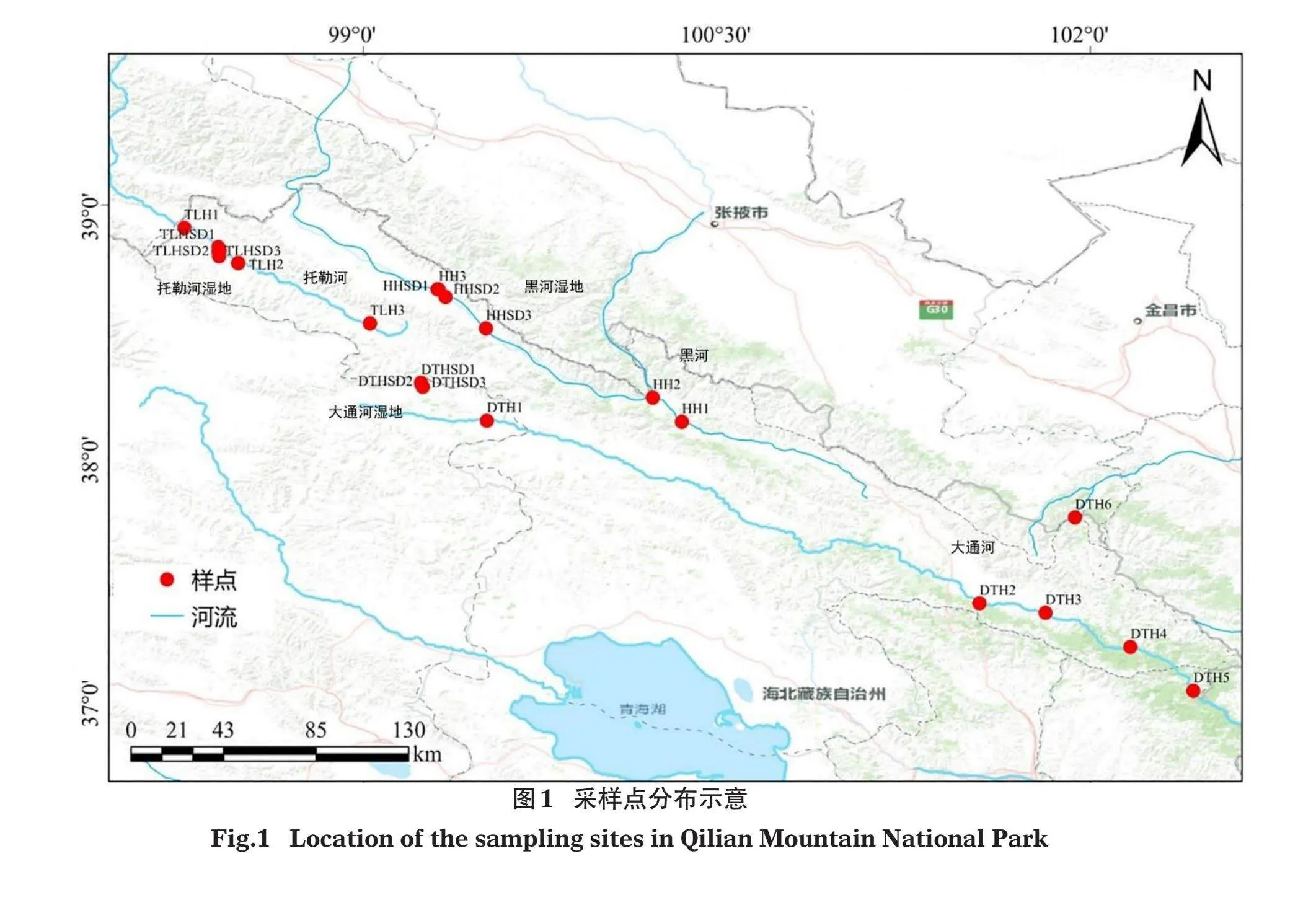
祁连山国家公园位于青海省东北部和甘肃省西南部,总面积5.02万km2,分为甘肃片区和青海片区,其中甘肃片区3.44万km2,占总面积的68.5%;青海片区1.58万km2,占总面积的31.5%(金万洲等,2022)。青海片区位于37°03′~39°12′ N,96°49′~102°41′ E,区域包括海北藏族自治州的祁连县、门源县和海西蒙古族藏族自治州的德令哈市和天峻县部分区域,辖区共12个乡(镇)48个村(牧委会)(金万洲等,2022)。祁连山国家公园青海片区为青藏高原东北部边缘的祁连山山地,该地区河流密布,流域地表水资源总量丰富,主要河流有大通河、黑河和托勒河等,同时该流域内湿地众多,包括大通河湿地、黑河湿地和托勒河湿地等主要湿地(李新等,2019;马芳,2020)。
2020年7-8月在祁连山国家公园青海片区共设置21个采样点(图1),其中3条河流设置样点12个,分别为黑河3个(HH1~3)、托勒河3个(TLH1~3)和大通河6个(DTH1~6);湿地共设置样点9个,分别为大通河湿地3个(DTHSD1~3)、黑河湿地3个(HHSD1~3)和托勒河湿地3个(TLHSD1~3)。
1.2" "样品采集
每个样点采集3个水环境样品,共获得水体样品63份,其中,环境DNA样品采集步骤为:(1)采集采样点表层(约10~20 cm水深)原位水约5 L,先用200 μm的滤网过滤以去除水体中不可溶性杂质及其他大型生物个体及水生植物(组织)等,再将过滤后的原位水收集至5 L水袋。(2)采集的原位水于12 h内进行过滤处理,取1.2 L(4×300 mL)原位水,通过真空抽滤装置,将水样中DNA抽滤至4张0.22 μm PC膜(Millipore,USA)上,放置于锡箔纸中,并立即置于干燥剂中干燥保存,用于下一步的DNA提取。(3)DNA样品滤膜冷链运输至广东深圳华大基因股份有限公司进行宏基因组测序分析,其中测序成功的DNA样品58 份。
环境因子数据采集和检测:本研究共测定了17个水环境参数,包括总磷(TP)、总氮(TN)、硝酸盐氮(NO3-N)、氨氮(NH3-N)、亚硝酸盐氮(NO2-N)、总有机碳(TOC)、高锰酸盐指数(CODMn)、叶绿素(Chl-a)、浊度(TUR)、氯离子(Cl-)、水流速度(V)、盐度(Salt)、溶解氧(DO)、水体酸碱度(pH)、水温(T)、溶解性总固体(TDS)和电导率(EC)。pH、T、TDS、Salt、DO和EC用美国哈希HQ40D便携式多参数水质分析仪现场测定;TUR用美国哈希2100Q便携式浊度仪现场测定;V用便携式流速测算仪(SLD300-A)现场测定;Chl-a浓度采用多波长分光光度法实验室测定;TOC用TOC仪(Elementar,德国)实验室测定;Cl-用离子色谱仪(930 Compact Ic Flex);NO3-N、NH3-N、NO2-N、CODMn、TN和TP测定参照《水和废水监测分析方法》(国家环境保护总局编委会,2002)于实验室内完成。
1.3" "宏基因组测序及生物信息分析
采用CTAB方法进行DNA提取。环境DNA纯度和浓度用2%的琼脂糖凝胶进行检测,将检测合格的DNA使用M220聚焦超声仪(Covaris Inc,Woburn,MA,USA)破碎成大约300 bp的片段,构建文库,并基于Illumina Hiseq 4000进行宏基因组测序。
对采集到的58份水体样品进行宏基因组测序,共获得数据量1.5 Tb。然后用fast QC (v0.11.9)对测序所得的原始序列进行质量评估,对于低质量碱基使用Fastx trimmer(v0.0.14)移除,通过BLASTN(BLAST Version 2.10.1+,http://blast.ncbi.nlm.nih.gov/Blast.cgi)将经过质控的序列比对至SILVA数据库,设置e值阈值为1[×]10-5,将得到符合要求的数据进行后续分析。然后使用MEGAHIT(v1.1.3)进行组装,得到潜在的rDNA contigs。使用nhmmer从组装得到的rDNA contigs中提取16S或18S rDNA序列,经97%相似度聚类后,用于物种鉴定。使用Bwa(0.7.17-r1188)将reads比对至16S和18S rDNA,使用featurecounts(v1.6.0)进行reads数目统计,并用RPKM(reads per kilobase per million mapped reads)的方式进行标准化得到OTUs(operational taxonomic units)丰度表。
1.4" "统计分析
利用R软件(4.0.3)vegan包计算均匀度指数(Pielou)、香农指数(Shannon)、丰富度指数(Richness)、辛普森指数(Simpson),并进行非度量多维尺度分析。利用R软件的vegan、psych和pheatmap等软件包进行冗余分析和相关性分析。使用R进行共现网络分析,使用Gephi软件进行共现网络图绘制。利用R软件的rdacca.hp包分析不同水环境因子对原生生物群落的贡献度,并利用ggplot2包进行排序图可视化。
2" "结果与分析
2.1" "水环境因子
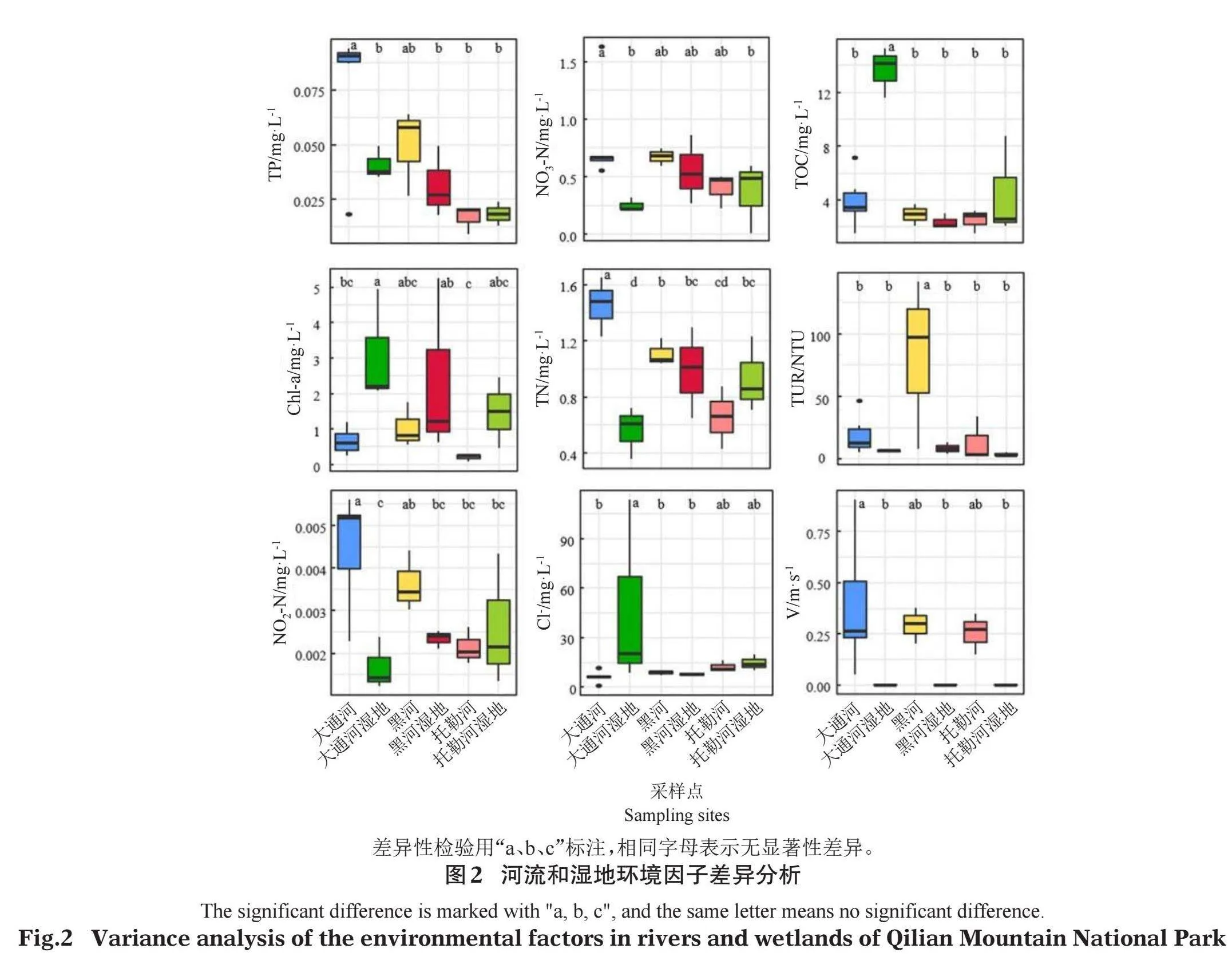
对测定的水环境因子进行共线性分析,去除共线性高于0.6即相关性高的3个水环境因子(TDS、EC和CODMn)后,保留14个环境因子进行下一步分析。对大通河、大通河湿地、黑河、黑河湿地、托勒河和托勒河湿地的水环境因子进行差异分析,结果见图2。TP在大通河显著高于大通河湿地、黑河湿地、托勒河、托勒河湿地(Plt;0.05),NO3-N在大通河显著高于大通河湿地和托勒河,TOC和Cl-在大通河湿地显著高于其他区域,Chl-a在大通河湿地显著高于大通河和托勒河,TN在大通河显著高于其他区域,TUR在黑河显著高于其他区域,NO2-N在大通河显著高于大通河湿地、黑河湿地、托勒河和托勒河湿地,V在河流区域显著高于湿地区域,Cl-和TN在大通河湿地显著高于其他区域,NO3-N在大通河显著高于其他区域,Salt、DO、pH、NH3-N和T在各个区域均没有显著差异。
2.2" "原生生物多样性和群落结构
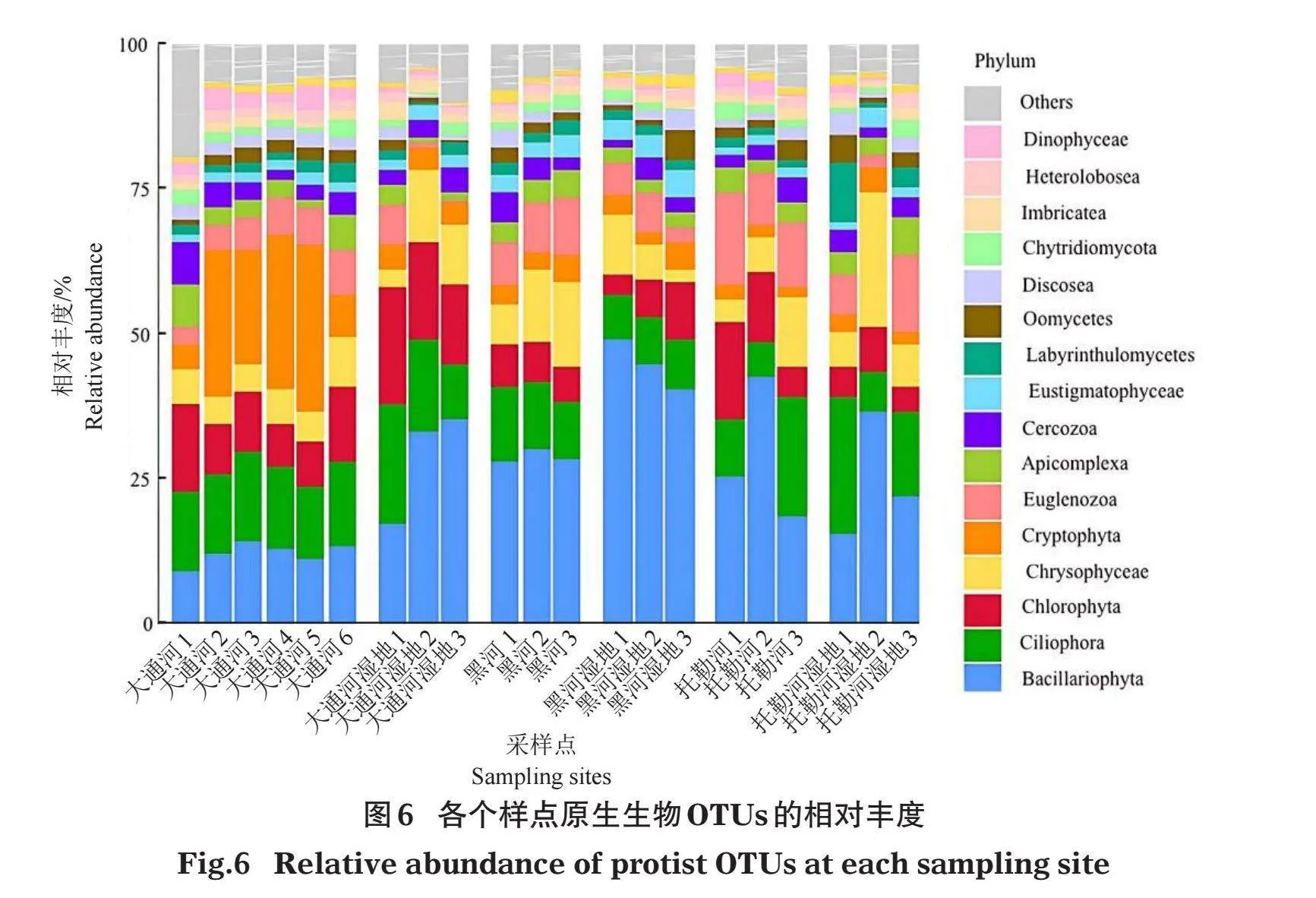
对21个样点的水环境样品进行宏基因组测序,经组装分析共提取到2 832条rDNA contigs,经过97%相似性聚类后,共获得538个真核生物OTUs,其中原生生物393个OTUs,其他真核145个OTUs。鉴定到的393个原生生物OTUs隶属18门,其中OTUs个数占比gt;2%的优势门类有13个(图3),依次为裸藻门(Euglenozoa)占21%,纤毛门(Ciliophora)占18%,硅藻门(Bacillariophyta)占11%,绿藻门(Chlorophyta)占9%,Discosea占7%,管涌足虫门(Tubulinea)占5%,透色门(Heterolobosea)占4%,顶复门(Apicomplexa)占3%,丝足虫门(Cercozoa)占3%,隐藻门(Cryptophyta)、Haptista、Perkinsozoa和红藻门(Rhodophyta)各占2%。鉴定的393个原生生物OUTs中有140个可以鉴定到种水平,其中18个为优势种(相对丰度大于1%)(表1)。
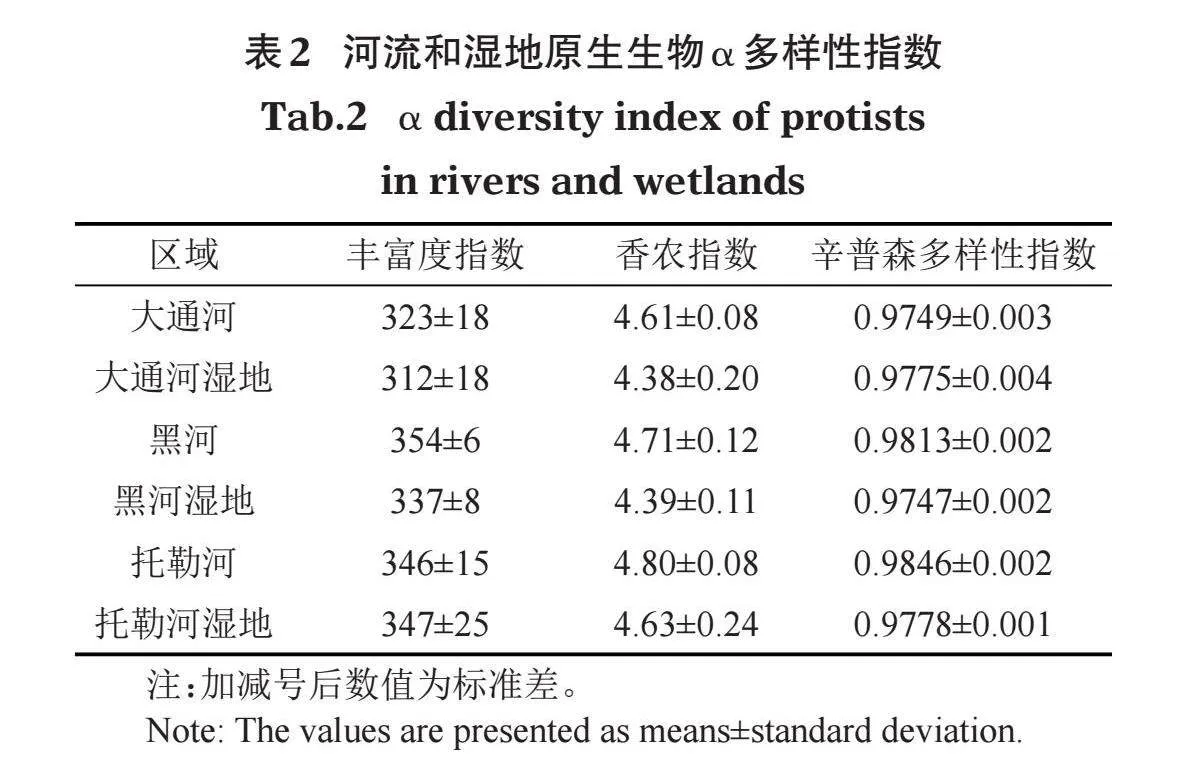
研究区域各个河流和湿地原生生物α多样性指数见表2,香农指数(Shannon)为4.13~4.94,丰富度指数(Richness)为236~380,辛普森多样指数(Simpson)为0.965~0.987。香农指数在大通河湿地平均值最低,为4.38,在托勒河平均值最高,为4.80;丰富度指数在大通河湿地平均值最低,为312,在黑河平均值最高,为354;辛普森多样性指数在黑河湿地平均值最低,为0.9747,在托勒河平均值最高,为0.9846。
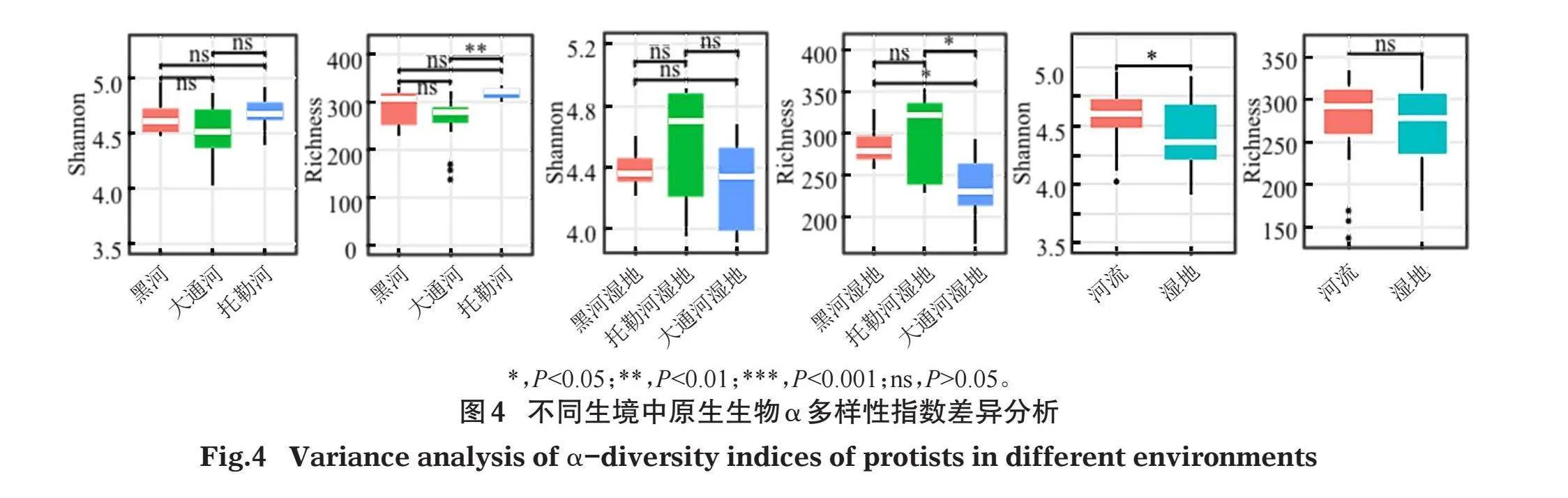
研究区域原生生物多样性指数差异分析如图4所示,香农指数在各个河流间和各个湿地间均没有显著差异,但是在河流与湿地之间存在显著差异,且河流显著高于湿地。在河流中,丰富度指数仅在托勒河显著高于大通河,其他河流间均没有显著差异。在各个湿地中,丰富度指数表现为黑河湿地显著高于大通河湿地,托勒河湿地显著高于大通河湿地,黑河湿地和托勒河湿地间没有显著差异;河流与湿地之间的丰富度指数没有显著差异。
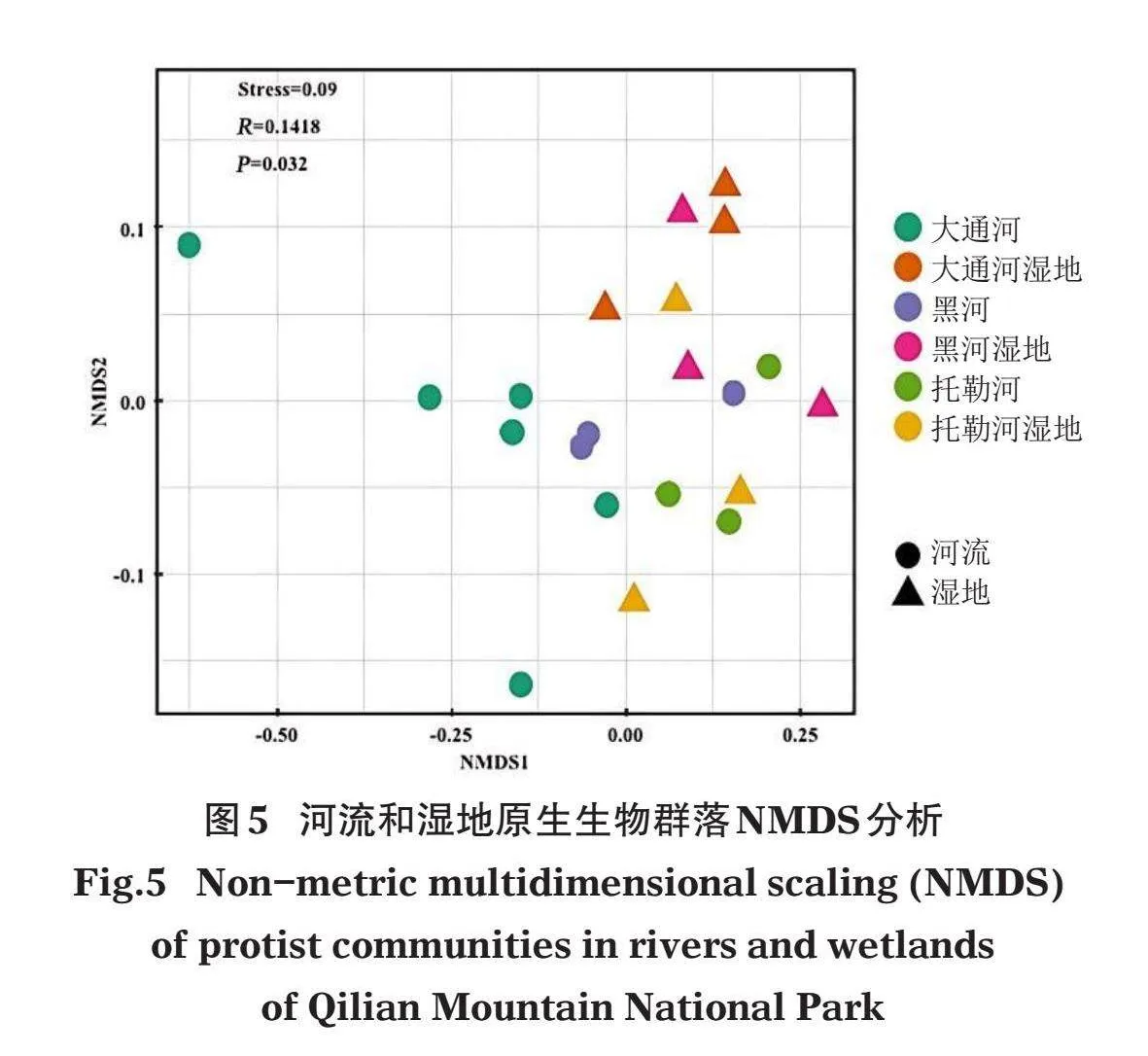
对祁连山国家公园21个采样点原生生物群落基于bray-curtis距离进行的非度量多维标度(non-metric multidimensional scaling,NMDS)分析如图5所示,Stress值低于0.1,表明降维效果越好,能较准确反映数据排序的真实分布。排序图结果显示,湿地和河流之间、各个河流流域之间及各湿地之间的原生生物群落均存在较明显的分组,表明在不同河流流域间、不同湿地间以及不同的水环境类型间,原生生物群落存在较大差异。
原生生物各个类群在各样点的相对丰度如图6所示,硅藻门在黑河(HH1~3)样点和黑河湿地(HHSD1~3)样点的相对丰度均超过25%。隐藻门在大通河相对丰度最高,且在大通河(DTH2~4)样点的相对丰度超过20%。纤毛门在大通河、黑河、黑河湿地各样点的相对丰度差异较小,而在大通河湿地、托勒河、托勒河湿地各样点的相对丰度差异较大。除大通河区域外,硅藻门在其他各个区域相对丰度均相对较高,且在黑河湿地超过25%。纤毛门、裸藻门、金藻门、丝足虫门等在不同区域的相对丰度变化较小。
2.3" "原生生物群落共现网络
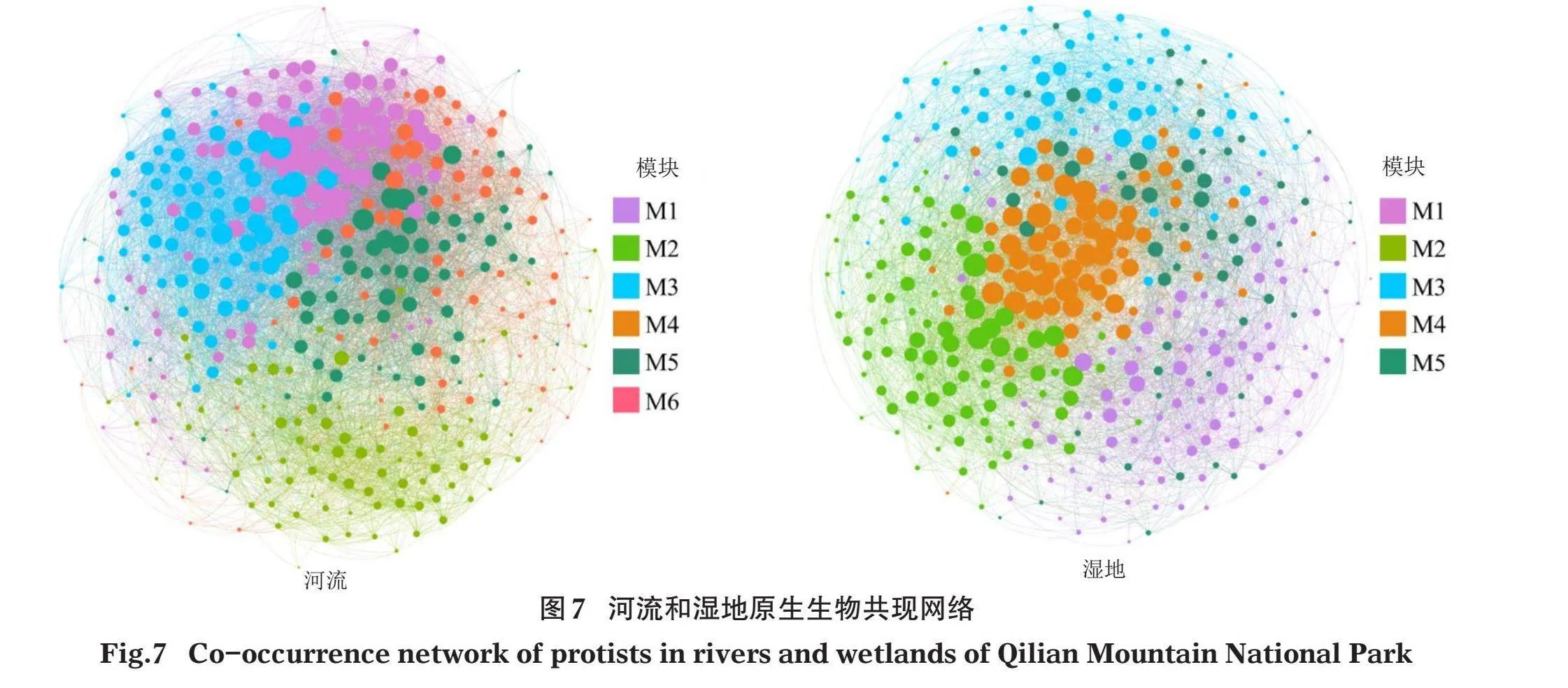
为探究区域内河流与湿地原生生物OTUs之间的互作关系,分别对河流及湿地的原生生物群落进行共现网络分析(图7),其中节点代表OTUs,边代表OTUs之间的Spearman秩相关系数,即OTUs之间相互关系。河流中原生生物共现网络主要的模块有6个(M1~M6),分别占总OTUs的22.80%、18.91%、14.51%、17.62%、25.91%和0.26%;湿地中原生生物共现网络主要的模块有5个(M1~M5),分别占总OTUs的17.88%、23.58%、19.43%、22.02%和17.10%。河流及湿地原生生物群落共现网络节点间的连接均以正相关为主,表明原生生物OTUs间多为互利关系。
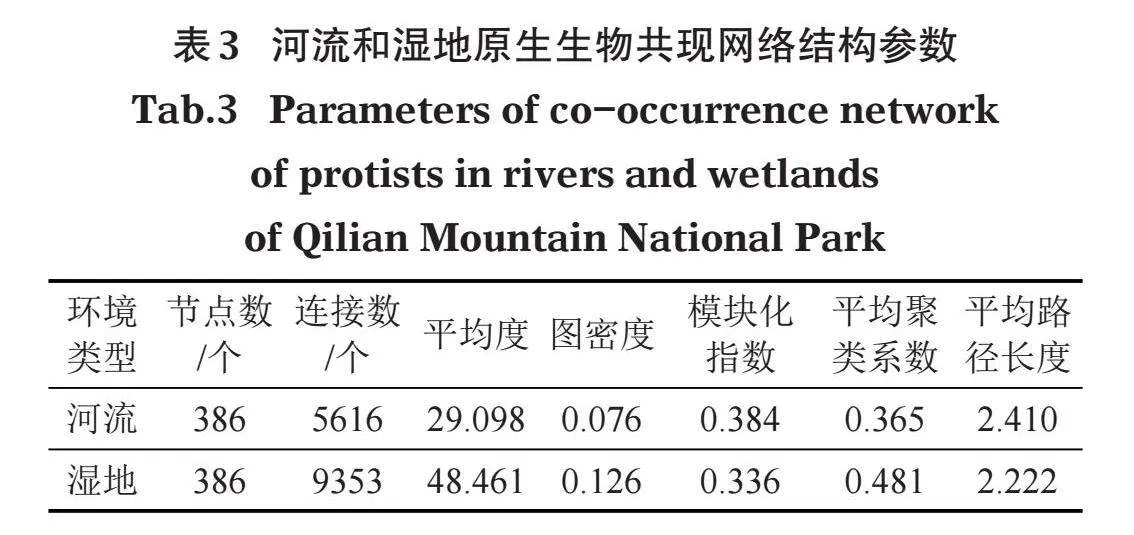
研究区域河流与湿地环境中原生生物群落共现网络结构参数如表3所示,河流原生生物群落共现网络由386个节点和5 616条边构成,其平均度(节点连接性)为29.098,图密度为0.076,模块化指数为0.384,平均聚类系数0.365,平均路径长度为2.410;湿地原生生物群落共现网络由386个节点和9 353 条边构成,其平均度为48.461,图密度为0.126,模块化指数为0.336,平均聚类系数0.481,平均路径长度为2.222。通过对比河流与湿地中原生生物共现网络拓扑结构参数,结果显示湿地原生生物群落共现网络连接数、平均度、图密度和平均聚类系数均远高于河流,表明湿地原生生物共现网络中各个OTUs之间的联系更为紧密,共现网络关系更复杂。而河流原生生物共现网络的模块化指数和平均路径长度均高于湿地,表明河流原生生物共现网络模块化特性更强,OTUs之间的聚集更为明显。
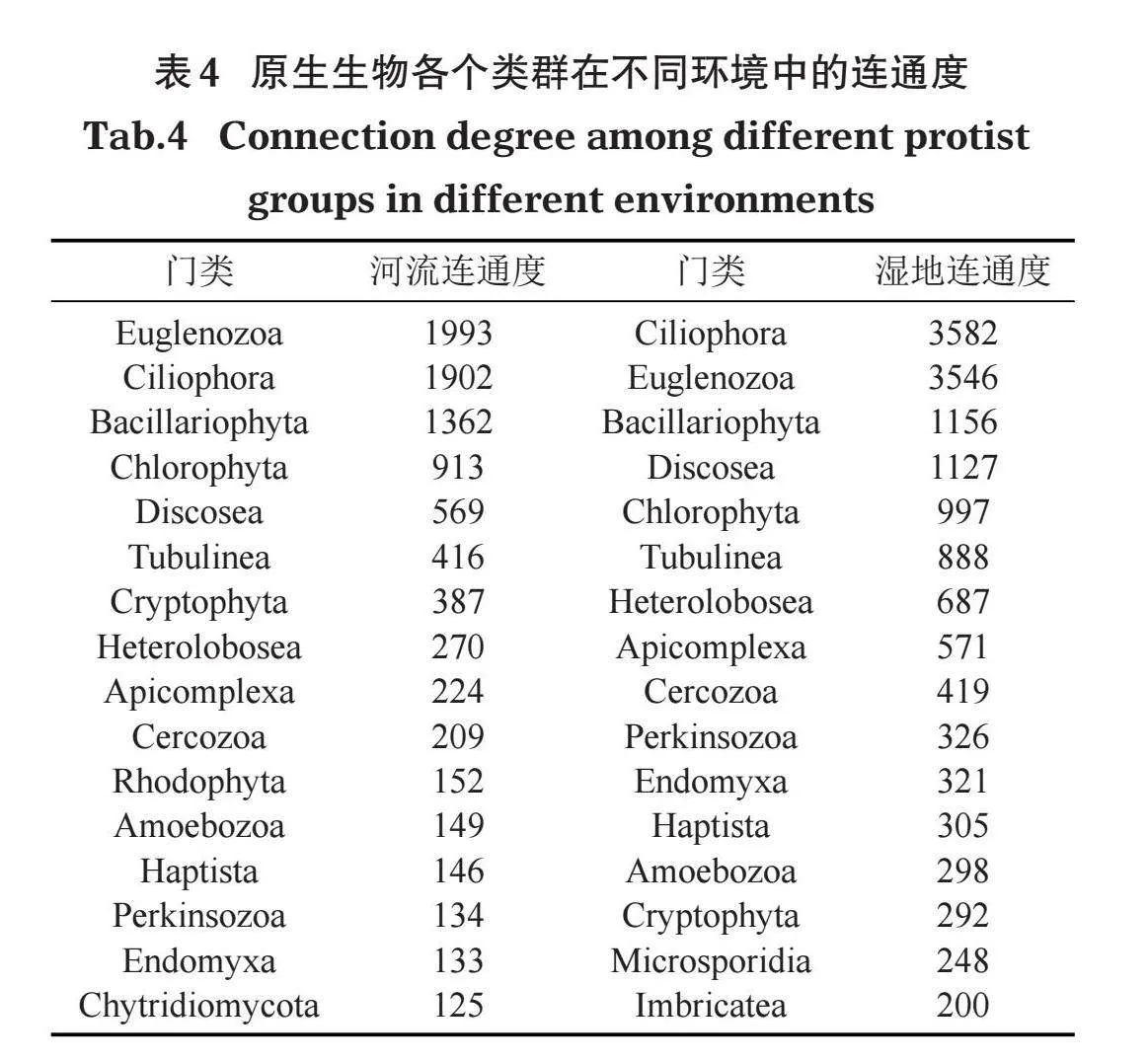
为了进一步探究原生生物群落共现网络中不同类群的相互关系,对各个类群在共现网络中的连通度进行分析,结果显示各个类群在不同环境中的连通度存在差异(表4)。在河流中,连通度高于200的类群有10个,按连通度排序依次为裸藻门、纤毛门、硅藻门、绿藻门、Discosea、管涌足虫门、隐藻门、透色藻门、顶复门和丝足虫门。在湿地中,连通度高于200的类群有16个,按连通度排序依次为纤毛门、裸藻门、硅藻门、Discosea、绿藻门、管涌足虫门、顶复门、丝足虫门、Perkinsozoa、定鞭藻门、变形虫门、隐藻门、Microsporidia和Imbricatea。河流中硅藻门和隐藻门的连通度高于湿地,其他类群在湿地中连通度均高于河流,这表明湿地中原生生物群落共现网络更稳定,原生生物除硅藻门和隐藻门类群外,其他类群OTUs之间的共现关系在湿地中的联系更为紧密。
2.4" "原生生物群落与环境因子的关系
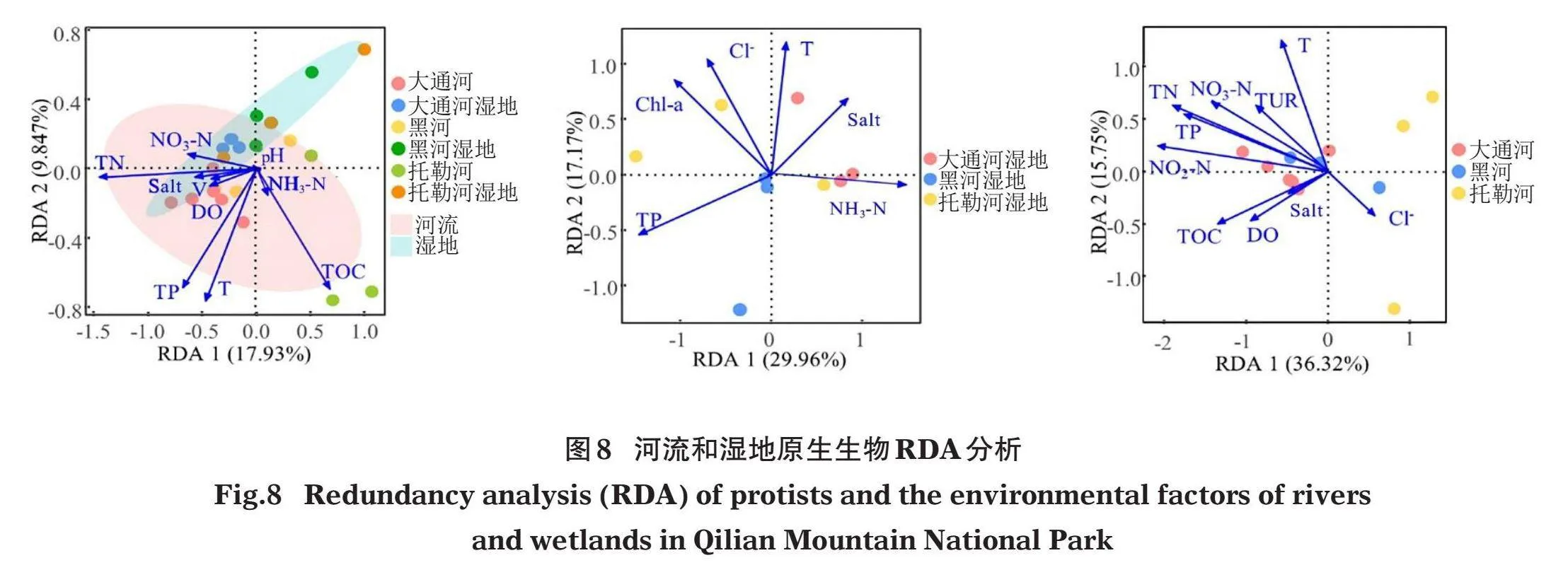
对原生生物与环境因子进行RDA分析,结果见图8,排序图中仅显示对RDA分析模型贡献度大于0的环境因子。在河流和湿地中对RDA分析模型贡献度大于0的环境因子有10个,为TP、T、pH、TOC、DO、Salt、TN、NO3-N、NH3-N和V。对于湿地而言,对RDA分析模型贡献度大于0的环境因子有6个,为TP、T、Chl-a、Salt、Cl-和NH3-N。对于河流而言,对RDA分析模型贡献度大于0的环境因子有10个,为TP、T、DO、Salt、Cl-、TUR、TN、NO2-N、TOC和NO3-N。
对各个环境因子的贡献度进行分析(表5),结果发现在河流和湿地中,TP、TN、NH3-N、NO3-N和TOC对原生生物群落的解释率高于10%;在湿地环境中,TP和NH3-N对原生生物群落的解释率高于10%;在河流TP、TN和NO3-N对原生生物群落的解释率高于10%。
基于Spearman相关性分析,对研究区域河流和湿地原生生物主要门类与环境因子相关性进行分析,结果见图9。河流与湿地的Parabasalia、硅藻门和裸藻门与COD和TOC呈显著负相关,Imbricatea与NO3-N、TN和Salt呈显著负相关;纤毛虫门与Chl-a和COD呈显著正相关,Amoebozoa与COD呈显著正相关,Discosea与Chl-a、T和DO呈显著正相关,隐藻门与COD、TP和TOC呈显著正相关。
3" "讨论
3.1" "原生生物群落分布特征
本研究通过宏基因组测序,在祁连山国家公园青海片区共鉴定出393个原生生物OTUs,隶属于24门40纲95目126科162属。在原生生物多样性研究中,由于原生生物个体较小,传统方法很难鉴定到种,显微鉴定过程费时费力,且难以标准化,对鉴定人员的专业程度存在较高要求;传统鉴定方法能够做到绝对定量,并且方便与之前的数据做对比。而宏基因组测序技术在原生生物多样性研究中,能够更全面获得原生生物多样性信息,也可以对原生生物与环境因子的关系进行分析,结果更加准确,且效率也相对较高,更容易标准化;但宏基因组测序技术难以做到绝对定量,同时易受干扰,物种注释依赖于数据库的完整性,可能对分类的准确性产生影响(罗帅等,2022)。根据鉴定结果,其中OTUs相对丰度最高的类群为硅藻门,其次为纤毛门和绿藻门,在高海拔低温水环境中,硅藻门的占比较高,这与前人的研究结果一致(杨菲,2014)。祁连山国家公园青海片区原生生物多样性存在区域差异,在河流中为托勒河gt;黑河gt;大通河,在湿地中为托勒河湿地gt;黑河湿地gt;大通河湿地,且河流多样性指数显著高于湿地;根据沈韫芬等(1990)提出的水环境质量越高,原生生物多样性越高的理论,表明祁连山国家公园的水环境质量为河流高于湿地,且在各个河流样点水质状况为托勒河gt;黑河gt;大通河,各个湿地样点水质状况为托勒河湿地gt;黑河湿地gt;大通河湿地,这也与水环境因子差异分析结果相一致,表明祁连山国家公园青海片区各个河流湿地的环境分化明显,环境差异较大(Zhou et al,2021)。祁连山国家公园青海片区的原生生物种类占比最高的类群为裸藻门占21%,纤毛门占18%,硅藻门占11%,表明裸藻门、纤毛门和硅藻门是该区域最常见的3种原生生物类群;其中硅藻门的相对丰度较高,这一结果可能与祁连山地区的高海拔和低水温的环境条件有关,根据以往研究,硅藻为适应低温环境的生物类群,因此它们能够在祁连山国家公园青海片区的高海拔低温环境下生存和繁殖,所以硅藻门在祁连山地区的占比较高(邓建明等,2010;Hattori-Saito et al,2010)。同时比较大通河、托勒河和黑河硅藻门的相对丰度,发现大通河硅藻门相对丰度远低于黑河和托勒河(图6),这与大通河地处祁连山山系东段,海拔相对较低,流经城镇村落较多,而托勒河与黑河地处祁连山腹地,海拔相对较高,且流域内环境干扰较低,水环境较为原始有一定关系。
3.2" "影响原生生物群落的水环境因子存在差异
已有研究表明,T、Salt、pH、TP、TN、NH3-N、NO3-N、TOC等多种因素会对原生生物群落结构产生影响(王鑫,2014;杨渐,2015;胡菊香等,2019)。通过分析原生生物与水环境因子的关系,发现总磷(TP)、总氮(TN)和总有机碳(TOC)是对原生生物群落影响较强的水环境因子,这与研究区域地处祁连山山系的高海拔地区、水环境营养物质较低有关,因此原生生物对水环境中营养物质的依赖较高。从不同河流来看,大通河及大通河湿地采样点位于天峻县木里矿区附近,总氮总磷可能来源于地表径流输送或其他天然源;黑河样点位于城镇周围城镇牧场下游,总氮总磷可能来源于城镇人为排入和草地系统的淋溶。大通河是人类活动最多的区域,人类放牧、农耕及旅游等活动带来的各种人为干扰,可能是导致其总磷总氮浓度较高的原因,并且由此导致大通河流域的硅藻门类群相比于其他区域较低,而隐藻门类群相比于其他区域较高。托勒河及托勒河湿地总磷的含量相比于其他区域相对较低,这可能与托勒河及托勒河湿地所处地区相对封闭、人为干扰较少、环境较为原始有关。整体湿地区域相较河流区域,人为活动较少,因此减少了外源营养物质的输入,从而导致其营养物质较为缺乏,因而使得该地区原生生物多样性较低(杨建新等,2008;王芸,2017;支珞昀,2020)。总体而言,祁连山国家公园青海片区大通河,黑河和托勒河的水环境中影响原生生物群落的水环境因子存在差异,且在湿地中主要的环境因子为TP和NH3-N,对原生生物群落的影响高于70%(表5),而在河流中影响原生生物的水环境因子则更加多元化。
3.3" "河流和湿地原生生物群落共现网络存在差异
生物间的相互作用是维持生物群落稳定及保持生态系统结构的重要因素之一(Chaffron et al,2010)。群落中各种生物之间存在着共生、合作、竞争、掠夺等互作关系(Liu et al,2019;Morris et al,2019),这些互作关系在原生生物群落中决定了各个类群间的共现关系,因此我们利用原生生物共现网络来揭示原生生物之间潜在的相互作用,以此来揭示各个类群之间的共存模式(Proulx et al,2005)。本研究中祁连山国家公园青海片区河流和湿地2大类水体原生生物共现网络存在差异。相较于河流,湿地环境的共现网络更为复杂,表明其原生动物群落结构较为稳定,所以湿地共现网络联系较为紧密结构更为复杂,相比之下河流环境中原生生物共现网络结构相对简单和碎片化。这表明河流环境中共现网络复杂性较低,生物群落更容易受到外部环境压力的影响,其稳定性也越低。祁连山国家公园青海片区的各个河流海拔高,水源补给多为冰川融水,水温较低,原生生物类群相对单一,这些环境条件的限制使得生物的生长和繁殖相对较为困难,从而导致生态系统的多样性和稳定性降低,因此在河流中原生生物群落共现网络复杂度较低。而湿地环境对生物群落的限制更加严格,因此在湿地中生存的物种更倾向于形成更加稳定的群落,湿地中的一些藻类如硅藻和绿藻比例较高,这与水体温度和光照条件有关,这些藻类可以提供大量的有机物和能量,为水生动物提供养分和食物来源,构建起一个相对完整的食物链或食物网。此外湿地中的水体更接近于静态,没有大的水流影响,也有利于提高原生生物群落的稳定性。因此湿地中原生生物群落的共现网络更为复杂,原生生物群落更为稳定。
志谢:本研究得到中国科学院超级计算武汉分中心支持。
参考文献
安瑞志, 2021. 麦地卡湿地国家级自然保护区原生动物群落生态学研究[D]. 拉萨:西藏大学.
安瑞志, 潘成梅, 塔巴拉珍, 等, 2021. 西藏巴松错浮游植物功能群垂直分布特征及其与环境因子的关系[J]. 湖泊科学, 33(1):86-101.
邓建明, 蔡永久, 陈宇炜, 等, 2010. 洪湖浮游植物群落结构及其与环境因子的关系[J]. 湖泊科学, 22(1):70-78.
翟万营, 汪倩, 王佳华, 等, 2022. 南极中山站附近海水微生物多样性和宏基因组分析[J]. 上海海洋大学学报, 31(1):288-297.
国家环境保护总局编委会, 2002. 水和废水监测分析方法[M].4版. 北京:中国环境科学出版社.
胡菊香, 梁亮, 池仕运, 等, 2019. 环境因子对供水水库原生动物群落特征的影响[J]. 水生态学杂志, 40(4):30-41.
胡明慧, 赵建琪, 王玄, 等, 2022. 自然增温对南亚热带森林土壤微生物群落与有机碳代谢功能基因的影响[J]. 生态学报, 42(1):359-369.
黄平平, 2017. 基于高通量测序和形态学的黄渤海沉积物中纤毛虫生物多样性及分布特征研究[D]. 青岛:中国科学院大学(中国科学院海洋研究所).
金万洲, 卜静, 罗惠文, 等, 2022. 祁连山国家公园青海片区种子植物区系特征[J]. 浙江农林大学学报, 39(2):289-296.
兰翔宇, 叶冲冲, 王毅, 等, 2021. 1995-2014年青藏高原水源涵养功能时空演变特征及其驱动力分析[J]. 草地学报, 29(增刊1):80-92.
李铁, 1998. 莫失祁连山:祁连山水源涵养林保护调查[J]. 瞭望新闻周刊,(2):20-21.
李新, 勾晓华, 王宁练, 等, 2019. 祁连山绿色发展:从生态治理到生态恢复[J]. 科学通报, 64(27):2928-2937.
刘斌, 刘真诚, 罗帅, 等, 2022. 黑龙江省典型城市湿地龙凤湿地和呼兰河口湿地的原生生物分子多样性[J]. 基因组学与应用生物学, 41(2):352-362.
罗帅, 刘真诚, 王粟, 等, 2022. 基于宏基因组的保安湖浮游动物多样性研究[J]. 水生生物学报, 46(11):1719-1729.
马芳, 2020. 祁连山国家公园(青海片区)脆弱生态环境保护与修复的法治保障[J]. 青海民族大学学报(社会科学版), 46(2):62-68.
沈韫芬, 1999. 原生动物学[M]. 北京:科学出版社.
沈韫芬, 章宗涉, 龚循矩, 等, 1990. 微型生物监测新技术[M]. 北京:中国建筑工业出版社.
王玲慧, 张代青, 李凯娟, 2015. 河流生态系统服务价值评价综述[J]. 中国人口·资源与环境, 25(增刊1):10-14.
王新源, 2018. 生态文明建设可持续发展研究:以祁连山为例[J]. 河南农业,(11):82-84.
王鑫, 2014. 青藏高原不同海拔咸水湖微生物多样性及适应性特征[D]. 兰州:兰州交通大学.
王学福, 2020. 祁连山河流湿地生态退化现状与恢复[J]. 甘肃科技, 36(11):3-6, 21.
王莹莹, 左金淼, 刘家冈, 2005. 以态势理论为基础的更新生态位测度研究[J]. 林业科学,(4):20-24.
王芸, 2017. 拉萨河中上游原生动物群落结构特征及其与水环境之间的关系[D]. 拉萨:西藏大学.
熊杰, 陈建平, 陈晓光, 等, 2019. 进展中的原生动物学研究:热点领域与新格局[J]. 中国科学:生命科学, 49(10):1301-1322.
杨菲, 2014. 西藏盐湖浮游植物及原生动物群落结构特征的研究[D]. 上海:上海海洋大学.
杨建新, 祁洪芳, 史建全, 等, 2008. 青海湖夏季水生生物调查[J]. 青海科技, 15(6):19-25.
杨渐, 2015. 青藏高原湖泊微生物群落演替及其环境指示意义[D]. 武汉:中国地质大学.
张华, 韩武宏, 宋金岳, 等, 2021. 祁连山国家公园生境质量时空演变[J]. 生态学杂志, 40(5):1419-1430.
支珞昀, 2020. 高原湖泊浮游动物群落空间分布驱动力解析[D]. 北京:中国地质大学(北京).
Boscaro V, Rossi A, Vannini C, et al, 2017. Strengths and biases of high-throughput sequencing data in the characterization of freshwater ciliate microbiomes [J]. Microb Ecol, 73:865-875.
Chaffron S, Rehrauer H, Pernthaler J, et al, 2010. A global network of coexisting microbes from environmental and whole-genome sequence data [J]. Genome Res, 20:947-959.
Fenchel T M, Jørgensen B B,1977. Detritus food chains of aquatic ecosystems: the role of bacteria[C]//Alexander M. Advances in Microbial Ecology. Boston, MA:Springer US:1-58.
Hattori-Saito A, Nishioka J, Ono T, et al, 2010. Iron deficiency in micro-sized diatoms in the Oyashio region of the Western subarctic Pacific during spring [J]. Journal of Oceanography, 66:105-115.
Jiang C, Liu B, Zhang J, et al, 2021. Diversity and seasonality dynamics of ciliate communities in four estuaries of Shenzhen, China (South China Sea) [J]. Journal of Marine Science and Engineering, 9:260.
Jiao N, Herndl G J, Hansell D A, et al, 2010. Microbial production of recalcitrant dissolved organic matter: long-term carbon storage in the global ocean [J]. Nature Reviews Microbiology, 8:593-599.
Keeling P J, Campo J d, 2017. Marine protists are not just big bacteria [J]. Current Biology, 27:R541-R549.
Liu L, Chen H, Liu M, et al, 2019. Response of the eukaryotic plankton community to the cyanobacterial biomass cycle over 6 years in two subtropical reservoirs [J]. The ISME Journal, 13:2196-2208.
Morris L A, Voolstra C R, Quigley K M, et al, 2019. Nutrient availability and metabolism affect the stability of coral-symbiodiniaceae symbioses [J]. Trends in Microbiology, 27:678-689.
Pokarzhevskii A D, van Straalen N M, Zaboev D P, et al, 2003. Microbial links and element flows in nested detrital food-webs [J]. Pedobiologia, 47:213-224.
Proulx S R, Promislow D E L, Phillips P C, 2005. Network thinking in ecology and evolution [J]. Trends in Ecology amp; Evolution, 20:345-353.
Zhang P, Xiong J, Qiao N, et al, 2022. Spatiotemporal distribution of protists in the Yarlung Zangbo River, Tibetan Plateau [J]. Water Biology and Security, 1:100064.
Zhou L, Wang P, Huang S, et al, 2021. Environmental filtering dominates bacterioplankton community assembly in a highly urbanized estuarine ecosystem [J]. Environmental Research, 196:110934.
Zhu W, Zhang A, Qin C, et al, 2021. Seasonal and spatial variation of protist communities from reef water and open ocean water in patchy coral reef areas of a semi-enclosed bay[J]. Marine Environmental Research, 169:105407.
(责任编辑" "熊美华)
Protist Diversity of Rivers and Wetlands in Qilian Mountain National Park
(Qinghai Region) Based on Metagenomics
WANG Hao‐hua1,2, ZHANG Peng2, LUO Shuai2, GU Si‐yu2, XIONG Xiong2,
YU Yao3, LI Lun3, MIAO Wei2, XIONG Jie2
(1. Dalian Ocean University, Dalian" "116023, P.R. China;
2. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan" "430072, P.R. China;
3. Qinghai Service Guarantee Center of Qilian Mountain National Park, Xining" "810000, P.R. China)
Abstract: Qilian Mountain National Park (Qinghai region) is located at the northeastern edge of the Qinghai-Tibet Plateau, an important ecological security barrier in western China and the most important water source region of the Yellow River. In this study, we explored the protist community structure and its relationship with environmental factors in the rivers and wetlands of Qilian Mountain National Park, aiming to accumulate a baseline to support conservation of biological resources and the water environment in the area. In July and August of 2020, water samples were collected at 21 sites at rivers and wetlands in Qilian Mountain National Park for the analysis of water environmental factors and DNA. A total of 58 DNA samples were obtained, and then metagenomic sequencing was used to investigate species composition and the community structure of protists. Results show that: (1) A total of 393 protist OTUs (Operational Taxonomic Units, OTUs) were identified and annotated, including 162 genera, 126 families, 95 orders, 40 classes, and 24 phyla. Euglenozoa and Ciliophora had the largest number of OTUs, while Bacillariophyta and Ciliophora were the most abundant. (2) There were significant differences in the community structure of protists from different rivers and wetlands, and the diversity of protists in rivers was significantly higher than in wetlands. The highest average Shannon (4.80) and Simpson (0.9846) diversity indices were both in Tuole River, and the highest average Margalef richness index (354) was in the Heihe River. The lowest average Shannon diversity index (4.38) and Margalef richness index (312) were both in the Datong River wetland, and the lowest average Simpson diversity index (0.9747) was in the wetland of the Heihe River. (3) Redundancy analysis shows that the protist community was primarily affected by the environmental factors TP, water temperature, PH, TOC, DO, salinity, TN, NO3--N, NH3-N and velocity. (4) The co-occurrence network in wetlands was more stable than that in rivers. This work provides basic data for the ecological assessment and monitoring of water environments in the region.
Key words:protist; diversity; metagenome; river; wetland; Qilian Mountain National Park
