中枢性性早熟女童的诊断模型建立与验证
2024-01-01解淑钰孟超王琼瑾周光中金玉赵映敏曹唯慰陶月红





[摘" "要]" "目的:综合多项对中枢性性早熟(central precocious puberty,CPP)女童具有诊断价值的临床指标,建立CPP女童诊断模型并进行验证,以减少促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)激发试验,提高CPP诊断阳性率。方法:收集在江苏省6家医院儿科就诊的性早熟女童1 337例的临床资料,其中CPP女童529例(39.6%),周围性性早熟(peripheral precocious puberty,PPP)女童808例(60.4%)。年龄<8岁性早熟女童646例,其中CPP女童137例(21.2%)设为CPP组,PPP女童509例(78.8%)设为PPP组。年龄≥8岁性早熟女童691例,其中CPP女童392例(56.7%)设为CPP组,PPP女童299例(43.3%)设为PPP组。分别比较两个年龄段CPP与PPP女童体质量、身高、身高生长曲线偏离标准差比值(standard deviation score,SDS)(ΔZ身高)、骨龄超前数、血清黄体生成素(luteinizing hormone,LH)基础值、卵泡刺激素(follicle stimulating hormone,FSH)基础值、LH/FSH基础值、雌二醇(estradiol,E2)、子宫容积、卵巢体积等临床特征。采用二元Logistic回归分析两个年龄段女童罹患CPP的危险因素,分别建立CPP诊断模型。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析诊断模型及单一指标对CPP的诊断价值。以GnRH激发试验确诊为CPP的115例及PPP的162例为研究对象,验证两个年龄段CPP诊断模型的预测价值。结果:年龄<8岁的CPP女童身高、体质量、ΔZ身高、骨龄超前数、E2、LH基础值、FSH基础值、LH/FSH基础值、子宫容积、卵巢体积大于PPP女童(均P<0.05);年龄≥8岁的CPP女童身高、体质量、ΔZ身高、体质量指数(body mass index,BMI)、骨龄超前数、E2、LH基础值、FSH基础值、LH/FSH基础值、子宫容积、卵巢体积大于PPP女童(均P<0.05)。Logistic回归分析发现,ΔZ身高、体质量、骨龄超前数、LH基础值及子宫容积是年龄<8岁女童罹患CPP的危险因素;ΔZ身高、体质量、骨龄超前数、LH基础值、雌二醇及子宫容积是年龄≥8岁女童罹患CPP的危险因素。建立两个年龄段诊断CPP模型,Y(<8岁)=-3.221+1.285×ΔZ身高-0.108×体质量(kg)+0.127×骨龄超前数(月)+0.809×LH基础值(IU/L)+0.647×子宫容积(mL)。Y(≥8岁)=-1.713+1.241×ΔZ身高-0.07×体质量(kg)+0.082×骨龄超前数(月)+0.761×LH基础值(IU/L)+0.005×雌二醇(pmol/L)+0.161×子宫容积(mL)。ROC曲线分析显示,与单一指标相比,诊断模型Y(<8岁)(AUC为0.907)和诊断模型Y(≥8岁)(AUC为0.897)较单一危险因素有更高的诊断价值。验证研究显示,模型Y(<8岁)预测CPP诊断的灵敏度为75.9%,特异度为77.3%,漏诊率为24.1%;模型Y(≥8岁)预测CPP诊断的灵敏度为79.1%,特异度为84.6%,漏诊率为20.9%。结论:本研究建立的两个年龄段CPP诊断模型均具有较好的灵敏度和特异度,可用于CPP的预测诊断。
[关键词]" "女童;中枢性性早熟;诊断模型;临床验证
[中图分类号]" "R725.8 [文献标志码]" "B [DOI]" "10.19767/j.cnki.32-1412.2024.05.14
中枢性性早熟(central precocious puberty,CPP)和周围性性早熟(peripheral precocious puberty,PPP)的主要区别在于下丘脑-垂体-性腺轴是否提前启动[1],促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)激发试验是鉴别两者的重要手段[2]。但GnRH激发试验需多次采血,程序繁杂、花费高,患儿依从性低,且重复GnRH激发试验存在点火效应,可诱发CPP。近年来国内外研究发现,女童基础血清促性腺激素水平、骨龄、妇科盆腔超声等检查对临床诊断CPP有一定价值,但凭单项指标不能完全确定或排除CPP,且各指标对CPP诊断的权重尚不明确[3-5]。本文在综合临床多项常见指标的基础上,建立女童中枢性性早熟的诊断模型,评估是否需要进一步作GnRH激发试验,以提高激发试验的阳性率,节约医疗资源。
1" "资料与方法
1.1" "一般资料" "回顾性分析2015年6月—2021年12月在苏北人民医院、扬州市第一人民医院、江都人民医院、扬州妇幼保健院、靖江市人民医院及仪征医院儿科就诊的1 614例性早熟女童的临床资料,其中前5年1 337例(CPP 529例,PPP 808例)用于建立诊断模型,另277例(CPP 115例,PPP 162例)用于验证模型的诊断价值。CPP诊断标准[1]:(1)8岁前出现乳房发育;(2)血清促性腺激素及性激素升高达青春期水平;(3)身高呈线性生长加速;(4)骨龄超前1年及1年以上;(5)性腺开始发育,子宫及卵巢容积增大;(6)GnRH激发试验LH峰值/FSH峰值≥0.6,同时LH峰值≥5.0 IU/L。不符合以上CPP诊断标准且除外以下排除标准的性早熟女童诊断为PPP。排除标准:(1)年龄<4岁出现乳房发育者;(2)甲状腺、肾上腺疾病及其他肿瘤性疾病;(3)部分性性早熟患儿。
记录患儿父亲身高、母亲身高、遗传标准身高、实际年龄、身高、身高生长曲线偏离标准差比值(standard deviation score,SDS)(ΔZ身高)、体质量、体质量指数(body mass index,BMI)、月经是否来潮、骨龄、骨龄超前数、子宫内容积、卵巢体积。(1)遗传标准身高=(父亲身高+母亲身高-13)/2。(2)ΔZ身高=[(女童身高实测值-同年龄女童身高平均值)/同年龄女童身高标准差]-[(女童遗传靶身高-社会女童18岁成年对应身高的平均值)/社会女童18岁对应身高的标准差][6]。(3)骨龄:摄患儿左手X线正位片,统一上传至扬州大学附属苏北人民医院,根据腕骨龄图谱读片记录骨龄。(4)骨龄超前数=骨龄-实际年龄(月)。(5)子宫及卵巢容积=长×宽×厚×0.5233。
1.2" "血清黄体生成素、卵泡刺激素及雌二醇水平检测" "采集患儿晨起空腹静脉血2~3 mL,离心取上清,采用全自动电化学发光免疫分析仪测定血清中黄体生成素(luteinizing hormone,LH)、卵泡刺激素(follicle stimulating hormone,FSH)及雌二醇(estradiol,E2)水平。
1.3" "GnRH激发试验" "患儿空腹8小时以上,于早晨8~9点安静卧床状态下皮下注射戈那瑞林2.5 μg/kg(最大剂量100 μg),给药后15、30、60、90分钟采血,化学发光法测定LH及FSH。
1.4" "统计学处理" "应用SPSS 26.0统计学软件对数据进行分析处理。正态分布的计量资料以±s表示,非正态分布的计量资料以[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验;分类资料以频数和百分率表示。采用二元Logistic回归分析进行CPP危险因素筛检,并建立模型。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under curve,AUC),评估各因素的诊断价值。P<0.05为差异具有统计学意义。
2" "结" " " 果
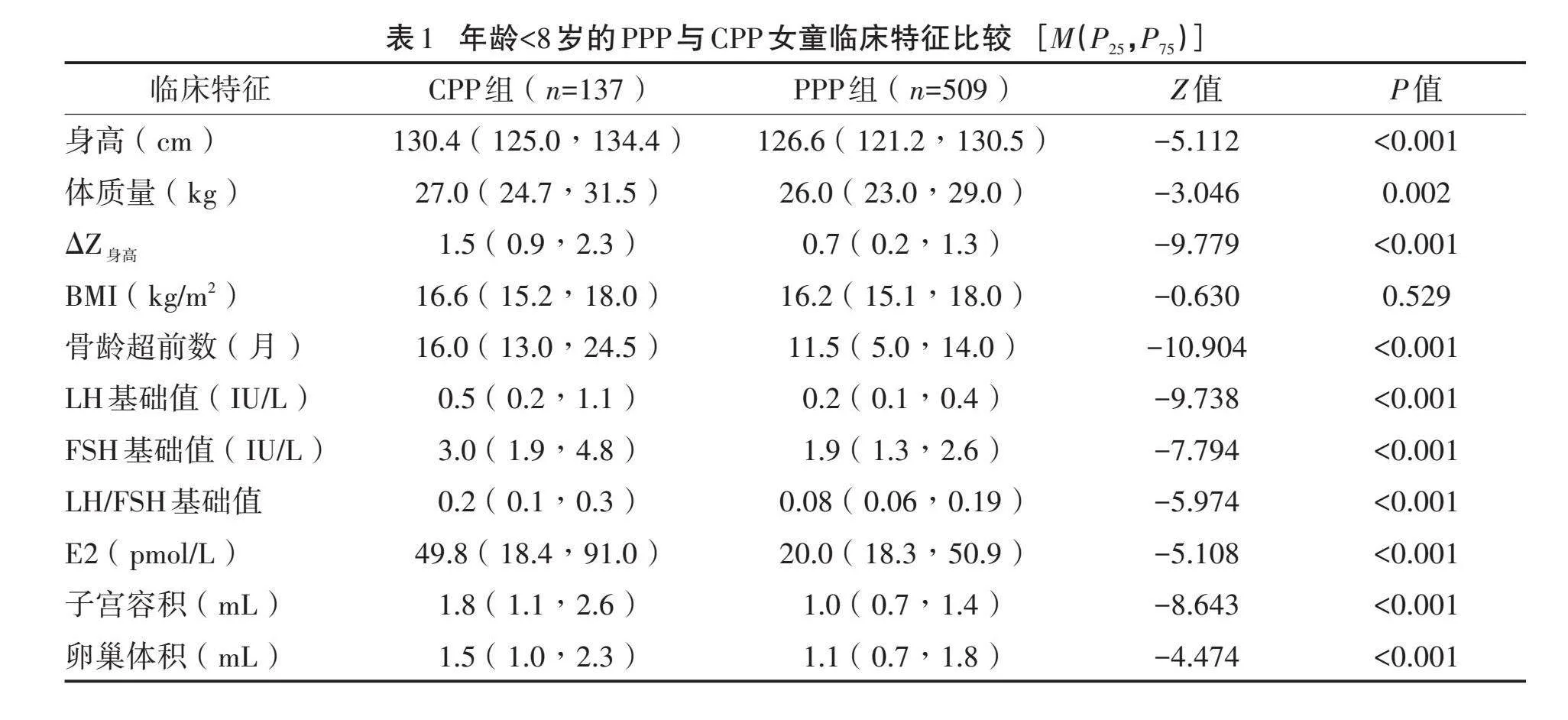
2.1" "年龄<8岁的CPP与PPP女童临床特征比较" "年龄<8岁的性早熟女童646例,其中CPP 137例(21.2%),PPP 509例(78.8%)。CPP组身高、体质量、ΔZ身高、骨龄超前数、LH基础值、FSH基础值、LH/FSH基础值、E2、子宫容积、卵巢体积均大于PPP组(P<0.05)。见表1。
2.2" "年龄≥8岁的CPP与PPP女童临床特征比较" "年龄≥8岁的性早熟女童691例,其中CPP 392例(56.7%),PPP 299例(43.3%)。CPP组身高、体质量、ΔZ身高、BMI、骨龄超前数、LH基础值、FSH基础值、LH/FSH基础值、E2、子宫容积、卵巢体积大于PPP组(P<0.05)。见表2。
2.3" "二元Logistic回归分析罹患CPP的危险因素" "将年龄、体质量、身高、ΔZ身高、BMI、骨龄超前数、E2、LH基础值、FSH基础值及LH/FSH基础值、子宫容积、卵巢体积纳入二元Logistic回归分析,筛选罹患CPP的危险因素,建立诊断预测模型。
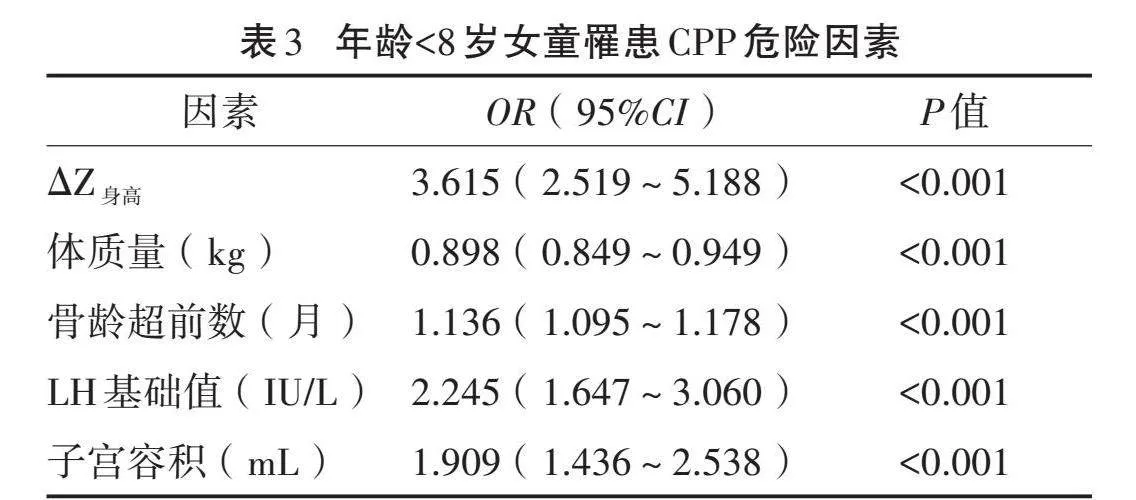
2.3.1" "年龄<8岁女童诊断预测CPP模型:二元Logistic回归分析显示,ΔZ身高、体质量、骨龄超前数、LH基础值、子宫容积是年龄<8岁女童罹患CPP的危险因素。见表3。
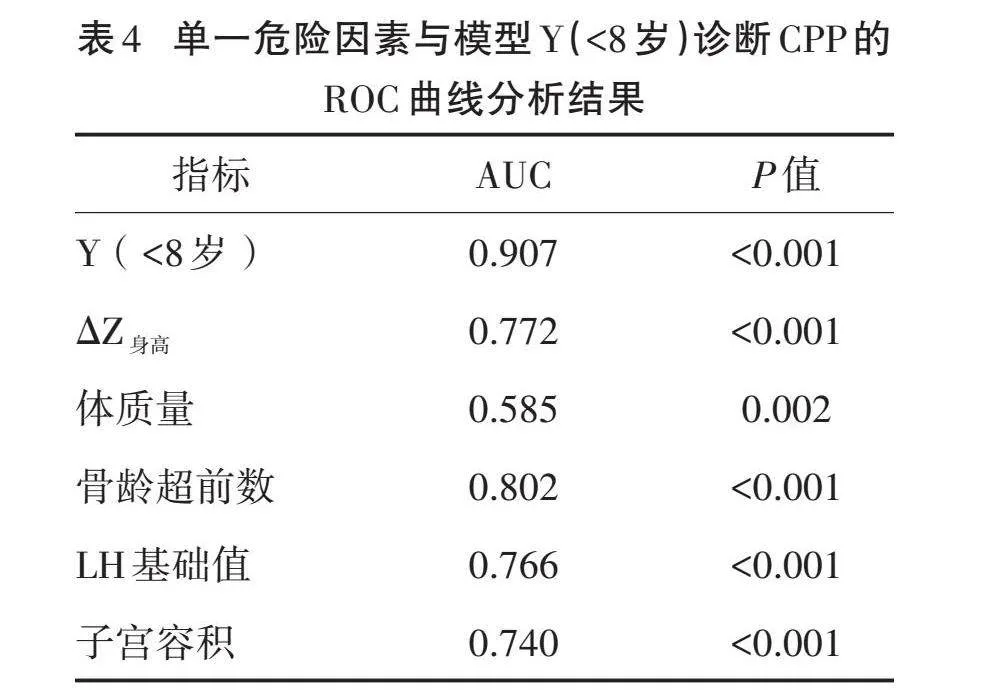
预测模型:Y(<8岁)=-3.221+1.285×ΔZ身高-0.108×体质量(kg)+0.127×骨龄超前数(月)+0.809×LH基础值(IU/L)+0.647×子宫容积(mL)。绘制ROC曲线,结果显示,与单一指标相比,诊断模型Y(<8岁)的AUC最大,为0.907,表明诊断模型较单一危险因素有更高的诊断价值。见表4,图1。将约登指数最大(0.701)时所对应的Y值-1.47作为诊断CPP的临界值,其敏感度为87.6%,特异度为82.5%。当Y(<8岁)值≥-1.47时,诊断为CPP的可能性更大,需进一步作GnRH激发试验明确诊断。
2.3.2" "年龄≥8岁女童诊断预测CPP模型:二元Logistic回归分析显示,ΔZ身高、体质量、骨龄超前数、LH基础值、E2、子宫容积是年龄≥8岁女童罹患CPP的危险因素。见表5。
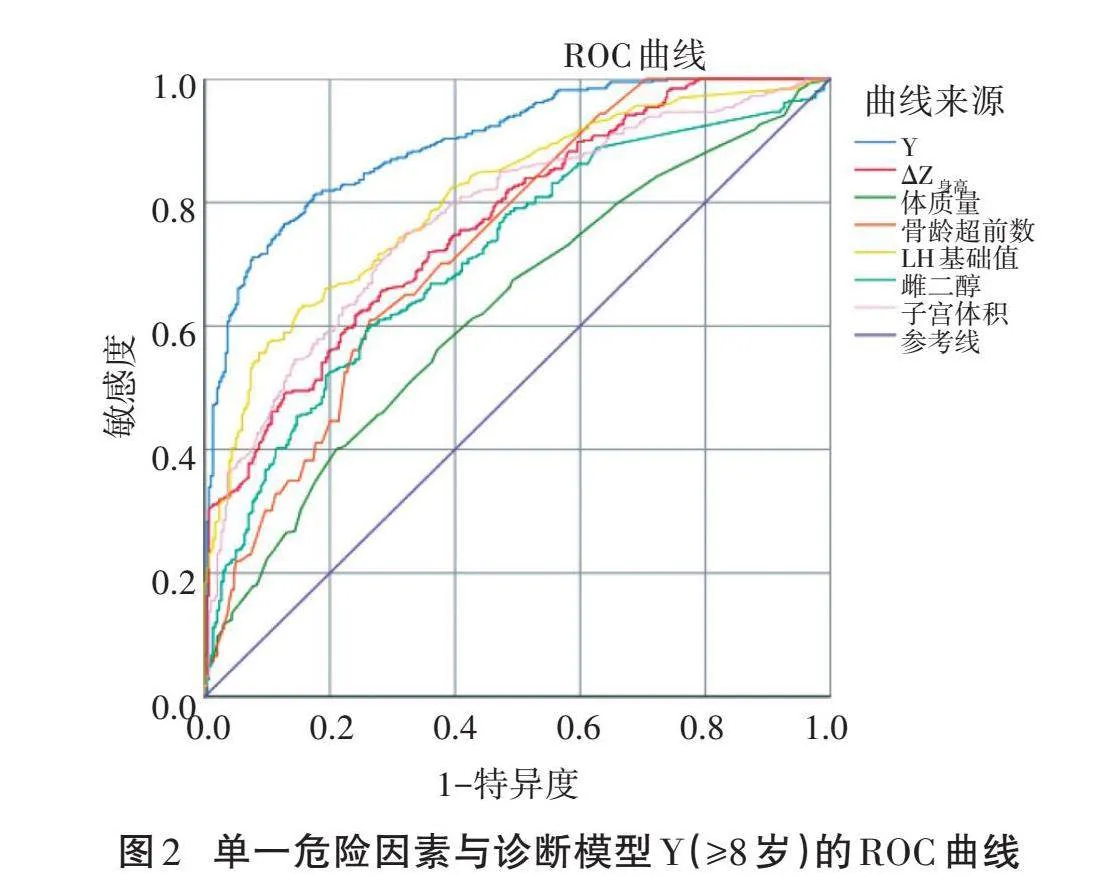
预测模型:Y(≥8岁)=-1.713+1.241×ΔZ身高-0.07×体质量(kg)+0.082×骨龄超前数(月)+0.761×LH基础值(IU/L)+0.005×E2(pmol/L)+0.161×子宫容积(mL)。绘制ROC曲线显示,与单一指标相比,诊断模型Y(≥8岁)的AUC最大,为0.897,表明诊断模型较单一危险因素有更高的诊断价值,见表6、图2。将约登指数最大(0.638)时所对应的Y值(0.35)作为诊断CPP的临界值,其灵敏度为76.5%,特异度为87.3%。当Y(≥8岁)值≥0.35时,诊断为CPP的可能性更大,需进一步作GnRH激发试验明确诊断。
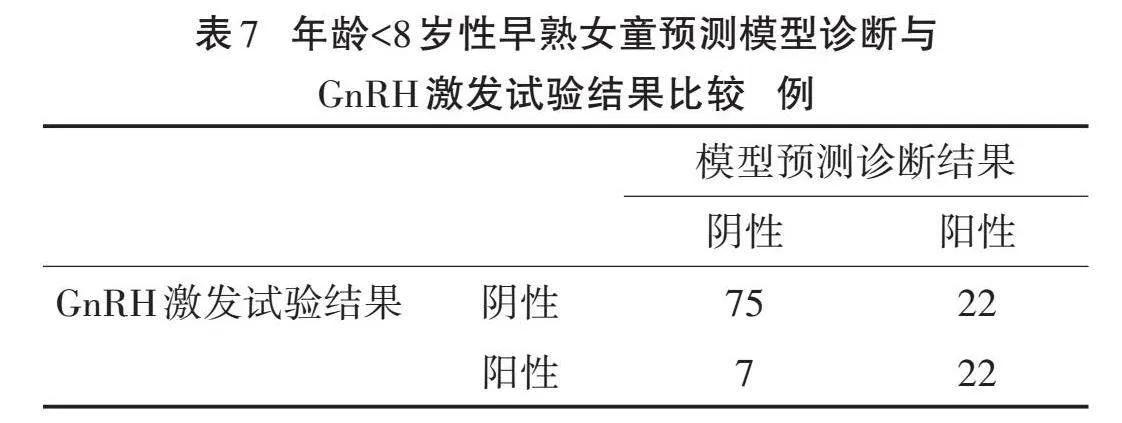
2.4" "验证诊断模型对CPP女童的诊断价值" "验证性早熟女童277例,其中<8岁126例(CPP 29例,PPP 97例),≥8岁151例(CPP 86例,PPP 65例)。将所有患儿模型预测诊断结果与GnRH激发试验进行对比,结果显示模型Y(<8岁)的敏感度为75.9%,特异度为77.3%,漏诊率为24.1%。而模型Y(≥8岁)的敏感度为79.1%,特异度为84.6%,漏诊率为20.9%。见表7、表8。
3" "讨" " " 论
CPP女童由于下丘脑-垂体-性腺轴提前激活,导致生长加速、骨龄提前发育、子宫及卵巢体积增大、血清LH、FSH、E2水平增高等。受到遗传、营养、环境和社会经济因素的影响,CPP发病率逐年上升[7]。GnRH激发试验需反复抽血,操作繁琐,不利于CPP早期诊断。多年来众多学者致力于优化CPP女童的诊断,但大多为单一指标的研究[3-5],亦有少数研究基于多项指标建立诊断模型。YUAN等[8]通过性腺超声及性激素水平建立CPP诊断模型,但性腺易受外源性激素影响,无法区分是下丘脑-垂体-性腺轴启动还是外周因素导致的提前发育,影响了模型的诊断价值。许媛媛等[9]将女童晨尿LH、血清LH、子宫容积作为CPP初筛指标,虽然晨尿采集便捷,但尿LH浓度受尿量影响,且对于尿液标本的留取时间存在争议[10]。汤陈璐等[11]结合激素、营养类食品摄入、性腺超声、血清促性腺激素水平建立CPP诊断预测模型,但激素、营养食品摄入指标评价的主观性过大,且未将年龄、生长速度等与CPP高相关性指标纳入研究,临床应用价值不确定。同时,上述均为单中心、小样本研究。吴文涌等[12]收集来自福建儿童医院的1 000余例性早熟女童的临床资料,综合年龄、病程、BMI、乳房Tanner分期、血清促性腺激素水平、骨龄、性腺超声等多项指标建立诊断模型,同时设置多个预测截点用于临床诊断,相较于单个预测因素,该模型的预测能力更好,预测范围更广。但其为单中心研究,危险因素中乳房分期及子宫容积可能受外源性激素影响,病程评估亦受患儿及家长主观因素左右,未将生长速度纳入模型,且未能单独收集病例用于验证模型的诊断价值。
本研究从江苏省内多家医院收集大量样本,其中1 337例用于建立模型,另277例用于验证模型的诊断价值。考虑到生长速度数据采集困难,需要多次监测身高才能获取,而且研究对象存在年龄和所在地区间的差异,生长速度并无统一的评价标准,因而采用ΔZ身高来衡量女童身高生长趋势。ΔZ身高可间接反映年生长速度,ΔZ身高越大,说明女童身高生长趋势偏离遗传靶身高生长曲线的程度就越大,存在生长速度加快或减慢[13-14]。本研究建立的两个模型中,ΔZ身高常数项数值最大,表明在<8岁和≥8岁两个年龄段中线性生长加速与CPP的诊断相关性最高,其次为LH基础值、子宫容积、骨龄超前数,而FSH基础值及卵巢容积未被纳入模型,表明LH基础值、子宫容积对CPP的诊断预测价值更高,与有关诊断模型结果一致[8,12]。本研究收集性早熟女童277例用于模型验证,结果显示两个模型均具有较高的敏感度及特异度,漏诊率较低,诊断效能较高。
综上所述,诊断模型Y(<8岁)和诊断模型Y(≥8岁)均具有较高的灵敏度和特异度,诊断价值较高,可应用于CPP的预测诊断。本研究仍存在一定局限性,所纳入的女童绝大多数来自江苏省内,对其他地区CPP的诊断效果有待验证;再者,骨龄最佳的诊断方法是使用统一的软件,人工判读存在人为误差。今后将选取多个分布范围较广、差异较大的地区,扩大样本量,进一步修正模型和验证模型的预测效能。
[参考文献]
[1] 中华医学会儿科学分会内分泌遗传代谢学组,《中华儿科杂志》编辑委员会. 中枢性性早熟诊断与治疗共识(2015)[J]. 中华儿科杂志,2015,53(6):412-418.
[2] MURATOLU AHIN N,URADIKMEN A,ETINKAYA S,et al. Subnormal growth velocity and related factors during GnRH analog therapy for idiopathic central precocious puberty[J]. J Clin Res Pediatr Endocrinol,2018,10(3):239-246.
[3] 鱼建飞,马晓鹏,梅林华,等. 特发性性早熟女童治疗前后血清性激素及IGF-1水平的研究[J]. 中国性科学,2017,26(4):81-84.
[4] XU Y Q,LI G M,L IY. Advanced bone age as an indicator facilitates the diagnosis of precocious puberty[J]. J Pediatr,2018,94(1):69-75.
[5] EKSIOGLU A S,YILMAZ S,CETINKAYA S,et al. Value of pelvic sonography in the diagnosis of various forms of precocious puberty in girls[J]. J Clin Ultrasound,2013,41(2):84-93.
[6] 九市儿童体格发育调查协作组,首都儿科研究所. 2005年中国九市七岁以下儿童体格发育调查[J]. 中华儿科杂志,2007,45(8):609-614.
[7] LANCIOTTI L,COFINI M,LEONARDI A,et al. Up-to-date review about minipuberty and overview on hypothalamic-pituitary-gonadal axis activation in fetal and neonatal life[J]. Front Endocrinol,2018,9:410.
[8] YUAN B,PI Y L,ZHANG Y N,et al. A diagnostic model of idiopathic central precocious puberty based on transrectal pelvic ultrasound and basal gonadotropin levels[J]. J Int Med Res,2020,48(8):300060520935278.
[9] 许媛媛,王婕,汤勇泉,等. 晨尿联合盆腔超声及血清基础促性腺激素水平在女童中枢性性早熟初步诊断中的应用[J]. 南京医科大学学报(自然科学版),2022,42(11):1572-1577.
[10] 王咪露,吴海瑛. 尿促性腺激素在评估性发育中的价值研究[J]. 实用临床医药杂志,2022,26(9):124-129.
[11] 汤陈璐,马世奇,李章,等.女童中枢性性早熟预测模型的建立及评价[J].国际检验医学杂志,2023,44(10):1214-1218.
[12] 吴文涌,陈瑞敏,袁欣. 女孩中枢性性早熟诊断预测模型的建立和验证[J]. 中国循证儿科杂志,2021,16(2):109-113.
[13] KLEINK O,DRAGNIC S,SOLIMANA M,et al. Predictors of bone maturation,growth rate and adult height in children with central precocious puberty treated with depot leuprolide acetate[J]. J Pediatr Endocrinol Metab,2018,31(6):655-663.
[14] BROWNJ J,WARNEG L. Growth in precocious puberty[J]. Indian J Pediatr,2006,73(1):81-88.
[收稿日期] 2024-07-13
(本文编辑" "赵喜)
